Что такое стафилококковые инфекции сепсис остеомиелит
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision September 2017 by Larry M. Bush, MD, FACP; Maria T. Perez, MD





Способность к тромбообразованию путем продуцирования коагулазы отличает вирулентный патоген, Staphylococcus aureus, от менее вирулентных коагулазонегативных штаммов стафилококка. Коагулазопозитивный S. aureus - один из самых распространенных и опасных для человека болезнетворных микроорганизмов из-за его высокой вирулентности и способности к формированию резистентности к антибиотикам.
Коагулазонегативные виды, такие как S. epidermidis все чаще ассоциируются с внутрибольничной инфекцией; S. saprophyticus является причиной инфекции мочевых путей. Коагулазонегативный S. lugdunensis может вызывать инвазивное заболевание с вирулентностью, аналогичной S. aureus. В отличие от большинства коагулазонегативных стафилококков, S. lugdunensis часто остается чувствительным к пенициллиназа-резистентным бета-лактамным антибиотикам (например, к метициллину).
Патогенные стафилококки распространены повсеместно. Около 30% здоровых взрослых, обычно временно, являются носителями стрептококков в носовых проходах и около 20% – на коже; отсюда стрептококки могут инфицировать самого носителя и других людей. Обсемененность пациентов стационаров и медперсонала значительно выше. Инфекция, вызванная S. aureus, чаще встречается среди бактерионосителей, чем среди лиц, которые таковыми не являются, и обычно вызвана колонизирующим штаммом.
Факторы риска
Людьми, предрасположенными к стафилококковой инфекции, являются:
Новорожденные младенцы и кормящие матери
Пациенты с гриппом, хроническими бронхолегочными заболеваниями (например, муковисцидоз, эмфизема), лейкемией, опухолями, хроническими кожными заболеваниями или сахарным диабетом
Пациенты с трансплантатами, имплантированными протезами, другими инородными телами или имплантированными внутрисосудистыми пластмассовыми катетерами
Пациенты, получающие глюкокортикоиды, иммуносупрессанты, лучевую терапию, или противоопухолевую химиотерапию
Пациенты с хронической болезнью почек и находятся на диализе
Пациенты с хирургическими разрезами, открытыми ранами или ожогами
Предрасположенным пациентам могут передаваться антибиотикорезистентные штаммы стафилококков от других пациентов, медперсонала или контактно-бытовым путем через предметы ухода за пациентами. Передача через руки персонала – наиболее распространенный способ заражения, воздушно-капельная передача также актуальна.
Болезни, вызываемые стафилококками
Стафилококки вызывают заболевание путем
Прямого проникновения в ткань
Иногда продукцией экзотоксина
Прямое проникновение в ткань является наиболее распространенным механизмом возникновения стафилококковых заболеваний, включая следующее:
Иногда стафилококками продуцируются множественные экзотоксины. Некоторые имеют локальные проявления; другие вызывают выработку цитокина из определенных Т-клеток, что ведет к серьезным системным поражениям (например, поражения кожи, шок, недостаточность органа, смерть). Лейкоцидин Пантона-Валентайна (PVL) является токсином, продуцируемым штаммами, инфицированными определенным бактериофагом. Лейкоцидин Пантон-Валентайна, как правило, присутствует в штаммах бытового метициллин резистентного стафилококка S. aureus (БМРЗС) и считается, что он опосредует способность к формированию некрозов; однако этот эффект не был доказан.
Токсин-опосредованные стафилококковые заболевания включают следующие:
Синдром токсического шока
Стафилококковый синдром ошпаренной кожи
Стафилококковое пищевое отравление
Упомянутые болезни обсуждаются далее в Р у к оводстве .
S. aureus вызываетбактериемию, которая часто приводит к появлению метастатических очагов инфекции, может возникнуть от инфекции S. aureus любой локализации, но особенно часто – от инфекции, связанной с присутствием внутрисосудистых катетеров или других инородных тел. Может также проявляться без какой-либо четко выявленной первичной локализации. S. epidermidis и другие коагулазонегативные стафилококки чаще вызывают внутрибольничную бактериемию, связанную с наличием внутрисосудистых катетеров и других инородных тел, так как они могут образовывать биопленки на этих материалах. Стафилококковая бактериемия является основной причиной заболеваемости (особенно удлинения периода госпитализации) и смертности среди ослабленных пациентов.
Инфекция кожи – наиболее распространенная форма стафилококкового заболевания. Поверхностные инфекции могут быть диффузными, с везикулярными пустулами, покрытыми коркой (импетиго), иногда в виде флегмоны или очаговыми с узловыми абсцессами (фурункулы и карбункулы). Более глубокие кожные абсцессы также широко распространены. Могут встречаться тяжелые некротизирующие инфекции кожи.




Стафилококки обычно являются причиной раневых и ожоговых инфекций, послеоперационных раневых инфекций и мастита или абсцесса груди у кормящих матерей.
Неонатальные инфекции обычно появляются у детей в течение 6 нед после рождения и включают:
Повреждения кожи с шелушением или без него
Пневмония, которая возникает в амбулаторных условиях, не является распространенной, однако может развиваться у пациентов
Пациенты, получающие кортикостероиды или иммуносупрессанты
Имеют хронические бронхолегочные или другие заболевания с высоким уровнем риска
Стафилококковая пневмония может быть первичной инфекцией, а также следствием гематогенного распространения инфекции S. aureus из других частей тела (например инфицирование внутривенного катетера, эндокардит, инфекция мягких тканей) или инъекционной наркомании. Однако S. aureus является частой причиной развития внутрибольничной пневмонии, включая вентиляторную пневмонию при ИВЛ
Стафилококковая пневмония иногда характеризуется формированием абсцессов легких, сопровождаемых быстрым развитием пневматоцеле и эмпиемы. Внебольничный MRSA часто является причиной развития тяжелой некротизирующей пневмонии.
Эндокардит может развиться у инъекционных наркоманов и пациентов с протезами клапанов сердца. Поскольку частота использования внутрисосудистых катетеров и имплантаций сердечных устройств увеличилась, S. aureus стал ведущей причиной бактериального эндокардита.
Эндокардит, вызванный S. aureus, является острым фебрильным заболеванием, которое часто сопровождается формированием висцеральных абсцессов, эмболий, перикардита, подногтевых петехий, кровоизлияний в конъюнктиву глаза, пурпуры, шумов в сердце и сердечной недостаточности, как следствие вторичного повреждения клапанов сердца.
Остеомиелит встречается наиболее часто у детей, вызывая озноб, лихорадку и боль поражённой кости. Впоследствии и мягкие ткани над зоной поражения становятся красными и отечными. Может наблюдаться суставная инфекция, что часто приводит к суставному выпоту, предполагая септический артрит, а не остеомиелит. Большинство инфекций позвонков и межпозвоночных дисков у взрослых связаны с S. aureus.
Стафилококковый синдром токсического шока может быть следствием применения вагинальных тампонов или осложнением любого типа инфекции S. aureus (например послеоперационная раневая инфекция, ожоговые инфекции, инфекции кожи). Хотя большинство случаев связано с метициллин-чувствительным S. aureus (MSSA), случаи, связанные с MRSA, становятся все более частыми.

Стафилококковый синдром ошпаренной кожи вызывается несколькими токсинами, так называемыми эксфолиатинами, и проявляется как детский эксфолиативный дерматит, характеризующийся крупными волдырями и шелушением верхнего слоя кожи. В конечном счёте происходит эксфолиация. Синдром "ошпаренной кожи" наиболее часто встречается у младенцев и детей
Стафилококковое пищевое отравление вызывается употреблением в пищу инфицированных стафилококками продуктов питания (устойчивый к высокой температуре стафилококковый энтеротоксин). Пища может быть заражена стафилококковыми носителями или людьми с выраженными заболеваниями кожи. В пище, недостаточно термически обработанной или оставленной при комнатной температуре, стафилококки активно размножаются и вырабатывают энтеротоксин. Многие продукты могут служить питательной средой, не изменяя при этом своих органолептических свойств (вкус и запах). Тяжелая тошнота и рвота начинаются спустя 2–8 ч после приема пищи, как правило, сопровождаемыми спазмами брюшной полости и диареей. Приступ непродолжительный, часто составляет 12 ч.
Диагностика
Цитобактерископия мазков, окрашенных по Граму, и посев на обогащенные питательные среды
Диагноз стафилококковой инфекции устанавливается после бактериоскопии мазков, окрашенных по Граму, и посевов инфицированного материала на питательные среды.
Необходимо провести тесты на восприимчивость, поскольку метициллин-резистентные микроорганизмы теперь повсеместно распространены и требуют альтернативной терапии.
Если подозревается стафилококковый синдром ошпаренной кожи, то следует провести посевы крови, мочи, носоглотки, отделяемого пупочного кольца, пораженной кожи или любого подозреваемого очага инфекции; интактные волдыри являются асептическими. Хотя диагноз обычно ставится клинически, биопсия зараженной кожи может помочь подтвердить диагноз.
Стафилококковое пищевое отравление обычно предполагают из-за регистрации однотипных случаев инфекции (например, в пределах семьи, среди посетителей массовых социальных учреждений или ресторанов). Подтверждение (как правило, отделом здравоохранения) подразумевает выделение стафилококков в подозрительной пище и иногда анализ на наличие энтеротоксинов.
При остеомиелите рентгенологические изменения могут не проявиться до 10–14 дней болезни, и размягчение кости, и периостальная реакция могут не выявляться и дольше. Отклонения по МРТ, КТ или сканирование радионуклида кости часто становятся очевидными раньше. Биопсия кости (открытая или перкутатная) должна быть проведена для идентификации патогена и анализа антибиотикорезистентности.
В некоторых учреждениях с высокой распространённостью метициллин - резистентных штаммов S. аureus обычно проверяют пациентов на стафилококковое носительство (активное наблюдение), используя лабораторные методы быстрой диагностики, чтобы оценить образцы мазков из носа. Некоторые учреждения проводят скрининг только у пациентов группы риска (например тех, кто поступает в отделение интенсивной терапии, у кого ранее была инфекция MRSA, кому планируются сосудистые, ортопедические оперативные вмешательства или операция на сердце).
Быстрая идентификация MRSA:
позволяет произвести изоляцию контактных носителей и, в случае необходимости предоперационной антибиотикопрофилактики против кожных микроорганизмов, назначить ванкомицин как часть их курса лечения
уменьшает распространение MRSA
может снизить частоту внутрибольничных инфекций MRSA
Однако лечение, направленное на деколонизацию (например, местное применение назального мупироцина), хотя иногда и проводится, но еще окончательно не доказало своей эффективности, так как выявлена резистентность к мупироцину. Ежедневное обмывание с хлоргексидином пациентов отделения интенсивной терапии снижает частоту инфекций, вызванных MRSA.
Лечение
Местные меры (например, санация раны, удаление катетеров)
Антибиотики выбираются с учетом тяжести заболевания и результатов антибиотикограммы
Контроль стафилококковых инфекций включает дренирование абсцесса, санацию некротической ткани, удаление инородных тел (включая внутрисосудистые катетеры) и назначение антибиотиков ( Лечение антибиотиками стафилококковых инфекций у взрослых).
Первоначальный выбор и дозировка антибиотиков зависят от
вероятности того, что задействованы резистентные штаммы
Таким образом, необходимо иметь данные о циркуляции антибиотикорезистентных штаммов в определенном регионе для стартовой терапии (и в конечном счете знать фактическую антибиотикочувствительность выделенного микроорганизма).
Лечение токсин-опосредованного стафилококкового заболевания (самым тяжелым из которых является синдром токсического шока) подразумевает деконтаминацию токсин-продуцирующих областей (ревизия хирургических ран, некрэктомия, промывание), интенсивную терапию (включая внутривенное введение жидкостей, вазопрессоры и респираторную поддержку), коррекцию водно-электролитного баланса и антибактериальные препараты. Доказательства in vitro свидетельствуют о предпочтительном назначении ингибиторов синтеза белка (например, клиндамицин по 900 мг внутривенно каждые 8 ч, линезолид 600 мг внутривенно каждые 12 ч) по сравнению с другими классами антибиотиков. В тяжелых случаях оправдано применение внутривенного иммуноглобулина.
Многие стафилококковые штаммы продуцируют пенициллиназу, фермент, который инактивирует некоторые бета-лактамные антибиотики; эти штаммы являются резистентными к пенициллину G, ампициллину и противопсевдомонадному пенициллину.
Внебольничные штаммы часто чувствительны к пенициллиназа-резистентным пенициллинам (например, метициллину, оксациллину, нафциллину, клоксациллину, диклоксациллину), цефалоспоринам, карбапенемам (например, имипенему, меропенему, эртапенему, дорипенему), тетрациклинам, макролидам, фторхинолонам, триметоприму/сульфаметоксазолу (TMP/SMX), гентамицину, ванкомицину и тейкопланину.
Изоляты MRSAстали повсеместно распространены, особенно в стационарах. Кроме того, внебольничный МRSA появился за последние несколько лет в большинстве географических регионов. Как правило, внебольничные MRSA обладают меньшей резистентностью ко многим антибиотикам, в отличие от внутрибольничных. Эти штаммы, хотя и резистентные к большинству бета-лактамов, обычно чувствительны к TMP/SMX, тетрациклинам (миноциклину, доксициклину) и часто чувствительны к клиндамицину, однако есть возможность развития резистентности к клиндамицину у штаммов с индуцируемой устойчивостью к эритромицину (эти штаммы могут быть выявлены с помощью D-теста). Ванкомицин эффективен против большинства MRSA, иногда в сочетании с рифампином и аминогликозидами при тяжелых инфекциях (таких как остеомиелит, инфекции протезированных суставов, эндокардит протезированного клапана). Назначение альтернативного препарата (даптомицин, линезолид, тедизолид, далбаванцин, оритаванцин, тигециклин, хинупристин/дальфопристин, TMP-SMX, возможно цефтаролин) следует рассматривать при лечении метициллин-резистентных штаммов S. аureus с МИК (минимальная ингибирующая концентрация) ванкомицина > 1,5 мкг/мл.
В США появились штаммы ванкомицин-резистентного S. aureus (VRSA; МИК > 16 мкг/мл) и штаммы S. aureus с умеренной чувствительностью к ванкомицину (VISA, МИК 4–8 мкг/мл). Для терапии инфекций, вызванных этими штаммами стафилококка, требуется назначение линезолида, тедизолида, хинупристина/дальфопристина, даптомицина, TMP/SMX или цефтаролина.
Поскольку распространённость метициллин - резистентных штаммов S. аureus увеличилась, стартовое лечение тяжелых стафилококковых инфекций (особенно тех, которые возникают в стенах учреждений здравоохранения) должно включать препарат с высокой активностью против метициллин-резистентного S. аureus. Таким образом, адекватными лекарственными средствами являются:
Для доказанных или подозреваемых инфекций кровотока– ванкомицин или даптомицин
Для пневмонии – ванкомицин, телаванцин или линезолид (т к даптомицин не проявляет должной активности в легких)
(1) Санкт-Перербургский НИИ фтизиопульмонологии; Северо-Западный государственный медицинский университет им. И.И.Мечникова
(2) Городская многопрофильная больница №2, Санкт-Петербург
Локальный мониторинг структуры возбудителей и их чувствительности к антибиотикам на уровне стационаров и его верификация при пункционной биопсии является основой для выбора рациональной эмпирической терапии в лечении неспецифического остеомиелита позвоночника (НОП). Анализ хирургического лечения 196 пациентов с НОП показал, что в посевах преобладала грамположительная микрофлора (75,2%), из которых в 57,3% (51 пациент) верифицированы различные штаммы стафилококков. У 11 пациентов выявлены штаммы MRSA. В 6 случаях входными воротами стафилококковой бактериемии являлся подключичный катетер. Госпитальные штаммы MRSA характеризовались полирезистентностью.
Ключевые слова: метициллин-резистентный стафилококк, спондилит, неспецифический остеомиелит позвоночника, антибиотикотерапия.
Сведения об авторе:
Вишневский А.А. – д.м.н., руководитель отдела фтизиовертебрологии, С.-Пб НИИ фтизоиопульмонологии
Nonspecific Osteomyelitis of the Spine Caused by Methicillin-resistant Staphylococcus: Rational Antibiotic Treatment
A.A. Vishnevsky (1), S.V. Babak (2)
(1) St-Petersburg SRC for Phthisiopneumology, and I.I.Mechnikov North-West State Medicine University, St.Petersburg
(2) City Multihospital №2, St.Petersburg
Monitoring of pathogens types and their antibiotics resistance at a hospital level, as well as pathogens verifying after needle biopsy is the basis for the treatment of non-specific osteomyelitis of the spine (NOS). Data gained from 196 surgical inpatients with NOP showed that Gram-positive pathogens (75,2% of all cases) prevailed in crops, among them there were 57.3% various strains of staphylococci (51 patients). In 11 patients (12,3% of all cases) MRSA strains revealed. In 6 cases a gateway for staphylococcal bacteremia was subclavian catheter. Nosocomial MRSA strains were characterized by polyresistance.
Keywords: methicillin-resistant staphylococcus, spondylitis, nonspecific osteomyelitis of the spine, antibiotic treatment.
Проблема выбора рациональной антибиотикотерапии (АБТ) при хирургических инфекциях, и в частности, при cпондилитах имеет не только медицинское, но и важное экономическое значение. Прежде всего, это определяется большими финансовыми затратами, обусловленными резистентными формами микроорганизмов. В бактериологических исследованиях послеоперационного материала при хирургическом лечении неспецифического остеомиелита позвоночника (НОП) в 70–80% случаев выявляют грамположительную микрофлору, которая более чем в половине случаев представлена различными штаммами золотистого стафилококка [1–3].
Рациональное применение антибиотиков имеет исключительное значение для хирургии, поскольку подразумевает не только получение хорошего результата при профилактике хирургической инфекции, но и при лечении уже развившейся нозокомиальной инфекции (НИ). На основании многочисленных исследований установлено, что в 40–60% случаев стартовая эмпирическая антибактериальная терапия НИ является неадекватной [4, 5]. В большинстве случаев это объясняется полирезистентностью микрофлоры [6, 7]. В частности, в 8,0–12,3% всех случаев НИ выявляются госпитальные штаммы золотистого стафилококка, которые характеризуются тем, что они нечувствительные ко всему классу бета-лактамов, включая карбапенемы [8–10].
В последние годы ВОЗ были разработаны специальные рекомендации, которым должны соответствовать препараты, применяемые для лечения инфекций: эффективность препарата не менее 95%, доступная цена, хорошая переносимость и малая токсичность, возможность однократного применения, пероральный прием, медленное развитие резистентности микроорганизмов к средствам терапии [1]. При этом подразумевается и снижение расходов на антибиотикотерапию, являющейся одной из самых затратных видов фармакотерапии в [12].
Таким образом, трудность терапии заболеваний, вызванных резистентными штаммами стафилококков, в первую очередь – MRSA, связана с ограничением выбора эффективных антибиотиков, а неадекватный эмпирический режим антибактериальной терапии существенно ухудшает прогноз, увеличивает длительность госпитализации и стоимость лечения.
Материал и методы
В период с 1995 по 2012 гг. в Санкт-Петербургском Центре хирургии позвоночника (Городская многопрофильная больница №2) и СПб НИИ фтизиопульмонологии было пролечено 196 больных НОП. Диагноз НОП у всех больных был верифицирован при гистологическом и бактериологическом исследованиях. Верификацию возбудителя проводили по методике культурологического типирования и определения чувствительности микроорганизма к антибиотику с применением дисков Научно-исследовательского центра фармакотерапии (С.-Петербург) и дисков фирмы Bristol Myers Squibb (Англия).
Результаты бактериологического исследования посевов крови позволили обнаружить микрофлору у 64 (32,6%) пациентов. При посевах крови и послеоперационного материала лишь у 89 (45,4%) больного верифицирована микрофлора. В посевах преобладала грамположительная флора – у 67 (75,2%) больного, у 22 (24,8%) пациентов выявлена грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, протей, клебсиелла и т.д.). Среди грамположительных микроорганизмов у 51 (57,3%) пациентов верифицированы различные штаммы стафилококков. У 11 (12,3%) пациентов выявлены MRSA штаммы.
Проведенный анализ материала показал, что у штаммов Staphylococcus aureus отсутствует чувствительность к природным и полусинтетическим пенициллинам, а также к цефалоспориновым актибиотикам III–IV поколений (цефипим, цефатоксим). В то время, сохраняется умеренная чувствительность к цефлоспоринам I–II поколения (цефазолину, цефамандолу, цефуроксиму) и в 50–70% случаев сохраняется чувствительность к гликопептидам (ванкомицин) и карбапенемам (меронем, имепинем) (табл. 1.). Эти данные согласуются с результатами исследования С.В.Яковлева [9], который показал, что чувствительность госпитальных штаммов S.aureus к оксациллину составляет 67%, к линкомицину – 56%, к ципрофлоксацину – 50%.
При неизвестном возбудителе все пациенты в качестве стартовой терапии в течении 2-х недель получали стартовую антибикотикотерапию (цефалоспориновые антибиотики I–II поколения в сочетании с аминогликозидами) [9]. В дальнейшем, в соответствии с полученными результатами посевов крови и биопсии, пациенты были разбиты на 2 группы. В первую группу (I) вошли пациенты (n=40), у которых был были выявлены микроорганизмы с широкий спектром чувствительности к антибиотикам. В качестве этиотропной терапии были использованы оксациллин или цефалоспориновые антибиотики. При выявлении резистентных штаммов стафилококка у 11 пациентов (II группа) были использованы гликопептиды (ванкомицин, линезолид, тейкопланин), карбапенемы (имипенем, меронем) или рифампицин в сочтеании с ко-тримоксазолом. Курс антибиотикотерапии был не менее 6–8 недель, поскольку при коротких курсах (до 2–3х недель) рецидивы заболевания возникают в 19–25% случаев [13, 14].
Своевременное назначение антибиотикотерапии дает лучшие результаты и позволяет в начальной стадии затормозить развитие НОП и снижает риск развития септического шока. Клиническая эффективность действия антибиотика проявляется снижением температуры тела, уменьшением выраженности болевого синдрома, как правило, на 2–3 сутки после назначения. Однако ориентироваться только на клинические признаки не следует. Целесообразно оценивать выраженность системного воспалительного ответа, определять концентрацию антибиотика в крови пациента [1, 2].
Затраты на АБТ разделяли на прямые и непрямые. Прямые затраты подразделяли на медицинские и немедицинские. При расчете прямых медицинских затрат были учтены следующие расходы, связанные с оказанием медицинской помощи:
1. Стоимость основной антибактериальной терапии.
2. Стоимость дополнительной антибактериальной терапии, назначенной в связи с неэффективностью основной антибактериальной терапии.
3. Стоимость пребывания пациента в стационаре рассчитывалась как стоимость пребывания пациента в специализированном отделении, умноженная на среднее количество суток, в течение которых пациенты каждой подгруппы в нем находились.
Стоимость пребывания пациентов в отделении и в палате интенсивной терапии была взята из тарифов Спб НИИФ (соответственно 1000 и 9000 руб. в сутки). Средний срок пребывания пациентов в стационаре для I группы составил 37,2±2,4 дня, для II – 57,1± 5,6 дня, для III – 54,4±2,8 дня. В данном исследовании стоимость оперативного вмешательства не учитывалась. Анализ прямых немедицинских затрат не проводился, т.к. все включенные в исследование пациенты с документированным диагнозом спондилит находились в отделении по поводу основного заболевания и прямые немедицинские затраты (транспортирование пациента в ЛПУ, спецодежда, питание, лабораторные материалы и др.) были приняты как одинаковые для обеих групп. Анализ непрямых затрат не проводился, т.к. протокол клинического исследования не предполагал сбор информации о социальном статусе пациентов и не представлялось возможным оценить затраты на оплату больничных листов, стоимость производственных потерь и т.д. (табл. 2).
Результаты исследования и обсуждение
В настоящее время нет оптимального антибиотика для стартовой терапии НОП, но с учетом преобладания грамположительной флоры для выбора эмпирической антибиотикотерапии пациенты в течении 2-х недель получали антибиотики широкого спектра действия (комбинация оксациллина, цефалоспоринов 1-го поколения или ингибиторозащищенных пенициллинов в сочетании с аминогликозидами). Таким образом, средние затраты на антибиотикотерапию до выявления возбудителя (2-недельный курс) составили от 1220 руб. (при комбинации оксациллина и гентамицина) до 3880 руб. (при сочетании ципрофлоксацина и гентамицина).
При выявлении резистентных штаммов стафилококка (II группа) предпочтительно использовать гликопептиды (ванкомицин, линезолид, тейкопланин), карбапенемы (имипенем, меронем) или циклические липопептиды (даптомицин). Менее затратным было использование рифампицина (0,45–0,9 г в сутки) в сочетании с ко-тримоксазолом. Использовать рифампицин в качестве монотерапии нельзя в силу того, что к нему быстро развивается устойчивость. Месячный курс антибиотикотерапии во II группе составлял от 15600 до 168 000 руб. (табл. 3.).
С целью оптимизации антибиотикотерапии при лечении НОП необходимо придерживаться следующих принципов выбора препарата:
- определение спектра антимикробной активности препарата in vitro;
- доказанная эффективность в контролируемых клинических исследованиях;
- определение способа введения препарата и его кратности;
- безопасность и отсутствие токсичности препарата;
- фармакоэкономическая обоснованность применения препарата.
Таким образом, при выборе эмпирической антибиотикотерапии при НОП следует ориентироваться на спектр потенциального возбудителя, учитывать первичные данные микробиологического исследования (посевы крови и материала свищевого содержимого), уровень эндотоксемии, тяжесть состояния пациента (по шкалам SAPS, APACHE). Кроме того, при выборе той или иной схемы антибактериальной терапии необходимо учитывать не только механизм действия препаратов, их групповую характеристику, но и особенности взаимодействия лекарственных средств между собой, а также особенности чувствительности микрофлоры в конкретном стационаре.
Мы не проводим операции на позвоночнике по поводу спондилита на фоне генерализованного септического состояния или при выраженном системном воспалительном ответе. В течение 2-3 недель необходима подготовка к операции, включающая дезинтоксикационную терапию, экстракорпоральную детоксикацию, рациональную антибиотикотерапию и т.д. Эти мероприятия позволили исключить возможные осложнения и летальные исходы при операциях.



Острый гематогенный метаэпифизарный остеомиелит (МЭО) у детей ранней возрастной группы продолжает оставаться тяжелым гнойно-септическим заболеванием в педиатрической хирургической практике [1,2]. В последнее десятилетие он занимает одно из первых мест в гнойно-септической хирургии по частоте исхода в бактериальный сепсис. Динамика количества случаев заболевания не имеет четкой тенденции к снижению, что подтверждается высокой частотой встречаемости патологического процесса среди новорожденных, в т.ч. маловесных недоношенных детей, имеющих ряд физиологических и иммунологических особенностей, усугубляющих тяжесть течения заболевания [3]. Значимым в этиологии является патоморфоз возбудителей последнего десятилетия, характеризующийся уменьшением частоты роста культур моностафилококковой флоры (Stafilococcusaureus) до 50 %. Отмечается активный рост микст-культур эпидермального стафилококка с другими микроорганизмами (клебсиеллами, энтерококками), их ассоциации с анаэробами и культурами грибов рода Кандида [4]. Многообразие клинических проявлений процесса и наличие атипичных форм могут увести от своевременной постановки диагноза МЭО. Этиопатогенез заболевания отличается тем, что до оссификации эпифизов имеет место морфофункциональная незрелость ростковой зоны, хондробласты расположены хаотически, их упорядочивание происходит параллельно оссификации эпифиза (от центра зоны роста в направлении к периферии), и в соответствии с этим зона роста постепенно приобретает барьерные свойства. Вот почему при отсутствии ядра окостенения, воспалительный процесс пенентрирует зону роста в центральной части, при появлении ядра оссификации пенентрация происходит в периферической части.
Поражение эпифиза сопровождается деструкцией последнего, с вовлечением в патологический процесс сустава и возникновением артрита, который в свою очередь приводит к патологическому вывиху и параартикулярной флегмоне. Дискредитированная ростковая зона частично или полностью погибает, и это в дальнейшем обусловливает возникновение приобретенных пороков развития (укорочение или удлинение, деформации конечностей).
Таким образом, исходом заболевания могут быть ортопедические осложнения, влекущие инвалидизацию ребенка, от 10 до 40 % случаев. МЭО представляет собой один из наиболее сложных вариантов течения гнойно-воспалительного процесса, требующего детального анализа течения заболевания, а также применения доступных для использования эффективных методов диагностики [5].
Цель исследования: изучить особенности клинического течения метаэпифизарного остеомиелита, провести сравнительный анализ возможностей различных методов диагностики.
Материалы и методы
В исследование включено 64 ребенка в возрасте от 0 до 3-х лет с острым гематогенным метаэпифизарным остеомиелитом, находившихся на стационарном лечении по поводу данного заболевания в отделении гнойной и экстренной хирургии ДОКБ г. Твери с 2005 по 2015 г. Для уточнения особенностей клинического течения различных форм МЭО был проведен анализ результатов стандартного комплекса клинико-диагностических мероприятий, проведенного у всех поступивших. Диагноз ставился на основании анализа жалоб больного, данных анамнеза, клинического осмотра, использовались методы бактериологической и лабораторной диагностики, методы медицинской визуализации (рентгенография, ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография).
Результаты исследования и их обсуждение
В структуре обследуемых больных наибольшую группу составили дети до 1 года (n=4875 %), наиболее часто заболевание возникало в возрасте до 1 месяца (n=30; 46.8 %), от 1 г. до 3-х лет госпитализировано 16 (25 %) детей (таблица 1).
Число пациентов, n
От 1 месяца до 1 года
От 1 года до 3-х лет
По половой принадлежности преобладали мальчики (n=39; 60.9 %). Больные из районов области составили 60.9 % (n=39). В первые трое суток болезни был госпитализирован 21 ребенок (32.8 %). Наибольшее число пациентов (n=33; 51.5 %) обратилось за помощью детского хирурга на 4–7 сутки заболевания. Оставшиеся в более поздние сроки (n=10; 15.5 %). Анализ сроков поступления в специализированный хирургический стационар выявил достаточно позднее обращение за медицинской помощью, что связано с трудностями ранней диагностики МЭО из-за многообразия клинических проявлений заболевания, отсутствия ранних патогномоничных жалоб, преобладания у малышей общих реакций над местными, особенностями психофизиологического статуса пациентов раннего возраста. Немаловажная роль принадлежит ошибкам диагностики на догоспитальном этапе. Учитывая распределение больных по месту обращения, замечено, что достаточно большая группа детей поступала из род. домов (n=17; 26.5 %), из стационара (отделение патологии новорожденных) – (n=21;32.8 %). По направлению участковых педиатров, хирургов травматологов (n=23;35.9 %), 3 человека обратились самостоятельно.
Для характеристики клинического течения МЭО использовалась классификация Т.П. Краснобаева. Встречалась местная форма (n= 53;82.8 %) заболевания, септикопиемическая (n= 11; 17.2 %), токсическая форма не зарегистрирована. Из септических осложнений на первом месте оказалась пневмония (n= 6;54.5 %). Также имели место перикардит (n=3;27.2 %), поражение почек (n=1; 9 %), средний гнойный отит (n=1;9 %). Локальная форма заболевания превалировала в возрастной группе от 1 г. до 3-х лет. Результаты оценки степени тяжести состояния показали, что дети поступали в стационар преимущественно в состоянии средней степени тяжести (n=36;56.2 %). В тяжелом состоянии доставлено 28 детей (43.7 %). Это связано с поздним обращением за специализированной хирургической помощью, низкой иммунологической резистентностью детского организма, быстрым нарастанием симптомов интоксикации ввиду выраженности альтеративного компонента воспалительной реакции в раннем возрасте. Дети, поступившие в тяжелом состоянии, были госпитализированы в отделение реанимации, где проводилось непрерывное мониторирование жизненно важных функций организма и интенсивная комплексная терапия заболевания. В типичных случаях заболевание начиналось остро: (n=52; 81.2%), возникала резкая боль в пораженной конечности (n= 49; 76.5 %). Появлялись и нарастали симптомы интоксикации: повышение температуры тела (n=60; 93.7 %), вялость, отказ от еды (n= 44; 68.7 %). В тяжелых случаях возникала тахикардия (n=9; 14 %), тахипноэ (n=8; 12.5 %) менингеальные явления (n=4; 6.25 %).
При клиническом осмотре обращало на себя внимание вынужденное положение конечности, ограничение или отсутствие активных движений, болезненность при пальпации и попытке пассивных движений. (n=56; 87.5 %), отмечалась выраженная стойкая контрактура суставов (n=48; 75 %), что связано с вовлечением в процесс связочного аппарата и параартикулярных тканей. В более поздние сроки появлялось увеличение объема сустава из-за наличия в его полости жидкости (2–5 сутки и позже), гиперемия над очагом поражения –(n= 43; 67 %).
Факторы риска развития заболевания выявлены в 34 (53.1 %) случаях. Это –неблагоприятный антенатальный период: внутриутробная гипоксия плода разной степени выраженности, очаги хронической инфекции, синдром интоксикации у матери, оперативные роды, травматизация в родах, недоношенность, перинатальное поражение ЦНС, катетеризация центральной вены, низкая оценка по шкале Апгар, предшествующие гнойные заболевания. Важная роль отводится гипоксии не только как промоутеру каскада метаболических нарушений, но и фактору, способствующему развитию генерализованных форм МЭО. Результаты проведенных исследований показали, что у всех больных с септикопиемической формой выявлены факторы риска [6,7].
По локализации остеомиелитического очага преобладало поражение эпифизов длинных трубчатых костей скелета с поражением суставов в виде гнойных артритов: бедренной кости с поражением тазобедренного сустава (n=26;40.6 %), большеберцовой (n=13; 20 %), малоберцовой (n=11; 17.1 %), костей предплечья (n=5;7.8 %). Множественное поражение костей при МЭО отмечено у 2 (3 %) детей.
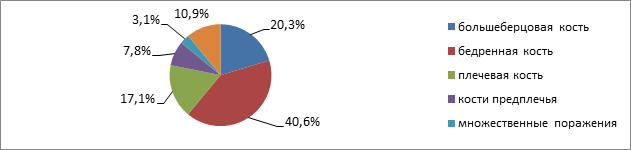
Рис.1. Локализация очага воспаления
С целью выявления этиологического фактора заболевания применялись бактериоскопический и бактериологический методы исследования с определением чувствительности микрофлоры к антибиотикам. При первичном заборе биоматериала идентифицирован возбудитель у 46(71.8 %) больных. Анализ полученных результатов показал, что в большинстве случаев основным этиологическим фактором является золотистый стафилококк (n=28;43.7 %), также были обнаружены другие виды стафилококка (n=4;8.6 %), энтерококк и клебсиелла (n=2;3.1 %) в равных количествах, гемолитический стрептококк (n=3;4,6 %), протей (n=1;1.5 %), кишечная и синегнойная палочка (n=2;3.1 %) и (n=1;1.5 %) соответственно, полифлора (n=3;4.6 %).
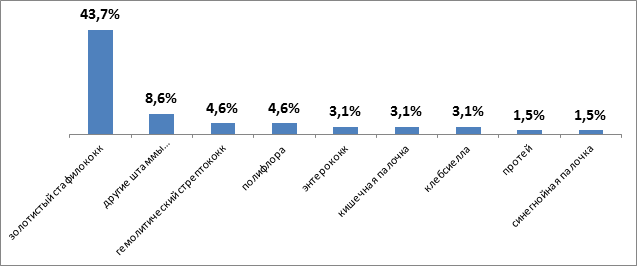
Рис. 2. Результаты высева микрофлоры из очага поражения
При анализе изменений состава периферической крови, констатирована анемия (n= 34;53.1 %), лейкоцитоз (n= 57;89 %), палочкоядерный сдвиг (n= 49; 76.5 %), ускорение СОЭ (n=28; 43.7 %). У больных с септикопиемической формой регистрировалась тромбоцитопения (n=11;7.2 %) у большинства пациентов имелись признаки системного воспалительного ответа (нейтрофильный лейкоцитоз со сдвигом формулы влево). В биохимическом анализе крови сохранялась нормогликемия (n=58; 90.6 %). Гипергликемия зарегистрирована с максимальным значением 13 ммоль/л (n=4; 6.25 %). Гипогликемия с минимальным значением 2.8 ммоль/л (n=2; 3.1%). Изменения белкового спектра крови проявлялись умеренной гипопротеинемией (n=29; 45.3 %). Повышение уровня С-реактивного белка как неспецифического маркера воспаления определялось качественным методом, было положительным (n= 44; 68.7 %) и резко положительным (n=13;20.3 %). Также имел место отрицательный результат (n= 7; 10.9 %). Лабораторные показатели, характеризующие функцию почек, оставались в пределах референтных значений. Средние значения электролитного обмена соответствовали возрастной норме. В ряде случаев отмечено изменение фибринолитической активности (n= 24;37.5 %).
В последнее десятилетие МЭО занимает одно из первых мест в гнойно-септической хирургии по частоте исхода в бактериальный сепсис. Для ранней диагностики септического процесса, в случае ухудшения состояния ребенка проводился прокальцитониновый тест сыворотки крови экспресс-методом по Brachms (n= 14; 21 %). Выполнение исследования позволило определить клиническую форму заболевания. В результате была диагносцирована местная форма (n=5;7.8 %) – прокальцитонин сыворотки крови 2 состояние трактовалось как сепсис, осложнивший остеомиелит – (n= 9;14 %).
На диагностическом этапе установления МЭО применяли различные методы медицинской визуализации. В качестве стандартизированного лучевого метода исследования опорно-двигательного аппарата стартовым являлась рентгенография пораженного отдела скелета. (n=64; 100 %). Метод позволял оценить форму, контуры, соотношения между костями. Ранние рентгенологические признаки заболевания в виде утолщения мягких тканей на уровне поражения, расширения суставной щели, размытости контуров эпифиза, остеопороза края метафиза выявлены в среднем на 3–5 день болезни (n=19;29.6 %). На 10–14 день болезни регистрировалась периостальная реакция и очаги деструкции в метаэпифизарной зоне (n= 47; 73.4 %). Рентгенографический метод не обладает достаточной чувствительностью к визуализации хрящевых структур в начальные периоды развития заболевания.
Магнитно-резонансная томография (МРТ) является высокоинформативным методом, обладающим высокой чувствительностью и достаточной специфичностью в интрамедуллярную фазу МЭО, позволяет выявить изменения костного мозга, определить так называемые участки патологической гидратации, а также оценить суставные поверхности и околосуставные мягкие ткани. К недостаткам метода следует отнести необходимость проведения анестезиологического пособия для исключения двигательной активности пациентов младшей возрастной группы во время исследования. МРТ использовали в качестве уточняющей методики в интрамедуллярную фазу (n=4 ;6.25 %) [8].
Компьютерная томография (КТ) – метод выбора для оценки суставных поверхностей, мягких тканей, изменений костного мозга, позволяет выявить отек мягких тканей и деструкцию кости, не замеченную на обычных рентгенограммах, наилучший метод выявления секвестров. КТ недавно внедрена в работу клиники (n=8;12.5 %). Сопряжена с лучевой нагрузкой, зарекомендовала себя как оптимальный способ ранней диагностики МЭО, уже на 2-е сутки заболевания в кортикальном слое проявляются отчетливые рентгенодеструктивные изменения костных структур.
Ультразвуковая диагностика выполнена всем пациентам с МЭО (n=64;100 %), в дебюте заболевания (n=29;45.3 %). Методика показала высокую информативность (80 %), верифицируемую во время операции. Проникающая способность ультразвука у детей раннего возраста большая, чем у более старших, что связано с незавершенным процессом остеогенеза, когда эпифизы костей состоят в основном из хрящевой ткани. Исследование позволило оценить состояние мягких тканей, определить анатомические взаимоотношения в суставе, состояние капсулы (уплотнение и утолщение), суставной полости, ядер окостенения, определить утолщение надкостницы, распознать поднадкостничные абсцессы, визуализировать участки деструкции кости в метаэпифизарной зоне [9,10]. В процессе проведения исследования были обнаружены следующие УЗ-признаки изменения анатомических структур: утолщение мягких тканей, повышение эхогенности, жидкостные парартикулярные скопления (n=32;50 %); изменения внутрисуставной полости (утолщение капсулы сустава, наличие внутрисуставной жидкости – n=39;60.9 %); изменения однородности эпифизарного хряща (n=34;53 %); изменение формы и структуры ядра окостенения эпифизарного конца конечности (n=27;42.1 %); изменения метаэпифизарной зоны (нечеткость, неровность дефект зоны предварительного обызвествления, анэхогенные участки и включения – n=43 67.1 %); изменения надкостницы (неровность наружного контура, утолщение, повышение эхогенности n=25;39 %). Основной УЗ-признак МЭО –изменения в метаэпифизарной зоне – появлялся на 4–7 день болезни.
Выводы и заключение
Т.о., резюмируя полученные результаты, отмечено, что метаэпифизарный остеомиелит наиболее часто встречается в группе новорожденных детей, у каждого из которых обнаружены факторы риска возникновения заболевания в виде внутриутробной гипоксии плода, наличия очагов хронической инфекции и синдрома интоксикации у матери, недоношенности. В большинстве случаев в дебюте заболевания преобладало наличие общей симптоматики. Локальные проявления прогрессировали медленно. Основным этиологическим фактором являлся золотистый стафилококк. Первичный очаг воспаления локализовался преимущественно в эпифизах длинных трубчатых костей нижних конечностей. В ранней диагностике заболевания методом выбора является компьютерная томография и ультразвуковое исследование.
Читайте также:


