Что такое гиперкератоз слизистой оболочки пищевода



Пищевод Барретта (ПБ) представляет собой заболевание, развивающееся в результате замещения многослойного плоского эпителия пищевода специализированным цилиндрическим эпителием [1]. ПБ является грозным осложнением гастроэзофагельной-рефлюксной болезни и в большинстве случаев протекает на фоне грыжи пищеводного отверстия диафрагмы. Частота выявления пищевода Барретта составляет от 2,4 до 4 % в среднем по популяции [2,3]. Однако значительное число больных, имеющих симптомы гастроэзофагеального рефлюкса (ГЭР), самостоятельно бесконтрольно в течение продолжительного времени применяют различные медикаментозные средства, чаще широкодоступные антациды, не обращаясь к врачам [4], поэтому значительная часть больных с пищеводом Барретта остается невыявленной [5]. Прогрессирование пищевода Барретта может приводить к дисплазии слизистой оболочки до возможного развития рака пищевода [6]. По данным ряда авторов в России, США, странах Западной Европы, а также в ряде стран Азии за последние 10 лет отмечается резкий подъем заболеваемости аденокарциномой пищевода [7]. В диагностике ПБ решающее значение имеют эндоскопическое исследование с морфологической верификацией диагноза. Эндоскопически пищевод Барретта рассматривается как ярко-розовые патологические участки на фоне бледно-розовой слизистой пищевода, отходящие от слизистой оболочки выше кардиоэзофагеального перехода (КЭП) – “языки пламени”. Обязательным критерием диагноза является наличие кишечной метаплазии. На сегодняшний день рекомендованным методом взятия биопсийного материала при ПБ является прицельная биопсия с четырехквадрантным методом забора материала через каждые 2 см. С целью повышения эффективности визуализации очагов метаплазии при проведении эндоскопического исследования широко применяются: метод хромоскопии с использованием красителей (раствора Люголя, метиленового синего, уксусной кислоты, индигокармина), осмотр слизистой оболочки с использованием увеличительной и узкоспектральной эндоскопии (режим NBI), а также конфокальная лазерная эндомикроскопия. В 2004 году в Праге Международной Рабочей Группой по классификации эзофагитов выдвинуты критерии на основании максимальной длины языков пламени (М) и максимальной длины циркулярного сегмента пищевода Барретта (С). В Пражской классификации учитываются очаги пищевода Барретта протяженностью 1 см и более, находящиеся выше КЭП [4]. По длине сегмента пищевода Барретта выделяют: короткий сегмент – от 1 до 3 см и длинный сегмент – более 3 см. Что касается вопроса лечения ПБ, то обзор отечественной и зарубежной литературы показал, что не существует единых подходов к лечению ПБ. В последнее время широко применяются эндоскопические методики, такие как аргон-плазменная коагуляция (АПК), фотодинамическая терапия, криоабляция, лазерная коагуляция и др. [8]. Тем не менее требуются дальнейшие исследования для оптимизации методов диагностики и лечения ПБ.
Цель исследования
Улучшение результатов лечения пациентов с пищеводом Барретта.
Материалы и методы
В хирургическом отделении клиники Ростовского государственного медицинского университета проходили лечение 125 пациентов с диагнозом – осложненная грыжа пищеводного отверстия диафрагмы, среди них – 27 пациентов с подозрением на метаплазию эпителия. Основными жалобами пациентов являлись изжога, боль за грудиной, отрыжка, регургитация, обусловленные наличием ГЭР. Практически все пациенты отмечали длительный анамнез симптомов гастроэзофагельной-рефлюксной болезни.
Всем пациентам выполнялось эндоскопическое исследование с биопсией подозрительных участков (в том числе применялся метод хромоскопии раствором метиленового синего и использовался режим NBI). Протокол эндоскопического исследования составлялся на основании клинических рекомендаций, принятых на XVIII Съезде Общества Эндоскопических Хирургов России, проходившем в Москве 2015 году [9].
В 19 наблюдениях был подтвержден диагноз пищевод Барретта. Возраст больных колебался от 17 до 72 лет (средний возраст составил 49,9 ± 14,7 лет). Частота заболевания у мужчин составила 47,3 %, у женщин – 52,7 %.
Алгоритм лечения пищевода Барретта включал несколько составляющих (рис. 1).

Рис. 1. Схема лечения пищевода Барретта
В до- и послеоперационном периоде проводилась медикаментозная терапия, направленная на снижение кислотности желудочного сока, нейтрализацию выработанной соляной кислоты, ускорение эвакуации пищи из желудка. Использовались следующие группы препаратов:
- Ингибиторы протонной помпы.
- Антацидные препараты.
- Прокинетики.
Всем пациентам выполнена операция Ниссена или Ниссена – Розетти из лапароскопического доступа, заключающаяся в восстановлении функции кардиального сфинктера, устранение ГЭР и клинических проявлений.
Следующим этапом выполнялись сеансы АПК с использованием электрохирургической станции ERBEVIO 300 Dсо следующими параметрами:
- режим: FORСED APC,
- мощность: 30 – 32 Вт,
- расход аргона: 2 – 2,2 л/мин.
За 1 сеанс проводилась коагуляция пораженного участка площадью не более 4 см². Время манипуляции составляло около 5–7 мин. Всем пациентам сеансы АПК проводились в амбулаторных условиях под внутривенной седацией. После лечения осуществлялся эндоскопический контроль с биопсией.
Результаты и их обсуждение
При эндоскопическом исследовании у 27 пациентов с подозрением на ПБ выявлены признаки метаплазии эпителия и рефлюкс-эзофагит различной степени тяжести. После патоморфологического заключения у 19 пациентов верифицирован эпителий кишечного типа (таблица). У 8 пациентов отмечалась желудочная метаплазия, данным пациентам выполнено хирургическое лечение по поводу грыжи пищеводного отверстия диафрагмы с медикаментозной коррекций и рекомендован эндоскопический контроль с биопсией каждые 3 года.
Распределение пациентов по патоморфологическому заключению
абс.
Кишечная метаплазия без дисплазии
Дисплазия низкой степени
Дисплазия высокой степени
Всего
27
100,0
Патоморфологическое исследование заключалось в фиксации биопсийного материала в забуференном 10 % растворе формалина в течение 24 часов от момента его поступления в патологоанатомическое отделение с последующей спиртовой проводкой по обычной методике. В последующем, фрагменты биопсийного материала заливались в парафин, проводилась микротомия с толщиной среза не более 3 мкм, после чего гистологические срезы окрашивались гематоксилином-эозином, пикрофуксином по Ван Гизон, по Хочкиссу (ШИК-реакция) с докраской альциановым – синим PH-2,0. Данные методики позволяли оценить степень секреторной активности клеток эпителия, накопление в нем кислых и нейтральных мукополисахаридов, состояние бокаловидных клеток при наличии метаплазии, дисплазии (высокой и низкой степени). Оценка морфологических изменений проводилась с использованием полуколичественных методов оценки.
Так как в настоящее время существуют разногласия в патоморфологической оценке степени выраженности дисплазии железистого эпителия при пищеводе Барретта в американских (европейских) и японских исследованиях, мы придерживались рекомендаций международной группы ученых [10].
Из 19 пациентов с ПБ в 12 случаях преобладал длинный сегмент метаплазии эпителия, у 7 пациентов – короткий сегмент. Для адекватной оценки длины сегмента метаплазированного эпителия при выполнении эндоскопического исследования особое внимание необходимо уделять определению истинной границы КЭП. Основными ориентирами КЭП принято считать дистальный край палисадных сосудов слизистой оболочки пищевода и проксимальный край складок кардиального отдела желудка. Наличие признаков рефлюкс-эзофагита, степень инсуффляции при исследовании, а также анатомические варианты сосудов пищевода могут приводить к трудностям в определении КЭП и требуют определенного навыка со стороны специалиста, проводимого исследование. Размеры сегментов ПБ необходимо определять с использованием Пражских критериев. Для лучшей визуализации патологических участков самыми оптимальными и простыми методами являются хромоскопия и осмотр слизистой оболочки пищевода в режиме NBI, не требующие дополнительных затрат и специального оборудования, но достаточно высокоэффективные. Таким образом, в комплекс диагностических мероприятий пациентов с подозрением на ПБ должны обязательно входить: эндоскопическое исследование в обычном режиме и с использованием узкоспектральной эндоскопии, биопсия подозрительных участков через каждые 2 см. С целью стандартизации описания изменений при ПБ необходимо вести протоколы эндоскопических исследований (рис. 2).
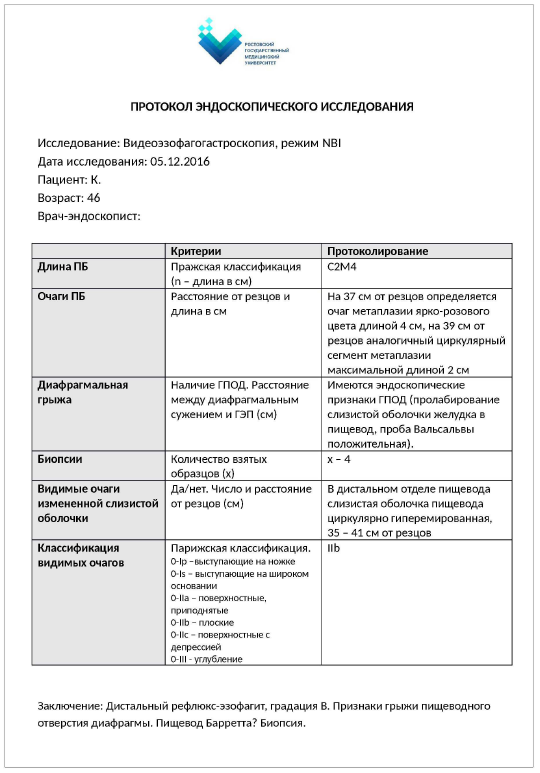
Рис. 2. Пример протокола эндоскопического исследования при пищеводе Барретта
Мы считаем, что лечение ПБ должно иметь комплексный подход, а именно, проведение медикаментозной терапии в пред- и послеоперационном периоде, выполнение антирефлюксных операций и последующие сеансы аргон-плазменной коагуляции [11].
Все наши пациенты в предоперационном периоде получали медикаментозную терапию, длительность которой зависела от степени повреждения слизистой оболочки пищевода. В настоящее время нет убедительных данных относительно регрессии метаплазии эпителия на фоне консервативной терапии. Медикаментозная терапия направлена лишь на уменьшение клинических проявлений рефлюкс-эзофагита.
Антирефлюксная хирургия не приводит к уменьшению сегментов ПБ, но это единственный метод, позволяющий восстановить функцию кардиального сфинктера и устранить гастроэзофагеальный рефлюкс с его последствиями, благодаря чему снижается воздействие кислой среды на слизистую оболочку пищевода, уменьшается воспаление тканей, тем самым создаются благоприятные условия для эффективного выполнения эндоскопического лечения ПБ. Всем пациентам с ПБ показано хирургическое лечение. Операциями выбора мы считаем операции Ниссена или Ниссена – Розетти из лапароскопического доступа. По нашим исследованиям первичное эндоскопическое лечение ПБ, т. е. до выполнения антирефлюксных операций, неэффективно и может приводить к неудовлетворительным результатам.
Через 1–1,5 мес после операции и стихания воспалительных изменений в пищеводе пациентам выполнялась эндоскопическая АПК. В ближайшем периоде после АПК осложнений лечения не отмечено. Болевой синдром после проведения АПК отмечался у 2-х пациентов, но купировался в течение 10-15 мин. применением антацидных препаратов с анестетиком. После выполнения эндоскопической АПК все пациенты возвращались к привычной деятельности на следующий день.
В зависимости от размеров сегмента метаплазии в среднем выполнялись от 1 до 5 сеансов АПК. Каждый повторный сеанс АПК проводили через 1–1,5 мес., это срок, достаточный для уменьшения посткоагуляционного отёка и визуализации границ эпителизации. За 1 сеанс площадь коагуляции поражённого участка составляла не более 4 см 2 , что практически не вызывает болевой реакции и снижает риск развития рубцовых стриктур пищевода. При проведении АПК воздействие начинали с краёв метаплазированного сегмента, что позволяло чётко отграничить патологический очаг, который требовал абляции.
Эндоскопическое лечение ПБ обеспечивает полное удаление очагов метаплазии эпителия. Из всех эндоскопических методик мы отдаем предпочтение АПК, так как данный метод лечения характеризуется высокой безопасностью применения с минимальными побочными эффектами и осложнениями.
В сроке до 3-х лет у 14 пациентов курс лечения полностью завершен. У данных пациентов отмечается полная регрессия метаплазированного эпителия и замещение его типичным многослойным плоским эпителием, подтвержденная гистологическим исследованием (Рис. 3). Еще 5 пациентов продолжают лечение.
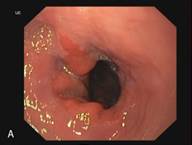
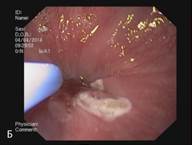
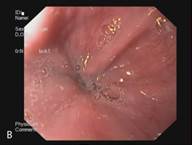
Рис. 3. Эндоскопическая картина пищевода Барретта. А – Эзофагоскопия. Слизистая оболочка пищевода до лечения, сегмент пищевода Барретта. Б – Аргон-плазменная коагуляция. В – Эзофагоскопия. Слизистая оболочка пищевода после лечения, полная регрессия метаплазированного эпителия
Обязательным условием при ведении пациентов с ПБ является эндоскопический контроль с биопсией, который необходимо осуществлять через 3, 6 и 12 мес. после лечения, затем (при длине сегмента более 3 см) – 1 раз в год, при длине сегмента менее 3 см – 1 раз в 2 года.
Выводы
- Комплекс диагностических мероприятий при пищеводе Барретта должен состоять из эндоскопического (с использованием методов, повышающих визуализацию) и морфологического исследований (прицельная биопсия + четырехквадрантный метод забора материала через каждые 2 см).
- Лечение пациентов с пищеводом Барретта должно иметь комплексный подход. Всем пациентам с пищеводом Барретта показано выполнение антирефлюксных операций. В пред- и послеоперационном периоде должна проводиться медикаментозная терапия, направленная на снижение кислотности желудочного сока, нейтрализацию выработанной соляной кислоты и ускорение эвакуации пищи из желудка.
- Аргон-плазменная коагуляция должна проводиться в зависимости от длины сегмента метаплазии, с интервалами 1–1,5 мес., с эндоскопическим и гистологическим контролем. За 1 сеанс площадь коагуляции метаплазированного участка не должна составлять более 4 см².
- Эндоскопический контроль с биопсией должен осуществляться через 3, 6 и 12 мес., а затем (при длине сегмента более 3 см) – 1 раз в год, при длине сегмента менее 3 см – 1 раз в 2 года.
| Авторы: Ильченко А.А. / Шибаева Л.О. / Чикунова Б.З. / Сперанский А.А. |
А.А. Ильченко, Л.О. Шибаева, Б.З. Чикунова, А.А. Сперанский
У 134 больных желчнокаменной болезнью изучено состояние слизистой оболочки пищевода, желудка и двенадцатиперстной кишки. В пищеводе в 54% случаев выявлены гиперкератоз и акантоз слизистой оболочки и в 17% признаки хронического эзофагита. При желчнокаменной болезни, протекающей самостоятельно, хеликобактерный гастрит обнаружен в 49% случаев, а при сочетании с язвенной болезнью двенадцатиперстной кишки в 70%. В слизистой оболочке двенадцатиперстной кишки у 72% больных желчнокаменной болезнью изменений найдено не было, в 28% изменения соответствовали хроническому умеренно выраженному дуодениту.
Течение желчнокаменной болезни (ЖКБ) сопровождается целым комплексом клинических симптомов со стороны верхнего отдела пищеварительного тракта. Вместе с тем характер патологических изменений со стороны пищевода, желудка и двенадцатиперстной кишки у больных ЖКБ изучен недостаточно. В то же время в литературе обсуждаются возможные патогенетические механизмы взаимосвязи изменений в гастродуоденальной зоне с патологией гепатобилиарной системы[1,8].
Цель работы - оценить состояние слизистой оболочки пищевода, желудка и двенадцатиперстной кишки у больных ЖКБ, в том числе и в сочетании с язвенной болезнью двенадцатиперстной кишки (ЯБДК).
Обследовано 134 больных ЖКБ в возрасте от 18 до 70 лет (103 женщины и 31 мужчина). Из них в 98 случаях ЖКБ протекала без сопутствующей патологии, а в 36 сочеталась с ЯБДК. В качестве контрольной группы обследовано 353 больных ЯБДК.
Клиническая картина у большинства больных характеризовалась симптомами, свидетельствующими о патологии желчного пузыря и желчевыводящих путей, основными из которых являлись боли в правом подреберье, временами усиливающихся до приступов желчных колик.
У части больных на первый план выступал симптомокомплекс разнообразных клинических проявлений в виде болевого, диспепсического или регуртационного синдромов, указывающих на патологию органов верхнего отдела пищеварительного тракта - ноющие боли и чувство тяжести в эпигастрии после еды, изжога, тошнота, отрыжка воздухом, чувство горечи во рту.
Диагноз ЖКБ и функциональное состояние желчного пузыря устанавливали по данным серийных ультразвуковых исследований и пероральной холецистографии. Наличие дуодено-гастрального и гастро-эзофагального рефлюкса определяли с помощью компьютерной внутрижелудочной рН-метрии.
Для оценки характера морфологических изменений со стороны верхнего отдела пищеварительного тракта всем больным проводили эзофагогастродуоденоскопию с множественными прицельными биопсиями из слизистой оболочки нижней трети пищевода, антрального и фундального отделов желудка, проксимальной части двенадцатиперстной кишки.
Биопсийный материал фиксировали в 10% нейтральном, забуференном по Лилли формалине. Серийные парафиновые срезы окрашивали гематоксилином и эозином. Для выявления Helicobacter pylori (HP) биопсийный материал окрашивали по методу Гимзы без дифференцировки. При изучении гистологических препаратов выделяли 3 степени обсеменения слизистой оболочки при увеличении х630 - слабая (+) - до 20 микробных тел в поле зрения, средняя (++) - до 50 микробных тел в поле зрения и высокая (+++) - более 50 микробных тел в поле зрения.
В гистологических препаратах полуколичественным методом при помощи визуально-аналоговой шкалы, предложенной модифицированной классификацией Сиднейской системы для оценки выраженности морфологических изменений слизистой оболочки желудка, определяли инфильтрацию нейтрофилами собственной пластинки слизистой оболочки, хроническое воспаление, атрофию, кишечную и желудочную метаплазию.
| Характер изменений | Количество случаев (%) | ||
| ЖКБ | ЖКБ + ЯБДК | ЯБДК | |
| без патологии | 16 (30,8%) | 3 (8,3%) | 20 (62,5%) |
| хронический эзофагит | 8 (15,4%) | 11 (30,6%) | 4 (12,5%) |
| гиперкератоз и акантоз | 28 (53,8%) | 22 (61,2%) | 8 (25,0%) |
| 52 (100%) | 36 (100%) | 32 (100%) | |
Только в 15% случаев в слизистой оболочке пищевода у больных с ЖКБ была выявлена морфологическая картина хронического эзофагита. При сочетании ЖКБ с ЯБДК частота обнаружения патологических изменений в пищеводе повышалась до 91,7%.
При этом признаки хронического эзофагита выявлены у 30 % больных (у 11 из 36), что было в 2 раза чаще, чем у больных ЖКБ и ЯБДК, протекающей самостоятельно.
Эти данные превышали и показатели частоты выявления пептического эзофагита у больных только ЯБДП, полученные и другими исследователями [4].

Это состояние наблюдается при усиленном делении плоскоклеточного эпителия пищевода (гиперплазии) и обычно рассматривается как доброкачественное.
При Национальной токсикологической программе в США (NTP) создан атлас неопухолевых поражений. Там дается определение этому поражению.
Гиперкератоз – это обычное для пищевода изменение и проявляется утолщением плоскоклеточного эпителия, ороговением его, и в дальнейшем приводящим к его отмиранию и слущиванию. Врач-гистолог может определить его в двух видах в зависимости от наличия ядра в клетке и назвать этот процесс, либо – ортокератоз (нет ядра), либо – паракератоз (есть ядро, но оно сморщенное, измененное). Сразу оговорюсь, что гиперкератоз не принято делить на ортокератоз и паракератоз в диагностике, но это должно быть отчетливо описано в гистологическом отчете.
Гиперкератоз – это частое сопровождение гиперплазии
Гиперкератоз часто наблюдается при плоскоклеточной гиперплазии, как правило, не диагностируется как отдельный процесс, хотя он, может быть упомянут в описании в гистологическом отчете.
Многие годы, были уверены, что единственным достоверным критерием эзофагита было наличие воспаления в слизистой пищевода. Тем не менее, в начале 20 века исследователями впервые была обнаружена плоскоклеточная гиперплазия пищевода у некоторых пациентов с клиническими симптомами рефлюкса, но нормальной или минимально измененной слизистой пищевода при эндоскопии. Это открытие стало ранним гистологическим признаком начального повреждения слизистой пищевода при рефлюксе. Обнаруженная закономерность также применима и у младенцев, и у детей старшего возраста.
При изучении гиперкератоза у животных в аноректальной зоне, избыток утолщенной слизистой, предположительно, уменьшается в результате механического удаления его путем прохождения пищи, т.е. слущивания. При анорексии (голодании) гиперкератоз наряду с наличием в пищеводе обычно также присутствует и в кардиальном отделе желудка. В таких ситуациях, в тканях мы не найдем никаких доказательств гиперплазии.
Если выставляется гиперкератоз без гиперплазии или когда он выраженный (распространенный), то процесс должен быть описан и оценен по степени тяжести на основании утолщения слизистой и обширности зоны поражения пищевода.
На возникновение гиперкератоза влияет рацион питания с низким содержанием клетчатки, низким содержанием белка, или жидкие диеты, влекущие увеличение толщины эпителиального слоя. Кроме того, в опытах in vivo показано, что у животных, которые не едят, часто возникает гиперкератоз пищевода без сопутствующего усиления деления клеток (гиперплазии). Кроме того, витаминный дисбаланс и дефицит цинка может привести к паракератозу и связанного с ним плоскоклеточной гиперплазии.
Linda H. Kooistra, DVM, PhD, DACVP Pathologist Charles River Laboratories, Inc. Research Triangle Park, NC
Abraham Nyska, DVM, Diplomate ECVP, Fellow IATP Expert in Toxicologic Pathology Visiting Full Professor of Pathology Sackler School of Medicine, Tel Aviv University Timrat Israel
![]()
Про эффект ноцебо и глупых пациентов
Выявили эффект ноцебо все в тех же экспериментах с лекарствами. Добровольцы принимали таблетки-пустышки под видом препаратов, а потом рассказывали не только о предполагаемом эффекте, но и о побочных действиях. И это не какая-то редкость: по данным обзора 2013 года в Nature Reviews, 72% участников клинических исследований, которые изъявили прекратить участие в эксперименте из-за побочек от приема лекарств, были в группе плацебо.
И что бы вы думали. Разумеется, дорогой крем раздражал кожу гораздо сильнее дешевого. И жалобы на этот эффект у испытуемых со временем только нарастали (очевидно, в их представлении побочное действие имело накопительный эффект). В это же самое время дешевый крем почти не вызывал неприятных ощущений.
Кстати, у плацебо есть подобное свойство: чем сложнее и дороже псевдолечение, тем лучший эффект оно дает. Скажем, плацебо-операции, когда пациенту дают наркоз, делают надрез, а потом зашивают его, не проводя никаких манипуляций с больным органом, гораздо эффективнее, нежели плацебо-таблетки.

Рис. 1. Схематическое изображение эпителия в месте сочленения пищевода (Oesophagus) и желудка (Stomach), в котором встречаются эпителиальные клетки разных типов. Переходный эпителий (Transitional epithelium) образован базальными (Basal layer) и люминальными (Luminal layer) клетками, которые характеризуются различным уровнем экспрессии трех белков-маркеров (p63, KRT5 и KRT7). Рефлюкс, вызванный желчными кислотами, или нарушение экспрессии каких-то генов могут вызвать превращение эпителия пограничной области в аномальный — подобный эпителию кишечника — с включениями бокаловидных клеток (Goblet cell), и формируется разрастающаяся структура, называемая пищеводом Барретта (Barrett's oesophagus). Рисунок из популярного синопсиса к обсуждаемой статье
Ученым удалось разобраться в механизме возникновения предракового состояния в месте соединения пищевода и желудка — синдрома Барретта. Они смогли детально охарактеризовать эпителий в этой пограничной области и на лабораторных мышах показали, что базальные клетки с определенным набором маркеров могут стать предшественниками ткани, подобной ткани кишечника, которая замещает нормальный эпителий этой области. Клетки со сходными свойствами найдены на границе пищевода и желудка и у человека, поэтому данное исследование должно помочь улучшить методы ранней диагностики и лечения онкологических заболеваний.
Хорошо известно, что чем раньше диагностировать и начать лечить рак, тем легче может быть само лечение и тем выше шансы на выздоровление. Для некоторых типов рака выявлены так называемые предраковые состояния — изменения тканей, которые сами по себе не являются злокачественными, но повышают вероятность развития рака в этих тканях. Такие состояния известны пока для относительно небольшого числа раков. Поэтому, с одной стороны, нужно пытаться расширять список соответствий между злокачественными опухолями и предраковыми состояниями, а с другой стороны — выяснять механизмы возникновения этих состояний, чтобы повышать эффективность профилактики рака.
Один из типов предраковых состояний — метаплазии, при которых происходит замещение клеток одного типа клетками другого (как правило, обратимое). Метаплазии часто возникают на границах между разными типами эпителия и могут в таких случаях порождать карциномы — злокачественные опухоли эпителиальных клеток. Эпителий — это ткань, выстилающая поверхность тела (то есть, грубо говоря, кожа), внутренние полости и слизистые оболочки органов. В российской медицине различают два основных вида эпителия — многослойный плоский эпителий (кожа, слизистые оболочки, пищевод) и однослойный цилиндрический эпителий (желудок, кишечник). Особо выделяют эпителий, выстилающий органы, подвергающиеся сильному растяжению (например, в мочевыводящей системе), так называемый переходный. В западной медицине принята более детальная классификация эпителия (см. Epithelium).
Хотя с момента описания синдрома Барретта в 1950 году он активно изучался, ключевые процессы его развития оставались неизвестными: как возникает замещение плоского эпителия на цилиндрический (метаплазия)? от каких клеток происходит вновь формирующийся цилиндрический эпителий пищевода? как идет последующая трансформация в злокачественные новообразования?
Для объяснения метаплазии было предложено пять основных теорий (они схематично показаны на рис. 2):
1) возможна прямая конверсия плоского эпителия в цилиндрический — повреждение может вызвать превращение одного типа ткани в другой (рис. 2, a);
2) предшественниками цилиндрического эпителия являются циркулирующие в кровотоке стволовые клетки, способные дифференцироваться в цилиндрический эпителий (рис. 2, b);
3) предшественниками цилиндрического эпителия являются клетки субмукозных (слизистых) желез, локализованных под плоским эпителием (рис. 2, c);
4) возможна экспансия в пограничную область клеток цилиндрического эпителия желудка (рис. 2, d);
5) предшественниками цилиндрического эпителия являются остаточные эмбриональные клетки, локализованные вблизи пограничной области (рис. 2, e).

Рис. 2. Гипотезы возникновения пищевода Барретта, предложенные ранее. a — передифференцировка плоского эпителия пищевода; b — дифференцировка циркулирующих в крови стволовых клеток костного мозга; c — экспансия клеток слизистых желез пищевода и их превращение в эпителий Барретта; d — превращение стволовых клеток слизистых желез; e — экспансия и дифференцировка спящих остаточных эмбриональных клеток пограничной области пищевода/желудка. Рисунок из обсуждаемой статьи в Nature
Но ни одна из этих теорий не получила строгого экспериментального подтверждения. И ни одна не объясняла появления вкраплений бокаловидных клеток, свойственных кишечнику (а не пищеводу или желудку).
Большой коллектив ученых из Медицинского центра Колумбийского университета и других научных учреждений США и Китая провел сравнительный анализ экспрессии генов, характерных для эпителия. Они показали, что у мышей пограничный эпителий, состоящий из базальных и люминальных (обращенных в просвет пищевода) клеток, характеризуется различной экспрессией в этих клетках трех маркеров. В базальных клетках экспрессируются два цитокератина — Krt5 и Krt7, а также фактор регуляции транскрипции р63. В клетках люминального слоя экспрессируется только Krt7. Это отличает пограничную область от выше расположенной области пищевода, в которой ни в базальных клетках, ни в плоском эпителии нет экспрессии Krt7 (рис. 1). В эпителии желудка ни один из этих маркеров не экспрессируется.

Рис. 3. Схема анастомоза между двенадцатиперстной кишкой и пищеводом мыши, в результате которого желчные кислоты (красные стрелки) поступают в пищевод. Рисунок из обсуждаемой статьи в Nature
В следующей серии экспериментов авторы провели тонкую хирургическую операцию на мышах и сделали анастомоз между пищеводом и двенадцатиперстной кишкой (рис. 3). В результате желчные кислоты поступали в пищевод, что позволило имитировать рефлюкс.

Рис. 4. Предшественники базальных клеток (экспрессирующие гены p63 и KRT7) и люминальные клетки (KRT7 + ) эпителия пограничной области пищевод/желудок у мышей. Squamous epithelium — плоский эпителий пищевода. Transitional epithelium — эпителий пограничной области пищевода. Cardia — желудок. Рисунок из обсуждаемой статьи в Nature
В заключение авторы решили проверить, насколько похожа структура пограничной области между пищеводом желудком у человека и у мыши. Они провели анализ экспрессии эпителиальных маркеров человек и показали их сходство с мышиными. В этой области у человека были найдены базальные клетки с экспрессией генов p63, KRT5 и KRT7, а также люминальные клетки, в которых экспрессировался KRT7, но не было экспрессии гена p63. В базальных клетках, принадлежащих расположенной выше области пищевода, KRT7 не экспрессировался (рис. 5).


Рис. 5. В пограничной области пищевода и желудка человека локализован специфический переходный эпителий, который разрастается при пищеводе Барретта. a — микроскопическое изображение предшественников базальных клеток (отмечены стрелками) и люминальных клеток эпителия, окраска гематоксилином и эозином. Длина масштабного отрезка — 50 мкм. b — базальные клетки эпителия пограничной области экспрессируют гены p63, KRT5 и KRT7 (продукты экспрессии отмечены треугольниками). Базальные клетки плоского эпителия пищевода не экспрессируют KRT7 (отмечены стрелками). Иммуногистологическое окрашивание разными флюоресцирующими красителями. Длина масштабного отрезка — 50 мкм. c — схема строения эпителия пограничной области пищевод/желудок человека, обозначения как на рис. 4. Рисунок из обсуждаемой статьи в Nature
С помощью проточной цитометрии были разделены два типа базальных клеток пищевода человека (с маркерами p63 + KRT7 − и p63 + KRT7 + ). Из этих клеток in vitro были получены трехмерные культуры органоидов и оказалось, что органоиды, полученные из клеток типа p63 + KRT7 + и происходящие из пограничной области пищевода, способны формировать эпителиальные клетки, подобные эпителию кишечника. Органоиды, полученные из клеток типа p63 + KRT7 − , взятых из выше расположенной области, таким свойством не обладали.
Таким образом, ученым удалось на модели лабораторных мышей охарактеризовать эпителий пограничной области между пищеводом и желудком, который дает начало предраковому состоянию — пищеводу Барретта, а также проверить, что у людей все устроено аналогично. Оказалось, что этот эпителий более чувствителен к повреждающим факторам, чем эпителий расположенных выше областей пищевода или эпителий желудка. Полученные результаты лучше всего согласуются с выдвинутой ранее гипотезой происхождения пищевода Барретта о прямом превращении тканей эпителия пограничной области: показано, что базальные клетки пограничного эпителия могут быть предшественниками эпителия, подобного кишечному, который включает и бокаловидные клетки.
В то же время выявленные в ходе исследования генетические маркеры клеток эпителия пограничной зоны как таковые вряд ли могут быть причиной формирования пищевода Барретта и дальнейшего развития рака. В этом, скорее всего, задействованы какие-то иные факторы — кислотный рефлюкс, другие химические раздражители, гормональные нарушения или вирусные инфекции.
Несмотря на оставшиеся вопросы, обсуждаемая работа дает детальную картину формирования пищевода Барретта. Поскольку предраковые состояния и злокачественные опухоли особенно часто возникают именно в пограничных областях эпителия разных органов (матка, пищевод, прямая кишка), то можно надеяться, что там работают аналогичные механизмы. Впрочем, дальнейшие исследования должны будут прояснить этот вопрос, равно как и то, является ли пограничный эпителий единственным местом возникновения этой метаплазии и дальнейшей трансформации ее в рак. Ведь уже давно было показано, что структура, подобная пищеводу Барретта, может возникнуть и у больных, у которых пограничная область пищевода была удалена (S. R. Hamilton, J. H. Yardley, 1977. Regnerative of cardiac type mucosa and acquisition of Barrett mucosa after esophagogastrostomy). Так что полученные результаты могут способствовать разработке методов диагностики, профилактики и лечения этих состояний не только применительно к пищеводу, но и к другим органам.
Источники:
1) Ming Jiang, Haiyan Li, Yongchun Zhang, Ying Yang, Rong Lu, Kuancan Liu, Sijie Lin, Xiaopeng Lan, Haikun Wang, Han Wu, Jian Zhu, Zhongren Zhou, Jianming Xu, Dong-Kee Lee, Lanjing Zhang, Yuan-Cho Lee, Jingsong Yuan, Julian A. Abrams, Timothy C. Wang, Antonia R. Sepulveda, Qi Wu, Huaiyong Chen, Xin Sun, Junjun She, Xiaoxin Chen & Jianwen Que. Transitional basal cells at the squamous-columnar junction generate Barrett's oesophagus // Nature. 2017. V. 550. P. 529–533.
2) Lizhe Zhuang & Rebecca C. Fitzgerald. Cancer development: Origins in the oesophagus // Nature. 2017. V. 550. P. 463–464. Синопсис к обсуждаемой статье.
Читайте также:


