Что такое фаговая инфекция
Как протекает фаговая инфекция
Начинается все с того, что вирусная частица случайно сталкивается с клеткой бактерии. Фаг способен заразить вовсе не любую бактерию. Например, фаг, заражающий кишечную палочку, не замечает – сколько бы он с ними ни сталкивался – клетки стафилококка, и наоборот. Больше того, у той же кишечной палочки известно много разновидностей (их называют штаммами), и фаги, как правило, способны очень хорошо их различать. Они охотно заражают одни штаммы и совершенно игнорируют другие. Почему так происходит? Дело в том, что на поверхности бактериальной клетки есть структуры, к которым базальная пластинка фага по форме подходит, как ключ к замку. Такие структуры называются рецепторами. Есть рецептор для данного фага – фаг способен заражать эту бактерию, а эта бактерия способна стать его хозяином. Не подходит ключик? – Ну, стало быть, эта бактерия не для него.
Возникает вопрос, почему бактериальная клетка вынуждена жить под постоянной угрозой фаговой интервенции, не проще ли незаметно потерять где–то эти рецепторы и стать неприступной для фага? Но фаг тоже не прост, он использует в качестве причала структуры, предназначенные не для него, а совсем для других целей и жизненно важные для клетки, у которой, стало быть, есть веские причины не лишаться их.
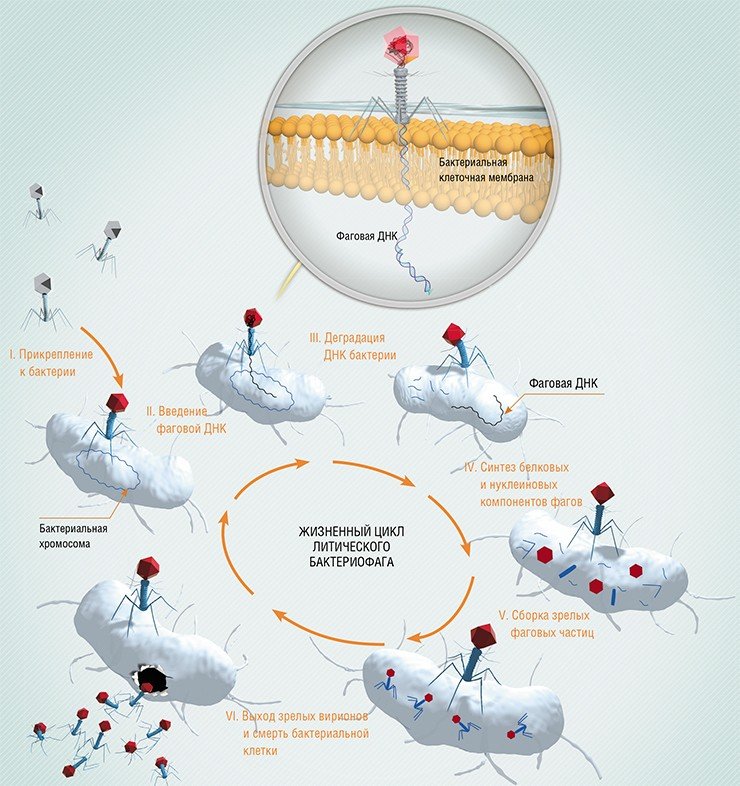
Если фаг и бактерия узнали друг друга, фаг прочно связывается с ее поверхностью. Дальнейшая задача вируса состоит в том, чтобы ввести свой генетический материал внутрь бактериальной клетки, не нанеся ей – до поры до времени – вреда. Вот как это делает, например, фаг Т4, заражающий кишечную палочку – обычного обитателя нашего кишечника.
Бактериофаг Т4 является одним из наиболее сложно устроенных вирусов. Несколько вытянутая головка служит контейнером для хранения нуклеиновой кислоты. Сокращение чехла обеспечивает прободение бактериальной стенки. По внутреннему каналу стержневого отростка фаговая ДНК перемещается внутрь бактериальной клетки. К шестиугольной базальной пластинке крепятся длинные нити – фибриллы, которые обеспечивают начальный контакт фага с поверхностью бактерии. Чехол с одной стороны жестко закреплен на фаговой головке, а с другой прикреплен к базальной пластинке, находящейся на конце отростка. Чехол заметно короче отростка, поэтому, подобно пружине, пребывает в растянутом состоянии. После стыковки фага с бактерией форма базальной пластинки меняется, она больше не может удерживать чехол в растянутом состоянии, тот сжимается, и жесткий стержень как бы выстреливает из чехла, проминая клеточную стенку бактерии.

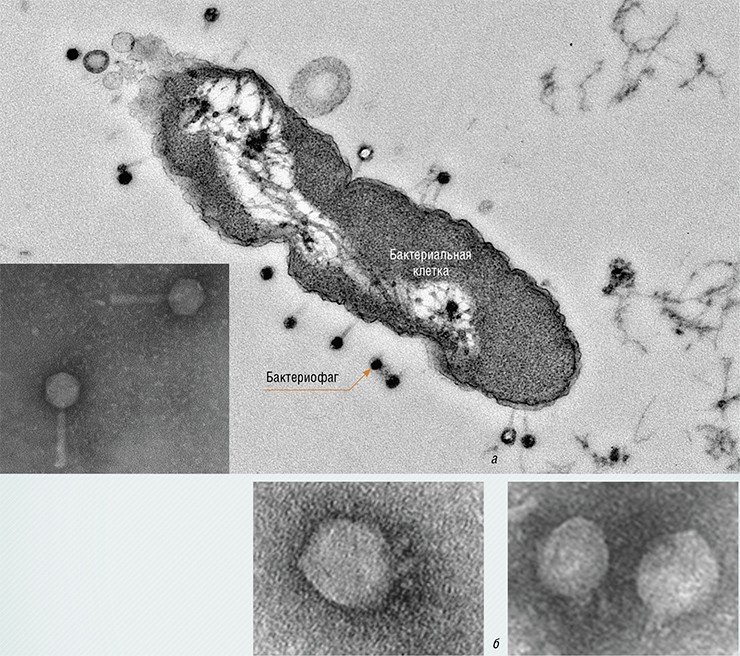
Бактериофаг Т4: 1 – головка; 2 – отросток, покрытый чехлом;3 – базальная пластинка; 4 – длинные фибриллы
Одного механического усилия недостаточно. Прогибаясь, клеточная стенка успешно сопротивляется попытке фагового отростка проткнуть ее, но оказывается бессильной противостоять секретному оружию фага – ферменту лизоциму, который находится вблизи острия отростка и, войдя в плотный контакт с клеточной стенкой, моментально прогрызает в ней дыру. Наконец–то стержень отростка пронзает клеточную стенку насквозь. Тут же по внутреннему каналу отростка, как сквозь игольное ушко, в бактерию впрыскивается нуклеиновая кислота, до того момента покоившаяся в фаговой головке.
На первый взгляд, задача может показаться не слишком сложной, но надо учесть, что молекула ДНК – очень длинная и чрезвычайно плотно упакована. Если уж сравнивать внутренний диаметр канала с игольным ушком, то в этом масштабе длина нити ДНК будет около метра, а скорость ее разматывания напоминает разматывание лески с катушки спиннинга при забрасывании блесны. И протащить нить надо так, чтобы не порвать ее. Порванная даже в одном месте, она уже неинфекционна и, стало быть, совершенно безвредна для бактерии и абсолютно бесполезна для фага.
Большинство фагов не имеют сократимого чехла, не говоря уже о том, что у многих и отростка–то никакого нет, ни большого, ни маленького. А преграда на пути серьезная – клеточная стенка бактерии. Она состоит из нескольких слоев и, подобно неповрежденной коже человека или кутикуле на поверхности листа, совершенно непроницаема для вируса. Как–то ее надо продырявить, и, так или иначе, все фаги умеют это делать.
Например, многие фаги связываются только с половыми пилями – нитевидными выростами на мужских клетках кишечной палочки. Да, как ни удивительно, у бактерий есть пол, мужской и женский, а у мужских клеток есть вырост, с помощью которого они конъюгируют с женской клеткой. Облепив вырост, фаги внедряют свою нуклеиновую кислоту в клетку бактерии. В общем, тем или иным способом, но фаги вводят свой генетический материал внутрь бактериальной клетки, оставляя на поверхности пустую, никому уже не нужную белковую оболочку.

Фаговая ДНК проникла внутрь бактерии. 1 – фаговая ДНК; 2 – стенка бактериальной клетки; 3 – сократившийся чехол; 4 – длинные фибриллы
С этого момента все меняется для бактериальной клетки. Вирус на время как бы исчезает. В клетке, куда проникла фаговая нуклеиновая кислота, не удается обнаружить никаких вирусных частиц. Более того, зараженная клетка выглядит совершенно нормальной. Но на самом деле жить ей осталось всего несколько минут. Под покровом клеточной стенки фаг начинает свое черное дело. Он заставляет все клеточные структуры работать на себя. Все ресурсы клетки отныне тратятся только на размножение фаговой ДНК, самой клетке уже ничего не достается. Белки образуются только фаговые, синтез клеточных компонентов совершенно подавлен или осуществляется лишь в той мере, в которой это нужно фагу. Многочисленные копии вновь образованной фаговой ДНК упаковываются в форме многогранника. Сверху они покрываются фаговым белком, и возникает зрелая фаговая головка с упакованной внутри нее ДНК. В другом месте клетки, в другом ее помещении налажено производство и сборка других фаговых белков, из которых образуется хвостовой отросток. Наконец, отростки и головки соединяются в полноценную фаговую частицу. Проникла в бактерию нуклеиновая кислота одной–единственной фаговой частицы, а теперь, через полчаса, их уже больше сотни. Им тесно, им пора покидать эту бактерию, с которой уже нечего взять. Вот только как это сделать? Бактерия мертва, но ее клеточная стенка все еще надежно удерживает взаперти многочисленное фаговое потомство.

Продольный разрез фага с пустой головкой: 1 – фибриллы, прикрепленные к головке;2 – "воротничок"; 3 – отросток;4 – канал, проходящий внутри отростка
И вновь приходит на помощь фаговый лизоцим. Он подгрызает клеточную стенку обреченной бактерии изнутри до тех пор, пока она достаточно не истончится и в конце концов не разорвется. Фаговое потомство выходит наружу и немедленно набрасывается на соседние бактерии, которые ожидает та же участь.
Такая инфекция называется продуктивной, а фаги, вызывающие продуктивную инфекцию – вирулентными.
Наша страна была пионером фаготерапии, ставшей сегодня актуальным биомедицинским направлением. Первые отечественные фаговые препараты были разработаны в Тбилиси еще в 1930-е гг., а в настоящие дни они выпускаются в широком ассортименте. В отличие от обычных антибиотиков они обладают высокой избирательностью, не приводят к возникновению лекарственной устойчивости у патогенов и не имеют негативного побочного действия на организм больного. Однако их применение в клинической практике до сих пор ограничено в силу ряда объективных и субъективных причин, от противодействия крупных фармацевтических компаний до отсутствия квалифицированных специалистов и хорошо оборудованных микробиологических центров
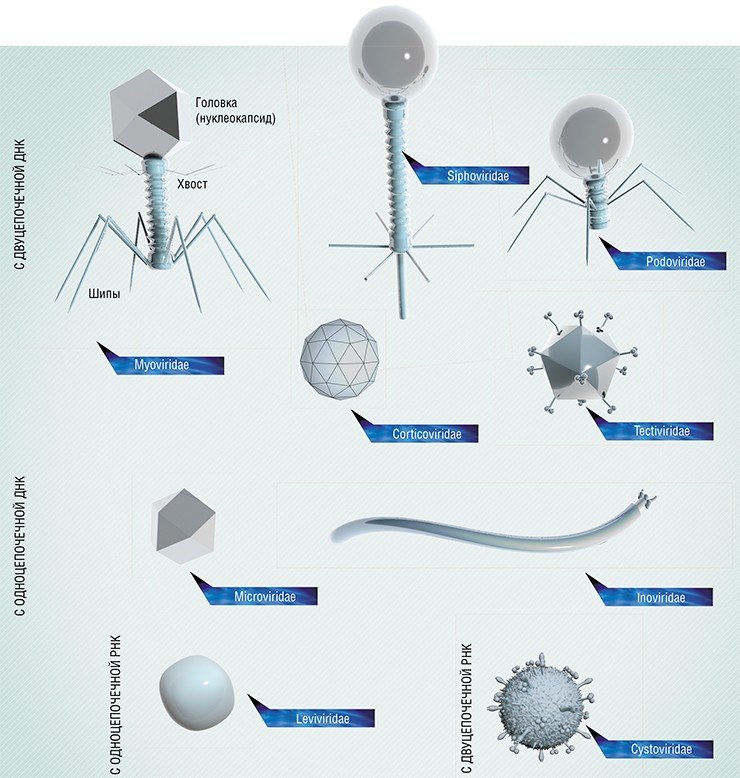
Размер генома у разных фагов может различаться. У некоторых он очень мал – (от 3,5 тыс. пар нуклеотидов), в таком геноме хранится информация всего лишь о 3—4 белках. Более того, гены, кодирующие эти белки, вынуждены перекрываться (накладываться друг на друга). Размер геномов у других фагов сопоставим с размером геномов крупных, сложно организованных вирусов многоклеточных животных, достигая 170 тыс. пар нуклеотидов (самый крупный из известных фагов содержит около 480 тыс. пар оснований!). Такой геном может кодировать уже до двухсот различных белков. Именно такие фаги обычно имеют большие размеры и сложно организованы.
Гонка вооружений
По оценке специалистов, каждые двое суток бактериофаги уничтожают половину мировой популяции бактерий. Вот почему эти быстро размножающиеся организмы не покрыли толстым слоем всю поверхность нашей планеты – в отсутствии фагов они сделали бы это за несколько дней.
Например, ДНК всех бактерий несет на себе особые метки (метилированные основания), и специальные бактериальные ферменты рестрикции расщепляют любую ДНК, на которой таких меток нет, в том числе и фаговую. Однако некоторые фаги научились имитировать такие метки и таким способом обходить защиту.
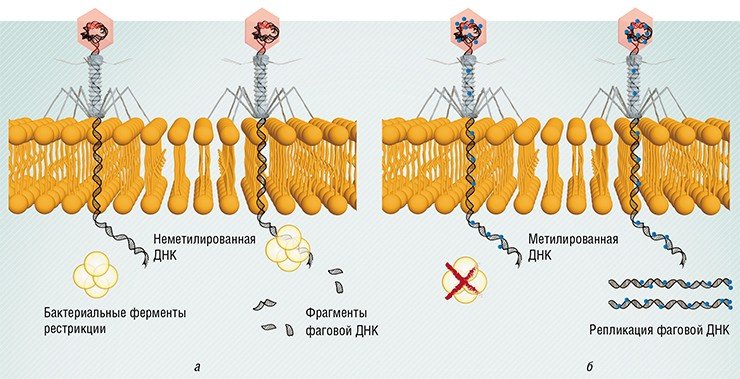
К слову сказать, с точки зрения медицины, изменение рецепторов болезнетворной бактерии может быть благом для человека, поскольку именно бактериальные рецепторы служат факторами вирулентности, определяющими выживание и размножение возбудителя в организме-хозяине. И устойчивые к фагу мутанты обычно являются менее патогенными по сравнению со своими предшественниками.
Фаготерапия: сквозь тернии
В медицинских целях бактериофаги были впервые применены в 1915 г., когда один из их первооткрывателей, Ф. д’Эрель, использовал такой препарат для лечения дизентерии у детей. Однако дальнейшая история развития фаговой терапии была непростой. Дело в том, что предложения д’Эреля намного опередили свое время, и долгие годы ему пришлось бороться за признание своего открытия. В том числе со знаменитыми французскими коллегами, которые не признавали точку зрения д’Эреля на природу этих бактерицидных агентов, считая их ферментами. Истина восторжествовала лишь в 1940-х гг., но задолго до этого, устав от борьбы, д’Эрель уехал работать в США.
В 1934 г. он приехал в Грузию, в Тбилиси, где к тому времени сложились уникальные возможности для развития фаговой терапии. Еще с 1918 г. там существовала лаборатория (впоследствии − институт) микробиологии, руководитель которой, Г. Элиава, был командирован в знаменитый Институт Пастера для освоения методик и приобретения оборудования. Именно там он и познакомился с д’Эрелем и его удивительным открытием.
С начала 1940-х гг. фаговая терапия начала применяться в странах Европы и США. Такие препараты получили миллионы пациентов, однако результаты лечения оказались противоречивы и невоспроизводимы. Реклама обещала чудеса, но их не было – сама идея фаготерапии была скомпрометирована. Причина заключалась в том, что в то время не только производители препаратов, но и сами ученые не располагали необходимыми знаниями о свойствах фагов и о механизме их действия, да к тому же не имелось и надежных технологий работы с вирусами.
Неудачи следовали за неудачами, поэтому неудивительно, что аптекари и врачи вздохнули с облегчением с появлением антибиотиков. Эти относительно дешевые, с широким спектром антибактериальной активности, хорошо хранящиеся химические вещества, казалось, радикально решили проблему лечения инфекционных заболеваний. Бактериофаги на Западе были забыты на много лет. Основанная д’Эрелем французская компания по выпуску коммерческих фаговых препаратов переключилась на другие проекты (на ее основе выросла знаменитая косметическая компания L’Oreal).
Исследования фагов продолжались только в СССР, Польше и Чехословакии. Самым большим производителем фаговых препаратов был грузинский институт, созданный Элиавой: к 1980-х гг. там работало около 1200 человек, а препараты рассылались для испытаний в клиниках по всему СССР. Производство бактериофагов было организовано также в Уфе и Горьком.
Коктейли из фагов
Новый виток интереса к фаговой терапии пришелся на последние годы. Дело в том, что антибиотики тоже не стали панацеей при лечении бактериальных инфекций: в наши дни разработка новых препаратов не поспевает за ростом числа бактерий с приобретенной устойчивостью к существующим антибиотикам. Уже сегодня в госпиталях Англии около 40 % стафилококковых инфекций вызвано такими штаммами, а в США от госпитальных инфекций, вызванных лекарственно устойчивыми бактериями, ежегодно умирает около 90 тыс. пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год!
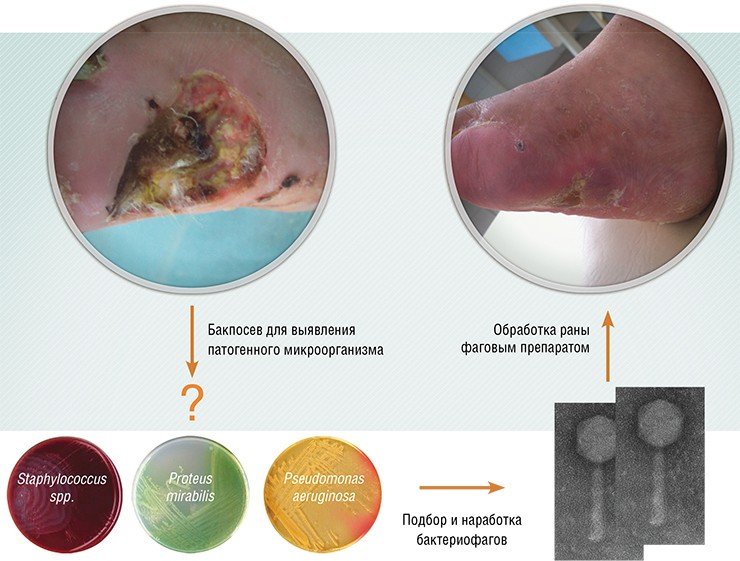
Как говорилось выше, спектры активности фагов обычно очень узки и ограничены одним или несколькими близкородственными видами бактерий. С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности.
Такой подход использовал еще д’Эрель. Коктейль д’Эреля, привезенный им из Парижа еще в 1930 г., до сих пор является одним из основных фаговых препаратов: он лежит в основе грузинского пиофага и российского интестифага. В Тбилиси на основе фаговых коктейлей разрабатывались препараты для лечения желудочно-кишечных заболеваний и гнойных ран для массового применения в случае возникновения эпидемий или военных действий. Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов.
Фаговые коктейли производятся стандартными, и ориентированы они на сообщества бактерий, часто встречающиеся при конкретных заболеваниях. Конечно, более эффективные коктейли получаются в том случае, когда их компоненты подбирают к бактериальному сообществу конкретного пациента. Для получения такого коктейля необходимо протестировать бактерии пациента на чувствительность к фагам из коллекции, чтобы подобрать наиболее эффективные фаговые штаммы. Если нужных фагов в коллекции не окажется, специфичные для бактерий фаги ищут в природных субстратах.
Вообще поиск бактериофагов довольно прост: на бактериальную культуру воздействуют образцами из различных источников: водоемов, почвы, канализационных стоков и т. п. Если бактерии погибают, их отделяют от раствора центрифугированием, а оставшийся раствор тестируют на активность. Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С.
Современная история
К настоящему времени самый большой опыт фаготерапии имеют специалисты из Тбилиси и специализированного центра Института иммунологии и экспериментальной терапии им. Л. Хиршфельда (Вроцлав, Польша), где в небольших количествах производятся препараты бактериофагов для испытаний.
Польские исследователи изначально делали акцент на персонализированную терапию. Они использовали фаготерапию для экспериментального лечения пациентов с хроническими заболеваниями, которым не помогают антибиотики. Через центр прошли уже тысячи пациентов, многие из которых были полностью излечены.
Результаты этих клинических испытаний доказали высокую эффективность фагов при лечении инфекционных легочных заболеваний: для подавления инфекции в горле, носу и в легких достаточно однократного интраназального введения препарата. Не менее эффективно фаги элиминируют патогенные бактерии из желудочно-кишечного тракта. Высокая эффективность бактериофагов была также продемонстрирована практически во всех случаях гноеродной язвы диабетической стопы, заболеваний легких, мастита, урогенитальных инфекциях. Список таких заболеваний можно продолжить, при этом важно отметить, что ни в одном из испытаний не наблюдалось каких-либо побочных эффектов, вызванных бактериофагами.
В Англии фаговые препараты были успешно испытаны для лечения хронического отита, трудно излечимого заболевания вследствие образования так называемых бактериальных биофильмов – лекарственно-устойчивых микробных пленок. Во Франции –колыбели фаговой терапии – исследования в этой области сейчас почти не ведутся, хотя до последнего времени Институт Пастера делал фаговые коктейли на заказ.
В промышленных масштабах фаговые препараты сегодня производит российская компания Микроген. Подобные лекарства можно купить в аптеках в России, Белоруссии и на Украине. Фаговые препараты производства Микроген и Тбилисского центра для лечения ожоговых инфекций были успешно испытаны и в Бельгии.
Тем не менее до сих пор в большинстве стран применение бактериофагов в терапии официально не разрешено: это касается как FDA, американского Управления по контролю качества пищевых продуктов и лекарственных препаратов, так и аналогичных европейских агентств. На территории Евросоюза фаги для лечения больных используют только в вышеупомянутом польском Институте иммунологии и экспериментальной терапии.
Выбираем фаги
Почему же фаговая терапия до сих пор не нашла широкого применения? Ведь очевидно, что антибиотики должны быть препаратом выбора при остром, угрожающем жизни заболевании, когда нет времени для подбора специфичного агента. Зато при хронических инфекциях предпочтение следует отдать бактериофагам, как более дружественным агентам.
Среди причин, сдерживающих применения фагов в медицине, в первую очередь следует отметить скептическое отношение многих специалистов, особенно зарубежных. По сложившейся недоброй традиции западные исследователи, несмотря на свое отставание в этой области, до сих пор выражают недоверие к результатам исследований, в свое время успешно проводимых в СССР.
Но есть и более весомые причины, связанные с тем, что в бактериофагах не заинтересованы большие фармацевтические компании. Им нужны исключительные права на изобретения, но фаги – природные агенты, поэтому запатентовать их не так просто, а сама идея фаговой терапии опубликована давно. Кроме того, эти компании вложили огромные средства в производство антибиотиков, поэтому им не нужна конкуренция с дешевыми фаговыми препаратами.
Что касается самих врачей, то они стандартно обучены применять для достижения максимального эффекта антибиотики широкого спектра действия. При фаговой же терапии нужно иметь большой арсенал препаратов, каждый из которых нужно тестировать и подбирать индивидуально для каждого больного. Это в конечном счете приводит к значительному удорожанию такого персонализированного лечения. К тому же хотя люди продолжают умирать от заражения лекарственно устойчивыми бактериями, однако с экономической точки зрения, этот рынок не слишком велик, а лече-ние таких тяжелых больных чревато юридическими проблемами.
Вместе с тем та же FDA сегодня признает, что благодаря своей высокоспецифичности и нетоксичности фаги помогают там, где альтернативные методы оказываются неэффективными. Поэтому FDA планирует выработать практические рекомендации по использованию литических фагов в терапии. Для этого необходимо секвенировать их геномы, определить безопасные условия культивирования, провести современное стандартное тестирование токсичности на животных. В случае использования фаговых коктейлей каждый их компонент должен быть охарактеризован. И, наконец, для доказательства эффективности этих препаратов необходимы контролируемые клинические испытания.
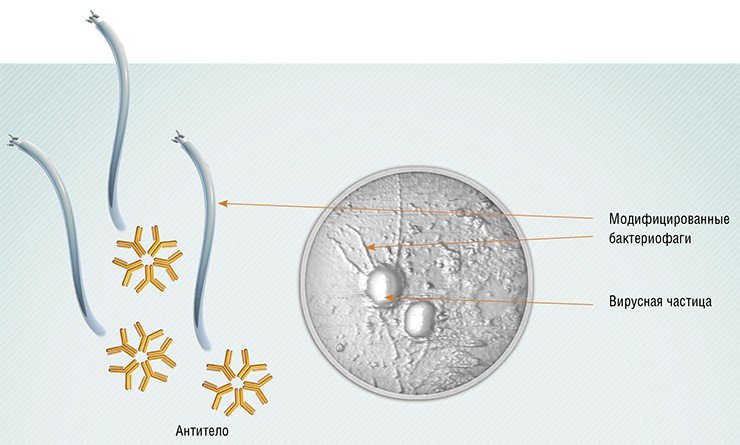
Кстати сказать, применение фагов в медицине может оказаться шире, чем это сегодня представляется. Так, современные технологии позволяют создавать фаги, производящие антибактериальные токсины, которые фаги будут доставлять непосредственно в бактериальную клетку. С помощью генетической инженерии сегодня можно заниматься настоящим дизайном фагов, например, получить фаги с измененной и расширенной специфичностью. Совершенно реалистичной задачей является и полный синтез фаговых геномов.
АНТИБИОТИКИ Достоинства:
широкий спектр действия;
простота патентования
Недостатки:
разрушают собственную микрофлору организма,
что создает угрозу вторичных инфекций;
не способны концентрироваться в области
инфекционного поражения;
вызывают побочные эффекты: аллергии, кишечные
расстройства и т. д.;
приводят к возникновению бактериальных штаммов с лекарственной устойчивостью;
создание новых антибиотиков – длительный
и дорогостоящий процесс БАКТЕРИОФАГИ Достоинства:
специфичность действия, для любой бактерии можно найти убивающий ее бактериофаг;
поиск нового фага занимает несколько дней или недель;
производство недорогое и экологически чистое;
не вызывают дисбактериоза;
не токсичны и не вызывают побочных эффектов;
после уничтожения патогенного агента элиминируются из организма
Недостатки:
слишком высокая избирательность – для гарантии
успеха лечения нужно идентифицировать патоген;
патентование затруднено из-за многообразия агентов
Уже испытываются в качестве противобактериальных средств отдельные компоненты фагов и вещества, используемые ими для поражения бактерий. Например, бактериоцины, фрагменты хвостовой структуры фагов, которые повреждают клеточную стенку бактерий, образуя в ней поры, что приводит к быстрой потере важных для клетки ионов и ее гибели.
Также разрабатываются подходы к применению фагов в качестве носителей лекарств – антител или химических терапевтических препаратов. На одну фаговую частицу можно присоединить до тысячи молекул антител и до нескольких тысяч молекул антибиотика. А благодаря присоединению к поверхности бактериофагов молекул полиэтиленгликоля удается получать фаги, способные долгое время циркулировать в кровотоке. Кроме того, фаги, несущие на поверхности определенные пептидные антигены, можно использовать в качестве вакцин.
Очевидно, что в XXI в. стимуляция дальнейшего развития фаготерапии должна стать делом государственным. Необходимо создать все условия для создания и поддержания коллекции фагов против устойчивых к антибиотикам патогенов. Что касается всевозможных разрешительных документов, то есть простое решение проблемы: рассматривать фаговые препараты наравне с вакцинами от гриппа. Ведь каждый год готовятся живые противогриппозные вакцины, представляющие собой коктейли нескольких вирусных штаммов, при этом их состав постоянно меняется. И разрешение распространяется на все эти вирусные коктейли, – а чем хуже фаги?
Выход в данной ситуации очевиден: нужно обязательно тестировать бактерии пациента на восприимчивость к фаговому препарату. Это можно делать лишь в хорошо оборудованных центрах, располагающих коллекциями фагов и лабораториями для микробиологического тестирования. Если сеть таких центров будет создаваться в рамках планируемого развития персонализированной медицины, то у нашей страны будут все шансы попасть в лидеры этого важнейшего биомедицинского направления.
Козлова Ю. Н., Репин В. Е., Анищенко и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки // Патент RU 2455355 C1. 2011.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acte Naturae. 2009. № 3б. С. 6—15.
Kropinski A., Lingohr E., Moyles D. et al. Endemic bacteriophages: a cautionary tale for evaluation of bacteriophage therapy and other interventions for infection control in animals // Virology J. 2012. V.9. P. 207—215.
Miedzybrodzki R., Borysowski J., Weber-Dabrowska B. et al. Clinical aspects of phage therapy //Advances in virus res. 2012. V. 83. P. 73—121.
Summers W. Bacteriophage therapy // Annu. Rev. Microbiol. 2001. V. 55. P. 437—451.

Dedrick, R. M. et al. / Nature, 2019
Ученые впервые применили бактериофаги для лечения микобактериальной инфекции у человека. В статье, опубликованной в Nature, говорится, что это первый случай медицинского использования генно-модифицированных бактериофагов. В описанном клиническом случае состояние пятнадцатилетней пациентки, больной муковисцидозом и хронически инфицированной Mycobacterium abscessus, существенно улучшилось после новаторского лечения.
Устойчивость патогенов к противомикробным препаратам уносит не менее 700000 жизней в год, без эффективной борьбы с этой проблемой к 2050 году эта цифра может вырасти до миллиона смертей ежегодно. Микобактериальные инфекции вносят существенный вклад в инфекционную заболеваемость и смертность: например, от полирезистентного туберкулеза умирает около 230000 человек в год. Антибиотикорезистентные нетуберкулезные микобактериальные болезни также широко распространены, в частности, от них часто страдают больные муковисцидозом. Хронические инфекции могут быть причиной осложнений и смерти после трансплантации легких, которая часто требуется таким пациентам.
Бактериофаги (вирусы, поражающие бактерии) – могут стать альтернативой антибиотикам, однако они ранее не применялись для лечения микобактериальных инфекций у людей. В то же время, персонализированная внутривенная фаговая терапия для других инфекций уже была описана (1, 2).
Ребека Дедрик (Rebekah M. Dedrick) и Карлос Гуерреро-Бустаманте (Carlos A. Guerrero-Bustamante) из Питтсбургского университета вместе с коллегами описали клинический случай пятнадцатилетней девушки, больной муковисцидозом и хронически инфицированной антибиотикорезистентным штаммом Mycobacterium abscessus подвида massiliense. Болезнь сопровождалась несколькими сопутствующими патологиями, включая недостаточность поджелудочной железы, инсулинозавизимый сахарный диабет и поражения печени, связанные с основным заболеванием.
Пациентке была проведена успешная двухсторонняя трансплантация легких. В течение восьми лет до этой операции она получала специфическую терапию против нетуберкулезной микобактериальной инфекции. Трансплантация прошла без осложнений, после нее девушка получала иммуносупрессивную терапию и антибиотики. После трансплантации в мокроте обнаружилась M.abscessus, печень была увеличена, функциональные печеночные пробы были патологическими. Послеоперационная рана через неделю после завершения курса внутривенного введения антибиотиков была воспалена, на предплечье появились поражения кожи.
Пациентка был выписана из больницы через семь месяцев с диагнозом диссеминированной микобактериальной инфекции. Несмотря на продолжение протвомикробного лечения, на разных частях тела продолжали появляться поражения кожи в виде узелков, состояние хирургической раны ухудшилось.
Поскольку лечение антибиотиками не давало эффекта, ученые решили провести лечение бактериофагами. Чтобы подобрать потенциально подходящие фаги, они использовали культуру штамма GD01 M.Abscessus, выделенную у пациентки через месяц после операции. Они обратились к коллекции, которая включала более 10000 фагов, геном 1800 из которых был известен. Был обнаружен только один бактериофаг, Muddy, который мог эффективно убивать микобактерии штамма GD01. Эффективность второго выбранного бактериофага, ZoeJ, была низкой, поэтому ученые использовали метод генной инженерии Bacteriophage Recombineeringof Electroporated DNA (BRED), чтобы увеличить его терапевтическую силу. Для третьего выбранного фага, BPs, который изначально слабо инфицировал M.Abscessus, авторы выделили мутантов с измененным спектром литического действия (HRM1 и HRM10).
Все три фага относятся к сифовирусам (Siphoviridae). В лабораторных экспериментах ZoeJ и BPs были менее эффективны, чем Muddy, но смесь из трех бактериофагов in vitro не оставляла в живых ни одной M.Abscessus даже при ее высоких концентрациях.
Ученые вводили пациентке приготовленную смесь из трех фагов (109 бляшкообразующих единиц каждого фага) внутривенно каждые 12 часов, лечение было назначено ориентировочно на 32 недели. Больная была выписана из больницы через девять дней, лечение продолжалось дома. Во время первых двух часов лечения у пациентки отмечалась потливость, она испытывала приливы жара, но в остальном лечение переносилось хорошо: другие побочные эффекты зафиксированы не были. Через месяц терапии было добавлено местное лечение бактериофагами в местах поражений кожи.
В течение шести месяцев (к моменту написания статьи) состояние пациентки постепенно улучшалось: послеоперационная рана заживала, улучшались функции легких и печени, она начала набирать вес, хотя рана на грудине затянулась не полностью. Позитронно-эмиссионная томография показала улучшения со стороны внутренних органов и кожных узелков. M.abscessus не обнаруживалась в мокроте и крови начиная с первого дня лечения, но все еще выделялась из кожных узелков.

Снимки, полученные при помощи позитронно-эмиссионной томографии за 12 недель до лечения и спустя шесть недель после него. 1) область грудины и окружающие мягкие ткани, 2) брюшные лимфатические узлы и ворота печени, 3) кожные узелки.
Dedrick, R. M. et al. / Nature, 2019

Снимки, полученные при помощи позитронно-эмиссионной томографии за 12 недель до лечения и спустя шесть недель после него. 1) область грудины и окружающие мягкие ткани, 2) брюшные лимфатические узлы и ворота печени, 3) кожные узелки.
Читайте также:


