Что такое дисбактериоз и как его лечить при сахарном диабете
Вагинальный кандидоз: этиология, эпидемиология, патогенез
Кафедра микробиологии и клинической химиотерапии Российской медицинской академии последипломного образования, Москва
Многими исследователями отмечены разнообразные патологические изменения у больных ИЗСД со стороны почек, печени, желудка и многосторонние нарушения функции и морфологии кишечника [1, 2].
Некоторые гастроэнтерологи отводят значительное место в патогенезе поражений желудочно-кишечного тракта (ЖКТ) больных сахарным диабетом изменениям кишечного микробиоценоза [1, 3]. Микробиоценоз кишечника представляет собой сложную ассоциацию микроорганизмов, взаимно влияющих на их жизнедеятельность и находящихся в постоянной взаимосвязи с макроорганизмом.
Одной из важнейших функций нормальной микрофлоры кишечника является непосредственное участие в формировании иммунологической реактивности организма. Собственные микроорганизмы полостей человека стимулируют лимфоидный аппарат, синтез иммуноглобулинов, увеличивают уровень пропердина и комплемента, повышают активность лизоцима и т.п. [2, 4]. Поскольку установлено, что существует тесная интеграция между состоянием иммунной системы и микробиоценозом организма, то нельзя исключить предположение о том, что нарушение иммуномикробиологического статуса может быть одной из эндогенных причин, определяющих течение сахарного диабета у детей. С этих позиций представляет интерес, исследование зависимости неспецифической резистентности организма от состояния микроэкологии кишечника детей, больных ИЗСД.
Ранее нами были опубликованы данные о выявлении глубоких изменений в микрофлоре кишечника у детей, больных ИЗСД [5]. Поэтому представляется несомненно значимым, с клинической точки зрения, исследовать возможность лечения тяжелых форм дисбактериоза кишечника у детей, страдающих ИЗСД.
В настоящей работе представлены результаты клинико-бактериологического обследования 23 детей, больных ИЗСД, в возрасте от 4 до 15 лет, находящихся под наблюдением у окружных эндокринологов.
Для оценки состояния иммунной системы в сыворотке крови детей определяли иммуноглобулины основных классов А, М и G общепринятым методом радиальной иммунодиффузии. Секреторный иммуноглобулин A (sIgA), поступая в полость рта и просвет кишечника, в значительной степени определяет состояние местной резистентности, обеспечивая становление иммунной компетенции макроорганизма. Уровень sIgA в фекалиях и слюне определяли с использованием методических рекомендаций "Исследование иммуноглобулинов и других белков в секретах человека" (М., 1987).
Учитывая значение фагоцитоза в системе защиты организма, определяли окислительный метаболизм лейкоцитов крови высокочувствительным хемилюминесцентным методом. Активность процессов фагоцитоза в нейтрофилах оценивали по интенсивности выделения световой энергии. Регистрацию хемилюминесценции проводили по выбросу фотонов на хемилюминометре (как известно, интенсивность хемилюминесценции лейкоцитов крови прямо коррелирует с активностью фагоцитоза).
Активность системы комплемента оценивали по уровню С3- и С4- компонентов с помощью общепринятого нефелометрического метода.
Состояние компенсации углеводного баланса оценивали по уровню гликированного гемоглобина (HbAlc), используя устройство "Диастат" (уровень гликированного гемоглобина у здоровых лиц по данной методике не превышал 6%).
Кроме того, для определения состояния компенсации углеводного обмена велось ежедневное мониторирование гликемии натощак и после еды с помощью глюкометра.
Иммунологический статус и состояние компенсации углеводного обмена у детей с ИЗСД определяли до лечения и через месяц после окончания лечения дисбактериоза кишечника.
Свечи Виферон всем детям вводили 2 раза в сутки в течение 5 дней одновременно с пероральным применением 15 доз в сутки (по 5 доз три раза в день) Ацилакта, который продолжали вводить еще в течение 16 дней после окончания введения свечей.
Через месяц после окончания лечения, т.е. когда освобождается кишечник от Ацилакта [5], у детей брали анализ крови, слюны, фекалий для определения состояния неспецифической резистентности организма, микрофлоры кишечника и для определения компенсации углеводного обмена.
Статистическую обработку полученных в ходе исследований данных проводили общепринятыми методами вариационной статистики с использованием критериев Стьюдента. Числовые данные приведены в виде средних величин со стандартной ошибкой (М m). Достоверными считались различия показателей при р бифидобактерий , несколько увеличилось содержание лактобактерий , хотя изначально их количество было снижено не столь значительно, как бифидобактерий (см. табл. 1). У всех детей возросла частота выделения лактозоположительных кишечных палочек и, что особенно важно, снизился среди них процент гемолитических кишечных палочек : до лечения он составлял 30, после лечения - 8 (при норме - 2). Другие представители энтеробактерий и грамотрицательные неферментирующие бактерии выделялись в два раза реже после проведенного курса лечения.
Следует, однако, отметить, что хотя и произошло значительное снижение количества дрожжеподобных грибов после применения комплексного лечения, тем не менее они сохранились в количестве, несколько превышающем физиологическую норму (см. табл. 1).
В результате проведенного лечения, как видно из табл. 2, дисбактериоз IV степени отсутствовал у всех детей, хотя до лечения он был установлен у 63,5% из них. Дисбактериоз III степени сохранился лишь у 8,3% детей (до лечения был зафиксирован у 31,8%). И если до лечения не было ни одного ребенка, у которого бы не отмечали дисбактериоз той или иной степени, то через 7 недель после начала лечения нормальный микробиоценоз кишечника установился у 81,1% обследованных детей.
По данным Всемирной федерации диабета распространенность сахарного диабета (СД) в 2010 году составит 285 млн, а к 2030 году — 438 млн, причем у 85–90% пациентов будет иметь место СД 2-го типа [1].
По данным Всемирной федерации диабета распространенность сахарного диабета (СД) в 2010 году составит 285 млн, а к 2030 году — 438 млн, причем у 85–90% пациентов будет иметь место СД 2-го типа [1].
В настоящее время известно, что в патогенезе СД 2-го типа важнейшую роль играет ожирение. Так, у пациентов с ожирением I степени риск развития нарушений углеводного обмена возрастает в 2–5 раз, с ожирением II степени — в 10 раз, а с ожирением III степени — в 30–40 раз [2].
Жировая ткань играет немаловажную роль в развитии системного воспаления, стимулируя синтез провоспалительных цитокинов: интерлейкина 6 (ИЛ-6), фактора некроза опухоли альфа (ФНО-альфа), ингибитора активатора плазминогена 1-го типа (ИАП-1) [3] и инсулинорезистентности (ИР) [4], которые являются факторами риска СД 2-го типа.
Развитие ожирения связано с нарушениями энергетического баланса организма, т. е. регуляции потребления, расхода и хранения энергии. Физиологические процессы, регулирующие вес, включающие периферические сигналы голода и насыщения, центральное интегрирование поступающей информации, комплексный ответ органов желудочно-кишечного тракта на прием пищи, являются предметом многих научных исследований [5, 6, 7, 8, 9].
В норме микрофлора кишечника представляет собой сбалансированную микроэкологическую систему, сложившуюся в процессе филогенетического развития человека. Биомасса микробов, заселяющих кишечник человека, составляет примерно 5% его общего веса. В 1 грамме содержимого слепой кишки обнаруживают около 2 млрд микробных клеток (более 500 видов) [10]. Жизненные формы представлены тремя доменами: эукариоты, археи и значительно преобладающие бактерии. Причем Bacteroidetes и Firmicutes составляют более 90% всех филотипов бактерий [11].
Нормальная микрофлора важна для поддержания гомеостаза и взаимодействия организма с окружающей средой, она выполняет защитную, ферментативную, иммунизирующую, синтетическую, детоксикационную и другие функции.
Метаболическая активность кишечной микрофлоры облегчает извлечение энергии из потребляемой пищи и помогает запасать ее в жировой ткани человека для последующего использования. Индивидуальные различия в способности к поглощению энергии из питательных веществ объясняют то, что некоторые пациенты с ожирением не страдают перееданием. Ряд исследователей считает, что кишечная микрофлора каждого человека имеет свою метаболическую активность и определенные изменения ее состава могут служить предрасполагающим фактором к развитию ожирения [12].
В серии экспериментов проводилась пересадка кишечной флоры безмикробным мышам, выросшим в стерильной среде. В результате наблюдалось увеличение массы жировой ткани за две недели на 60% без каких-либо изменений в питании, что сопровождалось развитием ИР, гипертрофией адипоцитов, повышением уровней лептина и глюкозы в крови [13]. Было установлено, что кишечная микрофлора влияет на энергобаланс не только за счет эффективного извлечения энергии из питательных веществ, но и за счет воздействия на гены, регулирующие ее расход и запасание [14].
Еще в одном исследовании проводилась пересадка безмикробным мышам кишечной флоры от худых и от толстых мышей. Оказалось, что безмикробные мыши, которым пересадили кишечную флору от толстых мышей, набирают вес гораздо быстрее, чем те, кому пересадили флору от худых собратьев [15]. Полученные данные позволили предположить, что изменения микрофлоры кишечника могут играть роль в патогенезе ожирения и требуют дальнейшего изучения.
Как было указано выше, ожирение и ИР тесно связаны с хроническим системным воспалением [16], которое может быть вызвано нарушениями состава кишечной микрофлоры [17]. Бактериальные липополисахариды (ЛПС) являются триггерным фактором системного воспаления, способствуя продукции провоспалительных цитокинов: ИЛ-1, ИЛ-6, ФНО-альфа, ИАП-1. В экспериментах на мышах было показано, что диета с высоким содержанием жиров приводит к увеличению концентрации ЛПС в плазме крови вследствие дисбиоза кишечника (преобладания грамотрицательных микробов). Такая хроническая эндотоксемия способствует развитию метаболических нарушений, в том числе ожирения, ИР и СД [18]. Предполагают, что ЛПС через CD14-рецепторный аппарат влияют на чувствительность к инсулину, приводя к развитию этих расстройств [17]. Так, у пациентов с СД 2-го типа наблюдается более высокий уровень ЛПС, чем у пациентов без диабета [19].
И все-таки какие именно изменения кишечной микрофлоры происходят при ожирении? При анализе бактериального генома (микробиома) у мышей, страдающих наследственным ожирением, выявлено резкое снижение в кишечнике доли бактерий из группы Bacteroidetes по сравнению с обычными мышами, тогда как доля бактерий из группы Firmicutes, напротив, повышена [20]. Схожие изменения были выявлены и у людей: при обследовании 12 пациентов с ожирением обнаружено, что в их кишечнике меньше Bacteroidetes и больше Firmicutes по сравнению с контрольной группой худых людей. Затем пациентам была предписана низкокалорийная диета с ограничением жиров или углеводов, а исследователи в течение года следили за изменениями их кишечной флоры. Оказалось, что диета приводит к значительному снижению численности Firmicutes и росту численности Bacteroidetes, причем эти изменения коррелировали со степенью снижения массы тела [21].
Несмотря на то, что Bacteroidetes и Firmicutes являются доминирующими микроорганизмами в кишечном биоценозе, там также присутствуют метаногенные археи, среди которых преобладает Methanobrevibacter smithii. Эти выделяющие метан микроорганизмы повышают эффективность усвоения пищи микробным сообществом, поскольку они утилизируют водород и другие конечные продукты, образующиеся в результате ферментации полисахаридов. При двойной колонизации кишечника безмикробных мышей Methanobrevibacter smithii и Bacteroides thetaiotaomicron было установлено, что извлечение энергии из полисахаридов пищи более эффективно, чем при раздельной колонизации, и сопровождается увеличением массы жировой ткани [22].
Нормализация веса играет важную роль в лечении и профилактике СД 2-го типа. Очевидно, что изменение образа жизни и качества питания в сочетании с увеличением двигательной активности (т. е. создание энергетического дефицита) представляется основным способом коррекции ожирения [5]. И хотя роль микробиоценоза кишечника в регуляции энергетического обмена не до конца ясна, воздействие на кишечную микрофлору может способствовать коррекции ожирения и компенсации СД 2-го типа.
При применении антибиотиков у крыс с предрасположенностью к СД были выявлены различия в составе кишечной микрофлоры у животных с развившимся диабетом и без него: у крыс без диабета обнаружено более низкое содержание Bacteroidetes [23]. Исследователи предполагали, что изменения кишечной микрофлоры, вызванные приемом антибиотиков, приводят к снижению антигенной нагрузки и последующего воспаления, которое может способствовать деструкции бета-клеток поджелудочной железы.
Однако применение инулина у здоровых людей снижало поглощение жиров и энергии [27]. Использование олигофруктозы у мышей, получавших диету с высоким содержанием жиров, способствовало селективному повышению содержания бифидобактерий в кишечнике и уменьшению эндотоксемии, а кроме того, оказывало положительный эффект на толерантность к глюкозе, глюкозоопосредованную секрецию инсулина и нормализовало воспалительный фон [28]. Применение пребиотического комплекса Эубикор у пациентов с СД 2-го типа легкой и средней степени тяжести продемонстрировало существенный гипогликемический эффект препарата: снижение уровня глюкозы крови натощак на 20–25% от исходного уровня по результатам шестинедельного курса лечения. Столь выраженная гипогликемическая активность обусловлена прежде всего уменьшением инсулинорезистентности и, вероятно, восстановлением чувствительности рецепторного аппарата клеток к действию инсулина, что подтверждалось снижением коэффициента HOMA-IR с 7,8 ± 0,8 до 5,6 ± 0,6 (р
А. А. Тишкина
Н. В. Ворохобина, доктор медицинских наук, профессор
А. Ю. Барановский, доктор медицинских наук, профессор
СПбМАПО, Санкт-Петербург
КИШЕЧНАЯ МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ

МИКРОФЛОРА И ДИАБЕТ 1 ТИПА
Примечание: Диабет (сахарный диабет) классифицируется в медицине, как нарушение метаболизма. Подробнее об этом заболевании, а также о роли инсулина в развитии ожирения, повышающего в свою очередь риск возникновения диабета, см. по ссылке: "Диабет - расстройство метаболизма"
При диабете 1-го типа иммунная система ошибочно атакует клетки поджелудочной железы, производящие инсулин. В результате концентрация инсулина в крови падает, а уровень глюкозы растет. Хотя точная причина диабета 1-го типа остается не известной, ученые считают, что некоторые люди с особым набором генов больше подвержены развитию заболевания. Новые исследования показывают, что кишечные бактерии тесно связаны с развитием диабета.
Диабет 1 типа (T1D или СД1) - это аутоиммунное заболевание, характеризующееся иммуноопосредованным разрушением бета (β)-клеток. Генетические и экологические взаимодействия играют важную роль в сбое иммунной системы, вызывая агрессивный адаптивный иммунный ответ против β-клеток. Микробы, обитающие в кишечнике человека, тесно взаимодействуют с иммунной системой слизистой оболочки кишечника. Колонизация кишечной микробиоты и созревание иммунной системы происходят параллельно в первые годы жизни; следовательно, нарушения в микробиоте кишечника могут нарушать функции иммунных клеток и наоборот. Нарушения микробиоты кишечника (дисбиоз) часто выявляются у пациентов с СД1, особенно у тех, у кого диагностированы множественные аутоантитела в результате агрессивного и неблагоприятного иммунореагирования. Патогенез СД1 включает активацию аутореактивных Т-клеток, что приводит к разрушению β-клеток Т-лимфоцитами CD8 + . Становится также очевидным, что кишечные микробы тесно взаимодействуют с Т-клетками. Обнаружено, что устранение дисбактериоза кишечника с использованием специфических пробиотиков и пребиотиков связано со снижением аутоиммунного ответа (с уменьшением воспаления) и целостности кишечника (за счет повышенной экспрессии белков с плотным соединением в кишечном эпителии). В этом обзоре обсуждаются потенциальные взаимодействия между микробиотой кишечника и иммунными механизмами, которые участвуют в прогрессировании T1D, и рассматриваются потенциальные эффекты и перспективы применения модуляторов кишечной микробиоты, включая пробиотические и пребиотические вмешательства, при улучшении патологии T1D как у человека, так и у животных моделей. Подробнее см. статью по кнопке-ссылке:
Кишечные бактерии защищают от диабета. Предыстория.
Ученые обнаружили, что бактерии, живущие в кишечнике, играют большую роль в защите от сахарного диабета 1 типа. Этот эффект обусловлен сложным взаимодействием иммунитета и симбиотической кишечной микрофлоры .
Еще в 90-х было замечено, что у мышей, генетически предрасположенных к диабету 1 типа, это заболевание развивается с большей вероятностью, если животные растут в стерильных условиях. Группа исследователей из Университета Чикаго под руководством Александра Червонски (Alexander Chervonsky) решила изучить механизм этого явления. Для этого ученые лишили мышей, предрасположенных к диабету, гена белка MyD88 – ключевого регулятора иммунного ответа на симбиотическую микрофлору.
Оказалось, что мыши без гена MyD88 диабетом не заболевают. Однако если их выращивали в стерильных условиях, болезнь все же развивалась. Мыши, которым после выращивания в стерильных условиях вводили смесь кишечных бактерий, заболевали менее часто – 34% по сравнению с 80%. На основании полученных данных ученые предположили, что действие MyD88 снижает возможность бактерий предотвращать развитие диабета.
О роли кишечной микрофлоры в развитии сахарного диабета 1-го и 2-го типов см. по ссылке:
О роли кишечной микрофлоры в защите от развития сахарного диабета 1-го типа см. по ссылке:
О роли кишечной микрофлоры в здоровье проджелудочной железы:

В тонком кишечнике человека обитает огромное количество бактерий и других микроорганизмов, которые играют важную роль в сохранении и поддержании нашего здоровья. Они помогают переваривать пищу и снабжают нас энергией и витаминами.
Cимбиотические бактерии, обитающие в тонком кишечнике, предотвращают внедрение болезнетворных микроорганизмов. Биологические реакции, протекающие в нашем организме и поддерживающие постоянство его внутренней среды, зависят от населяющих тонкий кишечник бактерий и особенностей взаимодействия с ними клеток организма.
Одно из проведенных исследований указало на взаимосвязь между сосоянием микрофлоры тонкого кишечника и риском развития СД 1 типа:

Новое исследование было проведено под руководством профессора Джейне Данска (Jayne Danska) из Детской клиники при Университете Торонто ( Sick Children’s Hospital of the University of Toronto , Канада) и профессора Эндрю Макферсона (Andrew Macpherson) из Клиники Висцеральной Хирургии и Медицины Инзельшпиталь ( Clinic for Visceral Surgery and Medicine at the Inselspital ) при Бернском Университете ( University Bern , Швейцария).
Результаты исследования показали, бактерии, обитающие в тонком кишечнике, влияют на степень вероятности развития у их хозяина сахарного диабета. Поддержание нормального баланса микрофлоры за счет регулирования соотношения штаммов полезных микроорганизмов, является крайне важным фактором в профилактике данного заболевания.
Сегодня сахарный диабет все чаще диагностируют у людей молодого возраста, и медики уже говорят о настоящей эпидемии сахарного диабета
Увеличение распространенности этого заболевания наблюдается в последние сорок лет, когда отмечено повышение чистоты и гигиенического состояния наших домов и окружающей среды. У детей и пациентов молодого возраста развитие сахарного диабета обусловлено нарушением функционирования клеток иммунной системы, которые повреждают специализированные клетки поджелудочной железы, вырабатывающие гормон инсулин. В настоящее время после диагностирования у ребенка сахарного диабета он нуждается в пожизненном лечении.

Тридцать лет назад японские ученые обратили внимание на то, что лабораторные мыши штамма NOD (прим.: Мыши NOD - это модель у лабораторных животных аутоиммунного диабета человека, характеризующаяся разрушением b-клеток) имеют склонность к развитию сахарного диабета, так как в их геноме присутствуют гены, обусловливающие у человека предрасположенность к развитию сахарного диабета.
Еще раз отметим, что такая разновидность диабета, по мнению ученых, связана с образованием дефектов в иммунной системе организма. При возникновении этих процессов начинают формироваться специальные структуры - антитела, которые действуют отрицательным образом в поджелудочной железе на размножение и деятельность клеток, производящих инсулин. Развитие аутоиммунного диабета получает дополнительный толчок при распространении различных инфекционных заболеваний вирусного типа, а также влияния на организм человека ряда канцерогенных веществ.
Благодаря специальному оборудованию из Университета Берна и Канады исследовательские команды на данной модели на мышах смогли продемонстрировать, что бактерии, обитающие в тонком кишечник е , могут синтезировать биохимические соединения и гормоны, предотвращающие развитие сахарного диабета.
Подробнее об исследовании см:
По словам Эндрю Макферсон из Бернского Университета, ученые надеются, что полученные результаты расширят представления ученых о механизмах, позволяющих бактериям, обитающим в тонком кишечнике, защищать организм от развития сахарного диабета. Он считает, что новые данные о причинах развития диабета и о роли здоровой кишечной микрофлоры, препятствующей его появлению путем продукции определенных веществ, помогут создать инновационные методы лечения пациентов и предотвратить развитие заболевания у детей.
Еще об одном исследовании см.:

Возможно, больным диабетом 1-го типа удастся помочь, восстановив состав микрофлоры кишечника.
Как показало новое исследование, таргетирование конкретной микробиоты в кишечнике может быть одним из способов защиты от диабета 1 типа. Исследователи из Квинслендского Университет (University of Queensland) в Австралии обнаружили явные изменения микробиоты кишечника у грызунов и людей, которые подвергаются высокому риску диабета 1 типа.
Подробнее об исследовании см:
По матералам статьи в Microbiome
Соавтор исследования Доктор Эмма Гамильтон Уильямс (Dr. Emma Hamilton-Williams) из Института Трансляционных Исследований в Университете Квинсленда и ее коллеги говорят, что их результаты показывают, что таргетирование кишечной микробиоты может иметь потенциал для предотвращения диабета типа 1.
МИКРОФЛОРА КИШЕЧНИКА И САХАРНЫЙ ДИАБЕТ 2 ТИПА

Поджелудочная железа вырабатывает недостаточно инсулина или инсулин не перерабатывается.
Сахарный диабет 2-го типа - это метаболическое заболевание, которое проявляется нарушением обмена углеводов. Организм не производит достаточного количества инсулина для надлежащей функции, или клетки в теле не реагируют на инсулин (устойчивость к инсулину или инсулинорезистентность). Приблизительно 90% всех случаев диабета во всем мире - это диабет 2 типа. В результате приобретения инсулинорезистентности, то есть невосприимчивости клеток организма к этому гормону, - развивается гипергликемия (увеличение концентрации глюкозы в крови). Простыми словами, в организме - нормальный уровень инсулина и повышенный уровень глюкозы, которая по каким-то причинам не может попасть в клетки.


На рисунке: Влияние инсулина на поглощение и метаболизм глюкозы. Инсулин связывается со своим рецептором (1), который, в свою очередь, запускает несколько каскадов активации протеина (2). К ним относятся: транслокации транспортёра GLUT4 к плазматической мембране и приток глюкозы (3), синтез гликогена (4), гликолиз (5), синтез жирных кислот (6).
Ученые подтвердили роль микробиоты на инсулинорезистентность экспериментально путем пересадки микрофлоры от здорового донора к пациенту с сахарным диабетом 2 типа. В результате эксперимента у пациентов увеличилась чувствительность к инсулину на несколько недель.
Подробнее по ссылке:
Уже ни у кого не вызывает сомнения тот факт, что биохимические реакции, протекающие в нашем теле и фактически определяющие наше здоровье, напрямую зависят от состояния желудочно-кишечного тракта и взаимодействия его микрофлоры с клетками нашего организма. Если учесть, что пробиотики обладают иммуномодулирующими свойствами, способствуют нормализации микрофлоры ЖКТ, в т.ч. снижению избыточной массы тела , повышающей риск развития СД, то систематическое потребление в пищу пробиотических продуктов функционального питания и прием пробиотиков может рассматриваться как одно из перспективных средств в профилактике и комплексной терапии сахарного диабета.
ПОЧЕМУ РАСТИТЕЛЬНАЯ КЛЕТЧАТКА ЗАЩИЩАЕТ ОРГАНИЗМ ОТ САХАРНОГО ДИАБЕТА

С помощью кишечной микрофлоры пищевые волокна превращаются в жирные кислоты, которые кишечник потом использует для синтеза собственной глюкозы. Последняя служит для мозга сигналом о том, что нужно подавить чувство голода, повысить энергетические расходы и уменьшить выброс сахара из печени.
Вы ведь слышали о пользе клетчатки, верно? О тех самых пищевых волокнах, что защищают нас от ожирения и диабета. Волокна эти в изобилии есть в овощах и фруктах, но сам кишечник расщепить их не может, а потому ему на помощь спешит микрофлора. Положительный метаболический и физиологический эффект клетчатки подтверждён многочисленными опытами: животные на такой диете накапливали меньше жира, и у них снижался риск развития диабета. Однако нельзя сказать, что мы понимаем, как именно эти волокна действуют. Известно, что кишечные бактерии расщепляют их с образованием короткоцепочечных жирных кислот , пропионовой и масляной, которые потом всасываются в кровь. Учёные из Национального центра научных исследований (CNRS) во Франции предположили, что эти кислоты как-то влияют на синтез глюкозы кишечником. Его клетки действительно могут синтезировать глюкозу, выбрасывая её в кровь между приёмами пищи и по ночам. Нужно это вот для чего: сахар связывается с рецепторами воротной вены, которая собирает кровь, идущую от кишечника, и рецепторы эти подают соответствующий сигнал в мозг. Мозг реагирует, подавляя чувство голода, повышая расход запасённой энергии и заставляя печень сбавить производство глюкозы.
То есть за счёт небольшой порции глюкозы из кишечника подавляется выброс глюкозы из печени, и предпринимаются меры против поглощения новых — ненужных и опасных — калорий.
Оказалось, что активность генов в клетках кишечника, отвечающих за синтез глюкозы, зависит от тех самых волокон, а также от пропионовой и масляной кислот. Кишечник использовал пропионовую кислоту как сырьё для синтеза глюкозы. Мыши, поглощавшие много жира и углеводов, меньше набирали вес и реже болели диабетом, если вместе с жиром и сахаром съедали достаточно клетчатки. При этом у них повышалась чувствительность к инсулину (которая, как известно, снижается при диабете второго типа).
Прим.: Стоит заметить, что пропионовая кислота является одним из основных продуктов жизнедеятельности пропионовокислых бактерий , которая наряду с пропионатами и пропиоцинами, способна подавлять рост патогенных микроорганизмов. А, к примеру, масляную кислоту продуцируют клостридии , входящие в состав нормальной микрофлоры человека.
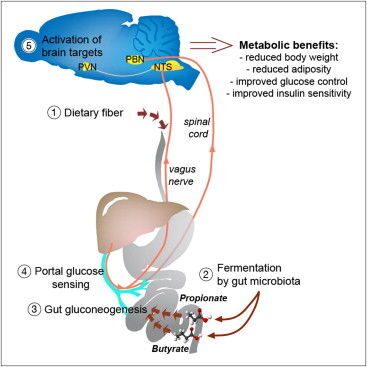
В другом эксперименте использовались мыши, у которых была выключена способность синтезировать глюкозу в кишечнике. В этом случае никакого полезного эффекта от пищевых волокон не было. То есть просматривается такая цепочка: мы едим клетчатку, микрофлора перерабатывает её до жирных кислот, которые потом клетки кишечника могут использовать для синтеза глюкозы-регулятора. Эта глюкоза нужна, чтобы ограничивать наше неуместное стремление пожевать что-нибудь ночью, а также для поддержки правильного баланса глюкозы в организме.
С одной стороны, это очередной аргумент в пользу того, что кишечная микрофлора нужна нам для того, чтобы оставаться здоровыми, причём сей аргумент обзавёлся конкретным биохимическим механизмом. С другой стороны, возможно, с помощью этой биохимической цепочки удастся в будущем искусственно пресекать нездоровые процессы, которые могут довести нас до ожирения и диабета. / Результаты исследования опубликованы в журнале Cell.

*О практическом использовании свойств пробиотических микроорганизмов в создании инновационных препаратов для лечения и профилактики дислипидемии и диабета см. в описании к пробиотику "Бификардио":
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
Читайте также:


