Чем достигается наиболее эффективная профилактика раневой инфекции
Поступила 01.04.2008 г.
А.Н. КАРАЛИН, В.А. ТЕРЕНТЬЕВ, Л.Г. МУРЗАЕВА
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ РАНЕВОЙ ИНФЕКЦИИ
НА ЭТАПАХ МЕДИЦИНСКОЙ ЭВАКУАЦИИ
Чувашский государственный университет им. И.Н. Ульянова, Чебоксары
Для профилактики раневой инфекции на этапах медицинской эвакуации (ЭМЭ) большое значение имеют как медицинские, так и организационные мероприятия. Рассмотрены основные принципы профилактики и лечения раневой инфекции на различных ЭМЭ в зависимости от сроков поступления раненого, а также профилактика местной и общей инфекции.
Medical as well as organizational measurements are essential in oder to prevent wound infection at the stage of medical evacuation(SME).these are the main prevention and treatment principles with the reference to SME depending on the terms the wounded was evacuated ,and also prevention of local and general infection
Любая огнестрельная рана является первично инфицированной. Это связано с тем, что в момент ранения с ранящим снарядом в рану заносятся микроорганизмы, находящиеся на одежде, коже. При несвоевременном оказании помощи в рану могут поступать микроорганизмы из окружающей среды. Такое микробное загрязнение называется вторичным инфицированием. И в первом, и во втором случаях этот путь микробной контаминации раны называется экзогенным, или инвазивным (микробная инвазия).
Более опасной является инвазия госпитальной флоры, устойчивой даже к современным бактериальным средствам. Она проникает через верхние дыхательные пути – в процессе ИВЛ и санационных мероприятий, через мочевые пути в процессе катетеризации, а также через кожный покров в ходе выполнения многочисленных инвазивных лечебных и диагностических манипуляций. Инфекционный процесс, вызванный госпитальной микрофлорой, получил название госпитальной или нозокомиальной инфекции.
Кроме того, у больных с огнестрельными ранениями на фоне развития травматической болезни возможны и другие пути попадания микроорганизмов в рану. Это так называемый эндогенный путь. Как указывает Е.К. Гуманенко [1], первым этиологическим фактором возникновения таких осложнений выступает эндогенная микрофлора. Причем могут развиваться не только местные, но и висцеральные и генерализованные инфекционные осложнения. Источником эндогенной инфекции является кишечная микрофлора, проникающая в систему кровообращения, так как при травматической болезни и нарушении микроциркуляции, в частности кишечника, стенка кишечных капилляров становится проницаемой для микроорганизмов: энтеробактерий, протея, кишечной палочки и других. Поступая в кровь, эти условно патогенные микроорганизмы попадают в поврежденные ткани, где обретают новую среду обитания. И если новая среда благоприятствует их существованию и развитию, то формируется новый метастатический патологический очаг раневой инфекции. Очень важным фактором его формирования является не только поступление эндогенной микробной флоры в зону раны (так называемая генерализованная транслокация (по Е.К. Гуманенко), но и состояние раны (объем первичного и вторичного некроза, степень нарушения кровообращения) и эффективность первичной хирургической обработки (удаление некротических тканей, восстановление кровообращения).
Местная и общая раневая инфекция – распространенное осложнение огнестрельных ранений. Качественная профилактика и лечение ее возможны только при четком и последовательном выполнении на каждом этапе алгоритма поставленных задач (таблица).
Алгоритм профилактики и лечения инфекционных осложнений огнестрельных ранений
Профилактика
и лечение
- Обеспечение ППИ, АИ-1.
- Профилактические прививки противостолбнячные.
- Быстрый и щадящий вынос из очага
- Соблюдение асептики и антисептики.
- Асептические повязки.
- Введение антибиотиков широкого спектра действия.
- Транспортная иммобилизация.
- Профилактика и лечение травматического и геморрагического шока
- Ранняя и полноценная ПХО.
- Исключение первичного хирургического шва
- Активная и пассивная профилактика столбняка.
- Пассивная профилактика анаэробной инфекции
- Местная аэрация тканей (внутрикожное, подкожное введение кислорода и озона).
- Внутривенное озонирование.
- ГБО.
- Кислородная ингаляция
Профилактика раневой инфекции на этапе первой медицинской помощи (на поле боя)
Здесь нет никакой этиологической дифференциации в способе профилактики. Осуществляются, главным образом, организационные и медицинские мероприятия.
Организационные: быстрый и щадящий вынос раненого с поля боя.
Медицинские: асептическая повязка на рану, прием пероральных антибиотиков из АИ – 1, транспортная иммобилизация.
Профилактика раневой инфекции на этапе доврачебной помощи (МПБ)
На данном этапе появляются элементы дифференцированного подхода к этиологической профилактике раневой инфекции. В обязательном порядке должна учитываться угроза развития не только местной, но и общей раневой инфекции (столбняк, газовая гангрена). На данном этапе нужно проводить следующие виды профилактики: организационные и медицинские.
Организационные: быстрая и щадящая эвакуация на следующий этап. Дифференциация профилактических мер должна включать мероприятия, направленные на предупреждение столбняка и газовой гангрены.
Медицинские: дополнительные асептические повязки; транспортная иммобилизация табельными средствами; в/м введения антибиотиков широкого спектра действия. Дополнительные меры профилактики должны включать мероприятия, направленные на предупреждение столбняка и газовой гангрены: тщательная оценка правильности и времени наложения жгута, обязательная ингаляция кислорода, особенно у раненых группы риска развития анаэробной инфекции.
Профилактика раневой инфекции на этапе первой врачебной помощи (МПП)
На этом этапе подключается специфический вид профилактики.
Организационные: проведение эвакотранспортной сортировки раненых, относящихся к группе особого риска.
Медицинские: обкалывание раны антибиотиками пролонгированного типа и широкого спектра действия, подбинтовывание повязок, табельная транспортная иммобилизация. Контроль жгута (правильность, время), смена жгута, замена его на другие виды временной остановки кровотечения (более щадящие, менее травматичные), противошоковая терапия.
Специфическая: ингаляция кислорода, местная аэрация тканей вокруг раны, в/в введение озонированных растворов, введение специфических сывороток (противостолбнячной и противогангренозной).
Профилактика и лечение раневой инфекции
на этапе квалифицированной помощи (ОМедБ)
Организационные мероприятия – тщательная внутрипунктовая сортировка раненых (ведение группы первой и второй очереди); эвакуационно-транспортная сортировка: эвакуация раненых в первую очередь с ранениями крупных магистральных сосудов в ГБФ.
Медицинская профилактика: антибиотикотерапия, соблюдение принципов асептики – антисептики, послеоперационная лечебная иммобилизация, окончательное выведение раненого из шока.
На данном этапе на первый план выходит специфический вид профилактики раневой инфекции. Это, прежде всего, ранняя первичная хирургическая обработка раны. Устранение компартмент–синдрома. Обязательны местная и общая аэрация и озонирование. Исключение раннего первичного хирургического шва. Введение специфических сывороток. Помимо профилактических мер на данном этапе необходимо лечение раневой инфекции. Это касается главным образом газовой гангрены (молниеносная форма). Для этого на данном этапе имеется анаэробная палатка, в которой проводятся специфические лечебные мероприятия: хирургические (лампасные разрезы, ампутация), введение лечебных доз противогангренозной сыворотки, местная аэрация тканей в зоне развития инфекции, внутривенное введение озонированных растворов.
Профилактика и лечение раневой инфекции в ГБФ
На госпитальном этапе эвакуации профилактика раневой инфекции должна включать прежде всего специфические методы: первичную и вторичную хирургическую обработку ран, восстановление сосудистого кровотока. Общая и местная аэрация тканей, стабилизация костных отломков, ампутации по вторичным показаниям. Введение сывороток. Большое внимание должно уделяться медицинским видам профилактики, направленным на борьбу с инвазивной госпитальной или нозокомиальной инфекцией: обязательное соблюдение правил асептики и антисептики, использование одноразового инструментария (шприцы, инструменты, интубационные трубки, катетер и маски для ингаляций и т.д.), т.к. многоразовый является носителем госпитальной микрофлоры. Активное лечение в каждом периоде травматической болезни.
Наиболее тяжелую группу представляют ранения, осложненные анаэробной инфекцией. В зависимости от ЭМЭ частота этого осложнения составляет от 0,08 до 15 % раненых. Профилактические меры, направленные на предупреждение данного грозного и тяжелого осложнения, делятся на неспецифические (организационные и медицинские) и специфические. Эти меры должны быть соблюдены на всех этапах оказания медицинской помощи. На первом месте стоит правильная, своевременная и эффективная эвакуация на этапы МПП и ОМедБ. При оказании первой медицинской, доврачебной и первой врачебной помощи необходимо всегда помнить о том, что: 1) наложенный жгут – это огромная опасность, если он наложен неправильно, не по показаниям, просрочено время; 2) ранение крупных магистральных сосудов – это показание к эвакуации в первую очередь.
Специфическая профилактика – это, прежде всего, проведение ранней первичной хирургической обработки с широкой фасциотомией, наложение сосудистого шва в первые 6 часов с момента ранения, тщательное дренирование раны (проточные дренажи), аэрирование раны, категорическое исключение показаний для наложения первичного хирургического шва.
В случаях, когда раненые поступают с клинической картиной анаэробной инфекции, необходимо помимо традиционного хирургического вмешательства (лампасные разрезы, некрэктомия) использовать ГБО и озонированные растворы.
Под нашим наблюдением находилось 20 человек с газовой гангреной после ранения. Они поступили на различных сроках. Причины в основном связаны с нарушением вышеуказанных принципов оказания помощи пострадавшим. После проведения вторичной хирургической обработки раны (лампасные разрезы, иссечение нежизнеспособных тканей), назначения лечебных доз противогангренозной сыворотки были использованы методика гипербарической оксигенации (2 раза в день), в/в введение озонированных растворов, местная аэрация тканей (Каралин А.Н., Терентьев В.А., Азизова Р.Х. Способ лечения ран: Пат. №2219932 от 27.12.03), дезинтоксикационная терапия.
Результатом нашей тактики лечения больных газовой гангреной стали их выздоровление и отсутствие ампутации.
Заключение. На всех этапах оказания медицинской помощи нужно помнить о том, что: любое огнестрельное ранение представляет угрозу развития анаэробной инфекции, в частности газовой гангрены.
Из раненых выделяется группа риска, в которой вероятность развития этого осложнения велика: слепые ранения, ранения нижних конечностей, с массивным повреждением тканей. Кроме того, должна быть выделена группа больных особого риска, в которой частота развития газовой гангрены выше во много раз. Это ранение конечностей, сопровождающееся повреждением магистральных сосудов, компартмент-синдромом, с наложением жгута, шоком (травматическим, геморрагическим, плевропульмональным).
Согласно такому распределению больных устанавливается очередность их эвакуации и срочность оказания квалифицированной хирургической помощи. Раненые группы особого риска должны эвакуироваться в те же сроки, что и раненые с внутренними кровотечениями. Квалифицированная хирургическая помощь им должна оказываться как группе раненых, нуждающихся в ней по жизненным показаниям: после выведения из шока, в перевязочной. В случаях повреждения магистральных сосудов – лучше на этапе специализированной помощи.
Профилактика газовой гангрены должна быть комплексной, т.е. включать организационные мероприятия, медицинскую помощь на этапах эвакуации и своевременное качественное хирургическое вмешательство.
Специфическая профилактика анаэробной инфекции должна делиться на патогенетическую и саногенетическую. Патогенетическая – прямое воздействие на анаэробную инфекцию (введение противогангренозной сыворотки), тщательная хирургическая обработка раны, исключение первичного хирургического шва.
Саногенетическая – повышение защитной функции организма и, в частности, общей и местной, путем аэрации тканей.
Специфическая патогенетическая профилактика – введение противогангренозной сыворотки в объеме 1 профилактической дозы. Несмотря на мнение, что таковая мера не является эффективной профилактической защитой от развития газовой гангрены, ее следует использовать. Но при этом четко придерживаться организационных и медицинских мероприятий, в которых главными являются ранняя первичная хирургическая обработка огнестрельной раны и полное исключение первичного шва.
Рекомендованные в хирургии мирного времени виды швов – первичный, первично-отсроченный, провизорный в военно-полевой хирургии нередко во много раз увеличивают угрозу развития раневой инфекции. Это относится, главными образом, к первичным швам. Показания к наложению при огнестрельных ранениях очень субъективны и нередко вводят в заблуждение хирурга. Результатом является, как правило, раневая инфекция.
С учетом высокого риска развития раневой инфекции, в частности газовой гангрены, при огнестрельных ранениях следует запретить применение первичного хирургического шва после хирургической обработки раны.
В военно-полевой хирургии, чтобы исключить сомнения в отношении применения первичного хирургического шва при огнестрельных ранениях, оставить только 3 вида швов: первично-отсроченный (через 3-4 дня после ПХО) и вторичный – ранний (через 2 недели после ПХО) и поздний (через 3-4 недели после ПХО).
Причина увеличения возможности развития газовой гангрены при шоке травматического характера связана с особенностями его патогенеза. Как известно, травматический и геморрагический шок сопровождается снижением ОЦК, что ведет к циркуляторной гипоксии. Кроме того, резко нарушается микроциркуляция тканей, идет централизация кровообращения. Все это ведет к резкому уменьшению поступления кислорода к периферическим тканям (конечностям). На этом фоне создаются благоприятные условия для активизации анаэробной инфекции при огнестрельных ранениях в группе риска и особенно в группе особого риска. То же самое происходит и при ранениях, осложненных плевропульмональным шоком. При этом степень гипоксии еще более выражена, так как помимо циркуляторной гипоксии развивается и дыхательная. Поэтому эта группа раненых должна относится к 3 группе (особого риска) и подлежит эвакуации в первую очередь.
В целях медицинской профилактики развития анаэробной инфекции на ЭМЭ рекомендуется применение у раненых 2 и 3 групп местной и общей аэрации (в/в озонированный раствор, обкалывание мягких тканей кислородом или озоном).
Лечение газовой гангрены должно в обязательном порядке включать местную и общую аэрацию тканей путем использования предложенной методики внутривенного введения кислорода и озона, а также ГБО, что значительно улучшает результат лечения и полностью устраняет угрозу ампутации конечности.
Выводы. Эффективная профилактика и лечение раневой инфекции на этапах медицинской эвакуации возможны только при четком и последовательном выполнении на каждом этапе алгоритма поставленных задач.
1.Должны быть выделены неспецифические (медицинские и организационные) и специфические виды профилактики и лечения.
2.Необходимо всех раненых, с учетом риска развития раневой инфекции, разделить на 3 группы (1 – все огнестрельные ранения, 2 – группа риска, 3 – особого риска).
3.В целях профилактики развития раневой инфекции исключить из практики военно-полевой хирургии первичный хирургический шов. Оставить только первично-отсроченный и вторично-отсроченный (ранний и поздний).
СПИСОК ЛИТЕРАТУРЫ
- Гуманенко Е.К. Военно-полевая хирургия. СПб.: Фолиант, 2005. 190 с.
- Каралин А.Н., Терентьев В.А., Азизова Р.Х. Способ лечения ран: Патент на изобретение 2219932 РФ.
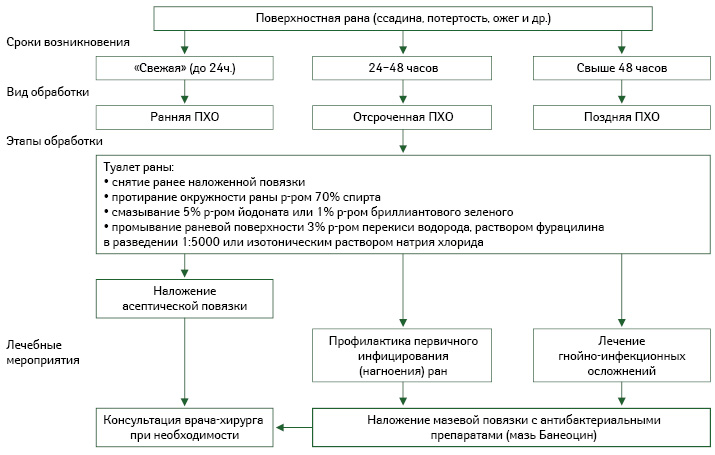
Расширение ассортимента лекарственных препаратов для локальной консервативной фармакотерапии раневого процесса позволяет проводить дифференцированное лечение ран и ожогов, которое осуществляется путем последовательного применения различных лекарственных средств с разнообразным механизмом их действия (Ляпунов Н.А. и соавт., 1995), влияющих на определенные фазы раневого процесса. Активный поиск эффективных лекарственных веществ в разных лекарственных формах является актуальным и в настоящее время.
Нанесение лекарственных препаратов для наружного применения на рану определяют как местное медикаментозное лечение. Для успешной терапии ран необходимо комплексное воздействие на раневой процесс (Кузнецов Н.А., 2006) с учетом не только степени тяжести его течения, но и уровня его распространения в глубину, количества вовлеченных в воспалительный процесс анатомических структур и т.д. (таблица; алгоритм обработки поверхностных ран).
| Таблица | Классификация хирургической инфекции мягких тканей (Ahrenholz D., 1991; Блатун Л.А., 2007) |
| Уровень | Поражение | Заболевания |
| I | Собственно кожи | Фурункул |
| Фурункулез | ||
| Рожа | ||
| Эризипелоид | ||
| II | Подкожной клетчатки | Карбункул |
| Гидраденит | ||
| Абсцесс | ||
| Целлюлит | ||
| III | Поверхностной фасции | Некротизирующий фасциит |
| IV | Мышц и глубоких фасциальных структур | Пиомиозит |
| Инфекции мышечных футляров | ||
| Клостридиальный мионекроз | ||
| Неклостридиальный мионекроз |
Терапия включает локальное назначение широкого спектра лекарственных веществ в форме мазей, гелей, порошков, масел и раневых покрытий (Кузин М.И., 1999; Блатун Л.А., 2007).
Поверхностные инфицированные раны лечат дренирующими сорбентами и протеолитическими ферментами. При лечении гнойных глубоких ран в первой фазе проводят терапию мазями под повязками (Блатун Л.А., 2009), причем успех профилактики и лечения ран в данной фазе определяется своевременным назначением различных лекарственных средств с антимикробным действием. А вот во второй фазе — регенерации, образования и созревания грануляционной ткани применяют мази, раневые покрытия, гелевые повязки и масла с активными компонентами, уже способствующими стимуляции этих процессов (алгоритм обработки поверхностных ран).
Неомицин — представитель антибиотиков-аминогликозидов, оказывает бактерицидное действие путем подавления синтеза бактериального белка и угнетения генетического кода бактерий. Для него характерен широкий спектр противомикробного действия (рис. 1).
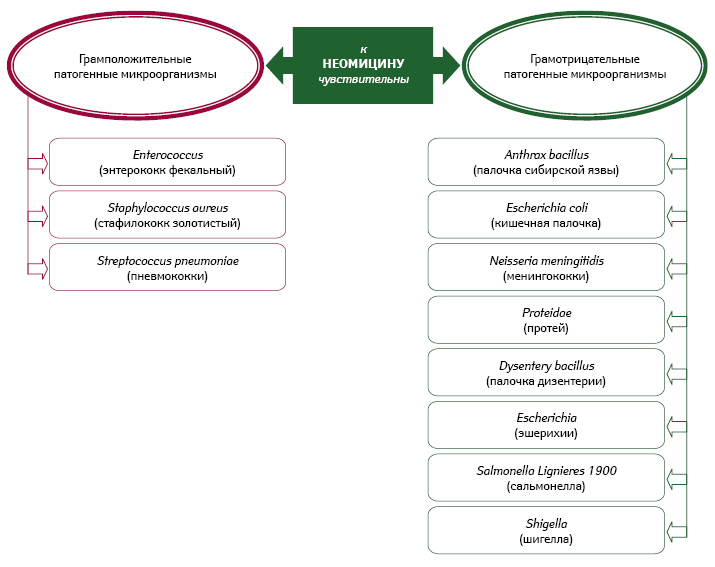
Очевидно, что неомицин проявляет широкий спектр антибактериальной активности, оказывая бактерицидное действие на чувствительную к нему микрофлору (Даценко Б.М. и соавт., 1989). Характерно медленное формирование устойчивости микроорганизмов к неомицину. Наружное применение неомицина в форме порошка или мази не позволяет развиться его токсическим проявлениям, которые могут возникать при парентеральном применении (ото-, нефротоксичность, блокада нейромышечной передачи). Неомицин не применяют перорально ввиду возможности его кумулирования в плазме крови, отмечающееся при нарушенной функции почек (Коваленко В.Н., 2012).
Бацитрацин — полипептидный антибиотик. Он угнетает синтез клеточной стенки путем подавления кругооборота липидных переносчиков субъединиц пептидогликанов (блокада синтеза пептидогликанов), что также реализуется в виде бактерицидного действия. Спектр антибактериального действия бацитрацина представлен на рис. 2.
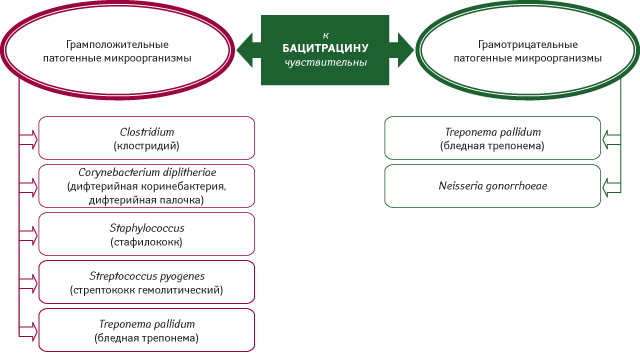
К бацитрацину устойчивость развивается крайне редко, механизмы ее развития не установлены. Он хорошо переносится тканями организма человека и не инактивируется кровью, тканевыми компонентами, биологическими продуктами (Паршина В.Л., 2007). Особенно актуально то, что при локальном его применении снижается риск проявлений повышенной чувствительности к составляющим Банеоцина .
Таким образом, фармацевтическая композиция неомицина и бацитрацина ( Банеоцин ) приводит к синергическому фармакологическому взаимодействию двух лекарственных средств. Такое объединенное действие в итоге превышает сумму действий этих действующих веществ (усиление действия друг друга) по сравнению с их раздельным использованием.
Эта комбинация антибактериальных средств выпускается в виде двух лекарственных форм — порошка и мази.
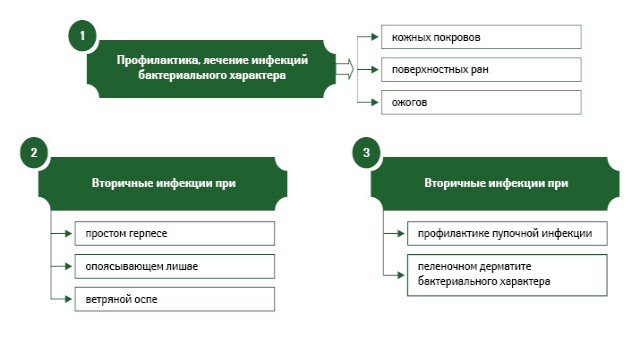
Показания к применению Банеоцина в форме мази и порошка представлены на рис. 3 и 4.

В качестве вспомогательного вещества в состав порошка Банеоцин входит крахмал кукурузный, содержащий не более 2% магния оксида (основа порошковая стерилизованная) (Коваленко В.Н., 2012). Ранее уже были отмечены высокие абсорбционные свойства порошковой основы, которые как раз и проявляются за счет легковесных аморфных порошков — магния оксида и крахмала кукурузного.
Порошок Банеоцин в короткие сроки купирует проявления воспалительного процесса, упреждает возможное возникновение нагноения (Зорин А.Н. и соавт., 2005). При нанесении на кожу порошок Банеоцин обусловливает активное поглощение раневого экссудата, осушение раны и на протяжении нескольких часов обеспечивает дренаж из раны с одновременным образованием защитного антибактериального слоя (Буслаев О.А. и соавт., 2006).
Также порошок Банеоцин обладает замечательными дополнительными действиями: охлаждающим и успокаивающим. Это особенно важно для лечения ран у пациентов детского возраста ввиду их высокой чувствительности к боли и страха перед спиртосодержащими средствами, традиционно используемыми для обработки ран.
Эффективность Банеоцина подтверждена комплексным изучением клинико-лабораторных показателей в лечении пациентов с гнойным поражением кожи и мягких тканей (бактериологическая эффективность составляла 92,5%, а клиническая — 95%) (Блатун Л.А., 2009). Это обусловлено длительным осмотическим действием порошка Банеоцин , что особенно эффективно в лечении гнойных ран в первой фазе раневого процесса, когда происходит активное впитывание раневого отделяемого. Ценным качеством Банеоцина является быстрое разрешение кожных проявлений инфекционных поражений кожи, таких как атопический дерматит, импетиго, фолликулит и т.д., которое отмечается в течение 1 или 2 сут от начала лечения (Шерстобитов А.С., 2008). Банеоцин успешно применяется в лечении пациентов с трофическими язвами и у больных с аллергологическим анамнезом, когда они не могут применять традиционные локальные препараты (Буслаев и соавт., 2006; Блатун Л.А., 2007; 2009). Кроме того, обработка ран, возникших вследствие лазерной деструкции (Соколовский Е.В. и соавт., 2004), порошком Банеоцин с дальнейшим переходом на мазь Банеоцин оказывается более щадящим методом по сравнению с традиционной обработкой (Хорук С.А., 2008).
В свою очередь, мазь Банеоцин представляет собой комбинированный мягкий лекарственный препарат с антибиотиками, введенными в дифильную абсорбционную основу, состоящую из гидрофобного компонента — вазелина, и вещества с дифильными свойствами — ланолина, обладающего эмульгирующей способностью (Хишова О.М., 2009).
Вазелин можно отнести к веществам, которые давно и успешно используют в качестве средства для смягчения кожных покровов, защиты кожи после некоторых косметических процедур и т.д. Это связано с тем, что вазелин способен удерживать влагу в клетках кожи, что, в свою очередь, позволяет смягчить загрубевшие участки кожи, устранить раздражение, защитить слизистую оболочку и саму кожу от агрессивного и вредного воздействия лекарственных препаратов или окружающей среды. При этом вазелин и введенные в него вещества, не проникают в глубокие слои кожи и, тем более, под кожу. Последнее особенно актуально, если рассматривать его в аспекте безопасности применения Банеоцина . Как уже было отмечено выше, использование как неомицина, так и бацитрацина предполагает их исключительно локальное применение с целью предотвращения побочного действия на организм.
Ланолин, относящийся к натуральным вспомогательным веществам, кроме прочего обладает увлажняющими и смягчающими свойствами, позволяющими защищать кожу от неблагоприятных внешних факторов, а также связывать и удерживать в коже влагу. Именно эти позитивные качества ланолина успешно используются в медицине и косметологии с целью обеспечения уменьшения потери влаги и восстановления натуральной мягкости и эластичности кожи. В качестве одного из свойств чистого ланолина отмечают положительное местное его применение у кормящих грудью, помогающее заживлению трещин на сосках и предотвращающее их появление.
Так, учитывая вышеизложенные свойства вспомогательных веществ, входящих в состав мази Банеоцин , можно резюмировать: мазевая основа обладает умеренными абсорбционными свойствами на фоне низких показателей осмотической активности; не нарушает аэрацию кожи и не всасывается в глубокие слои; гидрофобные компоненты, покрывая кожу, препятствуют сухости кожи вследствие исключения излишней потери влаги.
С точки зрения биофармацевтических аспектов создания мягких лекарственных средств, мазевая основа сегодня является не только носителем действующих веществ, поэтому основа мази Банеоцин , отвечая медико-биологическим требованиям к мазям определенного назначения, активно участвует в терапевтическом процессе.
Банеоцин в форме мази эффективен в лечении поверхностных ран, во второй фазе раневого процесса (где может быть использован наряду с порошком) (Буслаев и соавт., 2006). Банеоцин в высоких концентрациях скапливается в гнойном очаге, оказывая бактерицидное действие, не оказывая системного эффекта. При его нанесении образуется тонкая пленка, защищающая молодой эпителий от деструктирующих факторов. Нанесение Банеоцина под повязки приводит к полной эридикации болезнетворных микроорганизмов в короткие сроки и обеспечивает профилактику повторного инфицирования поверхности раны госпитальной инфекцией (Оболенский В.Н., 2013). Уместно использовать мазь Банеоцин в третьей фазе раневого процесса для организации рубца и эпителизации, когда пленка, образуемая мазью, защищает эпителий от повреждения и способствует ускорению эпителизации. Неоспоримые достоинства фармакологического действия Банеоцина объясняют его активное назначение и на этапе стационарного комплексного лечения больных, и в поликлинических условиях.
Доказана высокая клиническая эффективность Банеоцина при распространенной форме акне средней и тяжелой степени (Кунгуров Н.В., 2009; Шабардина О.В., 2010). При локальном применении Банеоцина снижен риск возникновения гиперчувствительности к его компонентам (Ширшов О.Н., 2008). Характерна достаточно хорошая переносимость Банеоцина . Отмечается успешное использование Банеоцина в педиатрии при топическом дерматите, осложненном вторичной инфекцией (Ahrenholz D.H., 1991; Зорин А.Н. и соавт., 2005), а также при сочетании топического дерматита с пиодермией, и даже в неонатологической практике применение порошка Банеоцина позволяет сокращать сроки эпителизации пупочной ранки новорожденных. Назначение Банеоцина предупреждает развитие серьезных гнойно-септических осложнений у новорожденных, позволяет эффективно купировать клинические проявления инфицированного пеленочного дерматита и эксфолиативного дерматита Риттера (Паршина В.Л., 2007).
Таким образом, благодаря комбинации двух антибактериальных компонентов достигается широкий спектр действия препарата и синергизм в отношении широкого ряда микроорганизмов, в который не попадают лишь псевдомонады, нокардии, грибы и вирусы. При местном нанесении на кожные покровы, раневые поверхности Банеоцин переносится хорошо, не вызывая раздражения; через интактную кожу препарат не всасывается, а через поврежденные кожные покровы всасывание незначительно, что позволяет создать максимальную концентрацию препарата непосредственно в месте применения. А две лекарственные формы Банеоцина ориентированы на последовательное его применение на различных стадиях раневого процесса (Буслаев О.А. и соавт., 2006).
Особые указания при применении Банеоцина
- Нельзя допускать попадания мази и порошка Банеоцин в глаза.
- С осторожностью наносить препарат на участки кожных покровов со значительными повреждениями.
- Нельзя применять Банеоцин в наружный слуховой проход в случае, если у пациента нарушена целостность барабанной перепонки и имеется сквозной дефект.
- Кратность нанесения порошка составляет 2–4 раза в сутки.
- Мазь Банеоцин наносится 2–3 раза в сутки.
- Суточная доза не должна превышать 1 г Банеоцина .
- Курс лечения обычно составляет 7 дней.
- При назначении повторного курса максимально допустимая доза снижается в 2 раза.
- Банеоцину присуща фотосенсибилизация. Поэтому рекомендуется предотвращать доступ прямых солнечных лучей к месту нанесения препарата.
Фармацевтическая опека при применении Банеоцина
- Не применять Банеоцин у пациентов с повышенной чувствительностью к бацитрацину, неомицину и другим антибиотикам аминогликозидного ряда.
- Не допускать сочетанного применения антибиотиков аминогликозидного ряда местного и системного действия из-за возможной их кумуляции и, как следствие, — риска развития токсичности.
- С осторожностью применять при миастении и других заболеваниях нервно-мышечной системы, а также при аллергических реакциях в анамнезе.
- При обширных поражениях кожи возникает риск абсорбции бацитрацина и неомицина, что может привести к развитию токсических проявлений у пациентов с нарушенной функцией печени или почек.
- Дисфункция вестибулярной и кохлеарной систем, патология почек с нарушением их выделительной функции является противопоказанием для приема Банеоцина , особенно при возможности его всасывания в системный кровоток.
- При ожоговых поражениях кожи площадью более 20% поверхности тела больного порошок Банеоцин наносится только 1 раз в сутки.
- При развитии аллергии или суперинфекции Банеоцин следует отменить.
- Избегать инсоляции из-за возможности возникновения фотосенсибилизации и фототоксических реакций.
- При лечении в период беременности и кормления грудью фармакотерапию Банеоцином следует проводить с осторожностью.
- Применение мази Банеоцин в педиатрии проводится по показаниям, аналогичным таковым у взрослых.
- Порошок Банеоцин применяется у детей с первых дней жизни при преобладании пользы от применения Банеоцина над риском развития его побочных эффектов.
- Нет сведений о способности Банеоцина изменять скорость реакций при управлении транспортными средствами и работе с другими механизмами.
Список использованной литературы
Информация для профессиональной деятельности медицинских и фармацевтических специалистов
БАНЕОЦИН (BANEOCIN) . Код АТС : D06A X54**. Состав и форма выпуска: мазь, туба 20 г, № 1 (бацитрацин цинк — 250 МЕ/г, неомицина сульфат — 5000 МЕ/г) — р.с. № UA/3951/01/01 от 28.04.2011 г. до 28.04.2016 г.; порошок накожный, контейнер 10 г, № 1 (бацитрацин цинк — 250 МЕ/г, неомицина сульфат — 5000 МЕ/г) — р.с. № UA/3951/02/01 от 11.05.2011 г. до 11.05.2016 г.). Показания . Порошок — бактериальное инфицирование ограниченных участков кожи при герпетических инфекциях, в том числе при ветряной оспе; инфицированные варикозные язвы; экзема; бактериальный пеленочный дерматит; профилактика пупочной инфекции у новорожденных; после хирургических манипуляций: как вспомогательная терапия в послеоперационный период (в том числе лечение разрывов промежности и эпизиотомии, мастита при дренировании, посттравматических инфекций); инфекции при ожогах. Мазь — местное лечение и профилактика бактериальных инфекций кожи, вызванных чувствительными к препарату микроорганизмами: фурункулы, карбункулы (после хирургического вмешательства), абсцессы (после разреза), сикоз, в том числе глубокий, на участке подбородка, гнойный гидраденит, псевдофурункулез, паронихии; бактериальные инфекции кожи ограниченной степени, в том числе контагиозное импетиго, инфицированные варикозные язвы, вторичные инфекции при экземе, инфекции при ожогах, после косметической хирургии и пересадки кожи (также с профилактической целью и при применении повязок); как вспомогательная терапия при лечении послеоперационных инфицированных ран (например при наружном отите, вторичном инфицировании хирургических рубцов). Побочные эффекты . Обычно препарат переносится хорошо. При продолжительном лечении возможно развитие аллергических реакций (гиперемия, сухость и шелушение кожи, сыпь, зуд). Если поражения распространяются или раны не заживают, это может быть следствием аллергической реакции (очень редко — в виде контактной экземы). Для пациентов со значительным поражением кожи следует учитывать возможную абсорбцию препарата и развитие таких побочных эффектов, как нарушения вестибулярной и кохлеарной функции, слуха, нервно-мышечной проводимости. Более детальная информация изложена в инструкции по медицинскому применению.
Читайте также:


