Антибиотик при инфекции костей суставов кожи и мягких тканей

Лечение инфекции костей и суставов является одной из сложных проблем в травматологии и ортопедии. Имплант-ассоциированная инфекция костей и суставов приводит к неэффективности антибактериальной терапии в связи с наличием биопленок [8]. С целью купирования воспаления проводятся неоднократные хирургические вмешательства с использованием материалов, способных доставлять и создавать локальную концентрацию антибиотика непосредственно в очаге инфекции [9].
В современной клинической медицине достигнуты значительные успехи в лечении периимплантной костной и суставной инфекции с применением различных материалов [4,6,7].
Остается много вопросов, которые необходимо решить при лечении данной патологии: как доставить антибиотик к месту назначения в необходимой концентрации для купирования воспаления; какой группы антибиотик использовать; какова его фармакокинетика; есть ли возможность использовать антибиотик совместно со средствами, усиливающими остеообразование и/или ослабляющими остеолиз; как удалить местную форму препарата из тканей, если это будет необходимо [5].
Все системы транспорта антибиотика к очагу инфекции можно разделить на нерассасывающиеся и рассасывающиеся (биодеградируемые)[10].
Цель исследования: улучшение результатов хирургического лечения периимплантной инфекции костей и суставов.
Материалы и методы исследования: в ОТО МОНИКИ с 2004 г. – по сентябрь 2015 г., при сочетании инфицирования с дестабилизацией компонентов эндопротеза у пациентов с перипротезным воспалением тазобедренного сустава в 34 случаях и с глубоким перипротезным нагноением коленного сустава в 8 случаях использован нерассасывающийся метод. Применяются временные спейсеры, импрегнированные антибиотиками с целью заполнения остаточной полости, воздействия на микрофлору очага воспаления и создание благоприятных условий для выполнения повторного тотального эндопротезирования на фоне стойкого купирования воспалительного процесса. Мужчин среди них – 24, женщин – 18, в возрасте от 31 до 75 лет.
При лечении имплант-ассоциированной костной инфекции с наличием костной деструкции в ОТО МОНИКИ с января 2015 г. – по сентябрь 2015 г. применен рассасывающий метод с использованием аутотрансплантата без фиксации и с фиксацией его биодеградируемым винтом с антибиотиком у 7-и пациентов, в возрасте от 36 до 60 лет. Мужчин – 6, женщин – 1.
Результаты и обсуждение:
Критерии для проведения двухэтапного эндопротезирования:
- Наличие местных проявлений перипротезного инфицирования;
- Стабильные компоненты эндопротеза при наличии положительной полирезистентной микрофлоры;
- Хроническое продуктивное воспаление с преобладанием сегментоядерных нейтрофилов [3].
- Гистопатологическое исследование: отсутствие при цитологическом исследовании остеокластов, наличие более 5 нейтрофилов в поле зрения при гистологическом исследовании свежезамороженных параартикулярных тканях;
- Неэффективность проведенных ранее хирургических санаций;
- Возможность проведения супрессивной антибиотикотерапии;
- Согласие больного на проведение двухэтапного метода лечения;
- Отсутствие тяжелых соматических заболеваний;
- Отсутствие критической потери костной ткани;
Первым этапом осуществляется хирургическая санация с широкой ревизией возможных путей распространения инфекции и удалением вертлужного, бедренного компонентов эндопротеза и фиксирующих материалов.
После завершения санации проводится интраоперационное формирование цементного спейсера в соответствии с формой и размерами вертлужной впадины с последующим укреплением его к проксимальному отделу бедренной кости (рис. 1)
а)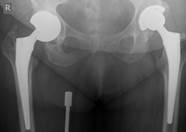
б)
в) 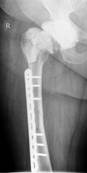
Рис. 1. Рентгенограмма таза больной К-ой, 1951 г.р., и/б 21813/18278
Нестабильность вертлужного компонента эндопротеза справа с комбинированным дефектом тазовой кости и повреждением бедренного компонента. а) – при поступлении в клинику; б) – удаленные компоненты эндопротеза с повреждением бедренного компонента; в) – рентгенограмма после первого этапа хирургического лечения – удаление компонентов эндопротеза справа, установка цементного спейсера, остеосинтез бедренной кости.
Фиксированный к бедренной кости цементный спейсер погружается в вертлужную впадину, заполняя пространство для последующего установления вертлужного компонента ревизионного эндопротеза (2-й этап).
Для изготовления цементного спейсера используется рентгеноконтрастный цементоподобный материал, обеспечивающий установку и крепление протезов к костям. Варианты антибиотиков, которые добавляют в спейсер: аминогликозиды (тобрамицин, гентамицин); Цефалоспорины 1-ого поколения (цефазолин), 2-ого поколения (цефуроксим), 3-его поколения (цефтазидим), 4-ого поколения (цефотаксим), 5-ого поколения (цефтаролин); фторхинолоны (ципрофлоксацин); гликопептиды (ванкомицин); оксазолидиноны (линезолид); противогрипковые (вориконазол).
Для формирования цементного спейсера достаточно полутора – двух доз, хотя требуемое количество зависит от характера хирургического вмешательства и применяемого метода. После окончания полимеризации приготовленный спейсер фиксируется к проксимальному отделу бедренной кости с помощью дополнительной дозы цемента. Перед установкой спейсера следует обеспечить тщательную санацию и высушивание проксимальной части костномозгового канала бедренной кости непосредственно перед погружением временного имплантата.
В случаях, когда нестабильность обоих компонентов эндопротеза сочетается с глубокой перипротезной инфекцией возможно применение преформированных (фабричных) спейсеров.
После тщательной хирургической санации очага воспаления выполняется удаление обоих компонентов эндопротеза тазобедренного сустава и фиксирующего материала. В канал бедренной кости устанавливается артикулирующий преформированный спейсер, импрегнированный антибиотиками (гентамицин, ванкомицин), а затем вправляются в вертлужную впадину, рана дренируется в течение двух дней (рис. 2).
а)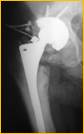
б)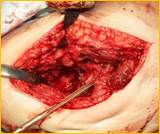
в) 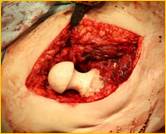
г)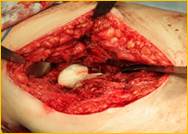
д) 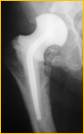
е) 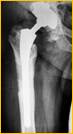
Рис. 2. Рентгенограмма правого тазобедренного сустава больного Г-на, 1963 г.р., и/б 16697/8454
Глубокое перипротезное инфицирование правого тазобедренного сустава. Комбинированный дефект правой вертлужной впадины и проксимального отдела бедренной кости. а) – при поступлении в клинику фистулограмма правого тазобедренного сустава; б) – внешний вид мягких тканей после удаления компонентов эндопротеза; в) – первый этап – санирующая операция на правом тазобедренном суставе с установкой спейсера в канал бедренной кости; г) – вправление спейсера; д) – рентгенограмма правого тазобедренного сустава после установки спейсера; е) – рентгенограмма правого тазобедренного сустава после второго этапа – удаление спейсера, повторное тотальное эндопротезирование правого тазобедренного сустава с установкой ревизионной конструкции и костной аутопластикой дефекта бедренной кости.
Среди 34 пациентов с перипротезным инфицированием тазобедренного сустава рецидив воспаления отмечен у 2 пациентов, что составило – 5,8%, которым выполнено удаление спейсера, формированием опорного неоартроза тазобедренного сустава. Три пациента отказываются от реэндопротезирования, что составляет – 8,8%. Купирование воспаления достигнуто в 94,2% случаев.
Среди 8 пациентов с глубоким нагноением эндопротеза коленного сустава рецидивов воспаления не отмечено. Двум пациентам планируется выполнить повторное эндопротезирование коленного сустава.
Необходимость проводить повторную операцию по замене спейсера на ревизионный эндопротез остается главным недостатком нерассасывающихся материалов [1].
С целью профилактики рецидивов перипротезного инфицирования суставов применен рассасывающийся биополимерный биодеградируемый материал на основе коллагеновой губки, содержащий антибиотик гентамицин. При имплантации 1 губки в полостях и тканях создается высокая локальная концентрация (666,66 мг/мл) гентамицина. Перед применением коллагеновой губки с гентамицином необходимо максимально просушить область аппликации.
а) 
б) 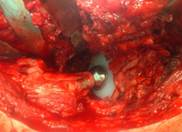
Рис. 3. а) – биополимерный биодеградируемый материал на основе коллагеной губки с гентамицином (collatampEG); б) – коллагеновая губка с гентамицином покрывает металлические участки эндопротеза тазобедренного сустава
Преимущества биополимерного биодеградируемого материала на основе коллагеновой губки с антибиотиком: создает высокую концентрацию антибиотика в областях с низкой перфузией крови в тканях; профилактики ранних и поздних инфекционных осложнений у пациентов из группы риска благодаря высокой концентрации антибиотика; обладает местным гемостатическим действием; является биодеградируемым материалом (не требует дальнейших манипуляций по удалению).
Критерии для лечения имплант-ассоциированной инфекции рассасывающимся методом с использованием аутотрансплантата без фиксации и с фиксацией его биодеградируемым винтом с антибиотиком.
- Наличие местных проявлений перииплантной костной и суставной инфекции;
- Возможность использовать аутотрансплантат для замещения костных дефектов;
- Отсутствие аллергической реакции на компоненты биодеградируемого винта;
- Чувствительность микрофлоры к антибиотику[2].
У 4-х пациентов с наличием дестрекции костей и суставов проводилась тщательная хирургическая санация очага воспаления, секвестрэктомия, замещение костного дефекта аутотрансплантатом из гребня подвздошной кости, дренирование послеоперационной раны (рис.4)
а) 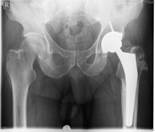
б)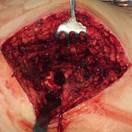
в) 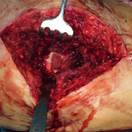
г) 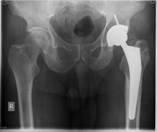
Рис. 4. Пациент К-н, 1957 г.р., и/б 14426
Глубокое перипротезное инфицирование левого тазобедренного сустава с наличием дефекта большого вертела, без дестабилизации комопнентовэндопротеза. а) – рентгенограмма левого тазобедренного сустава при поступлении в клинику; б) – внешний вид костного дефекта большого вертела после хирургической санации; в) – замещение костного дефекта трансплантатом из гребня подвздошной кости; г) – рентгенограмма левого тазобедренного сустава после оперативного лечения.
У одного пациента через четыре месяца после операции замещения костного дефекта большеберцовой кости по данным рентгенограмм отмечено рассасывания аутотрансплантата. У одного пациента после костной пластики костей стопы рецидив воспаления с формированием свищевого хода.
Трем пациентам с длительным вялотекущим процессом с наличием костной деструкции костей и суставов проведена хирургическая санация с замещением костного дефекта аутотрансплантатом и фиксация его биодеградируемым винтом с антибиотиком.
а)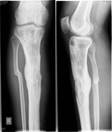
б)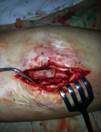
в) 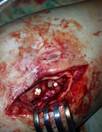
г) 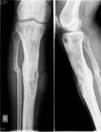
Рис. 5. Пациент Г., и/б 2485. Хронический остеомиелит большеберцовой кости справа с наличием секвестра, состояние после удаления погружного металлофиксатора большеберцовой кости, свищевая форма. а) – рентгенограмма правой голени с наличием очага деструкции большеберцовой кости, размером 9х2 см, б) – аутотрансплантат из гребня подвздошной кости, в) – фиксация аутотрансплантата винтами с антибиотиком,
г) – рентгенограмма правой голени после оперативного лечения
Послеоперационное ведение проводилось в соответствии со стандартным ведением пациентов с высоким риском инфекции.
У одного пациента в послеоперационном периоде отмечено длительное заживление послеоперационной раны. На контрольных рентгенограммах – рассасывания трансплантата ни в одном случае не произошло. Рецидива воспаления не отмечено ни в одном случае.
Заключение: использование спейсера с антибиотиком является золотым стандартом при лечении перипротезной инфекции крупных суставов и позволяет добиться стойкого купирования воспалительного процесса в 95,3% случаях. С целью профилактики перипротезного инфицирования у пациентов с высоким риском послеоперационного нагноения рекомендовано использовать биополимерный биодеградируемый материал на основе коллагеновой губки, содержащий антибиотик гентамицин.
При лечении имплант-ассоциированной костной инфекции с наличием костной деструкции использование биодеградируемого винта с антибиотиком позволяет воздействовать на микрофлору непосредственной в очаге инфекции, фиксация аутотрансплантата способствует его остеоинтеграции, повторной операции для удаления винта не требуется.
Рецензенты:
Оноприенко Г.А., д.м.н., профессор, ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва;
Дорожко И.Г., д.м.н., профессор, ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва.

Цефалексин является хорошим выбором первой линии для лечения многих инфекций костей и суставов, поскольку он является бактерицидным, эффективен против наиболее распространенных патогенов кожи и обеспечивает хорошее проникновение как в нормальную, так и остеолитическую кость. Цефалексин является цефалоспорином первого поколения, который убивает бактерии, нарушая синтез пептидогликана в стенке бактериальных клеток. Он преимущественно эффективен против грамположительных бактерий, таких как Staphylococcus spp и Streptococcus spp.
Цефалексин, как правило, плохо действует против грамотрицательных бактерий. Большинство анаэробов восприимчивы к цефалоспоринам первого поколения, за исключением Bacteroides spp. Цефалоспорины первого поколения также могут быть эффективными против грамотрицательных организмов, таких как Proteus mirabilis , некоторые E coli и Klebsiella spp.
Нет активности против Pseudomonas spp или Enterococcus spp. Цефалексин одобрен FDA для собак (22 мг / кг PO q12h) и можно применять у кошек.
Клиндамицин имеет большое проникновение в кости; однако, как антибиотик с линкозамидом, он является бактериостатическим и поэтому не следует его назначать в сочетании с бактерицидным лекарственным средством. Клиндамицин влияет на бактерии посредством ингибирования протеинового синтеза бактериальной рибосомы и обладает превосходной активностью против большинства патологических анаэробных бактерий; большинство аэробных грамположительных кокков (например, стафилококков, стрептококков) также восприимчивы. Этот препарат часто эффективен против Corynebacterium spp, Nocardia asteroides и Mycoplasma spp. Он одобрен FDA для лечения остеомиелита у собак (11-33 мг / кг PO q12h) и кошек (11-33 мг / кг PO q24h).
Амоксициллин-клавулановая кислота является потенцированным пенициллином с ингибирующими β-лактамазу эффектами, которые индуцируются клавулановой кислотой. Он эффективен против грамположительных и грамотрицательных аэробных и анаэробных бактерий (например, Staphylococcus aureus , Staphylococcus pseudintermedius , Staphylococcus spp, других Streptococcus spp, E coli , Pasteurella spp) и является антибиотиком для лечения инфекций, вызванных укусами кошек или собак. Амоксициллин-клавулановая кислота не эффективна против Pseudomonas spp или Enterobacter SPP. Он одобрен FDA для собак (13,75 мг / кг PO q12h) и кошек (62,5 мг PO q12h).
Энрофлоксацин является бактерицидным фторхинолоном, доступным на ветеринарном рынке. Он эффективен против широкого спектра грамотрицательных и грамположительных бактерий, но не эффективен против анаэробов. Считается, что его механизм действия заключается в ингибировании бактериальной ДНК-гиразы, которая предотвращает сверхспирализацию и синтез бактериальной ДНК. Энрофлоксацин эффективен против большинства Pseudomonas spp, Klebsiella spp, E coli , Enterobacter spp, Campylobacter spp, Proteus spp и Staphylococcusspp, среди прочих. Этот антибиотик следует избегать у молодых собак, так как это может вызвать отклонения в развитии хряща. Он одобрен FDA для собак (5-20 мг / кг PO q24h) и кошек (5 мг / кг PO q24h).
Цефподоксим является цефалоспорином третьего поколения. Он менее эффективен, чем цефалексин против грамположительных бактерий, но оказывает более широкое влияние на грамотрицательные организмы, включая Enterobacteriaceae (например, Proteus spp, E coli , Klebsiella spp). Однако он не эффективен против Pseudomonas aeruginosa , Enterococcus spp или Bacteroides fragilis . В дополнение к хорошему скелетно-мышечному проникновению, Цефподоксим имеет хорошее проникновение в ЦНС. Он одобрен FDA для собак (5-10 мг / кг PO q24h) и также можно использовать у кошек.
Антибиотикотерапия играет важную роль в комплексном лечении костных и суставных инфекций у кошек и собак. Для устранения инфекции часто необходимы успешная идентификация основной причины инфекции, выделения патологических бактерий и очищение раны для удаления некротической ткани и материала, покрытого биопленкой. Эмпирическая терапия должна основываться на причине инфекции и подозреваемых бактериальных организмов. Результаты бактериальной культуры могут указывать на необходимость изменения антибактериальной терапии.
Когда результаты противомикробной восприимчивости указывают на то, что несколько вариантов антибиотиков эффективны против патологического организма, выбор антибиотиков должен основываться на эффективности препарата, степени проникновения в ткани, побочных эффектах, пути введения и стоимости. Необходимо проявлять большую осторожность при выборе антибиотиков чтобы не вызвать устойчивость.
, MD, Cleveland Clinic Lerner College of Medicine at Case Western Reserve University
Бактерии, микобактерии и грибки могут инфицировать костную ткань при попадании в нее с кровотоком или, что случается чаще, проникая из близлежащей инфицированной ткани или загрязненной открытой раны.
У больных отмечается боль в одном фрагменте кости, лихорадка и потеря массы тела.
Проводятся анализы крови и визуализирующие обследования, также врач берет образец костной ткани на анализ.
Назначают курс лечения антибиотиками в течение нескольких недель, и не исключена необходимость в хирургическом вмешательстве для удаления инфицированной кости.
Остеомиелит чаще всего возникает у маленьких детей и у пожилых людей, но вероятность его развития есть в любой возрастной группе. Также вероятность развития остеомиелита высока у людей с серьезными болезнями.
При инфицировании костной ткани часто развивается отек ее мягкой внутренней части (костного мозга). Отекшая внутренняя часть начинает давить на твердую внешнюю стенку кости, приводя к передавливанию кровеносных сосудов костного мозга, в результате чего приток крови к кости снижается или прекращается.
Без достаточного поступления крови возможно отмирание участков костной ткани. Инфекции таких отмерших участков костной ткани сложны в лечении, поскольку в эти участки не проникают естественные клетки организма, специализирующиеся на защите от инфекций, а также антибиотики.
Инфекция также может распространиться за пределы кости и привести к образованию гнойных скоплений (абсцессов) в близлежащих мягких тканях, например, мышечной ткани. Абсцессы иногда самостоятельно прорываются через кожу.
Причины
Кости, обычно хорошо защищенные от инфекции, могут инфицироваться тремя путями:
через кровоток (инфекция переносится в кости из другой части тела);
через прямое проникновение (при открытых переломах, хирургических вмешательствах, проникающих ранениях костной ткани);
через инфекции в близлежащих структурах, например, естественных или искусственных суставах или мягких тканях.
К остеомиелиту могут приводить травмы, инородные тела (например, инфекция искусственного сустава), а также ухудшение кровоснабжения органа или ткани (ишемия).
Остеомиелит может возникать под глубокими пролежнями.
Большинство случаев остеомиелита возникает вследствие прямого проникновения или распространения инфекции из близлежащих мягких тканей (например, язвы стопы из-за недостаточного кровоснабжения или сахарного диабета).
Когда микроорганизмы, вызывающие остеомиелит, распространяются по кровотоку, инфекция обычно возникает:
на концах костей ног и рук у детей;
в позвоночнике (позвонках) у взрослых, особенно у пожилых людей.
При инфекции позвонков говорят об остеомиелите позвоночника. Пожилые люди, ослабленные (например, живущие в лечебно-реабилитационных центрах для престарелых), больные серповидно-клеточной анемией, проходящие процедуру почечного диализа, и люди, вводящие лекарственные препараты с помощью нестерильных игл, входят в группу риска развития остеомиелита позвоночника.
Staphylococcus aureus (золотистый стафилококк) — это микроорганизм, чаще всего вызывающий остеомиелит и распространяющийся с током крови. Mycobacterium tuberculosis (бактерия, вызывающая туберкулез) и грибки могут распространяться тем же путем и вызывать остеомиелит, особенно у людей с ослабленной иммунной системой (например, при ВИЧ-инфекции, определенных злокачественных новообразованиях или применении лекарственных препаратов, угнетающих иммунную систему) либо людей, живущих в регионах, где распространены определенные грибковые инфекции.
Остеомиелит также может возникать при хирургическом прикреплении к поверхности кости металлического предмета, например, при хирургическом лечении переломов шейки бедра или других переломов ( Восстановление перелома тазобедренного сустава). Кроме того, бактерии или грибковые споры могут инфицировать кость, к которой крепится искусственный сустав ( Инфекционный артрит искусственного сустава). Эти микроорганизмы могут проникать в область костной ткани, окружающую искусственный сустав, во время хирургического лечения, в ходе которого проводится замена сустава, или заражение может произойти позже.
Распространение из близлежащих структур
Остеомиелит также может развиться в результате инфицирования близлежащих мягких тканей. Инфекция распространяется в кость через несколько дней или недель. Такой тип распространения особенно вероятен у пожилых людей.
Такая инфекция может начаться в месте, поврежденном вследствие травмы или хирургического вмешательства, лучевой терапии, злокачественной опухоли или язвы кожи (особенно язвы кожи стопы) из-за плохого кровообращения или сахарного диабета. При инфекции носовых пазух, десен или зубов инфекция может распространяться в череп.
Симптомы
При остром остеомиелите инфекции костей ног и рук сопровождаются повышением температуры и, иногда спустя несколько дней, болью в пораженной кости. Участок над пораженной костью может быть болезненным, покрасневшим, горячим на ощупь и отекшим; движение может сопровождаться болью. Возможно снижение массы тела больного и утомляемость.
Если остеомиелит развивается в результате инфицирования близлежащих мягких тканей или вследствие прямого заражения микроорганизмом, участок над костью отекает и становится болезненным. В окружающих тканях возможны абсцессы. Такие инфекции могут не сопровождаться повышенной температурой.
Инфекции вблизи инфицированного искусственного сустава или конечности обычно приводят к стойкой боли в указанном участке.
Остеомиелит позвоночника обычно развивается постепенно, вызывая стойкую боль в спине и болезненность при прикосновении. Боль усиливается при движении и не проходит в покое, при прогревании или приеме обезболивающих препаратов (анальгетиков). У пациентов часто отсутствует лихорадка, которая обычно является наиболее очевидным признаком инфекции.
При отсутствии лечения остеомиелит переходит в хронический остеомиелит. Это стойкая инфекция, которую крайне сложно излечить полностью. Иногда хронический остеомиелит не обнаруживается в течение продолжительного времени, причем симптомы отсутствуют месяцы или годы. Чаще всего хронический остеомиелит приводит к боли в костях, рецидивирующих инфекциях мягких тканей над затронутой костью и непрерывным или периодическим выходом гноя через кожу. Такой дренаж возникает при образовании в инфицированной кости канала (свищевого хода) к поверхности кожи, по которому гной выходит наружу.
Диагностика
Визуализирующие исследования, такие как рентген, компьютерная томография (КТ), магнитно-резонансная томография (МРТ), сканирование костей или сканирование с мечеными лейкоцитами
Остеомиелит можно заподозрить на основании симптомов и по результатам физикального осмотра. Например, врачи могут подозревать остеомиелит у больного, предъявляющего жалобы на практически постоянную усталость, со стойкой болью в определенном участке кости, которая может сопровождаться, а может не сопровождаться лихорадкой.
Если врачи подозревают остеомиелит, они проводят анализы крови для выявления воспаления, определяя один из следующих показателей:
скорость оседания эритроцитов (СОЭ — анализ, который заключается в измерении скорости, с которой эритроциты оседают на дно пробирки с кровью);
уровень С-реактивного белка (белок, циркулирующий в крови, резко повышается в случае воспаления).
Повышенные показатели СОЭ и уровня С-реактивного белка обычно указывают на наличие воспаления. Кроме того, в результатах анализа крови часто выявляют повышение количества лейкоцитов. Результатов этих анализов крови недостаточно для диагностики остеомиелита. Тем не менее, результаты, указывающие на незначительное воспаление или его отсутствие, могут свидетельствовать о том, что у больного нет остеомиелита.
Рентгенологическое исследование позволяет обнаружить характерные признаки остеомиелита, но в ряде случаев это возможно только спустя 2–4 недели после появления первых симптомов.
В случае сомнительных результатов рентгенологического исследования или тяжелых симптомов проводится компьютерная томография (КТ) или магнитно-резонансная томография (МРТ). С помощью КТ и МРТ можно определить инфицированные участки или суставы и обнаружить инфекцию соседних тканей, например, абсцессы.
Для диагностики инфекции кости и определения микроорганизмов-возбудителей врачи могут взять на анализ образцы крови, гноя, синовиальной жидкости или самой костной ткани. Как правило, при остеомиелите позвоночника образцы костной ткани извлекают с помощью иглы или в ходе хирургического вмешательства.
Прогноз
Прогноз для больных остеомиелитом в большинстве случаев благоприятный, при условии своевременного и надлежащего лечения. Однако иногда развивается хронический остеомиелит, а спустя недели и месяцы или даже годы возможен рецидив абсцесса кости.
Инфекции кожи и мягких тканей
ЭТИОЛОГИЯ (табл. 47-1)
Рожа проявляется стрептококковым лимфангиитом дермы. Целлюлит вовлекает в процесс подкожную клетчатку; заражение происходит через незначительные повреждения кожи (5. pyogenes); раны, язвы или абсцессы (5. aureus); укусы (Pasteurella, Eikinella, анаэробы); синуситы (Я. influenzae); воду (Aeromonas, V. vulnificus). Некротизирующий фасциит может распространяться до кожных структур, вызывая тромбоз и изменение цвета кожи. Миозит может развиться спонтанно (5. aureus, S.pyogenes) или после проникающего ранения (Clostridium).
При рожистой инфекции возникают локальные, очень болезненные, четко ограниченные очаги отека ярко-красного цвета на лице и конечностях. Целлюлит характеризуется локальной болью, эритемой, отеком и жаром. Лихорадка вызвана инфекцией 5. pyogenes; периорбитальные ткани вовлекаются при наличии Н. influenzae. Импетиго начинается с острого высыпания небольших поверхностных пузырей на гиперемированном основании; пузыри вскрываются и их содержимое, засыхая, образует желтые корки. Поверхностная дерматофития (микроспория) проявляется образованием чешуйчатого шелушения кожи на гиперемированном фоне. Парони-хия (околоногтевая инфекция), вызванная S. aureus и Candida, сопровождается болью и отеком тканей, окружающих ноготь. Некротизирующий фасциит быстро прогрессирует от боли и лихорадки к индурации, образованию булл, общей интоксикации и шоку. Стрептококковый Некротизирующий миозит вызывает общий токсический шокоподобный синдром.
Диагноз микроспории ставят, смешивая с раствором калия гидроксида материал, полученный при соскобе из очага воспаления. Окраска по Романовскому—Гим-зе (препарат Tzanck) материала, полученного при соскобе везикул, позволяет обнаружить при герпетической инфекции характерные гигантские клетки. Необходим посев крови у всех больных с симптоматикой инфекции мягких тканей. Микробиологическая диагностика целлюлита неубедительна. При некротизирующем фасциите и миозите полезна биопсия с окрашиванием по Граму и культуральным исследованием материала.
Таблица 47-1 Инфекции кожи и мягких тканей
Смешанная аэробная и анаэробная инфекция
128
При рожистом воспалении применяют бензилпенициллин 1-2 млн. ЕД внутривенно через 4 ч, при целлюлите — бензилпенициллин или оксациллин 1-2 г внутривенно через 6 ч. Паронихии и абсцессы требуют дренирования, препарат выбора — диклоксациллин 500 мг через 6 ч внутрь. Раны от укуса обрабатывают антисептиками, промывают, исследуют; препарат выбора — амоксиклав 500 мг внутрь через 8 ч. Для лечения инфицированных ран от укуса назначают ампициллин-сульбактам 1,5-3,0 г внутривенно через 6 ч. Подозрение на некротизирующий фасциит и миозит требует ранней хирургической обработки и терапии антибиотиками широкого спектра действия: клиндамицин 600-800 мг внутривенно через 8 ч или метронида-зол 750 мг через б ч + ампициллин 2-3 г внутривенно через 6 ч + гентамицин 1,5 мг/ кг через 8 ч или ампициллин-сульбактам 3 г внутривенно через 6 ч отдельно или цефокситин отдельно.
Инфекции костей и суставов
Острый бактериальный артрит — частое заболевание, поражающее больных любого возраста, он требует быстрой диагностики и лечебных мероприятий.
Этиология и патогенез. Примерно 75 % негонококковых гнойных артритов возникает из-за инфекции грамположительными кокками. Среди них лидирует 5. aureus, затем стрептококки групп Л, G, viridans, пневмококки и далее стрептококк В у новорожденных. На грамотрицательную микробную флору приходится 20 % инфекций с типичными для больных факторами риска грамотрицательной бактериемии. У детей в возрасте до 5 лет Н. influenzae служит важной причиной инфекции суставов. Гонококковая инфекция — другая причина септического артрита (см. гл. 46). Инфекция распространяется путем гематогенного переноса в синовиальное пространство. Предрасполагающие факторы: ранний детский возраст, иммунодефицит-ные состояния, алкоголизм, внутривенное введение лекарств и уже имеющееся поражение суставов. Прямое обсеменение сустава микроорганизмами может произойти в результате травмы, при артроскопии или оперативном вмешательстве. В 25 % случаев удается обнаружить внесуставной очаг инфекции. Инфекция трансплантированных суставов обычно вызвана стафилококками (коагулазонегативный или Staph. aureus) и встречается в 1-4 % случаев в течение 10-летнего периода после протезирования. Чаще это происходит с трансплантатами, подвергавшимися ревизии. Другие причины острого инфекционного артрита: краснуха, гепатит В, эпидемический паротит, вирус Коксаки, аденовирусы, парвовирусы. Болезнь Лайма и сифилис могут вызвать более длительно текущий медленно прогрессирующий артрит, чем М. tuberculosis и грибы (Coccidioides, Sporothrix, Histoplasma). Candida и Blastomyces могут быть причиной острого или хронического артрита.
Клинические проявления. Острый бактериальный артрит протекает как моноартрит, поражающий крупные суставы, чаще всего тазобедренный и коленный, реже голеностопный, затем суставы кисти, локтевой, плечевой, грудиноключичный и под-вздошно-крестцовый. Инфекция, вызванная грамположительными кокками, обычно начинается остро с отека, болей, ограничений в движении, сустав горячий на ощупь. В тазобедренном суставе определить выпот бывает трудно, боли минимальны, могут иррадиировать в паховую область, ягодицу, латеральную поверхность бедра или переднюю поверхность коленного сустава. Клиническая картина грамотрицательной инфекции мало выражена и больные попадают к врачу обычно спустя 3 нед после начала болезни, часто с сопутствующим остеомиелитом. Боли при инфекции трансплантированных суставов крайне незначительны, симптомы выражены умеренно, что задерживает диагностику на несколько месяцев. Всегда сопутствует остеомиелит.
Лечение. Внутривенно вводят антибиотики, дренируют сустав (обычно с ежедневной аспирацией содержимого) и иммобилизуют его. Открытое хирургическое дренирование показано при инфекции тазобедренного, плечевого или грудиноклю-чичного суставов, когда имеется четкая местная флюктуация, если результат куль-туральных исследований постоянно положителен, или при сохранении выпота дольше 7 дней. Трансплантат следует извлечь и заменить после курса антибактериальной терапии. Выбор варианта начальной антибактериальной терапии основывается на результатах окраски по Граму, а затем на результатах культуральных исследований. Стафилококковую инфекцию лечат внутривенным введением нафциллина (2 г через 4 ч), с последующим назначением антибиотика внутрь (например, диклоксациллин 500 мг 4 раза в сутки) общей длительностью 3-6 нед. При стрептококковом артрите препарат выбора — бензилпенициллин G (2 млн. ЕД через 4 ч), курс—2 нед. При грамотрицательной инфекции назначают комбинацию: аминогликозиды (гентамицин 1 мг/кг через 8 ч) и р-лактамный антибиотик (мезлоциллин 3 г через 4 ч), вслед за этим назначают хинолоны (ципрофлоксацин 750 мг внутрь через 12ч) или цефалоспорины (цефтриаксон 1 г внутривенно через 12 ч) с общей длительностью терапии 3-6 нед.
Этиология и патогенез. Микробы проникают в кость гематогенным путем, прямо из раны или из соседнего инфекционного очага. Чаще поражены метафизы длинных костей (большеберцовая, бедренная, плечевая) и позвонки. S. aureus и коагула-зонегативные стафилококки — наиболее частые возбудители инфекции, а грамотрицательные палочки (Pseudomonas, Serratia, Salmonella, E. colt), анаэробы и полимикробная инфекция встречаются лишь в определенных ситуациях, например, при диабетической язве стопы. Туберкулез, бруцеллез, гистоплазмоз, кокцидиомикоз, бластомикоз вызывают остеомиелит много реже.
Клинические проявления. У половины больных отмечаются неопределенные боли в пораженной конечности или спине (такие же симптомы встречаются при остеомиелите позвоночника из-за боли, вызванной раздражением нервных корешков) в течение 1-3 мес с минимальной лихорадкой или без нее. У детей возможны острое начало лихорадки, раздражительность, заторможенность и местное воспаление длительностью менее 3 нед. При физикальном обследовании выявляют болезненность при пальпации, мышечный спазм и свищ (особенно при хроническом остеомиелите или инфекции трансплантированного сустава).
Диагностика. Диагноз остеомиелита ставят по результатам культуральных исследований соответствующих материалов. При отрицательных результатах посевов крови выполняют аспирацию гноя из кости или биопсию кости. Культуральные исследования с материалом, взятым с поверхностных участков, не информативны. Обычное рентгенологическое исследование не дает результатов в первые 10 дней, а участки лизиса костной ткани становятся различимыми через 2-6 нед. Сканирование с радионуклидами даст положительный результат через 2 дня после инфициро-вания. Так же быстро можно получить информацию с помощью КТ и МРТ, они позволяют уточнить локализацию поражения и секвестра. СОЭ повышена и замедляется при лечении.
Лечение. При быстром и правильном лечении хронический остеомиелит формируется менее чем у 5 % больных с острым гематогенным остеомиелитом. Антибактериальное лечение начинают только после взятия проб ткани для культуральных исследований. При остром гематогенном остеомиелите внутривенное введение антибиотиков против выделенных возбудителей показано в течение 4-6 нед. Хирургическое вмешательство необходимо, если в течение 48 ч отмечается слабая реакция на проводимое лечение или если не дренированы гнойный очаг или септический артрит. Направленное лечение против S. aureus или эмпирическое лечение при отсутствии четкого ответа культуральных исследований включает нафциллин (2 г через 4 ч) или цефазолин (2 г через 8 ч). При грамотрицательной инфекции применяют цефалоспорины 3-го поколения (цефтриаксон 1 г через 12 ч) или амино-гликозиды (гентамицин 1 мг/кг через 8 ч). Если позволяет чувствительность возбудителя, назначают ципрофлоксацин, 750 мг внутрь через 12ч, вслед за внутривенным введением или вместо него.
При хроническом остеомиелите требуется полноценное дренирование очага, хирургическая обработка секвестральной полости, извлечение трансплантата и 4-6-недельный курс антибиотиков, соответствующих выделенному из кости возбудителю. Пересадка кожных лоскутов и костных трансплантатов может ускорить выздоровление. При уточнении вида возбудителя антибактериальное лечение начинают за несколько дней до операции.
Читайте также:
- Впг инфекция что это такое у женщин
- Район неблагополучный по инфекционным болезням
- Шок виды шока при различных инфекционных заболеваниях
- Угму кафедра инфекционных болезней
- Жалобы на врачей инфекционной больницы
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

