Анаэробная инфекция при сахарном диабете
Используйте навигацию по текущей странице

Гангрена при сахарном диабете - процесс гнойно-некротического распада тканей конечности на фоне снижения кровообращения и присоединения вторичной инфекции. Влажная гангрена развивается при проникновении микробов в плохо-кровоснабжаемые ткани на фоне снижения иммунной защиты. При влажной гангрене бактерии могут быстро распространяться по всему телу, вызывая общее заражение организма - сепсис, что приводит к значительной летальности, при отсутствии адекватного лечения. При развитии анаэробной инфекции возникает газовая гангрена - смертельно опасное заболевание. Влажная гангрена является самой частой причиной высокой ампутации у людей, страдающих сахарным диабетом.
Хирургам Инновационного сосудистого центра удаётся сохранить ногу и возможность ходить у более чем 90% больных с диабетической гангреной. Ампутация в нашей клинике назначается только при полном гнойном распаде конечности, когда спасать уже больше нечего. При первых признаках влажной гангрены при сахарном диабете обращайтесь в Инновационный сосудистый центр и мы обязательно вам поможем.
В России из 80 000 ампутаций в год более 60 000 связаны с развитием гангрены конечности на фоне сахарного диабета. Слабое развитие службы профилактики сосудистых осложнений диабета, отсутствие сети кабинетов диабетической стопы приводит к тому, что почти 30% диабетиков теряют свои ноги от ампутации. Редкие эндокринологи объясняют пациентам правила ухода за стопами, осуществляют визуальный контроль и осмотр стоп у этих пациентов. Чаще всего общение эндокринолога с пациентом сводится к коррекции уровня сахара и выписывании рецептов на инсулин.
![]()
Сухая гангрена при диабете
Сухая гангрена при сахарном диабете развивается вследствие диабетической макроангиопатии, то есть поражения стенки сосудов кальцинированными бляшками. Количество кальция в сосудах таково, что даже при бесконтрастном рентгеновском исследовании видны пораженные бляшками сосуды отлично видны на снимках. Сухая гангрена развивается у больных с компенсированным диабетом и артериальной недостаточностью. При сахарном диабете всегда существует риск перехода сухой гангрены во влажную, с развитием опасных для жизни осложнений. Лечение сухой гангрены заключается в восстановлении кровотока и удалении только омертвевших тканей. Сложность заключается в характере поражения стенок сосудов. Чаще всего имеются протяженные сужения артерий и закрытые боковые перетоки. Лечение пациентов с сухой гангреной на фоне диабетической ангиопатии отличается от обычного атеросклероза. Необходимо иметь техническую возможность для выполнения гибридных вмешательств, сочетания ангиопластики и шунтирования. Удаление некрозов возможно проводить после восстановления кровотока, так как непосредственной угрозы общего заражения крови при сухой гангрене не существует.
![]()
Влажная гангрена при сахарном диабете
В отличие от сухой, влажная диабетическая гангрена почти всегда связана с инфекцией и нередко развивается на фоне существующего синдрома диабетической стопы. Травмы, связанные с раздавливанием тканей, острая закупорка сосуда тромбом (эмболия) могут быстро отрезать кровоснабжение пораженного участка ноги, вызывая гибель ткани и повышенный риск инфекции. На фоне сахарного диабета микробы при влажной форме некроза могут быстро распространиться по всему телу.
Газовая гангрена - это редкое, но очень опасное заболевание. Она начинается, когда инфекция проникает глубоко внутрь мышц или органов, чаще в результате травмы. Бактерии, которые вызывают газовую гангрену, носят название клостридий. Они выделяют опасные токсины, которые наносят тяжелый ущерб организму. Характерным для этой формы гангрены симптомом является образование пузырьков в тканях. Кожа при развитии газовой гангрены становится бледной и серой на вид, а при нажатии слышен характерный треск (крепитация), за счёт пузырьков в тканях. Если не лечиться, то без квалифицированной помощи смерть может наступить в течение 48 часов.
Тактика лечения влажной гангрены при сахарном диабете заключается в экстренном вмешательстве на очаге гнилостного расплавления ткней (некрэктомия, вскрытие флегмоны) со срочным проведением сосудистой операции по восстановлению кровотока. Если гангрену удаётся остановить, то следует этап восстановительного лечения с заживлением остаточных ран.
Причины влажной гангрены
Развитие деструктивных процессов в ноге возможно у пациентов со сниженной иммунной защитой на фоне сахарного диабета, при других факторах ослабления организма. Для перехода сухой гангрены во влажную необходимо довольно продолжительное время и формирование значительного отёка из-за вынужденного опускания больной ноги.
Развитие диабетической гангрены нижних конечностей нередко можно связать с попытками лечить начальные сухие некрозы пальцев с помощью "народных средств" - говяжьей печени, хлебного мякиша и им подобным. Эти "рекомендации" требуют длительного закрытия гангренозного очага "народными снадобьями". Соответственно создаётся прекрасная среда для размножения бактерий и прогрессированию гнойного процесса. Гнойно-некротическая гангрена нижних конечностей при сахарном диабете развивается молниеносно из-за распространения инфекции вдоль сухожилий.
Основным фактором риска потери ноги является сахарный диабет в стадии декомпенсации с поражением артерий голени (ангиопатия) и плохой уход за ногами при начальной стадии синдрома диабетической стопы.
Осложнения
Основное осложнение влажной гангрены - это развитие общего заражения организма. Это состояние наблюдается у 85% больных, не подвергшихся активному хирургическому лечению. Сепсис неминуемо ведёт к смерти. Гангрена ног при диабете приводит к летальному исходу у 60% заболевших, не получивших квалифицированную и своевременную помощь.
Тромбоз глубоких вен - одно из очень частых осложнений, которое ухудшает ситуацию с кровообращением. Тромботические массы могут быть инфицированными и с током крови переносят инфекцию по организму. Глубокий венозный тромбоз ног нередко способствует тромбоэмболии лёгочной артерии и приводит к внезапной смерти.
Прогноз
При отсутствии хирургической помощи все пациенты с влажной гангреной умирают от сепсиса. Основной подход к лечению до сих пор заключается в экстренной высокой ампутации. Поэтому можно сказать, что для большинства больных с влажной гангреной последняя заканчивается потерей ноги. Для профилактики развития заболевания диабетику необходимо изменить свой образ жизни, избавиться от лишнего веса, аккуратно подходить к обработке стопы, следить за мелкими травмами пальцев и ссадинами. Необходимо своевременно, при первых признаках изменений на ступнях и ногтях, обращаться за помощью к специалистам по диабетической стопе - подологам.
Республиканский центр гнойной хирургии и хирургических осложнений сахарного диабета, г. Ташкент, Узбекистан
Хирургические инфекции мягких тканей являются ведущей патологией в структуре первичной обращаемости хирургических больных в амбулаторно-поликлиническом звене. Лечение гнойно-воспалительных заболеваний в настоящее время остается одной из наиболее часто встречающейся проблем в хирургии. Интерес и постоянное внимание к этой проблеме объясняются тяжелым течением раневого процесса, сохранением тенденции к возрастанию длительно текущих и рецидивирующих форм [2,5,6,8,12]. Актуальность проблемы обусловливается еще и тем, что количество больных с острыми гнойными заболеваниями мягких тканей не уменьшается, а имеет тенденцию к росту, составляя до 35-40% от всего количества хирургических больных. Обширные гнойные раны как вариант проявления хирургической инфекции приводят не только к серьезным нарушениям гомеостаза и функций внутренних органов, но и к генерализации воспалительного процесса, которые являются основной причиной развития летальных исходов у больных хирургического профиля, которая варьирует в пределах от 16 до 80%, в зависимости от развития генерализованных форм и наличия фоновых заболеваний [4,7,14].
Хирургическая инфекция у больных на фоне нейроэндокринных нарушений, в частности сахарного диабета протекает атипично, с достаточно агрессивным течением. Те стандарты свойственные острым инфекциям мягких тканей без сахарного диабета, могут противоречиво влиять на судьбу больных с сопутствующим сахарным диабетом [7-9,11].
Настоящая работа посвящена оценке эффективности Г-КСФ (Филграстима) в комплексной терапии больных острой гнойной хирургической инфекцией мягких тканей на фоне сахарного диабета. Известно, что Г-КСФ заметно увеличивает число нейтрофилов в периферической крови уже в пределах первых 24 ч после введения 14.
Материалы и методы. В исследование были включены 132 пациентов с острой хирургической инфекцией мягких тканей на фоне сахарного диабета. Больные находились на стационарном лечении в Республиканском Центре гнойной хирургии и хирургических осложнений сахарного диабета, за период с 2005 по 2011 г. В их число входили 32 (24,2 %) пациентов с карбункулами различных локализации, 23 (17,4 %) - с флегмонами нижних конечностей, 22 (16,7 %) - с абсцессами и флегмоны туловище, 20 (15,2 %) с парапроктитами, флегмонами промежности и ягодицы. Удельный вес таких заболеваний как мастит, нагноения послеоперационных ран, флегмоны шеи и гнойно-некротические поражения стоп, встречались реже.
Больные были разделены на 2 группы - основную и контрольную, состав которых был, сопоставим по полу и возрасту больных, нозологическим формам и тяжести заболевания (табл. 1, 2).
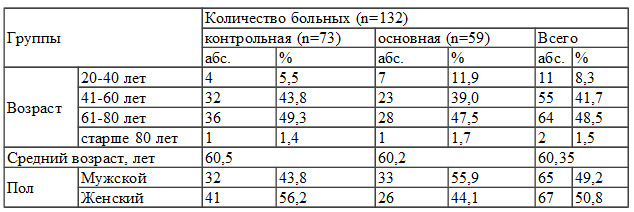
Таблица 1. Распределение пациентов в группах по возрасту и полу
Изучение больных согласно типа выявленного сахарного диабета показало, что у большинства больных был сахарный диабет II типа (94,7%), при этом сахарный диабет I типа наблюдался только у 7 из 132, что составляет 5,3%. Больные основной группы (59 человек) получали колониестимулирующий фактор - Г-КСФ подкожно в дозе 5 мг/кг массы тела больного или 30 млн. ЕД (300мкг) в комплексе с традиционным хирургическим и медикаментозным лечением гнойных процессов. Пациенты контрольной группы (73 человек) получали такое же лечение, но без применения Г-КСФ.
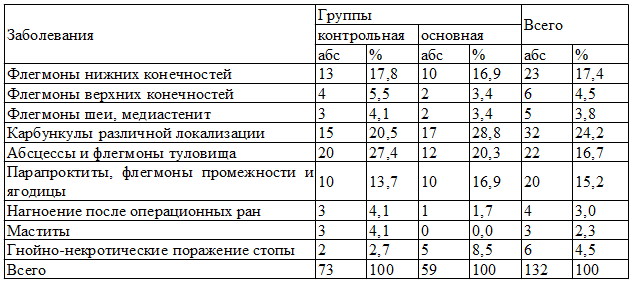
Таблица 2. Распределение больных по нозологии
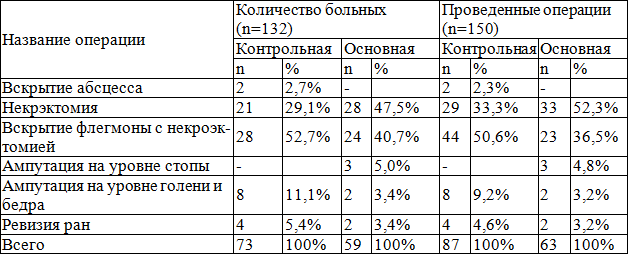
При поступлении, после кратковременной предоперационной подготовки, всем больным проводилось оперативное вмешательство, направленное на вскрытие патологического очага, с проведением адекватной некрэктомии. При этом 59 больным основной группы было выполнено 63 оперативных вмешательств, а в контрольной группе у 73 больных выполнено 87 операции. Это объясняется тем, что в данной группе был высоким удельный вес повторных операций. Анализ проведенных оперативных вмешательств показал на высокий удельный вес вскрытий флегмон с некрэктомией, которая была выполнена у 23 пациентов (36,5%), некрэктомия произведена в 33 (52,3%) случаях, ампутация на уровне стопы в 3 случаях. Ампутации нижних конечностях на уровне бедра и голени произведено у 2 больных (3,2%). В контрольной группе больных в общей сложности выполнено 87 оперативных вмешательств, при этом вскрытие флегмоны с некрэктомией - 44 больных, что составляло 50,6%, а некрэктомии -29 пациентов (33,3%).
Одним из важных диагностических критериев течения патологического процесса является температурная реакция, которая в 1 сутки была высокой у больных как основной, так и контрольной группы и составляла соответственно 38,6±0,09 и 38,0±0,09. Данный показатель на фоне проводимого лечения равномерно снижался в обеих группах, однако в контрольной группе к 3 суткам лечения он сохранялся, был на высоких цифрах и составлял 38,0±0,07, что говорит о сохранении воспалительных явлений в области патологического процесса. Лишь на 7 сутки отмечается нормализация температурной реакции, которая наблюдалось и в 14 сутки (табл. 3, 4).
Лейкоцитоз крови при поступлении в обеих группах был высоким. Так в основной он составлял 11,6?0,65•109/л, а в контрольной 9,7±0,35•10 9 /л. Увеличение лейкоцитоза происходила к 1-7 суткам лечения, причем в основной группе, к этому сроку она была на уровне высоких величин, за счет зрелых форм, составляя от 18,2±0,78•10 9 /л до 21±0,78•10 9 /л., тогда к 7 суткам в контрольной группы она сохранялась на уровне 8,4±0,25•10 9 /л. К 14 суткам лечения он был в пределах нормы в обеих группах. По остальным критериям особой разницы не выявлялось. Значения лейкоцитарного индекса интоксикации были различными в зависимости от выраженности и распространенности раневой инфекции от 3,5 до 4,2 при глубоких гнойных поражениях мягких тканей. Увеличение лейкоцитарного индекса интоксикации, т.е. до 4,2, в основной группе больных происходила в среднем к 7 суткам, в контрольной группе в этот показатель ЛИИ была 3,8. При этом в основной группе больных лейкоцитарный индекс интоксикации постепенно уменьшилось от 4,2±0,21 до 1,2±0,22 в течение 10 суток от начала лечения. Это показывает, что в 3-10 день от действия Г-КСФ костный мозг вырабатывает большой количество зрелых нейтрофилов.
Сравнительный анализ микробной обсемененности как аэробов, так и анаэробов показало, что их содержание в исследуемых группах было одинаковым (рис. 1). Так, если концентрация аэробов составляла 5,9 lg KOE в контрольной, то в основной она была 6,1 lg KOE. При этом, на фоне проводимого лечения, их снижение отмечалось уже на 3 сутки составляя 3,2 lg KOE. К 5 суткам лечения уровень аэробов был 2,1 lg KOE, что является показателем концентрации ниже критического уровня, тогда как в контрольной он составлял 3,4 lg KOE (рис. 1).
Изучение изменений анаэробной микрофлоры показало, что их доля в основной группе была выше в 1 сутки лечения, составляя 5,5 lg KOE, тогда как в контрольной этот показатель был на уровне 5,4 lg KOE. На фоне лечения к 3 суткам основной группы их содержание составляя 2,9 lg KOE, тогда как в контрольной он составлял 4,4 lg KOE (рис. 2).
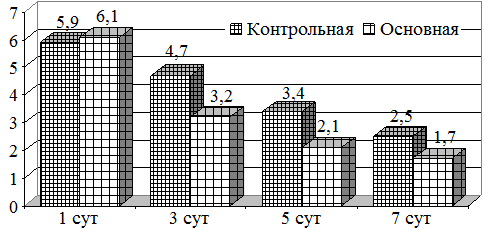
Рис. 1. Динамика изменений микробной обсемененности (аэробов)
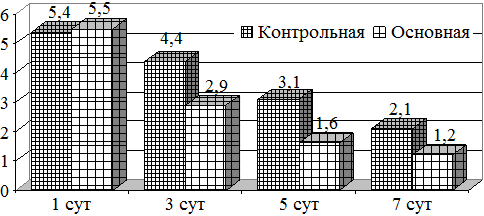
Рис. 2. Динамика изменений микробной обсемененности (анаэробов)
Существенное снижение отмечалось к 7 суткам лечения, так если в контрольной группе к этому сроку она составляла 2,1 lg KOE, то в основной она была 1,2 lg KOE.
Таблица 3. Динамика изменения площади раневой поверхности больных контрольной и основной группы.
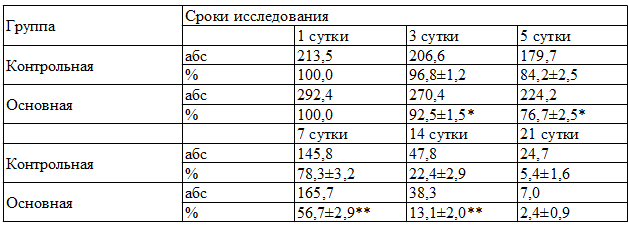
Примечание: * - различия относительно данных контрольной группы значимы (* - P 0,05 по сравнению с контролем).
Таблица 4. Результаты лечения больных
При выписке больные контрольной группы находились под диспансерным наблюдением с условиями выполнения рекомендуемых назначений и контрольным обследованием через каждые 3 дня. Сроки амбулаторного лечения составили 26,8±0,3 дня. В основной группе данный показатель был меньше, так среднее пребывание в стационаре составляла 9,3±0,7 дней. Продолжительность амбулаторного лечения составила 18,7±0,6 дня (рис 3.).
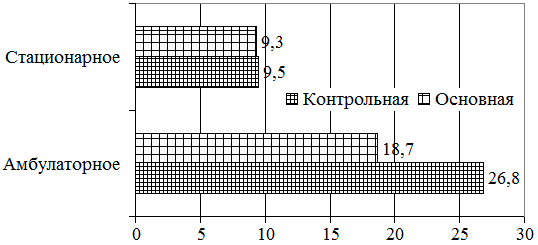
Рис.3.Средняя продолжительность лечения
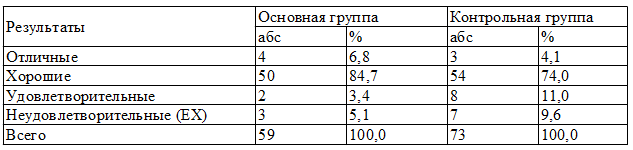
Результаты лечения обеих групп показали, что отличные результаты отмечены у 4 (6,7%) больных основной группы и 3 (4,1%) больных в контрольной, хорошие результаты преобладали у больных основной группы, которые отмечены у 50 (84,7%) больных, в сравнении с контрольной, где данный показатель отмечен у 54 (74,0%) больных.
По удовлетворительным результатам лечения, когда в ране сохранялся гнойный процесс, произведена повторная операция, в контрольной группе она была выявлена у 8 пациентов (11%), тогда как в основной данный показатель был выявлен у больных (3,38%). Летальные исходыв основной группы наблюдались у 3 больных (5%), а у контрольной группы 7 - больных (9,6%) (табл. 4).
Результаты лечения показали, что гладкое течение отмечено у 91,5% больных основной группы, и 78,1% больных контрольной группы. Осложненное течение, когда произведена повторная операция и есть летальные исходы, отмечено у 8,5% больных основной и 20,5% больных контрольной группы (рис 4).
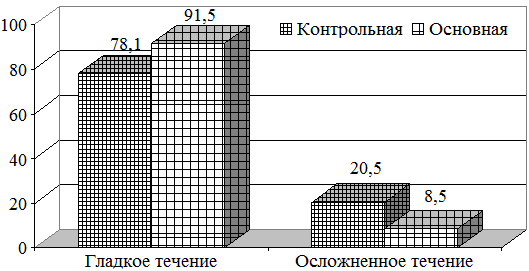
Рис. 4. Результаты лечения больных
Таким образом, подводя итоги клинического исследования по применению Г-КСФ при широком спектре гнойно-воспалительных поражений мягких тканей на фоне сахарного диабета, можно констатировать его высокую терапевтических эффективность, позволяющую обеспечивать улучшение качества жизни тяжелого контингента больных с хирургическими инфекциями мягких тканей. Назначение Г-КСФ обязательно в случае комбинации нейтропении с тяжелой бактериальной и грибковой обсемененностью, а также при сепсисе, причем основанием для его применения является наличие документированной инфекции.
Список использованных источников:
1. Акбаров З.С., Хайдарова Ф.А., Царева В.Э. Основные результаты изучения распространенности поздних осложнений сахарного диабета по городу Ташкенту. - Ташкент: Проспект. 1999, с.4.
2. Блатун Л.А., Светухин А.М., Митиш В., Терехова Р., Агафонов В. Современные йодофоры в лечении и профилактике гнойно-воспалительных процессов в ранах// Врач, 2000. - № 11. - С. 22-25.
3. Мухамедов Т.М. Диспансеризация больных с сахарным диабетом в Республике Узбекистан// Вестн. врача общ. практики. - Т., 2001. - №2. - С. 31-33.
4. Руднов В.А., Ножкин С.Н., Галеев Ф.С. и др. Фармакоэпидемиологический анализ лечения абдоминального сепсиса в отделениях реанимации и интенсивной терапии. Результаты многоцентрового исследования// Инфекции в хирургии. - 2003. - №2. - С.45-53.
5. Стручков В.И., Григорян А.В., Гостищев В.К. Гнойная рана. - М.: Медицина. - 1975. - 310 С.
7. Хаитов P.M. Пинегин Б.В. Иммуномодуляторы: механизмы действия и некоторые аспекты их клинического применения// Иммунология. - 1996. -№8.-С.7-12.
8. Яковлев В.П. Применение ципрофлоксацина при лечении и профилактики хирургической инфекции//Антибиотики и химиотерапия, 1999. - № 7. - С.38-44.
9. Ahrenholz D.Н. Necrotizing fasciitis and other infections. Intensive Care Medicine. - Boston, 1991; 1334.
10. Asano Т., Khanna A., Lagman M. et al. Immunostimulatory therary with anti-CD3 monoklonal antibodies and recombinant interleukin-2: heightened in vivo expression of mRNA encoding cytotoxic attack molecules and immunoregulatory cytokines and regression of murine renal cell carcinoma// J.Urol. 1997. Vol. 157, N6. P.2396-2401.
11. Jung K.H., Chu K., Lee S.T., Kim S.U., Kim M., Roh J.K. G-CSF protects human cerebral hybrid neurons against in vitro ischemia// Neuroscience Letters 2006;394:168-73.
12. Chun T.N., Engel D., Mizzell S.B. et al. Effect of interleukin-2 on the poll of latency infected resting CD4+ T cells in HIV-1-infected patients receiving highly active anti-retroviral therapy// Nature Med. 1999. Vol.5, N 6. P.651-655.
13. Kastenbauer T., Hornlein B., Sokol G., Irsigler K. Evaluation of granulocyte-colony stimulating factor (Filgrastim) in infected diabetic foot ulcers// Diabetologia. 2003 Jan; 46(1): 27-30.
Республиканский центр гнойной хирургии и хирургических осложнений сахарного диабета, г. Ташкент, Узбекистан
Хирургические инфекции мягких тканей - наиболее частая причина обращения пациентов за хирургической помощью, так в Великобритании она является причиной госпитализации 10% пациентов, в США она является причиной 330000 госпитализаций в год, а в России эта патология наблюдается примерно у 700000 пациентов. Это указывает на то, что диагностика и лечение хирургических инфекций остается одной из актуальных проблем современной хирургии [2-4,6]. Летальность при тяжелых формах хирургических инфекций колеблется в пределах от 28% до 56%, а при сепсисе свыше 90% [2]. Хирургическая инфекция у больных на фоне нейроэндокринных нарушений, в частности сахарного диабета протекает атипично, с достаточно агрессивным течением [1,4].
В настоящее время сахарный диабет рассматривается как аутоиммунное заболевание, характеризующееся нарушением клеточного и гуморального иммунитета. Механизм повреждения связан с иммунологическими нарушениями в организме больного. У трети больных сахарным диабетом выявлена клеточная антипанкреатическая гиперсенсибилизация, нарушение фагоцитарной функции лимфоцитов, снижение число Т-супрессоров и Т-хелперов. Нейтрофильные лейкоциты, фагоцитируя патогены, являются критическим компонентом естественной защиты организма. Нейтропения приводит к тому, что бактериальные и грибковые возбудители, попадая во внутреннюю среду, получают возможность беспрепятственно размножаться, формировать локальный очаг поражений мягких тканей и вызывать быстротекущий сепсис [5,8,10]. В связи с этим в последние годы большое внимание уделялось профилактическому применению препаратов, способных уменьшить продолжительность и выраженность нейтропении. Эти препараты, называемые миелоцитокинами (гранулоцитарный и гранулоцитарно-макрофагальный колоние-стимулирующие факторы (Г-КСФ и ГМ-КСФ), появились в клинической практике в начале 1980-x годов [7,8,11,12]. Настоящая работа посвящена оценке эффективности Г-КСФ (Филграстим) (Нейпоген (Neupogen), производитель F.Hoffmann-La Roche Ltd, Швецария) в комплексной терапии больных острой гнойной хирургической инфекцией мягких тканей на фоне сахарного диабета. В доступной литературе мы не обнаружили сообщений об использовании Г-КСФ (Филграстим) в комплексном лечении гнойной хирургической инфекции мягких тканей на фоне сахарного диабета, поэтому целью нашего исследования стало изучение эффективности применения Г-КСФ (Нейпоген) в комплексной терапии этого патологического состояния.
Материал и методы исследования. В основу работы положен анализ результатов лечения 132 больных с гнойно-некротическими поражениями мягких тканей на фоне сахарного диабета, находившихся на стационарном лечении в Республиканском Центре гнойной хирургии и хирургических осложнений сахарного диабета, за период с 2005 по 2011 г. В зависимости от характера проводимых лечебных мероприятий все пациенты были разделены на 2 группы.
Первая (контрольная) группа, представлена 73 (55,3%) пациентами с гнойно-некротическими заболеваниями мягких тканей, развившимися на фоне сахарного диабета и находившихся на стационарном лечении с 2005 по 2007 г. Находясь на стационарном лечении, данная группа больных получала традиционный комплекс лечебных-диагностических мероприятий.
1) фагоцитоз играет основную роль в элиминации условно-патогенных бактерий, вызывающих послеоперационные инфекционные осложнения;
2) активация фагоцитарных клеток вызывает естественную активацию всех компонентов иммунной системы, в связи с этим, данной группы больных является то, что в комплекс лечебных мероприятий добавлен гранулирующий колониестимулирующий фактор (Г-КСФ) - Нейпоген по 30 млн ЕД*1 мл/сутки в течение 5-7 дней.
Изучение возрастного аспекта больных в обеих группах показало, что доминировали больные пожилого и старческого возраста, так больных в возрасте от 41-60 лет в контрольной группе было 32 (44%), а в основной 28 (39%). У больных в возрасте 61-80 лет, картина была практически идентичной и составляла - в контрольной 36 (49%), а в основной 28 (47%). Среди обследованных было 65 мужчин (49%) и 67 женщин (51%).
Нозологическая характеристика больных показала, что доминировали больные с карбункулами различной локализации, выявленные у 32 (24,2%) больных, причем соотношение их в обеих группах было практически одинаково. На втором месте по частоте встречаемости были флегмоны нижних конечностей - 23 (17,4%), абсцессы и флегмоны туловища у 22 (24,2%), а также флегмона промежности выявление у 20 (15,1%) больных (табл. 1).
Изучение больных по типу выявленного сахарного диабета показало, что у большинства больных был выявлен сахарный диабет II типа (94,7%), при этом сахарный диабет I типа наблюдался только у 7 из 132, что составляет 5,3% (табл. 2).
Таблица 1. Распределение больных по нозологии
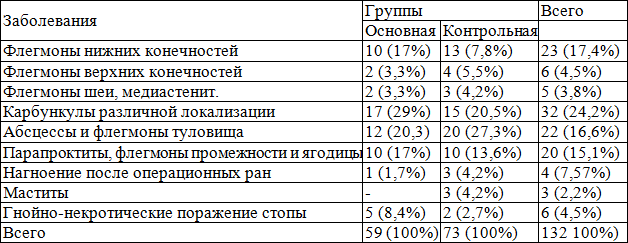
Таблица 2. Распределение больных в зависимости от типа СД
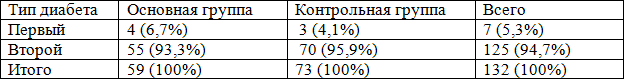
При поступлении, после кратковременной предоперационной подготовки, всем больным проводилось оперативное вмешательство, направленное на вскрытие патологического очага, с проведением адекватной некрэктомии (табл. 3). При этом 59 больным основной группы было выполнено 63 оперативных вмешательств, а в контрольной группе у 73 больных выполнено 87 операции. Это объясняется тем, что в данной группе был высоким удельный вес повторных операций. Анализ проведенных оперативных вмешательств показал на высокий удельный вес вскрытий флегмон с некрэктомией, которая была выполнена у 23 пациентов (36,5%), некрэктомия произведена в 33 (52,3%) случаях, ампутация на уровне стопы в 3 случаях. Ампутации нижних конечностях на уровне бедра и голени произведено у 2 больных (3,2%). В контрольной группе больных в общей сложности выполнено 87 оперативных вмешательств, при этом вскрытие флегмоны с некрэктомией- 44 больных, что составляло 50,6%, а некрэктомии -29 пациентов (33,3%) (табл. 3).
Таблица 3. Характер проведенных оперативных вмешательств
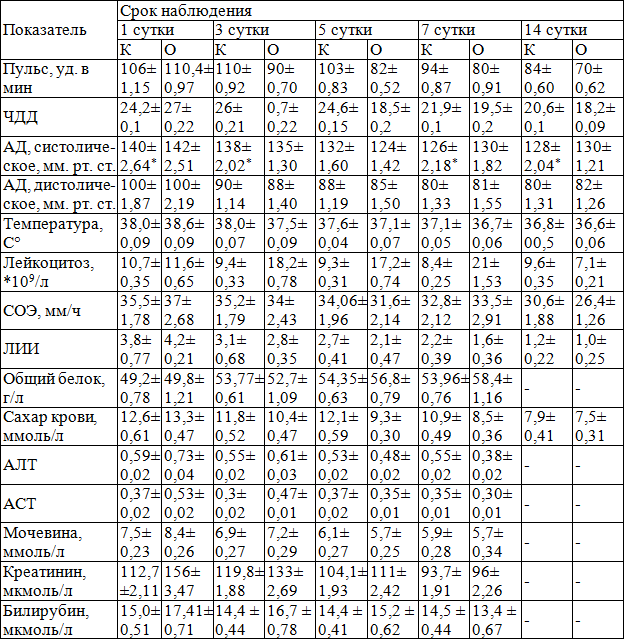
Изучение динамики изменения клинико-биохимических показателей в обеих группах показало, что показатели интоксикации в основной группе на фоне проводимого лечения прогрессивно снижались и уже на 3 сутки лечения были приближены к нормальным значениям кроме лейкоцитов, за счет действия Г-КСФ (нейпоген). Значение лейкоцитарного индекса интоксикации были различными зависимости от выраженности и распространенности раневой инфекции, доходя до 3,8 в контрольной и до 4,2 в основной. При этом, в основной группе больных лейкоцитарный индекс интоксикации постепенно снижался и составлял 1,6±0,36, к 7 суткам наблюдения. Это указывает что на 3-7 день от действия Г-КСФ (нейпоген) костный мозг вырабатывает большой количество зрелых нейтрофилов (табл. 4).
Одним из важных диагностических критериев течения патологического процесса является температурная реакция, которая в 1 сутки была высокой у больных как основной, так и контрольной группы и составляла соответственно 38,6±0,09 и 38,0±0,09 0 С. Данный показатель на фоне проводимого лечения равномерно снижался в обеих группах, однако в контрольной группе к 3 суткам лечения он сохранялся, был на высоких цифрах и составлял 38,0±0,07, что говорит о сохранении воспалительных явлений в области патологического процесса. Лишь на 7 сутки отмечается нормализация температурной реакции, которая сохранялась и остальные соки наблюдения (табл. 4).
Лейкоцитоз крови, при поступлении, в обеих группах был высоким. Так, в основной группе составлял 11,6±0,65*10 9 /л., в контрольной 10,7±0,35*10 9 /л. В динамике на фоне применения Г-КСФ (нейпоген) отмечается нарастание лейкоцитоза, причем в основной группы, данный показатель был выше за счет увеличения зрелых форм, составляя от 18,2±0,78*10 9 /л на 3 сутки лечения, с увеличением данного показателя к 7 суткам до 21±0,78*10 9 /л., при этом к 7 суткам в контрольной группе он сохраняется на уровне 8,4±0,25 *10 9 /л. (табл. 5).
К 14 суткам лечения он был в пределах нормы в обеих группах. По остальным критериям особой разницы не выявлялось.
Таблица 4. Динамика изменений клинико-биохимических показателей у больных основной и контрольной группы (М±m)
Примечание: здесь и далее *р
Список использованных источников:
1. Блатун Л.А., Светухин А.М., Митиш В., Терехова Р., Агафонов В. Современные йодофоры в лечении и профилактике гнойно-воспалительных процессов в ранах// Врач, 2000. - №11. - С. 22-25.
2. Руднов В.А., Ножкин С.Н., Галеев Ф.С. и др. Фармакоэпидемиологический анализ лечения абдоминального сепсиса в отделениях реанимации и интенсивной терапии. Результаты многоцентрового исследования// Инфекции в хирургии. - 2003. - №2. - С. 45-53.
3. Стручков В.И., Григорян А.В., Гостищев В.К. Гнойная рана. - М.: Медицина. - 1975. - 310 С.
5. Хаитов P.M., Пинегин Б.В. Иммуномодуляторы: механизмы действия и некоторые аспекты их клинического применения// Иммунология. - 1996. -№8.- С. 7-12.
6. Яковлев В.П. Применение ципрофлоксацина при лечении и профилактики хирургической инфекции//Антибиотики и химиотерапия, 1999. - №7. - С. 38-44.

Анаэробная инфекция занимает особое место в связи с исключительной тяжестью течения болезни, высокой летальностью (14-80%), частыми случаями глубокой инвалидизации пациентов.
По большому счету к анаэробным относят инфекции, вызываемые облигатными анаэробами, которые развиваются и оказывают свое болезнетворное действие в условиях аноксии (строгие анаэробы) или при небольших концентрациях кислорода (микроаэрофилы). Однако существует большая группа так называемая факультативных анаэробов (стрептококки, стафилококки, протей, кишечная палочка и др.), которые попадая в условия гипоксии, переключаются с аэробного на анаэробный путь метаболизма и способны вызывать развитие инфекционного процесса клинически и патоморфологически сходного с типичным анаэробным.
Анаэробы распространены повсеместно. В желудочно-кишечном тракте человека, являющемся основным местом их обитания, выделено более 400 видов анаэробных бактерий.Естественным местом обитания клостридий являются почва и толстый кишечник человека и животных.
Анаэробная эндогенная инфекция развивается в случае появления условно патогенных анаэробов в местах, несвойственных для их обитания. Проникновение анаэробов в ткани и кровеносное русло происходит во время оперативных вмешательств, при травмах, инвазивных манипуляциях, распаде опухолей, при транслокации бактерий из кишечника при острых заболеваниях брюшной полости и сепсисе.
Однако для развития инфекции еще недостаточно простого попадания бактерий в неестественные места их существования. Для внедрения анаэробной флоры и развития инфекционного патологического процесса необходимо участие дополнительных факторов, к которым относят большую кровопотерю, местную ишемию тканей, шок, голодание, стресс, переутомление и др. Немаловажную роль играют сопутствующие заболевания (сахарный диабет, коллагенозы, злокачественные опухоли и др.), длительный прием гормонов и цитостатиков, первичный и вторичный иммунодефициты на фоне ВИЧ-инфекции и других хронических инфекционных и аутоиммунных заболеваний.
Для всех анаэробных инфекций, независимо от локализации очага, имеется ряд весьма характерных клинических признаков):
- стертость местных классических признаков инфекции с преобладанием симптомов общей интоксикации;
- локализация очага инфекции в местах обычного обитания анаэробов;
- неприятный гнилостный запах экссудата, являющийся следствием анаэробного окисления белков;
- преобладание процессов альтеративного воспаления над экссудативным с развитием некроза тканей;
- газообразование с развитием эмфиземы и крепитации мягких тканей за счет образования плохорастворимых в воде продуктов анаэробного метаболизма бактерий (водорода, азота, метана и др.).
Различные виды анаэробов могут вызывать как поверхностные, так и глубокие гнойно-некротические процессы с развитием серозных и некротических целлюлитов, фасциитов, миозитов и мионекрозов, комбинированных поражений нескольких структур мягких тканей и костей.

В лечении анаэробных инфекций основное значение имеют оперативное вмешательство и комплексная интенсивная терапия. В основе хирургического лечения лежит радикальная ХОГО с последующими повторными обработками обширной раны и закрытием ее доступными методами пластики.
Фактор времени в организации хирургической помощи играет важное, иногда решающее значение. Задержка операции ведет к распространению инфекции на большие площади, ухудшению состояния пациента и возрастанию риска самого вмешательства. У больных с септическим шоком хирургическое вмешательство возможно только после стабилизации артериальногодавления и разрешения олигоанурии(проявлений острой почечной недостаточности).
В ходе хирургической обработки необходимо выполнять широкое рассечение тканей, пораженных инфекцией, с заходом разрезов до уровня визуально не измененных участков. Распространение анаэробной инфекции отличается выраженной агрессивностью, преодолением различных преград в виде фасций, апоневрозов и других структур, что не характерно для инфекций, протекающих без доминирующего участия анаэробов.
При ХОГО необходимо удалять все нежизнеспособные ткани независимо от объема поражения. После радикальной ХОГО края и дно раны должны составлять визуально не измененные ткани. Площадь раны после операции может занимать от 5 до 40% поверхности тела. Не стоит опасаться образования очень больших раневых поверхностей, так как только полная некрэктомия является единственным выходом для спасения жизни пациента. Паллиативная же хирургическая обработка неизбежно приводит к прогрессированию флегмоны, синдрома системного воспалительного ответа, развитию сепсиса и ухудшению прогноза заболевания.
В отделении гнойной хирургии ГКБ29 накоплен глобальный опыт по лечению данной нозологии. Своевременность установки диагноза, адекватный объем хирургического вмешательства – основы благоприятного исхода в курировании пациентов с анаэробной инфекцией. Учитывая тяжесть состояния больных огромную помощь в лечении оказывают специалисты отделения реанимации. Наличие современных антибактериальных препаратов, перевязочных средств, квалифицированный средний и маладший медицинский персонал, а также грамотный лечащий врач, как руководитель лечебного процесса – создают условия для комплексной адекватной борьбы с этим грозным заболеванием. Так же в отделении выполняется весь спектр реконструктивно-пластических операций после купирования гнойного процесса.
Государственная клиническая больница №29 им. Н.Э.Баумана – это современная многопрофильная высокотехнологичная больница с уникальной полуторавековой историей и традицией, оказывающая высококачественную медицинскую помощь в круглосуточном режиме.
Читайте также:




