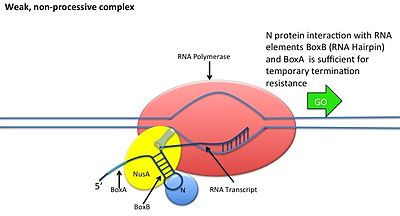
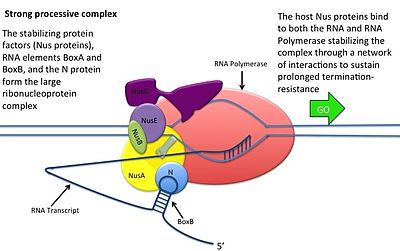
Жизненные циклы вирусов литический и лизогенный
Рис. 2.22. Жизненный цикл бактериофага.
Жизненный цикл типичного бактериофага показан на рис. 2.22. E. coli, являющаяся типичной клеткой-хозяином, может быть атакована по меньшей мере семью штаммами Т-фагов (от Т1 до Т7). Т-четный фаг (например, Т2-фаг) показан на рис. 2.19, А и Б и 2.20.
Рис. 2.19. А. Строение бактериофага Т2. Б. Электронная микрофотография бактериофага, полученная методом негативного контрастирования.
Рис. 2.20. Несколько упрощенных схематических изображений вирусов, отражающих различие их симметрии и размеров. Фаг Т2 показан с нитями хвостового отростка, которые фаг выпускает перед тем как инфицировать клетку; у фага λ нитей хвостового отростка нет.
Жизненные циклы большинства фагов в основном схожи. Однако у одних из них жизненный цикл протекает без перерывов; в таком случае говорят о литическом цикле развития. У других фагов, таких как фаг лямбда, фаговая ДНК, оказавшись в клетке, встраивается в ДНК клетки-хозяина и никак не проявляется на протяжении многих поколений. При каждом делении клетки фаговая ДНК копируется вместе с клеточной ДНК. Такой неактивный фаг называют профагом. Но в какой-то момент профаг вновь активируется: высвобождается из клеточной ДНК и завершает свой жизненный цикл, вызывая гибель клетки-хозяина обычным путем. Такие фаги называют лизогенизирующими, а клетку с встроенным в нее профагом – лизогенной.
Вирусы способны поражать и эукариотические клетки; при этом, как и в случае с прокариотическими клетками, каждый вирус имеет собственного специфического хозяина. ВТМ, например, инфицирует только растения табака. В целом вирусы вызывают множество различных заболеваний у растений, животных и грибов. К вирусным болезням человека относятся корь, краснуха, ветряная оспа, грипп, герпес и СПИД.
Вирусы вызывают много различных болезней у организмов почти всех других видов.
Особый интерес среди вирусных болезней вызывает СПИД (синдром приобретенного иммунодефицита человека), поскольку это относительно новая болезнь. Впервые сообщение о ней появилось в СШАв 1981 г. СПИД вызывается вирусом иммунодефицита человека, или сокращенно ВИЧ. Интерес к этому вирусу объясняется еще и тем обстоятельством, что ВИЧ относится к группе вирусов, получивших название ретровирусов – название, отражающее следующую особенность этого вируса. Обычно перенос генетической информации идет в направлении ДНК–> РНК, т.е. информация, закодированная в определенном отрезке ДНК (гене) транскрибируется, т.е. считывается, с образованием соответствующей РНК. У ретровирусов же, у которых наследуемым генетическим материалом служит РНК, происходит обратная транскрипция, т.е. генетическая информация считывается в обратном направлении: от РНК к ДНК. Фермент, участвующий в обратной транскрипции, называется обратной транскриптазой. Он широко используется в генетической инженерии (гл. 25).
Рис. 2.23. Жизненный цикл вируса иммунодефицита человека (ВИЧ).
- Вирус приближается к Т4-лимфоциту
- Вирусный гликопротеин прикрепляется к рецепторному белку, находящемуся на плазматической мембране
- Вирус проникает в клетку путем эндоцитоза
- Вирусная РНК высвобождается в цитоплазму вместе с ферментом обратной транскриптазой
- В результате транскрипции одноцепочечной вирусной РНК при участии обратной транскриптазы образуется двухцепочечная ДНК
- Образовавшаяся ДНК проникает в клеточное ядро и встраивается в ДНК клетки-хозяина. При каждом клеточном делении одновременно с копированием клеточной ДНК происходит копирование и встроенной вирусной ДНК. В результате число инфицированных клеток увеличивается
- По истечении неактивного периода, называемого латентным периодом, который длится примерно 5 лет, вирус вновь активируется. Факторы, индуцирующие превращение латентного вируса в активный, не установлены
- С использованием белоксинтезирующего аппарата клетки-хозяина образуется новая РНК (транскрипция) и синтезируются вирусные белки
- Сборка новых вирусных частиц
- Вирусные белки отпочковываются от клетки путем экзоцитоза
- В конечном счете инфицирование клетки вирусом приводит к ее гибели
На рис. 2.21 показано строение ВИЧ, а на рис. 2.23 приведена схема его жизненного цикла (см. также рис. 2.24). ВИЧ инфицирует и разрушает лейкоциты определенной группы, называемые Т-хелперными лимфоцитами, подавляя в результате активность иммунной системы. Вызываемая этим вирусом болезнь (СПИД) рассматривается в гл. 15.
Рис. 2.24. ВИЧ, покидающий инфицированную клетку.
Лизогении или лизогенный цикл , является одним из двух циклов вирусной репродукции (The литического цикла является другим). Лизогении характеризуются интеграцией бактериофага нуклеиновой кислоты в геном или формации круговой бактерии - хозяина в репликоне в бактериальной цитоплазме. В этом состоянии бактерии продолжают жить и размножаться нормально. Генетический материал бактериофага, называется профаг , может быть передана дочерним клеткам при каждом последующем делении клеток, а на последующих событий (например, УФ - излучением или при наличии определенных химических веществ) может освободить его, вызывая распространение новых фагов с помощью литический цикл. Лизогенные циклы могут также возникать в эукариот , хотя способ введения ДНК до конца не изучен.
Разница между лизогенными и литическими циклами является то, что в лизогенных циклах, распространение вирусной ДНК происходит через обычный прокариот размножения, в то время как цикл литического более немедленный в том , что это приводит к большому количеству копий вируса создается очень быстро и клетка разрушается. Ключевое различие между циклом литического и лизогенным циклом является то , что лизогенная цикл не лизировать клетки - хозяина сразу. Фаги , которые копируют только через цикл литической известны как вирулентные фаги , а фаги , которые копируют с использованием как литические и лизогенных циклов известны как умеренные фаги.
В лизогенной цикле, ДНК фага первый интегрируются в хромосому бактерии для получения профага. Когда бактерия воспроизводит, профаг также копируется и присутствует в каждом из дочерних клеток. Дочерние клетки могут продолжать репликацию с профаг настоящим или профаг может выйти из бактериальной хромосомы, чтобы инициировать цикл лизогенную литического cycle.In хозяина ДНК не гидролизует, а в литическом цикле хозяина ДНК гидролизует в литической фазе.
содержание
Бактериофаги
Бактериофаги представляют собой вирусы , которые заражают и копируют в бактерии. Умеренные фаги (например, фаг лямбды ) можно воспроизвести с использованием как литического и лизогенный цикла. Через лизогенном цикла, геном бактериофага выражается не и вместо того, чтобы интегрироваться в геном бактерий, в формировать профаг . Так как генетическая информация бактериофаги является включена в генетическую информацию бактерий, в качестве профага, бактериофага размножается пассивно , как бактерия делится , чтобы сформировать дочерние клетки бактерий. В этом случае клетка дочерних бактерий содержит профаг и известна как лизогены . Лизогенов может оставаться в лизогенном цикле на протяжении многих поколений , но может переключиться на литический цикл в любое время с помощью процесса , известного как индукция. Во время индукции, профаг ДНК вырезал из бактериального генома и транскрипция и трансляция , чтобы белки оболочки для вируса и регулировать литический рост.
Модель организма для изучения лизогении лямбда фага. Профаг интеграция, обслуживание лизогении, индукции и контроля генома фага иссечения в индукции подробно описана в лямбда - фага статье.
Бактериофаги паразитируют , потому что они заражают своих хозяев, используют бактериальные механизмы репликации, и в конечном счете лизировать бактерии. Умеренные фаги могут привести как преимущества и недостатки для их хозяв с помощью лизогенного цикла. Во время цикла лизогенного, вирусный геном включен как профаг и репрессор предотвращает репликацию вируса. Тем не менее, умеренный фаг может избежать репрессий тиражировать, продуцировать вирусные частицы, и лизировать бактерии. Умеренный фаг избежать репрессий будет недостаток для бактерий. С другой стороны, профаг может передавать гены , которые повышают хозяин вирулентность и устойчивость к иммунной системе. Кроме того , репрессор получают профага , который предотвращает гены профаг от быть выражено дает иммунитет для хозяина бактерий из литической инфекции за счет соответствующих вирусов.
В некоторых взаимодействиях между лизогенными фагами и бактерий, лизогенная конверсия может произойти, который также можно назвать преобразованием фага. Это когда умеренный фаг вызывает изменение фенотипа из инфицированных бактерий , которые не являются частью обычного фага цикла. Изменения могут часто включать в себя внешнюю мембрану клетки, делая ее непроницаемой для других фагов или даже за счет увеличения патогенной способности бактерий для хозяина. Таким образом, умеренные бактериофаги также играют определенную роль в распространении вирулентных факторов , такие как экзотоксины и экзоферменты, среди бактерий. Это изменение затем остается в геноме зараженных бактериями и копируется и передается дочерним клеткам.
Преобразование лизогенного показало , чтобы позволить биопленки образования в Bacillus антрэкис штаммах B. антрэкис отвержденного все фага были неспособны образовывать биопленки, которые являются поверхностно-придерживались бактериальных сообществ , которые позволяют бактерии , чтобы лучше питательные веществам доступа и выживают экологические стрессы. В дополнении к образованию биопленки в B. антрэкис , лизогенное превращение Bacillus зиЫШза , Bacillus Thuringiensis и Bacillus сегеиза показало повышенную скорость и степень спорообразования. Спороношение производит эндоспоры , которые метаболически покоящиеся формы бактерий , которые обладают высокой устойчивостью к температуре, ионизирующее излучение, высыхание, антибиотики, дезинфицирующие средства и.
Номера вирулентные бактерии , также были показаны , чтобы превратить в высоко вирулентные патогены через лизогенную конверсию с факторами вирулентности , проведенных на лизогенной профаге. Гены вирулентности , проведенные в рамках профагов в виде дискретных автономные генетических элементов, известных как дебилы , давать преимущество к бактериям , которые косвенно приносят пользу вируса путем расширение выживания лизогена.
- Corynebacterium дифтерии производит токсин дифтерии только тогдакогда она заражена фага р. В этом случае генкоторый кодирует токсин осуществляетсяпомощью фага,не бактерии.
- Холерный вибрион является нетоксичным штаммкоторый может стать токсичным, производя холерный токсин , когда он инфицирован фагом CTXφ.
- Шигеллы дизентерия , которая производит дизентерию имеет токсины , которые попадают в две основных группы, Stx1 и stx2, чьи гены считаются частью генома ламбдовидных профагов .
- Streptococcus Пирролидонилпептидаза , производит пирогенный экзотоксин , полученный лизогенном преобразования, который вызывает лихорадку и алую-красная сыпь, скарлатину .
- Некоторые штаммы Clostridium ботулизма , который вызывает ботулизм , выражает ботулинический токсин из фага-tranduced генов.
Стратегии борьбы с определенными бактериальных инфекций путем блокирования профага индукции (переход от лизогенной к циклу литической ) за счет устранения в естественных условиях индукции агентов были предложены. Активные формы кислорода (ROS), такие как перекись водорода, являются сильными окислителями , которые могут разлагаются на свободные радикалы и вызывают повреждение ДНК бактерий, что приводит к индукции профага. Одна потенциальная стратегия борьбы профага индукции посредством использования глутатиона , сильный антиоксидант , который может удалить свободные радикалы промежуточных продуктов . Другой подход может быть , чтобы вызвать избыточную экспрессию CI - репрессор , так как профаг индукция происходит только тогда , когда концентрация CI репрессора является слишком низкой.
Читает асс. А.В. Летаров
I. Предмет и история микробиологии.
Возникновение представлений о микроорганизмах. Ранние микроскопические исследования. Работы А. ван Левенгука. Развитие микробиологии в 18-19 веках: Л. Спаланцани, Д.Самойлович, Л. Пастер, Р. Кох, С.Н. Виноградский, М. Бейеринк. Открытие вирусов и бактериофагов.
II. Введение в клеточную биологию бактерий.
Отличия прокариот и эукариот. Филогения прокариот. Эубактерии и археи. Гр+ и Гр- бактерии. Морфология бактерий. Адаптивное значение формы клеток. Схема строение бактериальной клетки: капсулы, клеточная стенка Гр+ и Гр- типа, S-слой, пили, фимбрии и жгутики, клеточная мембрана и связанные с ней органеллы, цитоплазма и цитоскелет, цитоплазматические включения, газовые вакуоли.
III. Организация макромолекулярных синтезов в бактериальной клетке. Cинтез ДНК.
Организация генома и синтез ДНК. Размеры и топология хромосом бактерий. Репликационная вилка. Цикл репликации. Понятие репликона. Плазмиды бактерий. Совместимость плазмид. Латеральный перенос ДНК – конъюгация, трансформация и трансдукция.
IV . Организация макромолекулярных синтезов в бактериальной клетке. Cинтез РНК и белка.
Организация транскрибции. РНК-полимераза. Промоторы и терминаторы. Оперон. Регуляция транскрибции на уровне инициации: белки-активаторы, белки-репрессоры, сигма-факторы. Другие механизмы регуляции транскрибции. Рибосомы. Элонгационный цикл. Генетический код. Инициация трансляции у бактерий. Терминация трансляции. Фолдинг белка. Деградация белков в клетке.
V . Рост и размножение бактерий. Синтез клеточной стенки.
Строение муреина. Синтез муреинового слоя бактерий. Пеницилин-связывающие белки и их функции. Пространственная организация синтеза муреина и бактериальный цитоскелет. Тейхоевые кислоты. Их синтез и транспорт. Синтез внешней мембраны. ЛПС, их строение, функции, ситнез и транспорт. Липопротеины, порины и другие белки ВМ. Их транспорт и включение в мембрану.
VI . Рост и размножение бактерий. Цитокинез.
Выбор сайта деления клетки. Осциллирующие белки. Другие механизмы. FtsZ и дивидисома. Синтез муреина клеточной перегородки.
VII . Клеточная дифференциация у бактерий.
Примеры дифференцированных клеток. Покоящиеся формы, экзо и эндоспоры. Гетероцисты цианобактерий. Споруляция как модификация клеточного деления. Регуляция споруляции у бацилл – фосфореле. Споруляция как стадия жизненного цикла. Стадии споруляции. Обмен сигналами между спорангием и проспорой. Морфогенез споровых оболочек. Причины устойчивости спор к повреждающим факторам. Прорастание спор: сигналы, вызывающие прорастание. Последовательность событий при прорастании споры.
VIII . Движение бактерий.
Разнообразие механизмов движения бактерий. Плавание с .помощью жгутиков. Строение жгутика и принцип его работы. Сборка жгутиков и ее регуляция. Механизмы контроля морфогенеза. Ориентация бактерий в пространстве. Хемотаксис. Механизмы контроля переключения жгутика. Другие таксисы.
IX . Бактериофаги.
Распространенность фагов в природе. Жизненные циклы бактериофагов. Литический и лизогенный цикл. Развитие фага внутри клетки на примере хвостатых фагов. Принципы морфогенеза бактериофагов. Другие семейства бактериофагов. Экологическое значение фагов и их роль в эволюции бактерий.
Х. Бактерии и болезни.
Принципы работы иммунной системы. Неспецифический иммунитет к бактериальным инфекциям. Воспалительная реакция. Септический шок. Специфический иммунитет. Антитела. Принцип клональной селекции. Взаимодействие с неспецифическим звеном иммунного ответа. Аутоиммунные реакции. Факторы патогенности бактерий: факторы адгезии и инвазии. Защита бактерий от действия иммунной системы. Токсины бактерий и их действие.
ХI . Бактерии в природе.
Микробное сообщество. Функциональная организация сообщества. Обмен субстратами. Экологические стратегии микроорганизмов. Пространственная структура сообществ. Биопленки. Бактериальные маты. Роль бактерий в глобальных циклах элементов. Цикл углерода. Цикл азота. Бактерии и геологическая эволюция Земли.
Оказывается, проблема выбора возникла гораздо раньше, чем сортировка апельсинов и любая другая высшая нервная деятельность. При этом в цивилизованном обществе неправильный выбор грозит в худшем случае увольнением с работы, а вот в реальной жизни он означает вымирание. Если у вас проблемы с тем, чтобы активировать те гены, которые нужно, и именно тогда, когда нужно, то вы вместе со всеми вашими нерождёнными потомками навсегда уходите со сцены. Только существа, которые правильно выбирают, наследуют Землю.
Жизнь тяжела даже для бактерии. Что бы ни случилось во внешней среде – похолодало, потеплело, появились соседи, вирусы, еда, из тысяч возможных молекул нужно выбрать или построить именно те, которые помогут справиться с изменениями. Но ещё сложнее жизнь для клеток многоклеточного организма. Каждая из них должна не только решать текущие задачи, но и выбрать свой жизненный путь таким образом, чтобы принести организму как можно больше пользы и как можно меньше вреда. Если в эмбриональном развитии клетка оказалась частью мозга, она не должна вести себя как клетка печени. Если во взрослом организме клетка оказалась потенциально опасной, она должна совершить самоубийство. От способности клеток нашего организма играть по правилам – а значит, прежде всего понимать их – зависит наше существование.
Перефразируя Оруэлла, биолог может сказать:
Что позволяет клетке каждый раз принимать правильное решение? Какие молекулярные механизмы вынуждают её впадать в анабиоз, когда еды нет, размножаться, когда еда есть, и ежедневно принимать сотни тысяч менее глобальных решений – почти всегда правильных? Что мы уже знаем об этих механизмах, что предстоит выяснить и как мы можем их использовать? Один из учёных, работающих над этой проблемой, – специалист по молекулярной генетике Константин Северинов. На прошлой неделе он прочёл публичную лекцию о генетических переключателях – молекулярных системах, способных изменять работу генов.
Как бактерии питаются молоком
Для неё, так же, как и для всех живых существ в мире, глюкоза – самая лучшая еда. Если глюкоза есть, то всё в порядке, в этом случае ни на какие другие источники энергии можно вообще не обращать внимания. А вот если глюкозы нет, то приходится думать, чем бы её заменить или из чего добыть. И если в окружающей среде есть молочный сахар, лактоза, то это неплохой вариант: бактерия E. coli вполне способна расщепить его на два более простых вещества – глюкозу и галактозу. Для того чтобы переваривать молочный сахар, бактерия использует специальный фермент – β-галактозидазу. Этот фермент вырабатывается только тогда, когда, во-первых, в окружающей среде есть лактоза и во-вторых, отсутствует глюкоза, и, значит, её нужно добывать из других веществ.
Синтез любого белка, в том числе и β-галактозидазы, начинается с транскрипции – прочтения соответствующего гена. РНК-полимераза, фермент, который читает нуклеотидную последовательность ДНК, должна присоединиться к промотору – участку, с которого начинается считывание гена (или группы генов).
В ситуации когда молочного сахара нет вообще, не производится и нужный для его переваривания фермент, β-галактозидаза. Такая экономия ресурсов достигается благодаря тому, что с промотором гена β-галактозидазы связан белок-репрессор, который физически не позволяет РНК-полимеразе связаться с ДНК и начать транскрипцию.
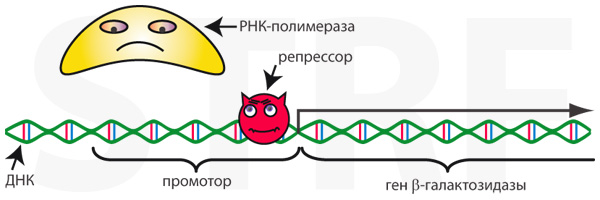
Рис. 2. Репрессор не позволяет РНК-полимеразе связаться с промотором, и поэтому β-галактозидаза не синтезируется.
Когда в клетке появляется лактоза, она сама же и снимает запрет на производство фермента, нужного для её расщепления. Молекула лактозы связывается с белком-репрессором, в результате чего он меняет конформацию и отсоединяется от ДНК.
Приманка начинает работать в том случае, если в клетке очень мало глюкозы. Значит, хочешь не хочешь, а использовать альтернативные источники пищи необходимо.
Отсутствие глюкозы – это настоящий голод, а в случае голода клетка вырабатывает молекулы-алармоны (от англ. alarm – тревога), которые служат сигналом для перестройки всей её жизнедеятельности.
В роли одного из таких посредников выступает циклический аденозинмонофосфат, цАМФ. Молекула этого вещества взаимодействует с белком, активирующим катаболизм, – CAP (catabolism activating protein), а образовавшийся комплекс связывается с промотором гена β-галактозидазы. CAP притягивает РНК-полимеразу к промотору и увеличивает вероятность того, что ген β-галактозидазы будет прочитан.
Эти два события – блокировка репрессора и активация CAP – приводят к активному производству β-галактозидазы. Клетка теперь может использовать молочный сахар в качестве пищи, что позволяет ей выйти из состояния голода и продолжить рост.
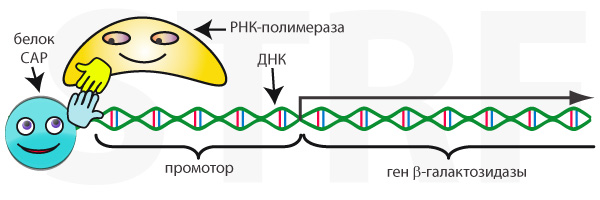
Рис. 3. Присутствие белка CAP повышает вероятность того, что РНК-полимераза свяжется с промотором и ген начнёт считываться.
Лактозный оперон вошёл во все учебники, потому что он иллюстрирует базовые принципы регуляции экспрессии генов, задействованные как в ингибировании, так и в активации транскрипции. Используя эти принципы, природа составляет сколь угодно сложные генетические переключатели, которые реагируют на изменение условий внешней среды.
Как вирусы решают проблему планирования семьи
Бактериофаги – это вирусы, поражающие бактерий. Их типичный жизненный путь выглядит так: впрыснуть свою ДНК в бактерию – использовать её ферменты для синтеза своих белков и новых копий своей ДНК – собрать новые вирусные частицы – уничтожить бактерию и отправиться к новым победам. Такой цикл называется литическим (от греч. Λυσις – растворение).
однажды бомба замедленного действия сработает, бактериофаг вернётся к литическому циклу и уничтожит бактерию.
Бактериофаг λ, паразит E. coli и классический объект вирусологических исследований – один из фагов, способных к литическому и лизогенному жизненному циклу. В его ДНК есть регуляторный участок, содержащий два промотора, направленных в разные стороны. Этот участок очень мал, и поместиться на нём может только одна молекула хозяйской РНК-полимеразы. Она пойдёт либо в одном, либо в другом направлении, и продукт первого же гена, который она прочитает, закрепит сделанный выбор: альтернативный промотор будет заблокирован, и вирусу придётся следовать выбранному пути, до тех пор пока условия внешней среды не заставят его пересмотреть своё решение.
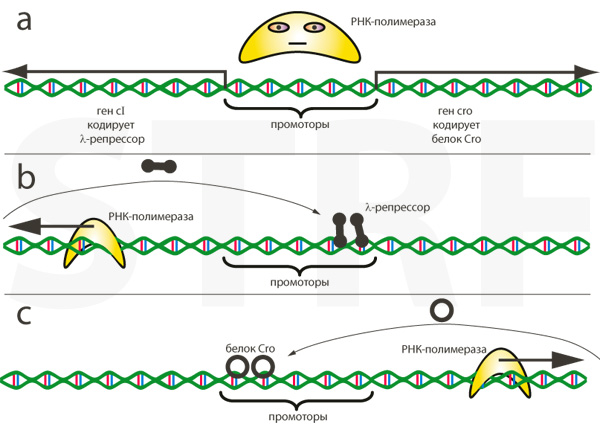
Рис. 4. С регуляторным участком ДНК бактериофага может связаться только одна РНК-полимераза. Если она будет двигаться влево, бактериофаг перейдёт в лизогенное состояние, а если вправо – он приступит к литическому размножению. В обоих случаях продукт первого гена заблокирует альтернативный промотор, и следующая РНК-полимераза будет вынуждена двигаться в том же направлении.
Многоклеточность: дополнительные трудности
Многоклеточный организм должен обладать ещё более совершенными механизмами регуляции транскрипции, чем одиночная клетка.
- Во-первых, необходимо интерпретировать большое количество сигналов и отвечать на них изменением активности самых разных генов – так решается проблема создания сотен типов разных клеток на базе одинакового для всех генома.
- Во-вторых, регуляция должна быть надёжной: ошибка в истолковании сигналов единственной клеткой может привести к проблемам для всего организма.
- В-третьих, система должна быть гибкой, чтобы оставалась возможность изменений и перенастройки как в ходе индивидуального развития, так и в ходе эволюции.
На самом деле все фундаментальные принципы регуляции работы генов многоклеточные унаследовали от общего с E. coli предка:
клетка получает сигналы, переводит их на понятный для ДНК язык и повышает (или снижает) вероятность того, что конкретный ген будет прочитан РНК-полимеразой.
Гормон взаимодействует с рецептором, фермент – с субстратом, транскрипционный фактор – с ДНК, и всё это называется жизнью. Разница между клетками высших организмов и бактерий количественная: наши клетки крупнее и сложнее, и разнообразных репрессоров и активаторов транскрипции генов в них намного больше. У всех эукариотических организмов, даже одноклеточных, в регуляции транскрипции какого-либо гена задействовано так много факторов, что они физически неспособны все вместе вступить в прямой контакт с РНК-полимеразой и передать ей свои сигналы. Поэтому эукариоты обзавелись очень крупным белковым комплексом, который гордо называется Медиатором с большой буквы. Он одновременно взаимодействует со всеми факторами транскрипции, суммирует полученную от них информацию (нередко противоречивую), а затем привлекает РНК-полимеразу к тому или иному промотору.
Система регуляции работы генов очень надёжна: мы все живы и здоровы только благодаря тому, что наши гены работают там и тогда, когда это нужно организму. Однако редкие нарушения этого процесса – изменения комбинаций транскрипционных факторов, задействованных во включении или выключении отдельных важных генов, – могут быть ответственны за то, что мы вообще есть.
| Энтеробактерии фага λ | |
|---|---|
 | |
| Лизис бляшки фага лямбда на E.coli , бактерии | |
| классификация Вирус | |
| Группа: | |