Жидкость в печени при гепатите

Цирроз печени (ЦП), осложненный портальной гипертензией (ПГ), нередко развивается на фоне вирусного гепатита С (HCV). Он является одной из актуальных медико-социальных проблем современной гепатологии. Способность возбудителя оказывать прямое цитопатическое действие на гепатоциты, его репликация в моноцитах и макрофагах часто приводят к развитию первично-хронического течения гепатита, трансформации в цирроз и первичную гепатокарциному и является причиной развития стойкой иммунной недостаточности [13,16,20,21,22]. Длительная вирусная инфекция (гепатит С) приводит к истощению иммунных механизмов, в частности к дефициту и истощению функций Th1 лимфоцитов, ответственных за выработку интерлейкина-2 [4,18,20,21]. Отмеченная особенность наиболее важна при хронической и тяжело протекающей патологии, когда применение традиционных иммуномодуляторов или синтетических индукторов синтеза цитокинов бессмысленно из-за истощения компенсаторных возможностей иммунной системы при необходимости дальнейшей хирургической коррекции внутрипеченочной ПГ [2,5,6,7,11,14,15,19]. Также нельзя не учитывать у данной категории пациентов явлений эндотоксемии, ишемию кишечника с микробной транслокацией, фармакологический анамнез и инвазивные манипуляции – как последовательность событий в формировании системного воспалительного ответа [1,3,8,12].
Появление синдрома портальной гипертензии (ПГ) имеет чрезвычайно важное значение в течение заболевания. Являясь приспособительным явлением в начале заболевания, ПГ с прогрессированием процесса приобретает роль ведущего патогенетического клинического фактора [23].
Асцит, рефрактерный к медикаментозным мероприятиям, встречается примерно у 10 % больных с ЦП [9]. С момента появления асцита у пациентов летальность составляет 42–70 % в течение года [17].
В ряде исследований последнего десятилетия установлена роль и значение гипопротеинемии как одного из основных факторов неблагоприятного исхода хирургического лечения больных с синдромом портальной гипертензии [10].
Наличие свободной жидкости в животе на фоне цирроза печени нередко сопровождается ее инфицированием – спонтанным бактериальным перитонитом. За последние годы частота этого осложнения значительно возросла и достигла 12–21 % [24,25].
Целью работы является улучшение результатов лечения пациентов с вирус-ассоциированнымHCV циррозом печени путём ликвидации гипо- и диспротеинемии, а также необходимостью предотвращения инфекционных осложнений и опасности развития генерализованной инфекции с проведением опережающего лечения, а именно – раннего применения интерлейкина-2 человеческого рекомбинантного при дальнейшей хирургической коррекции внутрипеченочной портальной гипертензии одним из известных способов.
Материалы и методы. В клинике хирургии Ростовского государственного медицинского университета с 1997 года пролечен 341 пациент с портальной гипертензией. Внутрипеченочная форма ПГ была у 297 (87,1 %) больных и у 2 (0,6 %) пациентов носила смешанный характер (внутрипеченочный и надпеченочный).
Из 299 больных внутрипеченочной ПГ у 287 был выявлен цирроз печени (у 227 из них в анамнезе выявлен вирусный гепатит), у 6 пациентов выявлена альфа-1-антитрипсиновая недостаточность, у одного редко встречающаяся гепатоцеребральная дистрофия (болезнь Вильсона – Коновалова), приведшие к развитию фиброза печени, у ребенка 8 лет ПГ развилась, как осложнение врожденного фиброза печени. У одного пациента регенеративный узел печени вызвал ПГ. Трем пациентам был поставлен диагноз полинодулярной трансформации печени. У двоих из них ПГ носила смешанный характер за счет гипоплазии нижней полой вены в области впадения печеночных вен с деформацией и стенозом их устьев в одном случае и сдавления печеночных вен и нижней полой вены в другом.
Из 297 пациентов с внутрипеченочной ПГ было выполнено 79 операций спленоренального венозного шунтирования (СВШ) и 128 операций трансъюгулярного внутрипеченочного портосистемного шунтирования (ТВПШ). Помимо этого больным выполнялся лапароцентез с реинфузией концентрата асцитической жидкости (38).
Из 207 пациентов, которым выполнялась коррекция ПГ одним из вышеуказанных способов, у 79 (38,2 %) вирусный гепатит не был выявлен. У 9 (4,3 %) в анамнезе присутствовал вирусный гепатит А, у 26 (12,6 %) – вирусный гепатит В, у 75 (36,2 %) – вирусный гепатит С, различное сочетание двух или трех вирусных гепатитов было у 18 (8,7 %) больных. Подробная характеристика представлена на рис.1.
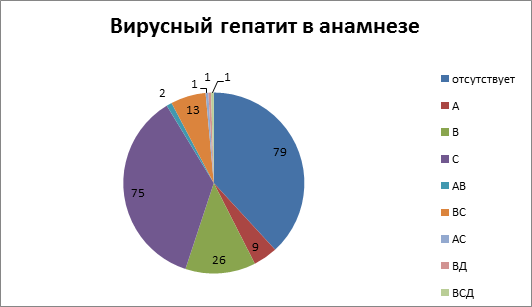
Рис.1. Этиология цирроза печени
Таким образом, вирус-ассоциированный цирроз печени присутствовал у 119 (67,5 %) больных, из них хронический вирусный гепатит С был выявлен у 89 (43,0 %) пациентов.
Сущность метода заключается в том, что внутривенно со скоростью перфузии 60 капель в минуту вводят 500 мл приготовленного концентрата асцитической жидкости с добавлением в него интерлейкина-2 человеческого рекомбинантного в дозе 500 МЕ, при необходимости оставшуюся часть концентрата вводят дробно по 500 мл интраоперационно и в первые сутки после хирургического лечения.
Результаты. 12 пациентам с вирус-ассоцированнымHCV циррозом печени и признаками иммунной недостаточности по клеточному типу с дефицитом CD3⁺- и CD4⁺-позитивных лимфоцитов, снижением содержания CD4⁺CD25⁺-лимфоцитов и NK-клеток, дисиммуноглобулинемией в предоперационном периоде была выполнена реинфузия концентрата асцитической жидкости по ранее заявленной методике.
Состав асцитической жидкости был исследован кроме данной группы еще у 26 больных с ЦП, всего у 38 пациентов. При биохимическом исследовании определялось содержание общего белка и белковых фракций, мочевины, креатинина и билирубина. Количество общего белка в асцитической жидкости составляло от 17,6 до 42,8 г/л (28,2±9,6 г/л). Низкое его содержание было у больных, которым ранее неоднократно выполнялся лапароцентез. Содержание альбумина в процентах составило 49,4±5,3, α-глобулина –14,1±2,4, β-глобулина – 13,4±1,9, γ-глобулина – 24,5±3,6, средние молекулы были в пределах 0,386±0,045 у.е.
В среднем показатели цитоза составляли 297±174 клеток в 1 мм3. Основную часть клеток при микроскопии осадка составляли лимфоциты (69 %), меньшую – сегментоядерные нейтрофилы (10 %), моноциты (2 %), макрофаги (2 %), мезотелиальные клетки (6 %), а также мононуклеары (11 %).
После ультрафильтрации объем асцитической жидкости уменьшался от 5 до 10 раз, содержание общего белка возрастало до 49,3±18,4 г/л. Фракция альбумина повышалась до 52,2±6,8 %, а количество γ-глобулина снижалось.
После выполнения реинфузии концентрата асцитической жидкости показатели общего белка плазмы крови составили 52,4±9,3 г/л до переливания и 58,8±8,4 г/л после, % содержание альбумина - 41,7±14,4 и 47,2±6,4 соответственно. Процент содержания гамма-глобулина – 32,6±7,5 до переливания и 28,4±5,4 после переливания. Коэффициент (отношение альбуминов к глобулинам) составил 0,62±0,04 и 1,1±0,03 соответственно.
После выполнения реинфузии перед операцией спленоренального венозного шунтирования (8) или трансъюгулярного внутрипеченочного портоситемного шунтирования (4) ни одному из 12 пациентов не понадобилось дополнительное введение альбумина, не было выявлено признаков гнойных осложнений, послеоперационные раны в 8 наблюдениях после СВШ зажили первичным натяжением, стабилизировались показатели биохимического анализа крови (табл.1).
Изменения показателей крови больных ЦП до и после лечения
Асцит является следствием цирроза печени в 75%; злокачественных новообразований - в 10%; сердечной недостаточности в 5% случаев.
В клинической картине у пациентов отмечается вздутие живота и прогрессирующее нарастание веса.
Диагноз основывается на результатах физикального и визуализирующих (рентгенологических, ультразвуковых) методов исследования.
Лечение заключается в назначении бессолевой диеты, диуретиков. Больным может производиться терапевтический лапароцентез, выполняются хирургические вмешательства. Пациенты с асцитом - кандидаты на трансплантацию печени.
Наиболее частым осложнением асцита является спонтанный бактериальный перитонит . Он возникает при инфицировании асцитической жидкости, которое в 90% случаев происходит спонтанно. У больных появляются боли в животе, повышается температура тела.
Для диагностики этого осложнения производится исследование асцитической жидкости. Для лечения спонтанного бактериального перитонита назначаются антибактериальные препараты.
Асцит, который не может быть устранен, или ранний рецидив которого не может быть адекватно предотвращен лечением.
- Асцит, резистентный к диуретикам: асцит, рефрактерный к диете с ограничением натрия и интенсивной терапии диуретиками ( спиронолактон 400 мг/день, фуросемид 160 мг/день в течение не менее 1 недели; диета с ограничением поваренной соли менее 5,2 г/день).
- Асцит, не контролированный диуретиками: асцит, рефрактерный к терапии из-за развития вызванных диуретиками осложнений, которые препятствуют применению эффективных дозировок диуретиков.
Примерно у половины пациентов с циррозом печени асцит развивается в течение 10 лет от начала заболевания. Он обусловлен нарушениями почечной функции, портального и висцерального кровообращения.
Примерно 50% пациентов с цирротическим асцитом умирают в течение 2 лет от начала заболевания. Показатели однолетней выживаемости у больных с асцитом, резистентным к терапии, составляют 50%.
У здоровых мужчин внутриперитонеальная жидкость обнаруживается в меньших количествах, чем у женщин, у которых ее объем составляет примерно 20 мл (в зависимости от фазы менструального цикла). При асците этот объем значительно увеличивается.
Частота возникновения спонтанного бактериального перитонита составляет 15-20%.
Непеченочными причинами асцита могут быть: заболевания сердца ( сердечная недостаточность , констриктивный перикардит), злокачественные новообразования (карциноматоз, псевдомиксома брюшины), заболевания брюшины (инфекционный перитонит), выраженная гипоальбуминемия (нефротический синдром), другие болезни (опухоли и кисты яичников, панкреатит , саркоидоз , системная красная волчанка, микседема).
Факторы риска возникновения асцита:
- Факторы риска при отсутствии патологических процессов в брюшине.
- Портальная гипертензия (градиент концентрации альбумина сыворотка-асцит ≥11 г/л).
- Цирроз печени .
- Алкогольный гепатит.
- Фулминантная печеночная недостаточность.
- Метастазы в печень .
- Хроническая сердечная недостаточность .
- Констриктивный перикардит .
- Синдром Бадда-Киари .
- Обструкция нижней полой вены.
- Гипоальбуминемия (градиент концентрации альбумина сыворотка-асцит 11г/л) и другими причинами (градиент концентрации альбумина сыворотка-асцит 225 мЕ/мл (или выше верхней границы нормы для сыворотки крови).
Клинически различают две формы рефрактерного асцита:
- Асцит с ежедневной потерей менее чем 200 г массы тела (несмотря на ограничения натрия) и прием 400 мг спиронолактона (Верошпирон) или 30 мг амилорида (Амипразид, Арумил, Мидамор), а также 160 мг фуросемида (Лазикс) в течение 2 недель.
- Асцит, который невозможно контролировать; рецидивирующий асцит, обострения которого невозможно предупредить, назначая диуретики в дозах, не вызывающих побочных явлений.
- Основные диагностические критерии гепаторенального синдрома:
- Гепаторенальный синдром развивается у пациентов с хроническими или острыми заболеваниями печени, выраженной печеночной недостаточностью, портальной гипертензией и асцитом.
- Существуют два варианта течения гепаторенального синдрома.
- Синдром первого типа характеризуется прогрессирующим течением: быстрым нарастанием симптомов почечной недостаточности. Диагностика синдрома первого типа производится на основании увеличения почти вдвое содержания сывороточного креатинина (более чем 1,5 мг/дл) или 50%-ным снижением суточного клиренса креатинина (менее 40 мл/мин) в течение 2 недель. Пациенты с синдромом первого типа нуждаются в трансплантации печени. В противном случае синдром заканчивается летально у 90% больных.
- Для синдрома второго типа характерно медленно прогрессирующее течение.
- Отсутствие шока, текущей бактериальной инфекции, данных о приеме нефротоксических препаратов, отсутствие диареи и рвоты, потери жидкости с почками (снижение веса более чем на 500 г в течение нескольких дней у пациентов с асцитом без периферических отеков и более 1 кг/сут у больных с периферическими отеками).
- Отсутствие улучшения почечной функции (сохранение уровня сывороточного креатинина более чем 1,5 мг/дл и суточного клиренса креатинина менее 40 мл/мин) после назначения диуретиков и увеличения объема плазмы за счет введения 1,5 л изотонического раствора.
- Протеинурия менее 500 мг/дл и отсутствие ультразвуковых признаков поражения почечной паренхимы или обструктивной уропатии.
- Дополнительные диагностические критерии гепаторенального синдрома:
- Объем суточной мочи менее 500 мл/сут.
- Концентрация натрия в моче менее 10 мЭкв/л.
- Осмолярность мочи выше, чем осмолярность крови.
- Концентрация натрия в сыворотке крови менее 130 мЭкв/л.
- Количество эритроцитов в моче более 50 в поле зрения.
- Цели лечения
- Улучшение самочувствия.
- Устранение причин асцита.
- Повышение качества жизни.
Постельный режим и ограничение потребления натрия являются эффективными терапевтическими мероприятиями у 10% пациентов с асцитом.
Ограничения в диете и лечение диуретиками оказывают терапевтический эффект у 90% пациентов с асцитом. При отсутствии эффекта или при выраженном асците необходимо стационарное лечение.
Больные с асцитом, не получающие диуретиков, ежедневно экскретируют почками примерно 20 ммоль/сут натрия.
Отрицательный баланс натрия может быть достигнут благодаря ограничению потребления натрия с пищей до 22 ммоль/сут, что затруднительно для больных. Как правило, удается поддерживать количество натрия в пище в количестве 44 ммоль/сут.
В пищевом рационе пациентов с асцитом должны содержаться низкие количества соли (1-1,5 г/сут или 40-60 ммоль/сут).
Ограничения объемов потребления жидкости (до 1 л/сут) показаны больным с цирротическим асцитом при условии гипонатриемии (содержание натрия в сыворотке крови
Асцит, или брюшная водянка, нередко является следствием другого, более опасного и сложного в лечении заболевания. Тем не менее и сам по себе асцит способен осложнить жизнь больному и привести к печальным последствиям. Современной медициной разработаны достаточно эффективные методы лечения асцита на разных его стадиях. Что нужно знать о первых признаках асцита, ходе его развития и к какому врачу обратиться за помощью?
![]()
Асцит как частый спутник опасных заболеваний
Под асцитом в медицине понимают вторичное патологическое состояние, для которого характерно скопление жидкости в брюшной полости. Чаще всего асцит вызывается нарушением регуляции обмена жидкости в организме в результате серьезных патологических состояний.
В здоровом организме в брюшной полости всегда находится немного жидкости, при этом она не скапливается, а всасывается лимфатическими капиллярами. При различных заболеваниях внутренних органов и систем увеличивается скорость образования жидкости и снижается скорость ее всасывания. При развитии асцита жидкости становится все больше, она начинает сдавливать жизненно важные органы. Это способствует усугублению развития основного заболевания и прогрессированию асцита. Кроме этого, поскольку основная часть жидкости скапливается в брюшной полости, происходит значительное уменьшение объема циркулирующей крови. Это приводит к запуску компенсаторных механизмов, задерживающих в организме воду. У больного существенно замедляется скорость образования мочи и ее выделения, при этом количество асцитической жидкости увеличивается.
Накопление жидкости в полости живота обычно сопровождается повышением внутрибрюшного давления, нарушением кровообращения и сердечной деятельности. В некоторых случаях возникают потеря белка и электролитные нарушения, вызывающие сердечную и дыхательную недостаточность, что значительно ухудшает прогноз основного заболевания.
В медицине выделяют три основных стадии развития асцита.
- Транзиторный асцит. На этой стадии в брюшной полости скапливается не более 400 мл жидкости. Выявить заболевание можно только при помощи специальных исследований. Функции органов не нарушены. Снятие симптомов асцита возможно с помощью терапии основного заболевания.
- Умеренный асцит. В брюшной полости на этой стадии скапливается до 4 л жидкости. Наблюдается увеличение живота у пациента. В положении стоя можно заметить выпирание нижней части брюшной стенки. В положении лежа больной нередко жалуется на одышку. Наличие жидкости определяется с помощью перкуссии (простукивания) или симптома флюктуации (колебания противоположной стенки живота при простукивании).
- Напряженный асцит. Количество жидкости на этой стадии может достигать, а в некоторых случаях даже превышать, 10–15 л. Давление в брюшной полости повышается и нарушает нормальную работу жизненно важных органов. Состояние пациента при этом тяжелое, его необходимо срочно госпитализировать.
Отдельно рассматривают рефрактерный асцит, практически не поддающийся лечению. Его диагностируют в том случае, если все виды проводимой терапии не дают результата и количество жидкости не только не уменьшается, но и постоянно увеличивается. Прогноз при таком виде асцита неблагоприятный.
По статистике основными причинами возникновения асцита брюшной полости являются:
- болезни печени (70%);
- онкологические заболевания (10%);
- сердечная недостаточность (5%).
Кроме того, асцитом могут сопровождаться следующие заболевания:
- болезни почек;
- туберкулезное поражение брюшины;
- гинекологические заболевания;
- эндокринные нарушения;
- ревматизм, ревматоидный артрит;
- красная волчанка;
- сахарный диабет второго типа;
- уремия;
- болезни пищеварительной системы;
- перитониты неинфекционной этиологии;
- нарушение оттока лимфы из брюшной полости.
Возникновению асцита, кроме указанных заболеваний, могут способствовать следующие факторы:
- злоупотребление спиртным, ведущее к циррозу печени;
- инъекции наркотических препаратов;
- переливание крови;
- ожирение;
- высокий уровень холестерина;
- татуаж;
- проживание в регионе, для которого характерны случаи возникновения вирусных гепатитов.
Во всех случаях в основе возникновения асцита лежит сложное сочетание нарушений жизненно важных функций организма, ведущее к скоплению жидкости в брюшной полости.
В животе появляются боли и чувство распирания изнутри. Человек испытывает трудности при наклонах туловища. К внешним проявлениям также относятся отеки ног, рук, лица, цианоз кожных покровов. У больного развивается дыхательная недостаточность, тахикардия. Возможно появление запоров, тошнота, отрыжка и потеря аппетита.
При лабораторных и инструментальных исследованиях врач подтверждает диагноз и устанавливает причину, вызвавшую асцит. Для этого проводятся УЗИ, МРТ, диагностический лапароцентез и лабораторные исследования. С помощью УЗИ выявляют наличие свободной жидкости в брюшной полости и ее объем, увеличение печени и селезенки, расширение полой и воротной вены, нарушение структуры почек, наличие опухолей и метастазов.
МРТ позволяет послойно изучить ту или иную ткань, выявить даже незначительное количество асцитической жидкости и диагностировать основное заболевание, вызвавшее асцит.
Кроме этого, врач проводит исследование при помощи пальпации и перкуссии. Пальпация помогает выявить признаки, указывающие на поражение определенного органа (печени или селезенки). Перкуссия используется непосредственно для выявления асцита. Суть ее заключается в простукивании брюшной полости пациента и анализе перкуторных звуков. При выраженном асците, например, тупой перкуторный звук определяется над всей поверхностью живота.
Лабораторные исследования крови показывают снижение концентрации эритроцитов, увеличение количества лейкоцитов и СОЭ, возможно повышение концентрации билирубина (при циррозе печени), белков острой фазы воспаления. Анализ мочи при асците на начальной стадии может показывать большее количество мочи меньшей плотности, поскольку асцит вызывает отклонения в работе мочевыделительной системы. При терминальной стадии плотность мочи может быть нормальной, но ее общее количество значительно снижается.
Общие принципы лечения асцита предполагают прежде всего терапию основного заболевания. Лечение самого асцита направлено на выведение жидкости из брюшной полости и предотвращение рецидивов.
Пациенты с первой степенью асцита не нуждаются в медикаментозном лечении и соблюдении бессолевой диеты.
Пациентам со второй степенью асцита назначается диета с пониженным содержанием натрия и диуретическая терапия. Она должна проводиться при постоянном мониторинге состояния больного, включая содержания электролитов в сыворотке крови.
Пациенты с третьей степенью заболевания проводят удаление жидкости из брюшной полости, а в дальнейшем диуретическую терапию в сочетании с бессолевой диетой.
Асцит обычно указывает на серьезные нарушения в работе пораженных органов, но тем не менее смертельным осложнением сам он не является. При своевременной диагностике и правильном лечении возможна полная ликвидация асцитической жидкости из брюшной полости и восстановление функций пораженного органа. В ряде случаев, например при раке, асцит способен быстро прогрессировать, вызывая осложнения и даже гибель пациента. Это объясняется тем, что на течение асцита большое влияние оказывает основное заболевание, способное вызывать серьезные поражения печени, почек, сердца и других органов.
На прогноз влияют и другие факторы:
- Степень асцита. Транзиторный асцит (первой степени) не является непосредственной угрозой жизни пациента. В этом случае все внимание следует уделить терапии основной болезни.
- Время начала лечения. При выявлении асцита на той стадии, когда жизненно важные органы еще на разрушены или их функции поражены незначительно, устранение основного заболевания также может привести к полному выздоровлению пациента.
На статистику выживаемости при асците также влияет вид и тяжесть основного заболевания. При компенсированном циррозе печени 50% больных способны прожить от 7 до 10 лет, а при декомпенсированном — пятилетняя выживаемость не превышает 20%.
При онкологических заболеваниях асцит, как правило, появляется на поздних стадиях, и пятилетняя выживаемость составляет не более 50% при своевременном лечении. Средний показатель жизни у таких больных составляет 1–2 года.
При неправильном лечении асцит может вызвать серьезные осложнения, ухудшающие прогноз:
- кровотечение;
- перитонит;
- отек мозга;
- дисфункцию сердечной деятельности;
- тяжелую дыхательную недостаточность.
Рецидивы асцита также могут возникать как побочные эффекты при неправильном лечении. Рецидивирование очень опасно, поскольку в большинстве случаев не поддающиеся излечению асциты приводят к летальному исходу.
Консервативное или симптоматическое лечение асцита применятся в тех случаях, когда асцит брюшной полости находится на ранней стадии развития или в качестве паллиативной терапии при онкологии и нецелесообразности применения других методов.
Во всех случаях основной задачей лечения является выведение асцитической жидкости и поддержание состояние пациента на определенном уровне. Для этого необходимо уменьшить количество поступающего в организм натрия и усилить его выведение с мочой.
Достичь положительных результатов можно только при комплексном подходе, соблюдая диету, контролируя изменения веса и принимая диуретические препараты.
Главные принципы диеты при асците следующие:
- Минимум соли. Ее избыточное потребление приводит к развитию отеков, а следовательно, асцита. Пациентам рекомендуется максимально ограничить прием соленой пищи.
- Минимум жидкости. При умеренном или напряженном асците нормой должно быть не более 500–1000 мл жидкости в чистом виде в сутки.
- Минимум жиров. Потребление пищи с большим количеством жиров приводит к развитию панкреатита.
- Достаточное количество белков в рационе. Именно белковая недостаточность может привести к возникновению отеков.
Рекомендуется употреблять в пищу нежирные сорта мяса и рыбы, обезжиренный творог и кефир, фрукты, овощи, зелень, пшеничную крупу, компоты, кисели. Готовить лучше на пару или запекая в духовке.
Запрещены жирное мясо и рыба, жареные блюда, копчености, соль, алкоголь, чай, кофе, специи.
При лечении асцита необходимо контролировать динамику веса. При начале бессолевой диеты в течение недели производится ежедневное взвешивание. Если пациент потерял более 2 кг, то диуретические препараты ему не назначаются. При потере веса менее 2 кг в течение следующей недели начинают медикаментозную терапию.
Мочегонные препараты помогают вывести лишнюю жидкость из организма и способствуют переходу части жидкости из брюшной полости в кровеносное русло. Клинические проявления асцита при этом существенно снижаются. Основными препаратами, используемыми в терапии, являются фуросемид, маннитол и спиронолактон. В амбулаторных условиях фуросемид назначается внутривенно не более 20 мг 1 раз в два дня. Он выводит жидкость из сосудистого русла через почки. Основной недостаток фуросемида — чрезмерное выведение калия из организма.
Маннитол применяется совместно с фуросемидом, поскольку их действие комбинируется. Маннитол выводит жидкость из межклеточного пространства в сосудистое русло. Назначается по 200 мг внутривенно. Однако в амбулаторных условиях его применять не рекомендуется.
Спиронолактон также является мочегонным средством, однако он способен предотвращать чрезмерное выведение калия.
Оперативное вмешательство при асците показано в тех случаях, когда скопление жидкости не может быть устранено при помощи консервативного лечения.
Лечебный лапароцентез при асците (прокол передней брюшной стенки) способен вывести большие объемы жидкости — от 6 до 10 литров за один раз. Проводят процедуру под местным обезболиванием с предварительным опустошением мочевого пузыря. Пациент принимает полусидячее или лежачее положение. Прокол производится по средней линии живота между пупком и лобковой костью. Скальпелем выполняется разрез кожи, через который в брюшную полость вводится специальный инструмент — троакар. Через него выводится жидкость в нужном объеме. После процедуры рану ушивают. Лапароцентез при асците можно выполнять только в условиях стационара, поскольку необходимо соблюдение норм антисептики и владение методикой проведения операции. Чтобы упростить процедуру для тех больных, которым лапароцентез требуется периодически, его проводят через постоянный перитонеальный порт.
Еще одной эффективной хирургической манипуляцией является оментогепатофренопексия. Она заключается в подшивании сальника к предварительно обработанным участкам поверхности диафрагмы и печени. Благодаря возникновению контакта между печенью и сальником появляется возможность всасывания асцитической жидкости соседними тканями. Дополнительно снижается давление в венозной системе и выход жидкости в брюшную полость через стенки сосудов.
ТИПС — трансъюгулярное интрапеченочное портосистемное шунтирование — позволяет провести декомпрессию портальной системы и устранить асцитический синдром. В основном ТИПС проводится при рефрактерном асците, не поддающемся медикаментозной терапии. При процедуре ТИПС в яремную вену вводится проводник до попадания в печеночную вену. Затем по проводнику специальный катетер проводится в саму печень. При помощи длинной изогнутой иглы в воротной вене устанавливается стент, создающий канал между воротной и печеночной венами. Кровь направляется в печеночную вену со сниженным давлением, что приводит к устранению портальной гипертензии. После выполнения ТИПС у пациентов с рефрактерным асцитом наблюдается уменьшение объема жидкости в 58% случаев.
Несмотря на то, что асцит и вызывающие его болезни являются достаточно серьезными и сложно поддающимися лечению, своевременная комплексная терапия может значительно повысить шансы на выздоровление или улучшить качество жизни неизлечимых больных. Лечить асцит нужно только под наблюдением врача, поскольку сложность основного заболевания редко позволяет обойтись домашними или народными методами. Особенно это касается асцитов, вызванных онкологией.
Асцит
АСЦИТ – патологическое накопление жидкости в брюшной полости. В клинической практике чаще всего встречается асцит, обусловленный портальной гипертензией при циррозе печени; дифференциальный диагноз проводят с асцитом, развивающимся при сердечной недостаточности, метастатическим поражением брюшины, асциты другой этиологии встречаются значительно реже.
![]()
![]()
Гален – римский
врач и философСостояния, сопровождающиеся появлением асцита, интересовали наших предков с древних времен. Первым проблему асцита изучил Эразистрат (греч. Erasistratos, ок. 300 – ок. 240 гг. до н. э.) - придворный врачеватель правителя Сирийского царства Селевка I. Эразистрат считал, что все части организма связаны между собой системой нервов, вен и артерий; причем полагал, что в венах течет кровь (питательная субстанция), которая формируется из пищи, а в артериях – жизненная пневма, которая в легких контактирует с кровью.
![]()
Больной с асцитом. Фредерик Деккер (1644-1720)Таблица 1. Наиболее частые причины развития асцита.
Нозологические формы и синдромы
- цирроз печени с развитием синдрома портальной гипертензии;
- метастатическое поражение печени;
- гепатоцеллюлярная карцинома
Болезни сердечно-сосудистой системы
- застойная сердечная недостаточность;
- констриктивный перикардит
Первичные болезни брюшины
Таблица 2. Классификация асцита.
Принцип классификации Варианты асцита По количеству жидкости - I степени: асцитическая жидкость определяется только при УЗИ;
- II степени: умеренный с симметричным растяжением живота;
- III степени: большой или напряженный, с заметным растяжением брюшной стенкиПо инфицированности содержимого - стерильный;
- инфицированный (в частности, бактериальный перитонит)По характеру жидкости - экссудат, транссудат,
- геморрагический, хилезный и др.По ответу на терапию диуретиками - поддающийся лекарственной терапии,
- рефрактерный![]()
Таблица 3. Оценка жалоб у больного с асцитом.
Вопрос Клиническая значимость ответа Основные жалобы пациента Увеличение живота в объеме, дискомфорт или тупая боль в животе, особенно в боковых его отделах, отсутствие аппетита, тошнота, изжога, быстрое насыщение во время еды и др. Есть ли одышка, когда она появилась? Одышка может быть следствием высокого стояния диафрагмы и ограничения ее подвижности при напряженном асците или сердечной недостаточности, явившейся причиной возникновения асцита. При сердечной недостаточности одышка и приступы удушья в горизонтальном положении предшествуют увеличению живота в объеме, при циррозе печени одышка появляется после формирования асцита. Есть ли отеки, когда они появились? Вероятность асцита в отсутствии отека лодыжек очень невелика. Асцит при сердечной недостаточности всегда появляется позднее, чем отеки нижних конечностей, при нефротическом синдроме – одновременно с развитием анасарки, при циррозе печени – предшествует появлению отеков ног. Асцит сам по себе может способствовать появлению отеков ног за счет сдавления нижней полой вены. Насколько стабильна масса пациента? Накопление жидкости обычно сопровождается увеличением массы тела. Потеря массы тела у молодого пациента с изолированным асцитом требует исключения туберкулезного перитонита, у пожилого больного – онкозаболевания. Таблица 4. Оценка анамнестических данных у пациента с асцитом
Читайте также:
- Не можем победить ротавирус
- Во рту на небе вирусная инфекция
- Убивает ли кипячение вирус герпеса
- Как создают лекарства от вирусов
- Вирус гриппа в каждом человеке
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
- Портальная гипертензия (градиент концентрации альбумина сыворотка-асцит ≥11 г/л).






