Выделение вирусов из клетки
1. Выделение и идентификация респираторных вирусов
Частота выделения респираторных вирусов зависит от сроков взятия материалов от больных, условий их хранения, доставки и времени первичной обработки. Решающее значение имеет ассортимент и качество клеточных культур и куриных эмбрионов, на которых проводят изоляцию вирусов.
Рекомендуемый состав культур для изоляции вирусов гриппа и ОРЗ:
1) первичная культура клеток почек эмбриона человека (ПЭЧ);
2) перевиваемые культуры клеток МДСК, Неla (или HEp2);
3) фибробласты легкого эмбриона человека (ЛЭЧ).
Материалом для выделения вирусов служат отделяемое носа, зева, конъюнктивы, а также секционный материал (ткани легкого, кусочки бронхов и др.).
Материал отбирают с помощью стерильного тампона, который погружают затем в пробирки с 5,0 мл среды Игла или среды 199 с антибиотиками и немедленно направляют в лабораторию, где тампоны с вирусным материалом отжимают в среду, материал центрифугируют в течение 20 мин при 2000-3000 об/мин и температуре 4°С или используют в неосветленном виде.
Кусочки секционного материала растирают в фарфоровой ступке со стеклянным песком, добавляют 10-кратное количество раствора Хенкса, взвесь ресуспендируют, после чего осветляют центрифугированием. Надосадочную жидкость используют для заражения куриных эмбрионов или тканевых культур.
1.1. Изоляция и идентификация вирусов
Для выделения вирусов гриппа исследуемые материалы после их первичной обработки вводят по 0,1 мл в амниотическую полость и по 0,2 мл в аллантоисную полость 10-дневных куриных эмбрионов.
Заражение проводят в затемненном боксе через боковую поверхность скорлупы, направляя иглу сначала в амниотическую, а затем в аллантоисную полости, предварительно сделав дополнительный прокол в скорлупе над воздушной камерой. Материалом от одного больного заражают 3 эмбриона.
Зараженные эмбрионы инкубируют в термостате 72 часа при 33-34°С. После инкубации эмбрионы помещают на ночь в рефрижератор при 4°С.
Индикацию вируса гриппа осуществляют в реакции гемагглютинации (РГА) путем добавления 0,5 мл 1% суспензии отмытых эритроцитов кур к 0,5 мл вируссодержащего материала. Результаты РГА учитывают после 30-минутного оседания эритроцитов в лунках панелей при комнатной температуре.
При отсутствии агглютинации эритроцитов необходимо провести 3 дополнительных пассажа путем заражения эмбрионов смесью амниотической и аллантоисной жидкостей от предыдущего пассажа. В случае отрицательных результатов РГА после 3-х пассажей исследование материалов прекращают.
Идентификацию вирусов гриппа проводят в РТГА.
Для этого к 0,2 мл последовательных разведений типоспецифических иммунных сывороток добавляют по 0,2 мл рабочей дозы вируса в количестве 4 гемагглютинирующих единиц (ГЕ). Одной ГЕ считают последнее разведение вируса, дающее отчетливую гемагглютинацию. После 1-часового контакта сыворотки с вирусом при комнатной температуре в каждую лунку добавляют по 0,4 мл 1% взвести куриных эритроцитов. Титром сывороток считают ее последнее разведение, блокирующее 4 ГЕ вируса.
Типовую принадлежность вируса определяют по ингибиции гемагглютинации, которая должна быть зарегистрирована в разведении не менее, чем 1:20.
Выделение вирусов гриппа может быть осуществлено на чувствительных культурах клеток, чаще всего МДСК. Для этого в пробирки монослоем, отмытым физиологическим фосфатным буфером или раствором Хэнкса, вносят по 0,2 мл материала от больного. Через 1 ч адсорбции при 38 °С в культуры добавляют по 1,5 мл поддерживающей среды (199, Игла с антибиотиками) и помещают в термостат при 33°С.
Индикацию, типирование и дополнительные пассажи вирусов гриппа проводят как указано выше. Кроме того, инфицированные культуры 1 раз в день микроскопируют для оценки цитопатогенного действия вирусов.
Изоляцию аденовирусов, парагриппозных вирусов, РС-вируса, коронавирусов, вирусов герпеса и др. проводят на клеточных культурах (ПЭЧ, ЛЭЧ и Нер-2). Наиболее чувствительные культуры вносят по 0,2 мл материала от больного. Через 30-60 мин адсорбции вируса на клетках в культуры вносят по 0,8 мл поддерживающей среды Игла с антибиотиками (100 ед/мл пенициллина, 100 мкг/мл стрептомицина) и с 2% инактивированной фетальной сыворотки. Зараженные культуры инкубируют при температуре 36 °С до появления в них проявлений цитопатогенного действия (ЦПД).
Индикацию парагриппозных вирусов проводят по ЦПД и гемадсорбции с 0,4% взвесью эритроцитов морской свинки (20 мин при комнатной температуре), а остальных вирусов
- по характерному цитопатогенному действию.
Если при первичном заражении вирус не был выявлен ни в одном из тестов, материалы дополнительно пассируют еще 2 раза в тех же условиях.
Идентификацию вирусов ОРЗ проводят в чувствительных тканевых культурах с помощью реакции нейтрализации (РН) со специфическими иммунными сыворотками. Вируссодержащую культурную жидкость в дозе 100 ТИД50/0,2 мл в объеме 0,2 мл смешивают с 0,2 мл каждой из типоспецифических иммунных сывороток, взятых в разведении 1:20. Смесь вируса и сыворотки выдерживают 2 часа при комнатной температуре, после чего по 0,2 мл каждой смеси вносят в 2 пробирки с монослоем чувствительных клеток, а затем в пробирки добавляют по 0,8 мл поддерживающей среды. Инфицированные и контрольные культуры клеток инкубируют при температуре 36 °С. Параллельно типоспецифические сыворотки контролируют в отношении их активности к типовым эталонным штаммам.
Учет реакции проводят по ингибиции цитопатогенного действия (для аденовирусов, РС, простого герпеса), гемадсорбции (для парагриппозных вирусов) в день, когда типируемый вирус вызвал выраженное ЦПД клеток в контрольных культурах без сыворотки (при отсутствии дегенерации в контрольных посевах неинфицированных клеток и в контролях диагностических сывороток), в то время как эталонные штаммы полностью нейтрализованы типоспецифическими сыворотками. Тип выделенного штамма определяют по сыворотке, которая полностью предохранила клетки от дегенерации.
Вирусы являются внутриклеточными инфекционными агентами. Весь репликативный цикл вируса осуществляется с исполь зованием метаболических и генетических ресурсов клеток. Поэтому патогенез вирусных инфекций, в первую очередь, следует рассматривать на молекулярном и клеточном уровнях (В.И. Покровский, О.И. Киселев, 2002). Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Поэтому характер развития внутритканевых процес сов при вирусных инфекциях, с одной стороны, определяется, как правило, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты от вирусной инфекции. Последние не редко носят деструктивный характер и усугубляют течение забо левания и его последствия. Поэтому понимание патогенеза вирусных инфекций представляется исключительно важным для создания рациональных схем лечения, основанных на гармоничном сочетании симптоматического лечения и противовирусной химиотерапии.
Стадии репликативного цикла вируса гриппа представлены на рис. 1. Такой же репликативный цикл свойствен большинству РНК- и ДНК-содержащих вирусов, кроме тех, кото рые обладают особыми механизмами хронизации процесса, латенции и способностью к интеграции в клеточный геном (например, ВИЧ, гепатит С, вирус папилломы и.т.). Ключевыми стадиями репликативного цикла вируса являются проникновение в клетки, декапсидация, активация процессов транскрипции и трансляции, собственно репликация вирусного генома и созревание зрелых вирусных частиц с выходом нового потомства инфекционного вируса.
Проникновение вируса в клетки - одна из ключевых стадий патогенеза инфекционного процесса. Для большинства вирусов степень цитопатического действия вируса прямо зависит от множественности заражения. В естественных условиях инфицирова ние клеток вирусами не происходит обычно с высокой множе ственностью. Исключение составляют респираторные вирусы, которые передаются воздушно-капельным путем с высокой инфицирующей дозой. ВИЧ и гепатиты, наоборот, эффективно передаются с кровью в самых незначительных трудно определяе мых титрах. Такие вирусы имеют особые свойства, определяющие их контагиозность.
Для проникновения вируса в клетку, необходимо: высокое сродство к вирусоспецифическому рецептору; множественность рецепторов; эффективность слияния вируса с клетками при инфицировании; способность к образованию синцития, к образованию гигантских синпластов, состоящих из множества слившихся клеток, в которых вирусный нуклеопротеид без эндоцитоза беспрепятственно переходит от одной зараженной клетки к множеству других через цитоплазму.
Такими свойствами из респираторных вирусов обладает респираторно-синцитиальный вирус, а среди ретровирусов – вирус иммунодефицита человека.
Стадии жизненного цикла вируса гриппа и соответствующие ингибиторы репродукции в известной степени могут быть экстраполированы на многие другие вирусы, за исключением тех, жизненный цикл которых включает интеграцию в клеточный геном. В процессе репликации вирусов обычно происходит селективная блокада трансляции клеточных мРНК и активация экспресси клеточных генов, кодирующих провоспапительные лимфокины. Многократные раунды репликации вирусного генома приводят к истощению энер гетических ресурсов клеток и пула предшественников азотистых оснований. Повышенное содержание провоспалительных лимфокинов приводит к развитию воспалительной реакции и локально му генерированию свободных радикалов, оказывающих, в свою очередь, повреждающее действие на клетки и ткани через перекисное окисление липидов клеточных мембран, инактивацию жизненно важных ферментов. Поэтому одним из важнейших факторов патогенности вирусов является их репликативный потенциал: чем активнее происходит репликация, тем сильнее цитопатическое действие вирусов на клетки и пораженную ткань (орган).
Значительный вклад в цитопатическое действие вирусов вносит репродукция вирусов в митохондриях, что сопровождается нарушением функций этих органоидов, падением продукции АТФ и индукцией опосредованного митохондриями пути апоптоза.
Впервые возможность репродукции вирусов в митохондриях была доказана выдающимся отечественным вирусологом В.М. Ждановым. Узкий тропизм вирусов, в известной степени, спасителен для организма, так как инфекционный процесс ограничен одним органом.
Это обстоятельство позволяет, проводит рациональную симптоматическую терапию, направленную на защиту данной ткани или органа и ориентировать противовирусные средства в данный орган, например, легкие.
Возбудители гриппа относятся к семейству ортомиксовирусов (Orthomyxo-viridae) и являются пневмотропными вирусами. Схематическое строение вируса гриппа представлено на рис. 2.1. Геном вируса складывается из 8-ми фрагментов однонитчатой РНК, которые кодируют
10 вирусных белков. Фрагменты РНК имеют общую белковую оболочку, соединяющую их, образуя антигенно-стабильный рибонуклеопротеид (S-антиген), который определяет принадлежность вируса к серотипу А, В или С. Снаружи вирус покрыт двойным липидным слоем с внутренней стороны которого находится слой мембранного белка.
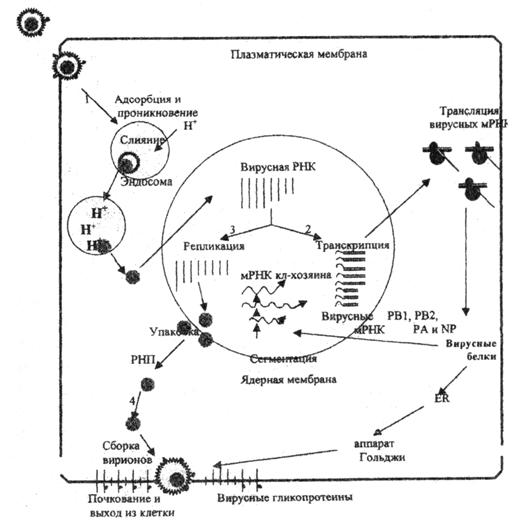
Рис. 1. Репликативный цикл вируса гриппа (В.И.Покровский, О.И.Киселев, 2002)
Представлены 4 основные фазы репликативного цикла вируса гриппа: 1 – адсорбция и проникновение вируса в клетку хозяина; 2 – транскрипция вирусной РНК и трансляция вирусных белков; 3 – репликация вирусной РНК и 4 – самосборка вирионов и последующий выход их из клетки.
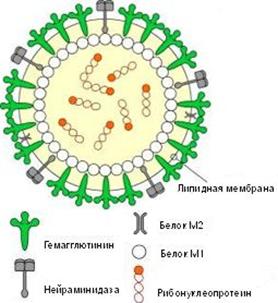
Рис. 2. Схематическое строение вируса гриппа
Гемаглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемаглютинина, а нейраминидаза обладает выраженным иммунодепресивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемаглютинины 1, 2, 3 типов и нейраминидазы 1, 2 типов содержат вирусы, которые поражают человека. Другие антигены характерные для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.).
Вирусы гриппа А. Эти возбудители более вирулентны и контагиозны, чем вирусы гриппа В и С. Это обусловлено тем, что вирус А содержит 2 типа нейраминидазы (N1, N2) и 4 –гемаглютинина (H0, H1, H2, H3); вирус В – 1 и 1 соответственно, поэтому он имеет лишь антигенные варианты внутри одного серотипа; вирус С содержит только гемаглютинин и не содержитнейраминидазу, но он имеет рецептор, который разрушает энзим. Вирусу С не свойственная изменчивость.
Одновременно циркулируют и имеют эпидемическое распространение 2 подтипа вируса гриппа А H3N2 и H1N1. На сегодняшний день во всем мире доминирует вариант А/Сидней/05/97, А/Берн/07/95 и А/Пекин/262/95. Характерной чертой современных вирусов гриппа А (H3N2) является изменение ряда их биологических свойств: тяжело размножаются в куриных эмбрионах, не агглютинируют эритроциты кур, взаимодействуют только с эритроцитами человека или морской свинки, имеют низкую иммуногенную активность.
Вирусы гриппа В выделяются только от людей. По вирулентности и эпидемиологической значимости они уступают вирусам гриппа А. По антигенным свойствам гемаглютинин инейраминидазу вируса В можно разделить на 5 подтипов. Их изменчивость носит более постепенный и медленный характер, что объясняет эпидемиологические особенности вируса гриппа В (эпидемии возникали 1 раз в 3-4 года до 1988 г.). В мире сейчас циркулируют 2 варианта вируса гриппа В: В/Пекин/184/93 (Европа, Америка, Африка, Австралия) и В/Виктория/2/87 (Юго-Восточная Азия). Характерной чертой современных вирусов гриппа А и В является их высокая чувствительность к ингибиторам гемаглютинирующей и инфекционной активности, которые содержатся в сыворотке крови нормальных животных.
Вирусы гриппа С . Вирусы гриппа С, в отличие от вирусов А и В, не вызывают эпидемий, но они могут быть причиной вспышек в организованных детских коллективах. Подъемы заболеваемости гриппом С нередко предшествуют или сопровождают эпидемии гриппа А и В. У детей раннего возраста и более старших возрастных группах он приводит к заболеваниям в легкой ибессимптомной форме.
Для вирусов гриппа С характерна значительно большая стабильность антигенных и биологических свойств. По ряду биологических характеристик эти возбудители отличаются от других представителей семейства ортомиксовирусов. Им присуща низкая репродуктивная активность в разных клеточных системах и наличие других, чем у вирусов гриппа А и В, рецепторов на поверхности эритроцитов. Рецептор-деструктирующая активность связана не с нейраминидазой, как у вирусов гриппа А и В, а с ферментом нейраминат-0-ацетилестеразою.
Сложность этиологии усиливают факты выделения от людей вирусов, которые не свойственные человеку. Гены вируса гриппа (H5N1), выделенные в 1997 году от человека в Гонконге, оказались подобными генам птичьего вируса, который преодолел межвидовой барьер. Оказалось, что человеческие и птичьи вирусы гриппа были реасортантами (рекомбинантные штаммы), которые получили внутренние гены РВ1 и РВ2 от перепелиного вируса гриппа А (H9N2) – штаммы А/перепел/Гонконг/61/97.
Вирусы гриппа малоустойчивы во внешней среде, в течение нескольких часов при комнатной температуре разрушаются. Под действием дезинфицирующих растворов (спирта, формалина, сулемы, кислот, щелочей) они быстро погибают. Нагревание до 50-60°С инактивирует вирусы в течение нескольких минут, в замороженном состоянии при температуре -70° С они сохраняются годами, не теряя инфекционных свойств, быстро погибают под воздействием ультрафиолетового излучения. Оптимум размножения вируса происходит при +37°С в слабощелочной среде. Как и другие вирусы, возбудитель гриппа отнюдь не чувствительный к антибиотикам и сульфаниламидам.
Вирус гриппа не растет на обычных питательных средах. Его можно выделить из материала, который получен от больного в первые дни болезни (смывы из носоглотки, мокроты), путем заражения культур или клеток куриных эмбрионов.
Традиционно считалось, что человеческий организм освобождается от возбудителя в ближайшие дни после выздоровления. Однако постепенно накапливались косвенные свидетельства, которые опровергают эту точку зрения. И в 1985 г. были получены прямые доказательства формирования длительной персистенции вируса гриппа. У одного человека удалось многократно выделять вирус гриппа в течение 9-ти месяцев и дольше. Возможность пожизненной персистенции вируса в организме человека продолжает изучаться.
1. Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. – СПб. – 2003.
2. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. – Санкт-Петербург. – 2003.
3. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. – Санкт-Петербург. – 2007. – 254 с.
4. Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. – М., 2006. –С. 226-247.
5. Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. – М., 2005. – С.159-175.
6. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). – М., 2005. – С. 287-292.
7. Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. – М., 2002.
8. Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. – М., – 2004. – С.5-9.
9. Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
10. Романцов М.Г., Ершов Ф.И. Часто болеющие дети: Современная фармакотерапия. – М., 2006. – 192 с.
11. Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. – СПб. – 2004. – С. 82-95.
12. Лекарственные средства в фармакотерапии патологии клетки / под редакцией Т.Г. Кожока.-М., 2007.

ВИРУСОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ , комплекс методов исследования, позволяющих распознать этиологию вирусного заболевания и изучить его возбудителя.
Осн. этапами В. и. являются выделение вируса от больных и павших животных (взятие, консервирование, пересылка и подготовка материала, заражение им животных, куриных эмбрионов, культуры клеток); титрование вирусов для определения их кол-ва в исследуемых материалах; культивирование вирусов на восприимчивых домашних и лабораторных животных, особенно на развивающихся куриных эмбрионах и культурах тканей (гл. обр. первичнотрипсинизированных).
С помощью морфологич. методов выявляют элементарные тельца, внутриклеточные включения (напр., Бабеша — Негри при бешенстве, Боллингера при оспе птиц). Иммунохимич. методы (гл. обр. метод флуоресцирующих антител) позволяют определить специфич. вирусный антиген в заражённых [зараженных] клетках тканевой культуры или органов и тканей инфицир. животных. С помощью серологич. методов проводят видовую и группоспецифич. идентификацию вируса и антител в сыворотках переболевших животных. С этой целью используют реакции нейтрализации, РСК, реакцию гемагглютинации, задержки гемагглютинации, диффузионной преципитации, торможения гемадсорбции. Реакция нейтрализации позволяет улавливать антигенные различия сходных между собой вирусов даже в пределах одноимённой [одноименной] группы. РСК применяют для обнаружения вирусных антигенов в материалах от больных и павших животных, идентификации выделенного вируса, изучения антигенных связей между различными вирусами и определения антител у переболевших животных. Реакции гемагглютинации и задержки гемагглютинации широко применяют в В. и. для диагностич. целей и типирования возбудителей болезни Ньюкасла, гриппа птиц, парагриппа и нек-рых аденовирусов; непрямую реакцию гемагглютинации используют для выявления адено- и миксовирусов, хламидий. Реакцией прицепитации в агаре изучают антигенную структуру вирусов, выявляют антитела в сыворотке и антигены в исследуемом материале. Реакцию гемадсорбции применяют для предварительной индикации и титрования вирусов в культуре клеток, особенно тех, к-рые не вызывают цитопатич. действия. Гемадсорбция наступает раньше проявления цитопатогенного действия, поэтому её [ее] используют как ранний метод предварительной индикации вирусов. Гемадсорбция островковая (адсорбция эритроцитов на отдельных участках монослоя клеток) типична для гриппа свиней, эпидемич. паротита; диффузная (адсорбция эритроцитов на клетках всего монослоя)— для классич. чумы кур, болезни Ньюкасла, афр. чумы свиней и др. Методы очистки и концентрации вирусов используют при изучении физич., химич. и морфологич. свойств вирусов. Фазовые системы, образованные полимерами, используют для концентрации вирусов из больших объёмов [объемов] вируссодержащих жидкостей, выделения нуклеиновых к-т вирусов. Радиобиологич. методы применяют в В. и. для изучения распределения и локализации вирусов (антител) в организме и особенно для изучения процессов онтогенеза вирусов. С помощью электронной микроскопии обнаруживают вирионы в исследуемом материале и специфич. конгломераты вирусов и антител (иммунная электронная микроскопия). Иммуноэлектроосмофорез обусловлен одновременным встречным движением в геле агара антигена и антитела в результате разной величины электрич. заряда с образованием комплекса антиген — антитело в виде линии преципитации и последующей его денатурацией. Метод применяют при изучении антигенной структуры вируса. Изоэлектрич. фокусирование основано на способности белков переходить в инертное (в отношении электрофоретич. подвижности), а затем агрегированное состояние в изоэлектрич. точке. Метод применяют для изучения белков вирусов. При иммуноферментативном методе происходит присоединение фермента к антителам с последующим образованием комплекса фермент — антитело — антиген, к-рый выявляют в клетке с помощью цитохимич. реакции на фермент (пероксидазу, щелочную и кислую фосфотазу, глюкозооксидазу). Метод используют с диагностич. целью для выявления вирусных антигенов в культурах клеток, мазках-отпечатках, криостатных срезах, а также для изучения тонкой структуры антигенов вируса, патогенеза вирусных болезней и др. См. также Вирусоскопия .
Лит.: Тихоненко Т. И., Методические основы биохимии вирусов, М., 1973, с. 152—58; Лабораторная диагностика вирусных и риккетсиозных заболеваний, пер. с англ., ред. Э. Леннет и Н. Шмидт, М., 1974.
Миллионы людей ежегодно заболевают гриппом и другими острыми респираторными вирусными инфекциями (ОРВИ или, как говорят в народе - ОРЗ). От этих инфекций страдает до 80% населения ежегодно. Наиболее тяжелые формы гриппа и ОРЗ наблюдаются, в первую очередь, у стариков и детей до года. Данные инфекции наносят огромный ущерб здоровью населения и иногда приводят к серьезным осложнениям. От гриппа и сопутствующих ему осложнений ежегодно умирают сотни людей.
Вследствие высокого уровня изменчивости антигенной структуры у циркулирующих вирусов иммунитет к вирусам, которые циркулируют в текущем году, может оказаться неэффективным против вирусов, которые начнут циркулировать в следующем. Ежегодные эпидемические вспышки гриппа объясняются именно высоким уровнем изменчивости вируса.
Пути передачи инфекции
Во время чихания, так же как и при кашле, изо рта больного человека вылетают мельчайшие частицы слюны и мокроты, в которых вирусы содержатся в огромных количествах. Поэтому основной механизм передачи гриппа и ОРВИ так и называется — воздушно-капельный. Другой механизм передачи респираторной инфекции — контактный. Он долгое время оставался недоказанным и менее очевидным, чем воздушно-капельный. Тем не менее, он играет не меньшую, а возможно, и бóльшую роль в распространении простудных заболеваний. Происходит это так. Как правило, чихающий или кашляющий человек прикрывает рот рукой, надеясь предотвратить распространение инфекции воздушно-капельным путём. При этом он и не подозревает, насколько упрощает передачу своей инфекции контактным путём. Дело в том, что вся колоссальная масса микробов, которая должна была выйти в открытое пространство, оседает на руке чихающего или кашляющего человека. Который благополучно разносит её по предметам обихода, в том числе и тем, к которым прикасаются другие люди. Либо разносит её по рукам друзей, коллег и знакомых при рукопожатиях. Тем, в свою очередь, остаётся лишь прикоснуться своей рукой ко рту, носу, либо протереть глаза, которые также выстланы восприимчивой к ОРВИ слизистой, и сложный воздушно-капельный путь передачи сокращается для вируса по времени и сложности в десятки раз. Вот почему важно мыть руки и избегать прикосновений рук к собственному лицу при вспышках респираторных инфекций.
К этому стоит добавить, что возбудители ОРВИ достаточно устойчивы во внешней среде. Так, вирус гриппа может сохранять жизнеспособность вне организма до 3-х недель. Поэтому заражение может происходить даже спустя значительное время после контакта больного человека с предметами домашнего обихода, детскими игрушками, посудой, ручками дверей общественных заведений и проч. С другой стороны, для успешного внедрения вируса в организм важен ещё один фактор — количество вирусных частиц, попадающих в организм. Чем оно меньше, тем меньше вероятность того, что защитные барьеры организма будут преодолены и возникнет заболевание. Высокая концентрация вирусов может сохраняться в закрытых помещениях, особенно с большими скоплениями людей: офисах, школах, детских садах, общественном транспорте, магазинах. Напротив, на открытом воздухе встретить достаточное для заражения количество микробных частиц практически невозможно. Поэтому, вопреки распространённому мнению, даже во время сезонной вспышки ОРВИ, гулять на открытом воздухе совершенно не опасно. Гораздо большее значение имеет, на каком транспорте вы добираетесь до места прогулки или работы.
Признаки заболевания, принципы лечения
После того, как возбудитель попал в организм, необходимо время, чтобы он преодолел защитные барьеры организма и начал размножаться в достаточном количестве, оказывая своё воздействие на организм. Это время называется инкубационным периодом. Для ОРВИ длительность инкубационного периода составляет от нескольких часов до 3-х суток, в среднем 2 суток и зависит от агрессивности вируса, количества вирусных частиц и состояния защитных сил дыхательной системы.
Далее начинает постепенно развиваться клиническая картина ОРВИ. Её можно разделить на 2 синдрома — катаральный и интоксикационный. Катаральный синдром является результатом поражения слизистых оболочек и проявляется так: сухость, першение и боль в горле, кашель, заложенность носа, чихание, изменение голоса, покраснение конъюнктивы, слезотечение, иногда — светобоязнь.
Интоксикационный синдром, как правило, появляется позже катарального и исчезает раньше него, но тем не менее является более тяжёлым. Размножение вирусов внутри клеток сопровождается образованием опасных для человека токсинов. Разрушение зараженных клеток ведёт к попаданию этих веществ в кровь, которые и вызывают картину интоксикационного синдрома. Он проявляется: повышением температуры, ознобом, болью в суставах и мышцах, в более тяжёлых случаях — тошнотой, рвотой и потерей сознания.
Для вирусных инфекций дыхательных путей характерны светлые, прозрачные выделения с небольшой вязкостью (специалисты называют их серозными). К концу заболевания они могут становиться желтоватыми. Если же выделения из носа или бронхов становятся густыми, количество их резко увеличивается, а цвет становится тёмно-желтым, это может говорить о присоединении бактериальной инфекции.
Несмотря на большое разнообразие симптомов, для большинства людей ОРВИ, в том числе и грипп, является нетяжёлым заболеванием. Опасность они представляют для людей, имеющих тяжёлые сопутствующие заболевания: сахарный диабет, сердечную недостаточность, хроническую почечную недостаточность, туберкулёз и другие.
Любая инфекция является конфликтом между организмом человека и патогенным возбудителем. Каждый такой конфликт при этом требует к себе самого пристального внимания. Обращение к врачу является обязательным, оно поможет своевременно постановить диагноз и определить адекватное лечение. Антибиотики, успешно излечивающие от бактериальных инфекций, неэффективны для лечения ОРВИ. Они имеют совершенно другие механизмы действия, которые никак не могут влиять на вирусы. Единственным случаем, когда оправдано применение антибиотиков, является присоединение ещё и бактериальной инфекции. Врачом назначаются противовирусные препараты, которых в настоящее время разработано множество и подбираются они индивидуально. Возможно назначение витаминов, дезинтоксикационной и симптоматической терапии.
Профилактика
Для предотвращения распространения инфекции следует по возможности оградить больного от контактов с окружающими. Для того, чтобы уменьшить выделение вирусов при чихании, можно использовать маску, надевая её на больного. Для того, чтобы маска выполняла свою защитную функцию, необходимо, чтобы она закрывала и рот, и нос. Только в этом случае она будет задерживать капельки жидкости, вылетающие при чихании, разговоре и кашле.
Вопреки распространённому мнению, маска, надетая на здорового человека, не выполняет роль фильтра, задерживающего вирусы (для этого она недостаточно герметична), а предотвращает случайный контакт рук человека со ртом и носом, снижая риск контактного пути передачи инфекции.
Проветривание помещений снизит концентрацию вируса в замкнутых пространствах. Индивидуально следует избегать рукопожатий, сократить до минимума пребывание в общественном транспорте и в местах больших скоплений людей. Как можно чаще мыть руки. Избегать касания руками глаз, носа и рта.
Помните! Любое вирусное заболевание, перенесённое "на ногах" может плохо отразиться на вашем здоровье в будущем. В любом случае, при первых признаках заболевания необходимо вызывть врача на дом и получить рекомендации специалиста относительно стратегии лечения. Помните о том, что любое самолечение может привести к нежелательным последствиям и осложнениям.
Читайте также:


