Воспаление яичников препараты противовирусные

Беспокоят слизистые либо гнойные выделения из влагалища, зуд и жжение во влагалище, усиливающиеся при мочеиспускании. Могут быть тупые, тянущие боли внизу живота. Ниже в статье вы найдете причины заболевания; врачей, которые его лечат; необходимые лечебные процедуры для лечения; а также общую информацию о заболевании его локализации, особенностях диагностики заболеваний и лечения их. Тем не менее, советуем проконсультироваться с врачом, ибо самолечение в 90% чревато переходом болезни в хроническую стадию с крайне неприятными осложнениями

Цервицит. Общая информация
Цервицит – заболевание, характеризующееся наличием воспалительного процесса во влагалищном сегменте шейки матки. Чаще всего протекает одновременно с вульвитом, вагинитом, бартолинитом, псевдоэрозией шейки матки, эктропионом (выворотом шейки матки). В 70% случаев возникает у женщин в репродуктивном возрасте. По характеру заболевания выделяются острый и хронический цервициты. По степени поражения бывают очаговый и диффузный цервициты.
При лечении Цервицита врачи клиники БИОСС используют как проверенные временем, так и самые новые разработки и авторские методики.
В нашей клинике работают лучшие врачи в Москве, имеющие большой опыт в лечении Цервицита:
- Болдырева Ольга Валерьевна, гинеколог, кандидат медицинских наук.
- Приходько Михаил Николаевич, гинеколог, кандидат медицинских наук, Заслуженный врач РФ.
Симптомы цервицита, эндцервицита, экзоцервицита
Симптомы цервицита могут быть стертыми, а могут быть ярко выражены. В большинстве случаев, выраженность клиники зависит от возбудителя инфекционного процесса. Выраженные жалобы чаще бывают у пациенток с цервицитом на фоне гонореи, а бессимптомное течение характерно для цервицита на фоне хламидиоза. По клиническому течению цервицит бывает острой и хронической формы.
При острой форме цервицита симптомы сильно выражены- беспокоят слизистые либо гнойные выделения из влагалища, зуд и жжение во влагалище, усиливающиеся при мочеиспускании. Могут быть тупые, тянущие боли внизу живота. Другие проявления цервицита, как правило, связаны с сопутствующими заболеваниями. Например, при сочетании цистита и цервицита, плюс ко всему беспокоит учащенное мочеиспускание. При воспалении придатков и цервиците боли внизу живота более выражены, при выраженном воспалительном процессе- повышается температура. При наличии эрозии шейки матки на фоне цервицита- могут быть кровотечения после полового акта. Характерно, что симптомы цервицита обостряются сразу после менструации.
При хронической форме цервицита симптомов почти нет. Это связано с тем, что воспалительный процесс постепенно стихает, происходит уплотнение шейки матки, образуются мелкие кисты после заживления сопутствующей цервициту эрозии.
Спутать цервицит по клиническим признакам можно с абсолютно любой инфекцией. Частое необдуманное применение антибиотиков, как правило, не приводит к излечению цервицита, а лишь подавляет симптомы заболевания.
При каких-либо проявлениях цервицита нужна очная консультация квалифицированного гинеколога.
Осложнения цервицитов:
- переход острой формы в хроническую;
- эрозия шейки матки;
- развитие восходящей инфекции ( распространение воспалительного процесса на матку, придатки, брюшину, мочевой пузырь). В 8-10 % случаев из 100 цервициты, вызванные хламидиозом или гонореей провоцируют воспалительный процесс полости малого таза;
- при наличии половой инфекции может развиться бартолинит- инфекционное воспаление выводных протоков бартолиниевых желез, которые расположены у входа во влагалище;
- воспаление придатков;
- развития синдрома Фитц-Хью-Куртиса при сочетании цервицита с хламидиозом, самым грозным осложнением подобного синдрома является развитие спаечного процесса в малом тазу и брюшной полости, что ведет к бесплодию;
- рак шейки матки. Группу риска представляют пациентки, у которых цервицит сочетается с вирусом папилломы человека высокого онкогенного типа.
Диагностика цервицита, эндцервицита, экзоцервицита
Диагностика цервицита не представляет трудностей, гораздо сложнее установить причину воспалительного процесса и ликвидировать ее. При осмотре в зеркалах отмечается гиперемия (покраснение и отечность) слизистой шейки матки вокруг наружного зева, шейка матки часто бывает эрозирована. Из цервикального канала обильно идут гнойные или слизисто-гнойные выделения. Это особенно заметно при острой форме эндоцервицита.
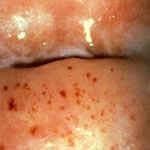
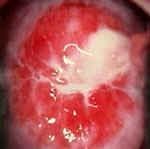
Фото Экзоцервицит Фото Слизисто-гнойный эндоцервицит
При хронической форме признаки цервицита видны меньше. Выделения имеют мутноватый цвет.
- мазок на флору;
- ПЦР-диагностика основных инфекций, передающихся половым путем
- ( хламидиоз, гонорея, трихомониаз, вирус папилломы человека, цитомегаловирусная инфекция, генитальный герпес, микоплазмоз, уреаплазмоз, кандидоз);
- цитологическое исследование соскоба с шейки матки и цервикального канала;
- бактериологический посев микрофлоры влагалища с определением чувствительности к антибиотикам;
- кровь на RW, ВИЧ и гепатиты;
- УЗИ органов малого таза;
- кольпоскопия - используют как дополнительный метод с целью определения сопутствующей патологи шейки матки (эрозия, псевдоэрозия);
- при жалобах на учащенное мочеиспускание- анализ мочи;
- при хроническом экзоцервиците необходима биопсия патологического участка в первую фазу менструального цикла.
Лечение цервицита, эндцервицита, экзоцервицита
Консервативное лечение цервицита, эндцервицита, экзоцервицита
Лечение цервицита должно проводится с учетом сопутствующих заболеваний и, желательно, в острую стадию заболевания, когда симптомы наиболее выражены.
Начинают с этиотропной терапии, направленной на ликвидацию причины цервицита. С этой целью применяют антибактериальные, противовирусные препараты , гормональные препараты и цитостатики системно. Не рекомендуется использовать препараты местно при острой форме цервицита, иначе это может спровоцировать восходящую инфекцию ( распространение инфекционного процесса на матку, трубы, яичники). Антибиотики подбирают только после определения чувствительности к ним возбудителя. Соответственно, и предпочтение той или иной группе антибиотиков отдается после выявления возбудителя.
При цервиците кандидозного происхождения назначают притивогрибковые антибиотики ( Дифлюкан, Микосист, Флюкостат. Нистатин), при хламидийном цервиците- антибиотики тетрациклинового ряда( Доксициклин), макролиды ( Сумамед) и так далее.
После окончания курса антибактериального лечения назначают лактобактерии ацидофильные или Бифидумбактерин для нормализации микрофлоры влагалища.
При наличии цервицита вирусной этиологии лечение более длительное и трудоемкое. При генитальном герпесе с симптомами цервицита показано длительное лечение противовирусными препаратами (Ацикловир, Зовиракс, Валтрекс).
При наличии папиломавирусной инфекции назначают цитостатики ( 5-Фторурацил).
Если женщина менопаузального возраста и никаких инфекций и острых проявлений воспалительного процесса не обнаружено, скорее всего цервицит возник из-за дефицитов эстрогенов. В этом случае показано местное применение заместительно - гормональной терапии (свечи Овестин).
Совместно с этиотропной терапией назначают витамины и иммуномодуляторы . Из иммуномодуляторов используют препарат Изопринозин, он обладает и иммуномоделирующим и противовирусным эффектом.
Если выявлена половая инфекция - обязательно проводят лечение обоих половых партнеров. Местное лечение применяют только после ликвидации симптомов заболевания. Местно используют спринцевания с дезинфицирующими растворами – с хлоргексидином, марганцовкой, содой и борной кислотой.
При хронической форме цервицита консервативное лечение менее эффективно, хотя в любом случае этиотропное лечение обязательно.
Хирургическое лечение цервицита, эндцервицита, экзоцервицита
При хронической форме цервицита для лечения шейки матки обычно применяют хирургические методы воздействия. Хирургическое лечение применяют только после излечения от всех инфекций. При наличии эрозии шейки матки и при хроническом экзоцервиците, подтвержденном гистологически- хирургическое лечение обязательно. В зависимости от конкретной ситуации проводят криотерапию (“примораживание” тканей жидким азотом), лазеротерапию ( воздействие лазерным лучом), электрохирургическое лечение аппаратом “Сургитрон”. Если женщина нерожавшая, возможна обработка пораженного участка шейки матки раствором Солковагин или Ваготил.
После прижигания назначают местно противовоспалительные ( свечи с индометацином) и иммуностимулирующие препараты (свечи Генферон).
При хронической форме применяют физиотерапевтические процедуры, например, электорофорез лекарственных веществ с помощью электрода, введенного во влагалище.
Обязательно необходимо проводить лечение сопутствующих заболеваний с целью избежания рецидивов.
Для успешного лечения цервицита и быстрого выздоровления необходимо половое воздержание до полного излечения и тщательное соблюдение гигиены половых органов, особенно во время менструации. Необходимо подмываться теплой водой после каждой смены прокладки или тампона, менять их через каждые 3-4 часа, даже если у Вас скудные менструальные выделения.
После хирургического лечения цервицита в период реабилитации могут быть незначительные сукровичные выделения, это является нормой и не должно вызывать опасений. Дело в том, что после отторжения некротизированных тканей слизистой оболочки шейки матки после прижигания, происходит постепенная регенерация тканей.
Важное место в лечении воспаления придатков занимает антибактериальная терапия, действие которой направлено на уничтожение возбудителя болезни. Обычно врач назначает антибиотики широкого спектра действия, среди которых можно выделить следующие препараты:Группа пенициллинов – Амоксиклав, Аугментин;
Цефалоспорины – Цефтриаксон, Цефазолин;
Макролиды – Эритромицин, Макропен, Фромилид. Курс лечения от 5 до 10 дней.
Если улучшения не наблюдается,то необходимо назначить более радикальные методы лечения, такие как операция.
Помимо антибиотиков, врач назначает и другие лекарственные препараты:
Противовоспалительные нестероидные препараты: Ибупрофен, Интометацин.
Вагинальные свечи. Положительно воздействуют на болезнетворные микроорганизмы, действуют непосредственно в очаге воспаления. Вводятся такие препараты перед сном. Обладают противомикробным, противовоспалительным, бактерицидным действием: Тержинан, Полижинакс, Клион-Д и другие. Такие препараты не влияют на микрофлору влагалища, имеют минимальное количество противопоказаний и хорошо переносятся женским организмом.
Витаминотерапия. Назначают витамины группы В, С и Е, также иммуностимуляторы для повышения иммунитета.
Важно помнить, что воспаление придатков – лечение и симптомы нельзя игнорировать, поскольку несвоевременное обращение к врачу может повлечь за собой серьезные осложнения.
Хороший ответ 4
Для начала выяснить причину отеков у специалиста. Она может быть как почечного, так и сосудистого харатера, не забывайте про воспалительные патологии (например, рожистое воспаление). Поэтому не стоит лечение начинать с мочегонных средств.
Хороший ответ 1
Думаю, что имеется в виду хронический панкреатит? Острый панкреатит - неотложное состояние, нужно вызвать скорую помощь и госпитализировать больного. В случае хронического панкреатита больной также должен находиться под регулярным наблюдением врача - гастроэнтерголога; лечащий доктор наилучшим образом подберёт лекарства для лечения. Чаще всего это ферментные препараты животного происхождения (мезим, креон, пангрол, панзинорм), желчегонные средства (холензим). Дополнительно могут назначаться средства, нормализующие микрофлору кишечника (бифидумбактерин). Дозировки подбираются с учётом формы заболевания, возраста, массы тела больного, сопутствующих заболеваний. Помимо лекарственного лечения необходимо также соблюдать специальную диету.
Хороший ответ 8
Для лечения десен в домашних необходимы подходят регулярные полоскания рта различными настоями и отварами лекарственных трав. Частота лечебных процедур:
1. Утром и перед сном;
2. За час до еды;
3. Сразу же после еды.
4. В остальные часы - по самочувствию.
Полоскать десна при воспалении:
1. Перекисью водорода. На стакан теплой кипяченой воды одна ложка перекиси.
2. Отвар коры дуба. На поллитра воды 2 ст ложки измельченной коры дуба, довести до кипения и кипятить 10 минут.
3. Ромашка и календула. 1 столовую ложку сушеной травы залить стаканом кипятка и дать настояться 20 минут.
Хороший ответ 2 0
Здравствуйте! В норме органы и стенки брюшной полости имеют гладкую, скользкую поверхность. Это предотвращает слипание органов и обеспечивает свободу движения, но при операциях или хронических воспалениях органов малого таза могут возникать спайки, как способ организма создать защиту.
Спайки - это нити фибрина. Во время операций стараются противоспаечные барьеры, которые не эффективны на 100 %, но уменьшают рецидив спаек.
Хороший ответ 2
Метронидазол является противомикробным и противопротозойным (действует на одноклеточные простейшие организмы) средством .
Показания к его применению достаточно широки.
Согласно инструкции, данный препарат применяют при:
Протозойные инфекции: внекишечный амебиаз, включая амебный абсцесс печени, кишечный амебиаз (амебная дизентерия), трихомониаз, гиардиазис, балантидиаз, лямблиоз, кожный лейшманиоз, трихомонадный вагинит, трихомонадный уретрит.
Инфекции, вызываемые Bacteroides spp. (в т.ч. В. fragilis, В. distasonis, В. ovatus, В. thetaiotaomicron, В. vulgatus): инфекции костей и суставов, инфекции центральной нервной системы (ЦНС), в т.ч. менингит, абсцесс мозга, бактериальный эндокардит, пневмония, эмпиема и абсцесс легких. Инфекции, вызываемые видами Bacteroides, включая группу В. fragilis, видами Clostridium, Peptococcus и Peptostreptococcus: инфекции брюшной полости (перитонит, абсцесс печени), инфекции органов таза (эндометрит, эндомиометрит, абсцесс фаллопиевых труб и яичников, инфекции свода влагалища после хирургических операций), инфекции кожи и мягких тканей. Инфекции, вызываемые видами Bacteroides, включая группу В. Fragilis и видами Clostridium: сепсис.
Псевдомембранозный колит (связанный с применением антибиотиков).
Гастрит или язва двенадцатиперстной кишки, связанные с Helicobacter pylori, алкоголизм.
Данный препарат назначается врачом только на очном приеме строго по показаниям с учетом результатов анализов и обследований.
Лекарства, которые назначают для лечения:
Аднексит - это воспаление яичников и маточных (фаллопиевых) труб. Это одно из самых частых гинекологических заболеваний, встречается в основном у женщин в возрасте от 20 до 30 лет.
Общие сведения
Как правило, воспалительный процесс начинается с маточных труб. В этом случае говорят о течении острого сальпингита. Инфекция может проникать в маточные трубы как восходящим (из половых путей), так и нисходящим (с током крови) путем. Причиной могут быть самые различные микробы стафилококки, стрептококки, эшерехии. Сальпингит является частым осложнением заболеваний, передающихся половым путем (гонореи, хламидиоза и др.). Факторами риска сальпингита являются также аборты, эндоскопическое исследование матки, установка внутриматочной спирали, диагностическое выскабливание матки. При всех этих манипуляциях велика вероятность проникновения бактерий через поврежденную слизистую матки. Процесс может быть как односторонним, так и двусторонним (при гонококковом сальпингите).
Сначала воспаляется слизистая маточной трубы. Со временем в процесс вовлекаются все ее стенки, а в просвете скапливается серозная жидкость, а иногда и гной. Чаще всего инфекция распространяется из маточной трубы в яичник. Сочетанное воспаление яичника (оофорит) и маточной трубы и называется сальпингоофоритом.
Причины аднексита
Воспаление придатков чаще всего является осложнением вовремя не вылеченной инфекции влагалища или шейки матки. Среди заболеваний, передающихся половым путем чаще всего вызывают воспаление придатков хламидиоз и гонорея. Существуют данные о том, что в воспалении придатков могут быть задействованы такие микроорганизмы:
- Гарднерелла
- Микоплазма
- Уреаплазма
- Генитальный герпес
- Цитомегаловирус
- Гемофильная палочка
- Трихомонады
- Стрептококки
- Кишечная палочка
- Анаэробные бактерии
- Пептококки
Симптомы
Аднексит начинается остро, с подъема температуры до 39 о С, периодических резких болей в нижней части живота с переходом в область поясницы и крестца. Иногда симптомы напоминают острый аппендицит. Менструальный цикл нарушается, месячные становятся болезненными и более длительными, возможны межменструальные кровотечения. Пациентки жалуются на боли при мочеиспускании, а также на характерные водянистые, а иногда и гнойные выделения (бели). Боли в животе возникают также при половом акте и сохраняются некоторое время после него.
Без лечения аднексит может перейти в хроническую форму. При этом симптомы становятся менее выраженными, боли постоянные, ноющие. При переохлаждении, стрессе возможно обострение хронического аднексита.
Воспаление придатков чревато осложнениями. При остром аднексите воспаление может перейти на брюшину с развитием перитонита, что потребует немедленного хирургического лечения. Отдаленные последствия - это, прежде всего, спаечный процесс в области маточных труб, который, в свою очередь, повышает риск внематочной беременности и бесплодия. Иногда бесплодие может быть единственным признаком, позволяющим заподозрить хронический аднексит.
Что можете сделать вы при аднексите
При появлении первых симптомов аднексита немедленно обратитесь к врачу. Самолечение может только усугубить картину болезни. Профилактика аднексита включает в себя, прежде всего, соблюдение правил личной гигиены, своевременное лечение половых инфекций, предупреждение абортов, охранительный режим после гинекологических операций. Старайтесь избегать переохлаждения, чрезмерных нагрузок и укреплять иммунитет.
Что может сделать врач
После гинекологического осмотра обязательно проводится исследование влагалищных мазков на флору. В редких случаях необходима диагностическая лапароскопия. Лечение аднексита основывается главным образом на антибактериальной терапии. Чаще всего назначают антибиотики из группы пенициллинов или цефалоспоринов. Курс лечения продолжается еще примерно 10-14 дней после исчезновения симптомов. В зависимости от тяжести состояния врач может назначить также обезболивающие, противовоспалительные средства, а после стихания симптомов болезни - физиотерапию.
Внимание! Карта симптомов предназначена исключительно для образовательных целей. Не занимайтесь самолечением; по всем вопросам, касающимся определения заболевания и способов его лечения, обращайтесь к врачу. Наш сайт не несет ответственности за последствия, вызванные использованием размещенной на портале информации.
Проведено обследование 45 женщин с ОВПМ в возрасте 17–38 лет. Контрольную группу составили 11 здоровых женщин. Все пациентки с ОВПМ при первичном обращении предъявляли жалобы на боль в нижнем отделе живота, продолжительность которой варьировала от одного дня до 3 месяцев, повышение температуры тела до субфебрильной и фебрильной, общую слабость, снижение работоспособности. Выделения из половых путей пациенток с ОВПМ носили различный характер — от сукровичных до слизисто-гнойных с неприятным запахом. Ранее стационарное лечение по поводу эндометритов и сальпингоофоритов было проведено у 34 (75,5%) пациенток. При влагалищном исследовании у всех пациенток пальпировали утолщенные болезненные придатки матки. При ультразвуковом сканировании объемных патологических образований матки, яичников и маточных труб не обнаружено. В клиническом анализе крови только у 13 женщин выявлено повышение общего содержания лейкоцитов крови и СОЭ. Биохимический анализ крови и клинический анализ мочи не выявили отклонений от нормы.
При диагностике инфекций, передающихся половым путем, были выявлены следующие возбудители в различных комбинациях: Chlamydia trachomatis — 9%, Candida albicans — 23%, Ureaplasma urealiticum — 15%, Human papillomavirus — 5%, Hepres simplex — 66%, Cytomegalovirus hominis — 9%, Toxoplasma gondii — 3%. Бактериальный вагиноз обнаружен у 40% пациенток.
В острой фазе воспаления придатков матки у 18 (40,0%) больных обнаружено снижение активности клеточного звена иммунитета. Выявленное снижение иммунорегуляторного (СD4/СD8+) и фагоцитарного индекса, а также общего количества и процентного соотношения цитотоксических клеток в острой фазе воспаления у всех обследуемых независимо от фазы менструального цикла указывало на ослабление противовирусного иммунитета и коррелировало с низким уровнем NK-клеток (CD16), что характерно для вирусной инфекции. Нарушение функциональной активности клеточного звена иммунитета может быть объяснено присутствием в организме пациенток персистирующей вирусной инфекции, что приводит к снижению количества Т-супрессоров и угнетению противовирусной активности организма. Снижение общего количества NK-клеток, а также количества фагоцитирующих клеток, вероятно, вызвано развитием вторичных бактериальных инфекций.
Выявлены высокие показатели циркулирующих иммунных комплексов (ЦИК), снижение бактерицидных свойств нейтрофилов, а также фагоцитарного индекса микробных тел и абсолютного фагоцитарного показателя микробных тел, что потребовало усилить функциональную активность нейтрофилов с помощью иммунокоррекции.
Повышенный уровень провоспалительных цитокинов (интерлейкинов IL-6, IL-8, IL-1-β, фактор некроза опухолей TNF-α, гранулоцитарного колониестимулирующего фактора GCSF и др.) позволил судить о давности, степени распространения и выраженности воспалительного процесса. При исследовании показателей гуморального иммунитета у 7 (15,5%) больных наблюдали значительное снижение уровня сывороточного IgA (1,75±0,15), что может говорить о давности воспалительного процесса. Уровень сывороточного IgG у 7 (15,5%) больных был повышен и составлял 17,85±3,28 г/л, у 3 (6,67%) — снижен (10,3±0,78 г/л), что могло свидетельствовать об иммунодефиците. У 9 (20,0%) больных диагностировано повышение уровня сывороточного IgM (3,75±1,43 г/л). У 3 (6,67%) пациенток наблюдали снижение уровня сывороточного IgM (1,13±0,08 г/л), что также может указывать на иммунодефицит.
У некоторых больных наблюдали как снижение количества одного из иммуноглобулинов, так и повышение другого. Поэтому судить о степени нарушений иммунной системы по количественному показателю иммуноглобулинов крайне сложно. При исследовании цитокинового статуса у 43 (95,5%) больных с ОВПМ отмечено стойкое снижение продукции клетками крови α- и γ -интерферонов (ИФН) почти в два раза.
Иммунокоррекцию проводили препаратом ГАЛАВИТ, обладающим противовоспалительными и иммуномодулирующими свойствами, которые обусловлены активацией иммунокомпетентных клеток и ингибированием провоспалительных цитокинов крови. ГАЛАВИТ получали 29 пациенток с ОВПМ по схеме: 100 мг внутримышечно в течение 10–15 суток. Остальные 19 больных c ОВПМ составили группу сравнения. Всем пациенткам проведена комплексная терапия, включающая противомикробные (цефалоспорины, фторхинолоны, производные имидазола, полиены) и нестероидные противовоспалительные препараты.
После терапии ГАЛАВИТОМ у 22 (75,8%) больных уровень лейкоцитарного α-ИФН нормализовался, а показатель γ-ИФН повысился на 65% от исходных значений. На фоне комплексной иммунотерапии уровень α-ИФН нормализовался у 21 женщины, повысился на 75% от исходных значений у 3, на 50% — у 3, на 30% — у 2.

Через месяц после терапии ГАЛАВИТОМ общее количество цитотоксических Т-лимфоцитов (СD8+) у 9 (31,3%) пациенток восстановилось до физиологических значений по сравнению с группой контроля (здоровые женщины). При этом отмечены активация нейтрофилов, увеличение фагоцитарного индекса и фагоцитарного числа микробных тел, а также уровня активированных Т-лимфоцитов. Восстановление абсолютных и относительных показателей зрелых В-лимфоцитов обнаружено у 11 (37,9%) женщин. Иммунорегуляторный индекс (CD4/CD8+) нормализовался у 14 (48,3%) пациенток. Выявлено преобладание уровней противовоспалительных цитокинов крови (IL-4, IL-10), в то время как уровень продукции в сыворотке крови IL-1, IL-6 и TNF-α несколько снизился, что также коррелировало со снижением титров IgG и исчезновением клинических проявлений воспалительного процесса. Наступление периода ремиссии и отсутствие острого воспаления у всех обследуемых основной группы подтверждалось постепенным снижением уровня сывороточного IgM.
Показатели иммунного статуса имели тенденцию к положительной динамике лишь у 16 пациенток, получавших лечение по общепринятой схеме без иммунотерапии. При этом у них не наблюдалось снижения уровня сывороточных иммуноглобулинов (IgM), не изменялся абсолютный показатель фагоцитоза (фагоцитарный индекс микробных тел), а интерфероновый статус оставался на прежнем уровне. Как показали результаты наших исследований, для больных с ОВПМ характерны Th-1 тип иммунного ответа за счет увеличения относительного количества CD4 лимфоцитов и угнетение функций местного иммунитета за счет снижения экспрессии молекул адгезии. При исследовании цитокинового статуса патогномоничными для больных с ОВПМ являются цитокины воспаления GCSF, IL-6, IL-8, уровни которых как в сыворотке крови, так и биологических жидкостях сопоставимы.
Таким образом, изучение всех звеньев иммунной системы позволяет определить степень противовоспалительной, противовирусной, антипролиферативной активности эндогенных цитокинов, процессы их взаимодействия с другими иммунокомпетентными клетками, а также прогнозировать течение и исход ОВПМ. В ходе исследования доказана высокая клиническая эффективность препарата ГАЛАВИТ, обладающего противовоспалительным, иммуномодулирующим действием, направленным на восстановление основных звеньев иммунитета. o
А.Н. Стрижаков, академик РАМН,
А.И. Давыдов, профессор, д-р медицинских наук,
Ж.А. Каграманова, кандидат медицинских наук,
Московская медицинская академия им. И.И. Сеченова
В.А.Лебедев, В.М. Пашков, И.А.Клиндухов
Московская медицинская академия им. И.М.Сеченова
Кафедра акушерства и гинекологии №2 лечебного факультета
Воспалительный процесс придатков матки по-прежнему занимает первое место в структуре гинекологической заболеваемости. Причем, почти у каждой десятой больной диагностируются гнойные воспалительные образования маточных труб и яичников. Особое социальное значение проблеме придает тот факт, что значительное повышение заболеваемости в последнее десятилетие отмечено среди молодых женщин, ещё не реализовавших свою генеративную функцию. В возрастной группе от 18 до 24 лет она увеличилась в 1,4 раза, а в группе от 2 5 до 29 лет - в 1,8 раза. До недавнего времени любая абсцедирующая форма воспалительного заболевания придатков матки являлась практически абсолютным показанием к их удалению, что приводило к утрате или значительному снижению фертильности [9].
Широкое внедрение в клиническую медицину высокоэффективных антибактериальных и иммунокорригирующих препаратов, успехи эндоскопической хирургии, разработка новых технологий инвазивных вмешательств послужило стимулом к развитию органосберегающих методик лечения больных с гнойными воспалительными заболеваниями придатков матки [1,8].
Мы провели обследование и лечение 68 больных в возрасте от 22 до 35 лет (28,4±3,2 лет) с абсцедирующими формами воспалительного процесса придатков матки. В анамнезе у обследованных больных отмечались неоднократные внутриматочные вмешательства, эпизоды воспалительного процесса гениталий, использование ВМК (у 7 пациенток - более 4 лет).
Диагноз гнойного воспалительного заболевания придатков матки (абсцедирующая форма) ставился на основании клинических проявлений: выраженные боли в нижних отделах живота, гипертермия до 37,5-38,5°С, симптомы интоксикации; данных общего обследования (болезненность нижних отделов живота, перитонеальные симптомы), данных специального гинекологического исследования (утолщенные, болезненные придатки матки, тубоовариальные образования).
Правильной постановке диагноза способствовали результаты трансвагинальной эхографии. При этом визуализировались расширенные маточные трубы с эхоплотной капсулой, заполненные анэхогенным содержимым со среднедисперсной эхопозитивной взвесью (у 42 больных). В ткани яичников определялись жидкостные полости, внутренняя структура которых была представлена хаотично расположенной мелкодисперсной взвесью на фоне повышенного уровня звукопроводности (отражение от гнойного экссудата); рядом с абсцессом яичника обнаруживалась ткань функционирующего яичника (наличие фолликулярного аппарата). Данная эхографическая картина установлена у 26 пациенток. Лабораторные данные также подтверждали наличие гнойного воспалительного процесса придатков матки: лейкоцитоз (более 15 10 9 /л), палочкоядерный сдвиг формулы крови влево.
Исследование микрофлоры цервикального канала обследованных пациенток позволило выявить полимикробный пейзаж, в основном представленный факультативными анаэробами. Наиболее часто встречались грамположительные кокки (Streptococcus pyogenus, Staphylococcus aureus, Staphylococcus epidermidis), грамотрицательные кокки - Escherichia coli. При общем и местном снижении иммунитета данная флора, являющаяся условно патогенной, имеет большое значение в генезе воспалительных процессов придатков матки [9]. Из патогенной флоры у обследованных больных также были установлены микроорганизмы, входящие в группу ИППП (хламидии, микоплазмы, уреаплазмы, циомегаловирусы).
У всех больных, кроме бактериологического подтверждения этиологии заболевания, было проведено определение чувствительности выделенных микроорганизмов к антибиотикам, что необходимо для проведения успешной антибактериальной терапии.
Поэтому, исходя из вышеизложенного, мы применяли следующую тактику ведения больных с абсцедирующими формами воспалительных заболеваний придатков матки: сначала проводили активное дренирование гнойных образований под контролем трансвагинальной эхографии, после которого применяли патогенетически обоснованную терапию: антибактериальную, ин-фузионную, препараты для воздействия на активность медиаторов и модуляторов воспаления, а также иммуномодулирующую терапию.
Активное дренирование гнойных образований придатков матки под контролем трансвагинального ультразвукового сканирования является простым, наименее инвазивным и, вместе с тем, достаточно эффективным способом эвакуации гноя и санации очага. Данная методика малоинвазивной хирургии была успешно применена у всех обследованных больных. При этом было эвакуировано от 10 до 40 мл гнойной жидкости.
Антибактериальная терапия при гнойном поражении придатков матки является этиотропным лечением. Всем больным антибактериальная терапия проводилась с учётом необходимых условий. А таковыми для успешной антибактериальной терапии являются:
- Точная верификация диагноза по нозологическим формам с обязательным бактериологическим подтверждением этиологии заболевания и определением чувствительности выделенных микроорганизмов к антибиотикам.
- Устранение факторов, препятствующих лечению, т. е. всем больным нами было проведено активное дренирование гнойных образований придатков матки под контролем трансвагинального ультразвукового сканирования.
- Выбор оптимального препарата производили с учётом его спектра активности, переносимости конкретной пациенткой, фармакокинетических особенностей препарата.
- Адекватной продолжительностью лечения мы считали длительность введения антибактериальных препаратов, которую прекращали через трое суток после исчезновения основных клинических проявлений острого воспалительного процесса (лихорадки, перитонеальных симптомов, лейкоцитоза).
Однако состояние больных абсцедируюшими формами воспалительных заболеваний придатков матки требует проведения этиотропного лечения, не дожидаясь информации о характере возбудителя и его чувствительности. Поэтому антибактериальную терапию мы начинали сразу, при поступлении больных в гинекологический стационар, с препаратов широкого спектра действия, принимая во внимание, что за развитие гнойного воспаления ответственны ассоциации аэробных бактерий (39,3%), ассоциации анаэробных бактерий (33,5%) смешанные аэробно-анаэробные ассоциации (16,1%) и лишь в каждом десятом случае - моноинфекция [9, 12]. Клинический опыт показывает, что наиболее эффективны комбинации двух и более антибактериальных препаратов синергического действия.
Другими важными направлениями патогенетической терапии следует считать детоксикацию, включая комплекс мер по улучшению микроциркуляции и реологии крови; воздействие на медиаторы и модуляторы воспаления; дифференцированную иммунокоррекцию.
Инфузионная терапия снижает уровень эндогенной интоксикации, способствует поддержанию оптимальных параметров гемодинамики, реологических свойств, объёма, белкового и ионного состава циркулирующей крови. Эффект детоксикации достигается за счёт гиперволемической гемодилюции. Использование растворов с более высокой, чем у плазмы, осмоляльностью (гиперосмоляльные растворы солей, глюкозы маннита, мочевины) или с более высоким коллоидно-онкотическим давлением (гиперонкотические коллоидные растворы или их комбинации) позволяет добиться перераспределения жидкости между сосудистым руслом и тканями.
Инфузионную терапию начинают с введения коллоидных растворов (полиглюкин, реополиглюкин, гелофузин). Они снижают вязкость крови, способствуют восстановлению кровотока в капиллярах, тормозят агрегацию форменных элементов крови, обеспечивают детоксикационный и диуретический эффекты. Другим важным компонентом инфузионной терапии являются простые и сложные солевые растворы, введение которых необходимо для нормализации водно-электролитного баланса. Общий объём инфузионной терапии у обследованных нами больных составлял от 1,5 до 2 л в сутки при соотношении коллоидных и кристаллоидных растворов 2:1. Инфузионную терапию продолжали 2-3 суток.
Воздействие на активность медиаторов и модуляторов воспаления достигается за счёт назначения нестероидных противовоспалительных препаратов (НПВП). Они оказывают влияние на основные патогенетические механизмы воспалительных реакций:
- уменьшают проницаемость капилляров, вследствие чего снижается интенсивность экссудативных проявлений воспалительных реакций [3];
- стабилизируют мембраны лизосом, что приводит к ограничению выхода в клетку и за её пределы лизосомальных гидролаз, способных повреждать любые тканевые компоненты;
- тормозят выработку АТФ и других макроэргических соединений, что приводит к угнетению воспалительной реакции;
- тормозят синтез и/или инактивируют медиаторы воспаления (простагландины, брадикинин, лейкотриены, гистамин, серотонин, лимфокины и т. д.), что определяет наличие болеутоляющих и жаропонижающих свойств препаратов этой группы;
- вызывают модификацию молекулярной конформации субстратов воспаления, препятствуя их вступлению в химические реакции с повреждающими факторами;
- тормозят пролиферативную фазу воспаления и, благодаря цитостатическому действию, уменьшают поствоспалительный склеротический процесс.
Группа НПВП включает салицилаты (ацетилсалициловая кислота), пиразолоны (анальгин), производные индолуксусной (метиндол), фенилуксусной (диклофенак), пропионовой (напросин), антраниловой (понстан, клотам) кислот, оксикамы (роксикам). Выбор препарата осуществляли в зависимости от клинической ситуации: для купирования лихорадки мы назначали аспирин и парацетамол, с целью обезболивания - анальгин или кеторолак, для достижения противовоспалительного эффекта - диклофенак или индометацин, преимущественно в форме ректальных суппозиториев.
Иммунокорригирующую терапию начинают на ранних этапах развития заболевания, сразу же после эвакуации воспалительного экссудата и дренирования гнойной полости. Задачами иммунотерапии являются: повышение эффективности, переносимости, безопасности всего комплекса лечебных мероприятий, функциональную активность и восстановление иммунной системы больного, предотвращение рецидивов заболеваниях [11].
Новым отечественным иммунокорригирующим препаратом является Полиоксидоний ® . Данный препарат представляет собой уникальную полимерную молекулу, обладающую многогранным положительным воздействием на организм человека. Это воздействие заключается в иммуномодулирующем, детоксицирующем, антиоксидантном, мембраностабилизирующем эффектах [4-7,10].
Полиоксидоний ® является физиологически активным соединением с молекулярной массой 100 kD и обладает выраженной иммуномодулирующей активностью. По своей химической структуре он является сополимером N-окси 1,4-этиленпиперазина и (N-карбоксиэтил-) 1,4-этиленпиперазиния бромида.
Препарат обладает иммуномодулирующим действием, увеличивает резистентность организма в отношении локальных и генерализованных инфекций. Основой механизма иммуномодулирующего действия Полиоксидония ® является прямое воздействие на фагоцитирующие клетки и естественные киллеры, а также стимуляция антителообразования.
Иммуномодулирующий эффект связан со способностью Полиоксидония ® нормализовать функциональную активность клеток моноцитарно-макрофагальной системы, активация клеток которой ведёт к повышению функциональной активности практически всех звеньев защиты организма от инфекции:
- факторов естественной резистентности: нейтрофилов, моноцитов, макрофагов, NK-клеток;
- факторов приобретенного иммунитета: гуморального и клеточного.
Детоксицирующее действие связано с особенностями химической структуры Полиоксидония ® , который, являясь высокомолекулярным веществом, содержит на своей поверхности большое количество активных группировок. В силу этого Полиоксидоний ® обладает способностью сорбировать различные токсические вещества, в том числе микробной природы.
Антиоксидантное и мембраностабилизирующее свойства Полиоксидония ® также тесно связаны с особенностями его химической структуры. Полиоксидоний ® повышает устойчивость мембран клеток к цитотоксическому действию лекарственных препаратов и химических веществ, снижает их токсичность.
Полиоксидоний ® характеризуется высокой биодоступностью (89%), достигая максимальной концентрации в крови при внутримышечном введении через 40 минут, быстро распределяется по всем органам и тканям. Период полураспределения в организме при внутривенном введении - 25 мин, полувыведения (медленная фаза) - 25,4 ч, при внутримышечном введении -36,2 ч. В организме препарат гидролизуется и выводится преимущественно через почки.
Полиоксидоний ® оказывает влияние на все звенья защиты организма от чужеродных агентов антигенной природы, повышая пониженные и понижая повышенные показатели иммунитета, т. е. является истинным им- муномодулятором. Мишенями для Полиоксидония ® являются клетки фагоцитарной системы и естественные киллеры. Он может стимулировать или оказывать костимулирующий эффект на продукцию этими клетками IL 1., IL 6, TNF-a. и интерферона. Другим важным свойством Полиоксидония ® является его способность усиливать способность фагоцитов убивать бактерии. При недостаточности гуморального иммунитета Полиоксидоний ® существенно усиливает антителообразование. Помимо иммуномодулирующего эффекта, Полиоксидоний ® характеризуется наличием детоксицирующей, антиоксидантной и мембраностабилизирующей активности. Это делает его незаменимым препаратом в комплексном лечении острых и хронических инфекций любой этиологии.
Показано, что под влиянием Полиоксидония ® приходят в движение все звенья защиты организма от чужеродных агентов антигенной природы: фагоцитоз, Т- и В-система иммунитета, причем первичными мишенями для действия Полиоксидония ® являются нейтрофилы, моноциты/макрофаги и естественные киллеры. По механизму действия на факторы иммунной защиты Полиоксидоний ® является классическим примером иммуномодулятора: он исправляет нарушенные, не действуя на нормальные показатели иммунитета. Особенно чётко это проявляется на модели цитокинов и естественных киллеров. Так, например, при исходно пониженных или средних уровнях Полиоксидоний ® может повысить продукцию фактора некроза опухоли, при исходно повышенном уровне указанного показателя он несколько понижает его продукцию. Механизмом действия обоснованы показания для клинического применения Полиоксидония ® .
Полиоксидоний ® разрешен к медицинскому применению у детей и взрослых в трех лекарственных формах: в виде инъекций , суппозиториев и таблеток.
С целью оценки клинической эффективности применения препарата Полиоксидоний ® в комплексной терапии больных с абсцедирующими формами воспалительных заболеваний придатков матки все обследованные пациентки были разделены на две группы, сопоставимые по выраженности клинических симптомов и иммунологических параметров, локализации патологического процесса и применению компонентов лечения. Первую (основную) группу составили 32 пациентки, которым в комплекс терапии, кроме антибактериальных, дезинтоксикационных средств, а также препаратов, воздействующих на медиаторы и модуляторы воспаления, включили применение Полиоксидония ® , во второй -контрольной - группе (36 женщин) было использовано общепринятое лечение.
Полиоксидоний ® вводили по следующей схеме. При купировании острого воспалительного процесса в первые два дня применяли по 6 мг внутримышечно каждый день, в последующие дни (с 3-го по 11-й) - по 6 мг через день.
Критериями эффективности проведенной терапии были: общее самочувствие, длительность лихорадки, выраженность болевого синдрома динамика перитонеальных симптомов; показатели лейкоцитоза и активности острофазовых реактантов крови, а также иммунологические показатели.
Дренирование гнойных воспалительных образований под контролем трансвагинальной эхографии и проведение комплексной этиотропной и патогенетической терапии у всех обследованных больных оказалось эффективным. После проведённой малоинвазивной хирургии и комплексного лечения у всех больных отмечалось уменьшение объема образований в области гениталий и инфильтративных перифокальных воспалительных изменений, определяемых при бимануальном исследовании.
Однако темпы улучшения состояния, динамика исчезновения общих и местных клинических симптомов заболевания, острофазовые показатели крови и иммунологические параметры оказались различными у пациенток основной и контрольной групп.
Так, у пациенток основной группы длительность лихорадки составила 2 дня, у больных контрольной группы -3-4 дня. Количество лейкоцитов и активность острофазовых показателей крови снизилось и нормализовалось у пациенток первой группы в течение 3 дней, в то время как у больных второй - через 5-6 дней.
Контрольная трансвагинальная эхография позволила оценить клинический эффект проведенного лечения и установить более быстрое исчезновение ультразвуковых признаков острого воспалительного процесса придатков матки, полное исчезновение очага гнойного воспаления, полость которого замещается грануляционной тканью, у пациенток основной группы. Это свидетельствует о системном воздействии препарата Полиоксидоний ® .
Иммунологические показатели также существенно различались у больных, получавших и не получавших Полиоксидоний ® .
Показатели CD3+, CD4+, CD8+, CD16+, CD20+ у пациенток основной и контрольной групп до начала лечения не различались. При этом отмечалось снижение CD3+, CD4+, CD8+ лимфоцитов и повышение CD16+, CD20+ клеточных элементов до начала реализации лечебных мероприятий (малоинвазивного хирургического вмешательства и комплексной этиотропной и патогенетической терапии). После проведенного лечения отмечено статистически достоверное повышение показателей CD3+, CD4+ у пациенток основной группы по сравнению с контрольной.
Таким образом, применение иммуномодулирующего препарата Полиоксидоний ® в комплексной терапии больных с абсцедирующими формами воспалительных заболеваний придатков матки приводит к повышению эффективности лечебных мероприятий. Это выражается в ускорении темпов исчезновения общих и местных симптомов заболевания, эхографических признаках воспаления, а также способствует нормализации иммунного статуса обследованных пациенток. Иммуномодулятор Полиоксидоний ® целесообразно включать в комплекс терапии больных с гнойными воспалительными заболеваниями придатков матки.
Читайте также:


