Война бактерий с вирусами
Все знают вирусы, которые поражают человека: вирус гриппа, вирус иммунодефицита человека, из самых известных еще вирус оспы, от которого, к счастью, удалось избавиться, вирус полиомиелита — много-много разных вирусов. Полезно понимать, что вирусы — это не изобретение эукариотического мира. До того как появились вирусы, заражающие эукариоты, существовало множество вирусов, которые заражают бактерии. Вирусы бактерий называются бактериофагами или просто фагами и существуют очень давно.
Картинка ровно такая же, как с нашими вирусами. Бактериофаг не сам проникает в бактерию, а впрыскивает туда свою ДНК, переключает все информационные процессы бактериальной клетки на изготовление новых бактериофагов. То есть он отключает синтез собственных белков и заставляет бактерию синтезировать белки фага. Постепенно бактерия превращается в мешочек с вирусными частицами, который затем лопается, бактериофаги выходят наружу, заражают новые бактерии — это довольно эффективный процесс. Ясно, что если бы так было, то бактерий бы не осталось: фаги заразили бы все бактерии, и они бы умерли. Этого не происходит, потому что у бактерий есть множество разнообразных механизмов защиты. Это еще одно проявление войны, которая происходит в микромире, теперь уже между бактериями и бактериофагами. Механизмы защиты есть очень разные и довольно остроумные. Примерно понятно, как они могли выработаться в ходе эволюции: можно наблюдать промежуточные стадии, которые оказались полезными, поэтому сохранились до наших времен.

Можно разрушить вирусную ДНК. Вирус присоединяется к белку на поверхности клетки, опознает таким способом бактерию, впрыскивает туда свою собственную ДНК, а клетка ее тут же разрушает. Для того чтобы разрушить ДНК вируса, надо ее узнать, отличить ДНК вируса от своей собственной ДНК, бактериальной. Это делается разными способами, например при помощи системы рестрикции-модификации, которую мы очень интенсивно используем в генной инженерии.
Второй способ. Есть фаги, которые модифицируют всю ДНК целиком. После этого ДНК такого фага не может узнать вообще никакая клеточная система. Клетки модифицируют свои системы, чтобы, наоборот, узнавать модифицированные буквы и не узнавать немодифицированные. За счет маленьких изменений белков и того, что они узнают, все время происходит гонка вооружений.
Для того чтобы опознать ту бактерию, которую ему надо заразить, фаг связывается с каким-то конкретным белком на поверхности бактерии. Это белок бактериальный, он для чего-то нужен (например, белок, транспортирующий что-то полезное). Но в ситуации, когда много фагов, которые узнают этот рецептор, он становится вредным, потому что это те ворота, через которые проникает фаг. Бактериальная клетка может либо вообще избавиться от такого белка, либо его модифицировать за счет точечных мутаций. Имеется в виду не то, что бактериальная клетка задумалась и решила поменять свой рецептор, чтобы фаги ее не узнавали. Происходят случайные мутации, и те из них, которые препятствуют распознаванию фагом, оказываются полезными в ситуации большой зараженности, и такие бактерии получают эволюционное преимущество.

Наконец, самый красивый и альтруистический пример ― это самоубийство, когда бактерия, которая заражена фагом, не продуцирует новых фаговых частиц, а просто совершает самоубийство, разлагается. Для этого тоже есть специальные молекулярные механизмы, что называется системой токсин-антитоксин. Представьте себе, что у вас есть два белка. Один ядовитый, его в клетке мало, он продуцируется с маленькой интенсивностью, но он долгоживущий, то есть молекул мало, но каждая из них живет долго. Второй белок — антитоксин, он может связаться с токсином и его заингибировать, то есть токсин больше не действует. Молекул антитоксина много, так чтобы свободных молекул токсина не образовалось даже случайно, но они короткоживущие. Молекулы в избытке, они быстро разлагаются, и клетка все время много их делает.
На первом этапе заражения фаг переключает все клеточные механизмы на синтез новых фагов, в частности механизмы синтеза токсина и антитоксина. Клетка перестает продуцировать собственные белки, заканчивается продукция токсина и продукция антитоксина. Что происходит? Токсин долгоживущий, значит, молекулы токсина как были, так и остались, они никуда не делись. Антитоксин разлагается, это происходит быстро, а новые молекулы антитоксина не производятся. Теперь появились свободные молекулы токсина, токсин отравляет клетку, и она умирает, не успев сделать новых фагов.
Почему такой механизм эволюционно мог закрепиться? Как может закрепиться такой механизм самоубийства? Казалось бы, клетке от этого ничего хорошего, она бы в любом случае умерла. Дело в том, что обычно бактериальные клетки не существуют изолированно. Бактериальные клетки живут колониями, и все клетки в колонии идентичны генетически. Метафорически можно рассматривать такую колонию как генетически однородный единый организм. Тогда отдельным клеткам оказывается полезно совершить самоубийство, потому что с точки зрения набора генов они все одинаковы. Если какая-то из клеток умерла, но ценой этого сохранились все остальные, то эволюционно это очень полезно, они все генетически идентичны. Для бактерии как вида неважна судьба отдельных клеток, вид все равно сохранил штамм — набор идентичных бактерий. Можно это сопоставить с обычной иммунной системой людей: наши иммунные клетки погибают в процессе борьбы с заражением, но благодаря этому сохраняется весь организм.
Еще один механизм, по времени открытый самым последним. Он будет очень широко использоваться, в генной инженерии уже используются отдельные компоненты этого механизма. Это очень похоже на человеческий иммунитет, потому что система адаптивная. Система рестрикции-модификации и система токсин-антитоксин работают всегда, но в индивидуальной бактерии адаптации под новые фаги не происходит. Бактерии адаптируются на эволюционных временах, когда за счет точечных мутаций происходит подстройка.

Это действительно удивительная система, она была открыта буквально в последние годы. Она эволюционно очень красивая и оказалась очень полезна в генной инженерии, потому что механизм точного опознавания фрагмента ДНК можно использовать для того, чтобы модифицировать геномы людей, растений, животных — кого угодно. Люди очень много это изучают, в частности в Сколтехе под руководством Константина Северинова, в том числе имея в виду индустриальное применение.

Подробнее:
— В чем важность исследований иммунитета бактерий, которые проводились в вашей работе?
— Работа посвящена новой недавно открытой системе антивирусной защиты бактерий — CRISPR/cas. То, что она существует и является именно системой иммунной защиты, стало известно только лет шесть-семь назад. Это очень новая популярная тема, ей занимаются многие лаборатории по всему миру. Эта система интересна тем, что работает по ламаркианским механизмам наследования: появление наследуемого признака непосредственно вызвано внешней средой. То есть
— Как работает эта система?
— Cистема состоит из CRISPR кассеты и cas-генов. CRISPR кассета — это участок ДНК, представляющий собой набор из уникальных коротких последовательностей в 20–30 пар азотистых оснований длиной (так называемые спейсеры), которые разделены повторяющимися последовательностями. Рядом с CRISPR кассетой находятся cas-гены, которые кодируют белки, необходимые для работы всей системы. Последовательности спейсеров, которые разделены повторами, совпадают с последовательностями в ДНК фагов или плазмид — внешних генетических угроз бактерии. Система способна узнавать последовательности ДНК угрожающих факторов, если они совпадают с последовательностью одного из спейсеров CRISPR-кассеты. Если такая ДНК распознана, соответствующие белки бактерии нападают на нее и уничтожают. В чем здесь ламаркианские черты? Спейсеры, которые запускают процесс уничтожения фага, берутся из самой последовательности фага. То есть ДНК бактерии изменяется не случайным, а направленным образом.
Процесс встраивания участка чужеродной ДНК в CRISPR кассету называется адаптацией. Это пример очень направленного генетического изменения. Однако четко механизм работы этой системы пока неизвестен.
Подробнее:
— Каким образом?
— Предположим, что есть фаг, данные о котором бактерия уже записала в свою CRISPR кассету. Что ему нужно сделать, чтобы все-таки заразить ее? Нужна мутация в участке ДНК, который соответствует спейсеру CRISPR кассеты бактерии. Тогда молекулярная машина не сможет найти соответствующий участок ДНК и разрушить фаг. Мы показали, что это не совсем так. Хотя молекулярная машина и не может уничтожить фаговую ДНК в этом случае, она узнает фаговую ДНК и привлечет белки, которые осуществляют процесс адаптации.
Экспериментальный факт такой: если клетки заразить фагом, ДНК которого не полностью соответствует спейсеру в CRISPR кассете клетки (но все же является схожей), то адаптация в такой системе происходит на два порядка более эффективно, чем если заразить клетки совершенно неизвестным им фагом.
Подробнее:
— Как вы определяете эффективность адаптации бактериальных клеток?
— У нас есть данные о генетике исходной популяции. Затем мы заражаем ее фагом, ждем какое-то время и затем секвенируем ДНК выживших клеток. Таким образом
мы смотрим, какие произошли изменения в CRISPR-кассетах, соотносим их с известными нам данными о ДНК фагов и делаем вывод о том, каким образом бактерии выжили, приспособились к новой угрозе.
Эти данные мы сравниваем с данными контрольного эксперимента, проведенного с фагами, ДНК которых были полностью неизвестны бактерии. Это позволяет нам сказать, что произошло с популяцией.
Подробнее:
— Как удалось набрести на эту мысль?
— Отчасти случайно, как это иногда бывает в науке. Мы проводили эксперименты с приспособляемостью бактерий, и идея была протестировать клеточную культуру на заведомо незнакомом фаге.
Однако по ошибке один из соавторов работы налил в чашку с бактериями как раз фаги, отчасти известные бактериям, то есть те фаги, которые несут последовательности ДНК, очень похожие на спейсеры CRISPR кассеты.
После завершения эксперимента, опять же не зная о закравшейся ошибке, мы проанализировали ДНК выживших клеток. Оказалось, что эффективность адаптации неожиданно высока. Стали разбираться в причинах, ошибка была найдена, и уже тогда эффект начали изучать более направленно.
Продолжается ли эволюция? Ответ — да. Собственно, на этом можно закончить. Было бы странно, если бы она три миллиарда лет продолжалась, а сейчас вдруг остановилась.
Эволюция бактерий
Зимой был флешмоб в Facebook: люди показывали свои фотографии сейчас и десять лет назад. Какие-то два человека сфотографировали положенные в чашку Петри таблеточки (антибиотиков. — Прим. T&P). В 2009-м вокруг них бактерий не было, а сейчас картина изменилась из-за лекарственной устойчивости, которую бактерии приобретают в результате продолжающейся у них эволюции.
Устойчивость не возникла в тот момент, когда мы начали употреблять антибиотики. Химическая война между разными микроорганизмами происходила всегда. Нас заботит вопрос, когда лекарственную устойчивость, которой раньше у них не было, приобрели наши патогены. Можно посчитать, что проходит примерно 10–15 лет между началом клинического употребления антибиотика и появлением значительного количества штаммов патогенов, устойчивых к этому антибиотику.
Самая сильная борьба идет между представителями одного вида, потому что они занимают одну экологическую нишу и соревнуются за один и тот же ресурс. Есть антибиотики — колицины, — которыми разные штаммы кишечной палочки травят друг друга. Если в одну пробирку поместить дикий штамм, чувствительный к антибиотику, и продуцент колицина, то последний сделает антибиотик и быстро убьет чувствительный штамм:

А что будет, если в одну пробирку поместить продуцент и устойчивый штамм? Производство антибиотика — штука небезобидная, оно чего-то стоит, и поэтому через некоторое время выяснится, что устойчивый штамм размножается быстрее и вытесняет продуцента. Но устойчивость тоже дается не просто так, а ценой порчи некоторых клеточных механизмов: вместе с антибиотиком из клетки выкидывается и полезное. Поэтому если поместить в одну пробирку устойчивый и дикий тип, то последний постепенно вытеснит устойчивого. Наконец, если всех троих посадить в одну банку, то продуцент сразу сделает антибиотик и убьет дикого типа (потому что отравиться — это быстро), после чего их остается двое. А что бывает в такой ситуации, мы уже знаем. Останется устойчивый.
В 2002 году исследователи провели соответствующий эксперимент: взяли чашку Петри, в узлы треугольной сетки на чашке случайным образом нанесли представителей этих трех штаммов и дали им расти. На третий день колонии выросли настолько, что начали соприкасаться. В отличие от банки, где бактерии плавают и встречаются все вместе в общей среде, в чашке Петри плоская среда и антибиотик по ней не распространяется — где его произвели, он там и остается. Поэтому каждая граница смещается туда, куда ей и положено смещаться.
Спустя пару лет те же ученые сделали другой эксперимент. Они взяли 12 клеток, в каждую из них посадили трех мышек, каждую мышку заразили своим штаммом кишечной палочки и создали такие условия, чтобы мышки свободно друг друга заражали. В итоге в каждой клетке оставался всегда какой-то один штамм — и это никогда не был продуцент. Если кому-то нужна мораль — вот она: гадости делать плохо .
Подчеркну две существенные идеи этих экспериментов. Во-первых, продукция антибиотика микроорганизмом и устойчивость к антибиотику всегда даются ценой чего-то. А, во-вторых, то, как происходит отбор, зависит от условий. Когда мы вносим антибиотик, мы на самом деле добавляем новый фактор отбора.
Бездумные игры с пенициллином
В работе трехлетней давности исследователи взяли емкость размером 1,2×0,6 м, нанесли на него питательную среду и антибиотик. С одного края антибиотика не было совсем, в следующей части емкости была минимальная доза, которую бактерии не могут переносить, затем в десять раз больше, в сто раз больше и, наконец, в тысячу раз больше. Сверху повесили камеру, на края нанесли бактерии и стали снимать, что происходит.
Сначала ничего не происходило. Через 44 часа бактерии заняли зону, свободную от антибиотиков, а еще через 44 часа отдельные представители прорвались в зону, где антибиотик уже был, получили возможность там размножаться (значит, что-то у них поменялось) и постепенно заполнили следующую зону. Прошло еще 44 часа, появились еще более устойчивые и затем еще более устойчивые. Через 11 суток образовались бактерии, способные перенести тысячекратную смертельную дозу антибиотиков.
Представим человека, у которого заболело горло. Он принял антибиотик. Горло прошло через день, зачем травиться? Бросил. Что случилось? Колесико провернулось на одно деление. Следующий человек, который заразился этой же бактерией, принимал антибиотик уже два дня, следующему пришлось принимать уже недельный курс — и т. д.
На фермах патогены встречаются с почвенными бактериями. Химическая война в почве происходила всегда, но раньше патогены никогда не встречались с антибиотиками, у них не было этого фактора отбора. Теперь же в результате горизонтального переноса генов, когда один вид бактерий может получить ДНК другого, получился биореактор — ровно те условия, которые нужны, чтобы вырастить лекарственно-устойчивый штамм. В результате растет доля заболеваний, вызванных такими бактериями.

У этого явления есть и экономическое следствие: разработка антибиотиков становится невыгодной. Затраты на их разработку колоссальные, а время жизни антибиотиков, когда они действительно работают и когда их покупают, не очень большое. В результате количество новых антибиотиков, введенных в клиническую практику, уменьшается год от года. В 1990 году фармкомпаний, которые занимались антибиотиками, было 18, в 2011 году их было уже только четыре.
Рак как эволюционный процесс
Рак на самом деле тоже эволюционная болезнь. Каждая опухоль неоднородна, разные клоны раковых клеток соревнуются за ресурс, которым является организм человека, заболевшего раком. В разных клонах происходят разные мутации, и быстрее всего делящийся клон становится большинством в опухоли. Это описывается классическими эволюционными построениями. Можно сравнить картинку из обзора 1965 года (просто про отбор) и изображение из обзора 2006 года (про отбор в раке). Прошло 40 лет, но, кроме цвета, они ничем не отличаются.

Современные методы позволяют брать образцы из разных участков опухоли, определять последовательность генома клеток и смотреть, какие мутации произошли. На получающемся эволюционном дереве становится видно, как постепенно опухоль набирает мутации, делающие ее все более и более злокачественной. Несколько лет назад редакционная статья в Science, одном из самых гламурных научных журналов, была посвящена тому, что врачей надо учить эволюционной теории, потому что без этого понимания лечить многие болезни уже не получается.
Даже жизнь лимфоцитов в нашей иммунной системе, процесс возникновения иммунитета происходит в той же эволюционной парадигме. Фактор отбора — это качество узнавания антигена: когда мы чем-то заболели или вакцинировались, быстрее делятся лимфоциты, которые лучше узнают антиген, и у нас появляется иммунитет к данному возбудителю.
Эволюция вирусов
Вирусом иммунодефицита человека (ВИЧ) мы заразились от обезьян, причем несколько раз: вирусом первого типа (основным, который вызвал эпидемию синдрома приобретенного иммунодефицита — СПИД) — от шимпанзе, а вирусом второго типа — от макак. Так выглядит эволюционное дерево разных штаммов ВИЧ, взятых от обезьян и людей:

Длина веточки — это количество мутаций, произошедших в вирусе за это время, прошедшее с момента появления ВИЧ. Образец, который взят раньше, еще не накопил всех мутаций, которые могли бы случиться. Если один образец взят 15 лет назад, а другой сейчас, то по сравнению с предком у современного образца замен будет больше. Существует общий предок всех этих вирусов, и по количеству замен мы можем понять, сколько времени прошло от каждого современного образца до этого общего предка. Если по одной оси отложить расстояние по эволюционному дереву, а по другой — дату, когда взят образец, то мы увидим линейную зависимость. Если экстраполировать ее назад, в точку, где количество замен равно нулю, то мы узнаем, когда жил общий предок всех этих вирусов. Так ученые выяснили дату, когда началась современная эпидемия СПИДа, — 1930-е годы.
До сих пор речь шла о случайных изменениях в вирусе. Но ведь у него бывают и полезные замены: вирусу необходимо менять свои поверхностные белки, потому что он борется с иммунной системой, научившейся распознавать его предыдущую версию. Есть методы, позволяющие идентифицировать места в белке, которые эволюционируют быстрее, чем если бы это было случайно. Идея в том, что если мы хотим сделать вакцину от ВИЧ, то она должна быть разработана против такого места в вирусе, которое он не сможет легко и быстро поменять.

Эволюция человека
У одного чудесного белка — дофаминового рецептора — есть, грубо говоря, две формы — так называемая длинная и так называемая короткая. Длинный вариант часто бывает у людей, показывающих высокие значения по тесту на novelty seeking (поиски нового).

Короткий вариант часто встречается у людей в Китае, а длинный — в Америке и в Австралии у белого населения. Причины ясны. Кто едет на новый континент? В Америку отправлялись за теми самыми поисками нового, а в Австралию просто ссылали каторжников (ясно, что поведение, связанное с поисками нового, часто приводит людей на каторгу).
Гены все время эволюционируют. Сейчас уже накопилось достаточно данных, чтобы проследить за человеческой эволюцией последнего времени. Ученые посмотрели, как действовал отбор в течение последних двух тысяч лет на Британских островах, и оказалось, что очень адаптивно быть высоким голубоглазым блондином или блондинкой.
Сегодня развиваются медицина и социальная структура общества, и отбор происходит совсем не так, как когда племена охотников жили в лесу. Это влияет на эволюцию: увеличивается генетический груз, то есть доля вредных и слабовредных мутаций в популяции. Ухудшаются стартовые возможности — и физические, и когнитивные. Тем не менее с развитием медицины и педагогики и на таком субстрате потенциально мы можем добиваться лучших результатов. Что с этим делать — отдельный вопрос.
Литература
Kerr B, Riley MA, Bohannan BJ. Nature 2002
Kirkup BC, Riley MA, Nature 2004
Michael Baym, Tami Lieberman, Eric Kelsic, Remy Chait, Rotem Gross, Idan Yelin, Roy Kishony. The Evolution of Bacteria on a “Mega-Plate” Petri Dish. Harvard Medical School, 2016
Randolph M. Nesse, Stephen C. Stearns, Gilbert S. Omenn. Medicine Needs Evolution. Science 24 Feb 2006: Vol. 311, Issue 5764, pp. 1071
Field Y, Boyle EA, Telis N, Gao Z. Detection of human adaptation during the past 2000 years. Science. 2016 Nov 11;354(6313):760-764.
Мы публикуем сокращенные записи лекций, вебинаров, подкастов — то есть устных выступлений.
Мнение спикера может не совпадать с мнением редакции.
Мы запрашиваем ссылки на первоисточники, но их предоставление остается на усмотрение спикера.
Коронавирус заразил множество людей. Наверное, вы уже задавались вопросом, а что же вообще такое эти вирусы?
Если из носа у вас течет, в этом, как правило, виноват обычный простудный вирус. К счастью, у нас имеется иммунитет, способный справиться с простудой, так что она быстро проходит.
Другие вирусы победить сложнее.
Существуют лекарства против вирусов, но они не всегда эффективны. Поэтому если вирус проник в клетки организма, задача иммунной системы — очистить их.
Между бактериями и вирусами — большая разница
И бактерии, и вирусы могут стать причиной болезни человека. Но при этом они очень разные.
Внутри бактериальной клетки есть все, что требуется для жизни. Бактерия способна питаться, размножаться и избавляться от ненужных ей веществ. А вот вирус этого не может. Он выживает только за счет других, просто-напросто заставляя чужие клетки работать на себя.
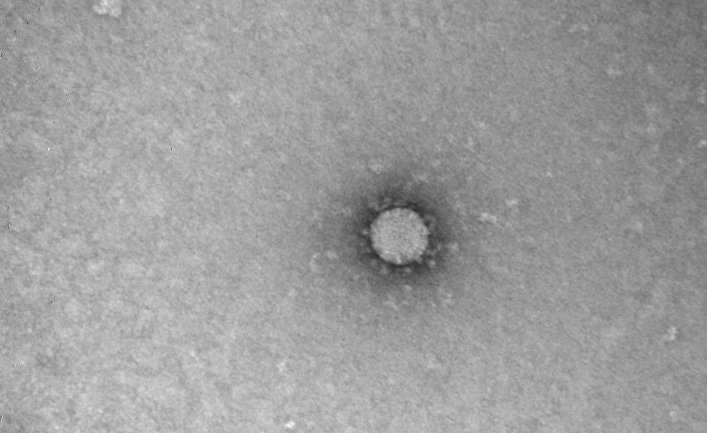
Вирус проникает в клетку. А затем начинает пользоваться ею, производя множество своих копий. Некоторые вирусы копируют себя в таких количествах, что клетка в итоге просто лопается и погибает. Из нее высвобождаются миллионы новых вирусов, готовых атаковать следующую клетку.
Коробка с инструкцией внутри
Клетка — очень сложная система. Вирус же, напротив, относительно примитивен. На самом деле он даже не выполняет все требования, сформулированные учеными, чтобы дать определение живого существа.
Вирусы ничего не поглощают и не выделяют. Все эти заботы они перекладывают на других.
Представьте себе вирус в виде маленькой коробочки. Внутри лежат его гены — своего рода инструкция, в которой описывается, как вирус работает.
Хорошие вирусы
Мы постоянно носим в себе множество вирусов. Они присутствуют повсюду. Но, к счастью, далеко не все вирусы опасны. Некоторые из них даже участвуют в очень важных процессах в природе.
Например, в чайной ложке воды — несколько миллионов вирусов! В море они убивают бактерии, обеспечивая питанием прочие организмы.
Большинство вирусов не вредят людям, ведь они атакуют лишь определенный тип клеток.
Некоторые вирусы нападают только на свиней, другие вызывают заболевания у растений. Третьи предпочитают бактерии. На земле существуют вирусы практически для всего живого.
Могут изменяться
Нынешний коронавирус изначально был вирусом животных. Вероятно, его носителями были летучие мыши.
Как вышло, что он перекинулся на людей?
В процессе создания копий вируса периодически случаются ошибки. Копия получается не совсем точной. Это называется мутацией.
Но изредка вирусы мутируют так, что, вместо того чтобы заражать животных, начинают атаковать клетки человека. Если в организм человека попадает такой вирус, это может стать началом нового опасного заболевания.
Нужен ключ

Клетка стала фабрикой по производству вируса
Клетка вырабатывает все, что нужно вирусу. Она становится вирусной фабрикой.
Готовые вирусы затем могут покинуть клетку и отправиться в путешествие по организму. Либо клетка настолько переполняется вирусами, что лопается и погибает. И тогда множество новых вирусов вырываются на волю и атакуют новые жертвы.
Вот почему человек болеет
В организме поднимается тревога. Иммунитет выпускает своих агентов, чтобы они арестовали непрошеных гостей. В этот момент человек чувствует себя слабым и больным.
Вирусы гриппа и коронавирус атакуют и повреждают клетки легких.
У заболевших коронавирусом поднимается температура и начинается кашель. Когда мы болеем гриппом, мы тоже страдаем от насморка и кашля. Так организм реагирует на инфекцию и защищается от нее.
Коронавирус распространяется по воздуху в маленьких капельках жидкости, при кашле вылетающих изо рта человека. Вдохнуть эти капельки может кто угодно. Либо кто-то может прикоснуться к месту, где они осели, а затем дотронуться до рта. Таким образом вирус распространяется.
Лекарства и вакцины могут помочь
Поскольку вирус на самом деле не совсем живое существо, очень трудно найти против него эффективное лекарство, которое при этом не навредило бы клеткам.
От некоторых вирусов защищают вакцины. Когда мы прививаемся, наш иммунитет учится распознавать вирус. В таком случае он нападает на вирус настолько быстро, что тот просто не успевает наплодить множество копий.
Сейчас ученые одновременно разрабатывают и лекарства, и вакцины против коронавируса.
От некоторых вирусов избавиться нельзя
Такое случается, например, когда иммунная система не в состоянии отследить вирус. К подобному типу относится вирус герпеса.

О мире вирусов известно многое, но еще больше ученым только предстоит узнать.
Гигантские вирусы
Вирусы — мельчайшие и простейшие микроорганизмы из всех существующих на Земле.
Если представить, что клетка — это авианосец, то бактерия по сравнению с ней покажется обычной весельной лодкой. А вирус — бутылочной пробкой, качающейся на волнах поблизости.
Но на самом деле есть и вирусы побольше. Их обнаружили всего несколько лет назад. Самые большие вирусы даже крупнее, чем простые бактерии. У них гораздо больше генов, чем у остальных вирусов, и большая часть их генетического материала совершенно не изучена.
Ученые задаются вопросом, откуда взялись гигантские вирусы. Может, прежде чем стать паразитами, они относились к отдельному виду живых организмов, обитавших на планете давным-давно?
К счастью, нам не стоит особенно бояться этих гигантских вирусов, как свидетельствуют проведенные исследования. Похоже, они предпочитают жить за счет амёб — одноклеточных организмов.
Материалы ИноСМИ содержат оценки исключительно зарубежных СМИ и не отражают позицию редакции ИноСМИ.
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()



![]()

![]()

![]()
- Популярное
- Обсуждаемое
При полном или частичном использовании материалов ссылка на ИноСМИ.Ru обязательна (в интернете — гиперссылка).


Произошла ошибка. Пожалуйста, повторите попытку позже.
Факт регистрации пользователя на сайтах РИА Новости обозначает его согласие с данными правилами.
Пользователь обязуется своими действиями не нарушать действующее законодательство Российской Федерации.
Пользователь обязуется высказываться уважительно по отношению к другим участникам дискуссии, читателям и лицам, фигурирующим в материалах.
Публикуются комментарии только на русском языке.
Комментарии пользователей размещаются без предварительного редактирования.
Комментарий пользователя может быть подвергнут редактированию или заблокирован в процессе размещения, если он:
В случае трехкратного нарушения правил комментирования пользователи будут переводиться в группу предварительного редактирования сроком на одну неделю.
При многократном нарушении правил комментирования возможность пользователя оставлять комментарии может быть заблокирована.
Пожалуйста, пишите грамотно – комментарии, в которых проявляется неуважение к русскому языку, намеренное пренебрежение его правилами и нормами, могут блокироваться вне зависимости от содержания.
Читайте также:


