Вирусы не имеют митохондрий

В пищеварительном тракте позвоночных животных живёт простейший организм, у которого никогда не было митохондрий.
Вся жизнь делится на три домена: бактерий, архей и эукариот, где эукариоты – это растения, животные, водоросли, грибы и огромная масса мельчайших одноклеточных существ, называемых простейшими.
Разнообразие эукариот, как видим огромно, достаточно сравнить одноклеточную инфузорию или малярийного плазмодия с весьма многоклеточным человеком, однако некоторые особенности неизменно присутствуют у всех эукариотических организмов, и одна из таких особенностей – наличие в клетках митохондрий. Так называют мембранные структуры, которые служат энергетическими станциями – в митохондриях идут биохимические реакции по извлечению энергии из расщепляемых молекул.
У митохондрий есть собственная ДНК, кодирующая ферменты, которые необходимы для энергетических реакций, и у них есть собственный аппарат для синтеза этих белков; кроме того, некоторые гены, нужные для функционирования митохондрий, есть в ядерных хромосомах – основном клеточном хранилище генетической информации.
И вот оказалось, что некоторые эукариоты могут обходиться без митохондрий. Владимир Хампл (Vladimir Hampl) из Карлова университета в Праге вместе с коллегами из Университета Альберты, Университета Далхаузи и Остравского технического университета опубликовал в Current Biology описание простейшего Monocercomonoides из пищеварительного тракта позвоночных животных – у Monocercomonoides, как оказалось митохондрий вообще нет.
Здесь следует уточнить, что на самом деле про безмитохондриальных эукариот известно относительно давно – есть такая группа жгутиковых простейших, как Metamonada, у которых нет этих энергетических органелл. (В качестве примера можно привести кишечную лямблию, возбудителя лямблиоза у человека.)
Считается, однако, что изначально митохондрии у метамонад были, просто они потом в эволюции утратили. Тому есть определённые доказательства: во-первых, у некоторых метамонад остались рудименты митохондрий, называемые митосомами и гидрогеносомами, во-вторых, в геноме таких простейших остались гены, которые когда-то определённо относились к митохондриям, а некоторые из таких генов вообще принадлежали собственной митохондриальной ДНК, переместившись в ядро после того, как митохондрии начали деградировать.
Однако в геноме Monocercomonoides (который, кстати, входит в ту же большую группу метамонад) не нашли никаких следов митохондриальных генов – ни тех, которые были в митохондриальной ДНК, ни тех, которые кодировали белки митохондрий, находясь в ядре.
Те, о ком шла речь выше, кто вторично утратил митохондрии, поступили так потому, что им приходится жить там, где мало кислорода. Митохондрии получают энергию с помощью кислородного окисления, только процесс этот растянут на много этапов и много белков; ну а если кислорода нет, то и вся окислительная кухня митохондрий, получается, не нужна.
Monocercomonoides тоже живут в условиях с низким содержанием кислорода (в желудочно-кишечном тракте), так что отсутствие митохондрий у них объяснимо; более того, у них даже нет белков, которые были бы хоть в чём-то похожи на митохондриальные ферменты. Однако, поскольку у Monocercomonoides есть эволюционные родственники с митохондриями, то очевидно, что и у предка Monocercomonoides они были, а сам он их утратил за ненадобностью.
Митохондрии не только служат энергетическими станциями, они ещё собирают вышеупомянутые железосерные кластеры – комплексы атомов железа и серы, которые могут получать, отдавать, переносить или накапливать электроны и которые используются клеткой много где. Митохондрии их собирают и экспортируют в цитоплазму, а там железосерные кластеры уже встраиваются в какие-то ферменты.
Специалисты пока комментируют новую работу достаточно осторожно, выказываясь в том смысле, что как же мы мало знаем ещё про эволюцию эукариот и сколько всего нового мы можем узнать, если будем уделять больше внимания малоисследованным одноклеточным.
Митохондрии – маленькие труженики или большие начальники?
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.

Рис. 1. Схематическое строение митохондрии
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Итак, если в клетку какой-либо из этих тканей (кроме некоторых нейронов в мозге, об этом потом) поступает большое количество питательных веществ (поступление превышает затраты), то митохондрии находятся в разделенном (фрагментированном) состоянии. Если клетка находится в состоянии голода (поступления меньше затрат), то происходит слияние митохондрий и они находятся в соединенном состоянии. [3,4]. Так поддерживается гомеостаз клетки (рис.2).

Рис. 2 Регулирование морфологии и биоэнергетической эффективности митохондрий в ответ на избыточное или недостаточное поступление питательных веществ [из 2]
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).

Рис.3 Баланс энергопотребления и энерогообеспечения связан с соответствующими изменениями архитектуры митохондрий и их биоэнергетической эффективностью [из 3]
Физиологические процессы, связанные с увеличением спроса на энергию и снижением энергопоставок, (например, острый стресс, голодание и фаза G1/S) характеризуются удлинением митохондрий и дыханием, связанным с синтезом АТФ. С другой стороны, физиологические процессы, связанные с уменьшением спроса на энергию и увеличением ее поставок (высокий уровень питательных веществ, ожирение и диабет типа 2), связаны с фрагментацией митохондрий, выделением тепла или снижением функции митохондрий.
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
Длительное ингибирование деления митохондрий (при длительном клеточном голодании) приводит к накоплению поврежденных митохондрий, которые не могут быть сегрегированы [3, 4].
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.

Рис.4 Жизненный цикл митохондрий и его регулирование доступностью питательных веществ [из 3]
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).
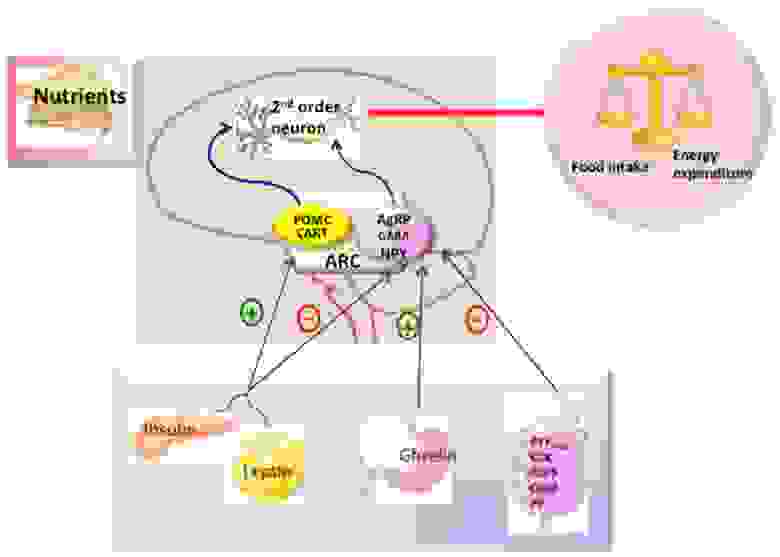
Рис. 5. Гипоталамический контроль метмболизма энергии. Мозг интегрирует метаболические сигналы (лептин, инсулин, грелин, PYY3-36) от периферических тканей, таких как поджелудочная железа, жировая ткань, желудок. В мозге специализированные нейронные сети координируют адаптивные изменения в поглощении и расходе пищи [из 5].
Изучение динамики митохондрий в тканях мозга показало, что динамика митохондрий играет существенную роль в способности нейронов гипоталамуса контролировать уровень глюкозы и гомеостаз энергии в организме [6,7,8].
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).

Рис.6. Метаболическая адаптация к стимулам окружающей среды [из 2]
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
1. Питание и физические упражнения
Циклы питания Избыток пищи и высокожировая диета (HFD) ингибирует слияние митохондрий в клетках (в некоторых нейронах мозга механизм иной). Незавершенный цикл деления-слияния митохондрий нарушает процессы аутофагии → увеличивается внутриклеточная гетерогенность митохондрий → не происходит селективного удаления митохондрий → накапливаются митохондрии с дисфункцией.
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
К насыщенным жирным кислотам относится пальмитиновая (С16) и стеариновая (С18). Показано, что употребление стеариновой кислоты (C18:0) стимулирует процесс слияния митохондрий. Действие ее связано с влиянием на митофузины. У мышей диетические добавки стеариновой кислоты могут частично восстанавливать митохондриальную дисфункцию, вызванную мутациями в генах Pink1 или parkin. В нейтрофилах людей, находящихся 2 дня на low-С18:0 диете, митохондрии находятся во фрагментированном состоянии (50% клеток имели фрагментированные МХ, 10 % соединенные МХ). Употребление стеариновой кислоты приводило у них к слиянию митохондрий через 3 часа [8]. Таким образом., стериновая кислота важна для поддержания циклов динамики митохондрий. Больше всего стеариновой кислоты находится в какао-бобах (31-34 %).
Фосфолипиды – основные компоненты мембран органелл. Они также регулируют динамику митохондрий, при этом их влияние различно [9].
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Для повышения эффективности доставки насыщенных жирных кислот в мембрану возможно использование переносчиков. Например, – использование насыщенного фосфатидилхолина (дипальмитофосфатидилхолин и дисероилфосфатидилхолин), который, потенциально, сможет доставить насыщенные ЖК прямо в кардиолипин [10]. Холин, как переносчик, легко проходит через цитозоль и поступает в митохондрии.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).
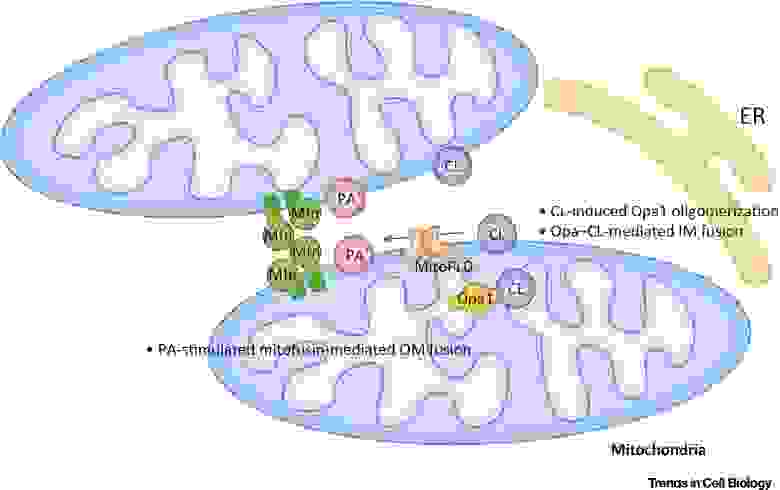
Рис.7 Регулирование слияния митохондрий фосфатидной кислотой (PA) и кардиолипином (CL) [из 9].
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Наиболее интересным является использование веществ, которые способны напрямую влиять на экспрессию митофузинов. Одним из потенциальных препаратов назван лефлюномид (leflunomide), который был одобрен FDA [5,11]. Он является индуктором экспрессии Mfn1 и Mfn2, а зарегистрирован был как препарат для лечения ревматоидного артрита.
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Ранее считалось, что образ жизни, в том числе переедание, приводит к образованию свободных радикалов, окислительному стрессу, мутациям митохондриального генома и, последовательно, нарушениям функциии митохондрий. Однако, в последнее время есть убедительные доказательства того, что мутации митохондриальной ДНК неизбежны, есть у всех (heteroplasmic DNA point mutations) и связаны с ошибками репликации, а не с оксидативными повреждениями, к которым митохондриальная ДНК довольно устойчива [12]. Уже на этапе оплодотворенной яйцеклетки часть наших митохондрий несут мутации. Со временем они делятся, мутантных митохондрий становится больше, они не могут нормально выполнять свою функцию.
Тут очень кстати можно было бы использовать редактирование генома митохондрий in vivo. Было показано, что для heteroplasmic DNA point mutations у мышей уже был достигнут значительный успех при помощи targeted zinc-finger nucleases (mtZFN) с доставкой при помощи аденовирусного вектора [13].
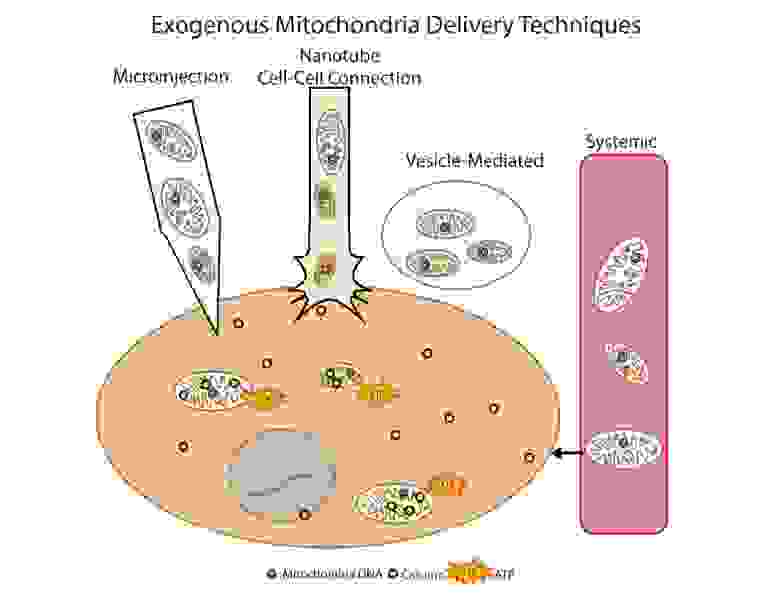
Рис.9 Способы доставки экзогенных митохондрий в клетку
Внутреннюю организацию клетки животных и растений можно сравнить с коммуной, где все равны и каждый выполняет одну, очень специфическую роль, создавая сбалансированный ансамбль. И вот только одна структура, митохондрия, может похвастаться множественностью внутриклеточных функций, которые определяют ее уникальность и обособленность, граничащие с некоторой самодостаточностью.
До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует
Эту структуру открыли в середине XIX века, и в течение 150 лет почти все считали, что ее единственная функция — быть энергетической машиной клетки. Грубо говоря, организм получает питательные вещества, которые после определенной деградации доходят до митохондрии и дальше происходит окислительная деградация питательных веществ, сопряженная с запасанием энергии в виде богатой энергией фосфорной связи в молекуле АТФ. Организм повсеместно использует энергию АТФ, расходуя ее на проведение нервного сигнала, мышечное сокращение, образование тепла, синтез нужных клеточных компонентов, уничтожение ненужных веществ и пр. В сутки в организме человека генерируется АТФ, весом равная весу самого человека, и в основном это заслуга митохондрий. До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует.
Постулат доминирующей в клетке энергетической функции митохондрии как-то оставлял в тени уже давно высказанную и всеми поддерживаемую теорию бактериального происхождения митохондрий. В простой трактовке она выглядит так: около 600 млн лет назад в клетку т. н. гетеротрофов внедряется бактерия, которая умеет утилизировать кислород. Есть точка зрения, что появление внутри клетки нового типа бактерий было вызвано постоянным увеличением в атмосфере Земли кислорода, начавшим поступать из мирового океана в атмосферу около 2,4 млрд лет назад. Высокая окислительная способность кислорода представляла опасность для внутриклеточных органических и неорганических элементов, и появляются бактерии, уничтожающие кислород в присутствии ионов водорода с образованием воды. Таким образом внутри клетки содержание кислорода уменьшается, а с ним и уменьшается вероятность нежелательного окисления клеточных компонентов, что, наверно, полезно для клетки.
Однако попадание в ядерную клетку бактерий давало им и ряд преимуществ, в частности, оно дало им эволюционную нишу с ограниченным объемом и окруженную мембраной. Можно было обеспечить больший запас различных веществ, которые можно "складировать" не внутри ограниченного собственного объема, а снаружи, но в пределах своей "собственности", где они не будут разворованы другими организмами. Это соображение подтверждается в условиях, когда клетка вдруг перестает получать кислород и питательные вещества (например, при прекращении кровотока в участок ткани, что происходит при инфарктах и инсультах). Митохондрия в этих условиях уже не может быть энергетической машиной клетки (производить АТФ без кислорода трудно) и превращается в паразита — она начинает поглощать АТФ для того, чтобы обеспечить генерацию разницы мембранных потенциалов на своей мембране и поддержать свои собственные процессы. Для чего это нужно митохондрии — пока не понятно, но полуавтономный статус митохондрии в клетке тут проявляется особенно заметно — подобное поведение в кризисных условиях выглядит довольно эгоистичным. Не для того ли она производит АТФ в количествах, превышающих нужды клетки, чтобы обеспечить себе "подушку безопасности" в условиях кризиса?
Попадание бактерий во внутриклеточную нишу обеспечивало и защиту от внешних врагов (а основные враги для бактерии — вирусы, то есть фаги). При этом было позволено выпускать сигнальные защитные вещества в ограниченный внутриклеточный объем; когда же бактерии существовали в "океане", выпуск таких сигнальных веществ был нерациональным — они немедленного разбавлялись в нем. Жизнь внутриклеточных бактерий в этой нише дала определенные преимущества: бактерии производят энергию и организуют в своей мембране белок, который выбрасывает в цитоплазму клетки синтезированный АТФ, чем клетка и пользуется. В итоге вроде бы наступает баланс: клетка дает митохондрии питательные субстраты, митохондрия дает клетке энергию,— что укрепляет теорию симбиотического взаимоотношения бактерий (они уже становятся митохондриями) с остальными частями клетки. Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики. Одним из родоначальников эндосимбиотической теории происхождения митохондрий можно считать русского ботаника Константина Мережковского, который в конце XIX — начале ХХ века предположил, что хлоропласты (структуры растительных клеток, отвечающие за фотосинтез) имеют бактериальное происхождение. Позже аналогичное предположение было сделано и для митохондрий.
Из сказанного видно, что понятие симбиоза и некоторого "эгоистического" поведения митохондрий довольно размыто. Да и идеалистическая картина симбиоза была "омрачена" в самом конце ХХ века открытием, что митохондрии, выпуская сигнальные молекулы, отдающие приказ на уничтожение клетки, отвечают за ее гибель. То есть вроде бы все по пословице "сколько волка ни корми. ". Однако надо взглянуть на ситуацию с другой стороны. Нужна ли клеточная смерть организму? Да, но не для всех клеток. Это обязательный процесс для тех клеток, которые постоянно делятся — иначе будет разрастание ткани, которое может быть нежелательным. Принципиально это и для предотвращения и лечения различного опухолеобразования. А вот для тех клеток, которые не очень умеют делиться, например, для нейронов или кардиомиоцитов, смерть не полезна. Если же рассматривать этот вопрос с позиции самих митохондрий, это выглядит как почти неприкрытый шантаж: или ты обеспечиваешь меня всем, что я хочу, или я убью тебя. С позиции же организма, все хорошо, когда митохондрия убивает неправильную клетку, и плохо, если убивает хорошую и нужную.
Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики
Приведенные выше рассуждения — это явный конфликт эволюционной стратегии и человеческой логики, пытающейся оценить ситуацию с позиции субъекта, внутри которого живут существа, способные из друзей превратиться во врагов. Этот конфликт не мешает исследователям понимать, что митохондрия, хоть она и "помнит", что была бактерией, активно участвует в функционировании клетки; важная роль митохондрий объясняет необходимость предоставления им привилегий. В определенных условиях они превращаются в источник наследуемых или приобретенных заболеваний — в частности, тех, которыми занимается митохондриальная медицина. Таких заболеваний — очень тяжелых и почти не поддающихся лечению — больше сотни. Да и помимо них есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий. Существуют теории митохондриального происхождения рака, болезни Паркинсона, Альцгеймера и других — с весьма достойным научным подтверждением.
Сегодня выяснилось, что большинство болезней сопровождается сбоем в работе внутриклеточной машины проверки качества митохондрий, своеобразного ОТК, отбраковывающего плохие митохондрии и отправляющего их на внутриклеточное переваривание (митофагию). Сбой возникает, например, при старении организма, и ОТК пропускает неправильные митохондрии. В результате в клетке начинают сосуществовать хорошие и плохие митохондрии. Когда же доля плохих превышает некоторый порог, наступает т. н. "фенотипическое проявление" болезни, которая до сих пор носила невидимый, латентный характер.
Можно сделать два вывода. Во-первых, без митохондрий ядерные клетки существовать не могут. Во-вторых, чтобы защитить клетку от поражения (чем бы оно ни было вызвано: химией, физикой или просто временем), надо "договориться" с митохондриями, то есть обеспечить им "достойное" существование. Это означает не только постоянную подпитку их активности за счет доставки питательных субстратов и кислорода, но и предоставление им своеобразной медицинской страховки, которая при необходимости обеспечит восстановление их структуры и функций и/или правильную утилизацию поврежденных митохондрий. Отсутствие утилизации поврежденных митохондриальных структур может привести к "заражению" здоровых структур, что непременно повлечет за собой заболевание.
Сейчас трансплантация органов стала вполне рутинной процедурой, хотя все еще сложной и дорогостоящей. Развивается и клеточная терапия, то есть пересадка стволовых клеток. А вот о возможности пересадки здоровых митохондрий говорить только начинают. Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка. Недавно для лечения последствий инсульта головного мозга оказалось достаточным обеспечить должное функционирование митохондрий почек. То есть налицо "разговоры" (по-английски это звучит более научно — cross-talk ) между органами, и почка со своими митохондриями помогает восстановлению головного мозга.
На каком языке "общаются" органы, еще предстоит выяснить,— пока предполагают химический язык общения. Хорошая и здоровая почка со своими здоровыми митохондриями вырабатывает и посылает в кровь эритропоэтин (тот самый, приемом которого увлекались спортсмены и который не только стимулирует выработку эритроцитов, но и мобилизует общий метаболизм, что повышает выносливость). Эритропоэтин обладает сильными нейрозащитными свойствами. Стоит повредить почку, скажем, неумеренным приемом антибиотиков (антибиотики убивают и митохондрии, потому что они — бывшие бактерии), и последствия инсульта головного мозга становятся более драматическими. Так на базе фундаментальных открытий начинает просматриваться стратегия лечения болезней.
Есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий
Возьмем, к примеру, сепсис — бактериальную инфекцию, одну из ведущих причин человеческой смертности. Сейчас уже можно — правда, пока шепотом — говорить и о "митохондриальном сепсисе", когда в кровь попадают компоненты митохондрий. Это не менее опасно, чем бактериальный сепсис, так как приводит к гиперактивации иммунного ответа (так называемый синдром системного воспаления, SIRS ) и возможной гибели организма.
Как уже было упомянуто, естественными врагами бактерий являются вирусы. Это также верно и для митохондрий. Недавно открытая бактериальная система защиты от вирусов CRISPR ( clustered regularly interspaced short palindromic repeats ), имеющая все признаки элементарно организованной иммунной системы, заставила задуматься: нет ли иммунной системы у митохондрий? У бактерий эта иммунная система устроена следующим образом: в бактериальном геноме (структурно очень похожем на митохондриальный) располагаются своего рода библиотеки, или антивирусные базы данных — куски генов тех вирусов, с которыми эта бактерия когда-либо встречалась. При считывании информации с этих участков синтезируются так называемые малые РНК. Эти РНК связываются с внедрившимися в бактерию вирусными нуклеиновыми кислотами, а затем такой комплекс расщепляется внутрибактериальными ферментами с нейтрализацией вируса. В чистом виде подобных структур в митохондриальном геноме обнаружено не было, кроме одного-единственного случая, описанного еще на заре исследования CRISPR-системы. Однако мы обнаружили отдельные случаи включения вирусных последовательностей в митохондриальный геном (вирусов гепатита B и гриппа), хотя и довольно редкие для того, чтобы говорить о системе. С другой стороны, наибольшее количество различных структур в геноме мы обнаружили в митохондриях растений, чей геном в разы больше митохондриального генома животных. Это особенно любопытно, учитывая, что растения в целом гораздо больше полагаются на противовирусную защиту на основе интерферирующих РНК, чем животные, поскольку не обладают особыми иммунными клетками, свободно перемещающимися по организму в кровотоке. Кроме того, не стоит забывать, что митохондрии делегируют значительную часть функций клетке, включая передачу части своего генетического материала в клеточное ядро, оставляя себе только "контрольный пакет акций", обеспечивающий их контроль над ключевыми функциями. Вполне возможно, что подобные клеточные библиотеки также были переданы в ядро — явление передачи малых РНК из цитоплазмы внутрь митохондрий известно. А значит, среди них могут быть и иммунные РНК. С другой стороны, возможно, что митохондрии полностью передали функции защиты клетке, довольствуясь возможностью убить клетку, которая их плохо защищает.
Приняв тезис "митохондрии помнят, что они были бактериями", мы можем поменять многое в стратегии базового научного мышления и практической медицинской деятельности, так или иначе связанных с митохондриями. А учитывая количество функций, выполняемых митохондриями в клетке, это большая часть всех биомедицинских задач: от рака до нейродегенеративных заболеваний.
Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка
Читайте также:


