Вирус из клеток vero

Геморрагическая лихорадка с почечным синдромом, вызываемая хантавирусами, занимает в Российской Федерации ведущее место среди зоонозных вирусных инфекций и одно из первых мест среди всех природно-очаговых болезней человека [3]. В связи с отсутствием лабораторной модели экспериментальных животных, чувствительных к размножению большинства хантавирусов, для выделения и культивирования этих вирусов активно используются клеточные культуры. Вместе с тем, хантавирусы, относящиеся к семейству Bunyaviridae, имеют характерные для большинства представителей этого семейства закономерности, связанные с трудностями их адаптирования к размножению в культурах клеток [2], прочной внутриклеточной ассоциацией и низким выходом вируса в культуральную жидкость. В обычных условиях культивирования хантавирусы не оказывают видимого цитопатического действия (ЦПД) на культуру клеток, в то время как в условиях искусственного закисления среды наблюдалось ЦПД в виде синцития [7].
Целью настоящего исследования явилось исследование морфологических характеристик вируса Пуумала, а также внутриклеточных структур клеток Vero E6, в процессе репликации в них вируса.
Материалы и методы
Исследования выполнены на модели хантавируса Пуумала, штамм K-27/Уфа-85. Вирус размножали в монослое клеток почки зеленой мартышки VeroE6 ( ATCC No. CRL-1586). Для роста клеток использовалась среда Игла MEM с добавлением 5% телячьей сыворотки и 200 мкг/мл канамицина. Титр вируса определяли методом индикации инфекционных фокусов в культуре Vero E6 [1].
Для морфологического исследования монослой клеток (зараженных, а также не зараженных) покрывали слоем фиксатора (глютеральдегид 2,5 % и параформальдегид 2,0% на буфере Хенкса) толщиной 1,5-2 мм и выдерживали в течение 30 минут. После ополаскивания буфером 3 раза по 5 минут стерильным шпателем клетки переносили в центрифужные пробирки и ресуспензировали в 1% растворе четырёхокиси осмия (OsO4) на буфере Хенкса для фиксации в течение часа. Клетки отмывали от фиксатора в трёх сменах буфера в течение 10 минут и обезвоживали в ацетоне восходящей концентрации (50%, 70%, 100%). Осадок клеток, полученный путём центрифугирования при 4000 об/мин в течение 10 минут, пропитывали в смеси эпоксидных смол эпон-аралдит с окисью пропилена, заключали в чистую смолу и полимеризовали при 55оС в течение 48 часов. С полученных блоков на ультрамикротоме изготавливали полутонкие срезы для светооптического изучения и ультратонкие срезы для исследования в электронном микроскопе JEM-100C. Полутонкие срезы окрашивали толуидиновым синим, а ультратонкие 1% раствором уранилацетата и цитратом свинца.
Результаты
Изучению патологических изменений культуры клеток при её заражении хантавирусом предшествовали исследования незаражённой культуры. При светооптическом исследовании полутонких срезов был выявлен клеточный полиморфизм, отражающий процессы созревания, инволюции и разрушения клеток (Рис. 1а).
Исследование зараженной культуры клеток в световом микроскопе на ранних сроках (3 суток) после инфекции, показало, что и в этом случае наблюдаются естественные процессы клеточной инволюции, практически не отличимые от таковых в незараженной культуре (Рис. 1б). При электронно-микроскопическом исследовании незараженных культур был обнаружен широкий спектр клеток, находящихся на разных стадиях жизненного цикла. Встречаются молодые небольшого размера клетки без признаков каких-либо нарушений и клетки на различных этапах деградации (деградация внутриклеточных структур, появление множественных вторичных лизосом (цитосегресом), набухание и изменение цитоплазмы, внутриклеточная гидратация в виде многочисленных вакуолей) (Рис. 2). Наряду с этим можно наблюдать клетки с полным разрушением цитоплазмы и клеточной оболочки.
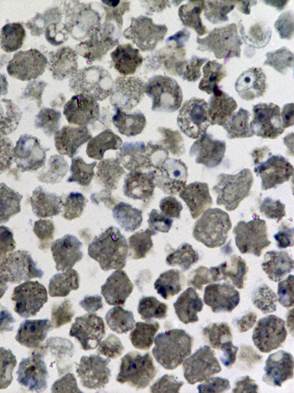
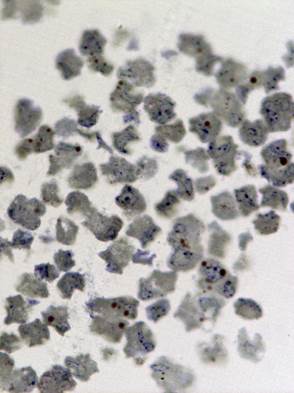
Рис. 1. Светооптическое исследование полутонких срезов культуры VeroE6.
а) нативная культура б) культура, зараженная вирусом Пуумала. Увеличение 20х60
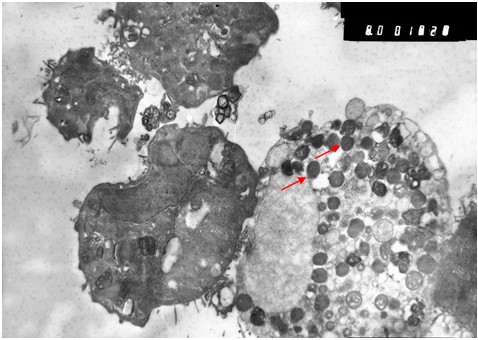
Рис. 2. Незараженная культура. Слева - молодая клетка, сверху стареющая клетка в процессе деградации, в цитоплазме которой множественные вторичные лизосомы (стрелка) и вакуоли. Увеличение х 6 тыс.
Таким образом, в незаражённой культуре клеток Vero E6 наблюдаются естественно протекающие процессы инволюции, которые при изучении заражённой культуры можно было бы принять за патологические изменения, вызванные хантавирусом.
При электронно-микроскопическом исследовании зараженной культуры, была получена картина, аналогичная картине при микроскопии незараженной культуры. Было отмечено, что на ранних сроках заражения встречаются молодые клетки, клетки в состоянии частичного распада и полной деградации у которых отмечается вакуолизация цитоплазмы, распад внутренней мембраны митохондрий, резкое просветление цитоплазматического матрикса и отсутствие рибосомального аппарата (Рис. 3).
При более длительном культивировании (7 суток) состояние заражённых клеток мало отличалось от 3-х суточной культуры. Вместе с тем, в этот период появлялись клетки с гораздо большим содержанием вирионов в цитоплазме (Рис. 4). Для сравнения следует указать, что титр вируса на 3 сутки составлял 3,6±0,4 lgФОЕ/мл, а на 7 сутки достигал максимальных показателей: 5,7±0,4 lgФОЕ/мл. В эти сроки наряду с вирионами в цитоплазме молодых и высокодифференцированных клеток обнаруживались вторичные лизосомы, состоящие преимущественно из миелиноподобных ламелл небольшого размера (150-200 нМ).
Рис. 3. Клетки, зараженные вирусом Пуумала. а) молодая клетка; б) разрушающаяся клетка. Вирионы хантавируса обозначены стрелкой. Увеличение х 10 тыс.
Визуально вирионы имели не только округлую, но и эллипсовидную форму размером около 90 нм в поперечнике и до 300 нм в длину. По абсолютно нормальной (без признаков патологии) картине клетки, представленной на иллюстрации, и большому количеству вирионов можно предположить, что в её цитоплазме вирус активно размножается. Следует отметить, что и при длительной инкубации заражённой культуры клеток инволютивные процессы протекают в культуре независимо от количества вирионов в цитоплазме и, скорее всего, не связаны с процессами вирусной репликации.
Рис. 4. Культура клеток Vero E6 на 7-е сутки после заражения. Большое количество вирионов хантавируса в цитоплазме (скобка). Увеличение х 10 тыс.
Обсуждение
Морфология хантавирусов впервые была описана для вируса Хантаан в 1982 году при негативном контрастировании вирусных частиц из вируссодержащей жидкости и лизата зараженных клеток, очищенных и сконцентрированных в градиенте плотности сахарозы [8, 10]. Применение этой методики позволило авторам представить описание вирионов, включая наличие шипиков на внешней оболочке и размеры вирионов от 90 до 120 нм, ставшие таксономическими характеристиками нового рода, получившего одноименное название. В последующих работах с применением электронной микроскопии основное внимание было уделено исследованиям, направленным на изучение морфологии вновь выделенных хантавирусов Нового света, включая механизмы созревания вирионов на клеточных мембранах [5, 9]. Позднее методом крио-электронной микроскопии вируса Хантаан было подтверждено, что вирионы имеют сферическую форму, однако средний диаметр их был определен в диапазоне от 120 до 154 нм (в среднем 130 нм) [4].
Результаты наших исследований выявили определенные отличия морфологии хантавируса Пуумала, вызывающего около 98 % случаев ГЛПС в России, от аналогичных характеристик, других патогенных хантавирусов, включая вирус Хантаан. Так, особенностью вирионов, наблюдаемых на ультратонких срезах зараженной культуры, является гетерогенность их формы (округлые и эллипсовидные) и размера (от 90 до 300 нм). Вариации в размере вирусных частиц могут объясняться особенностями методического подхода – диаметр вируса существенно больше толщины среза, поэтому размер вирусной частицы зависит от плоскости среза. Однако впервые были обнаружены вирионы хантавируса Пуумала вытянутой эллипсовидной формы с максимальным размером около 300 нм. Похожие результаты были получены ранее при электронной криотомографии вируса Тула, непатогенного хантавируса наиболее близкородственного вирусу Пуумала [6]. Было показано, что размер и форма вирионов вируса Тула значительно варьировали, наблюдались сферические частицы размером 120-160 нм и продолговатые вытянутые частицы с диаметром 80 нм в поперечнике и максимальной длиной около 350 нм. Можно предположить, что наличие вирионов вытянутой формы, длина которых почти вдвое превышает ранее описанный средний диаметр хантавирусных вирионов [4, 5, 8, 9, 10], является уникальной особенностью, присущей, по крайней мере, двум близкородственным хантавирусам – Пуумала и Тула, адаптированным к размножению в культуре Vero E6.
Впервые предпринята попытка охарактеризовать состояние клеточной культуры в процессе репликации в ней хантавирусов. Ранее было отмечено отсутствие цитопатических изменений, наблюдаемых in vitro в световом микроскопе при репликации вируса Пуумала в культуре Vero E6, на протяжении 57 дней культивирования с периодической сменой питательной среды. Количество накапливаемого в среде вируса после достижения пиковых значений на 7-9 сутки снижалось и поддерживалось до конца эксперимента на уровне 3,5±0,5 lg ФОЕ/мл (неопубликованные данные). При исследовании ультратонких срезов как незаражённой, так и зараженной культуры клеток Vero E6 наблюдаются естественно протекающие процессы инволюции, которые при изучении заражённой культуры можно принять за патологические изменения, вызванные хантавирусом.
Таким образом, методом электронной микроскопии ультратонких срезов культуры клеток Vero E6, инфицированной вирусом Пуумала показано, что проникновение в клетку и репликация в ней хантавируса не вызывают патологических изменений.
Рецензенты:
1 флакон – 150 млн. кл.
Область применения: вирусология, клеточная биология.
Описание: культура клеток почечной ткани обезьяны BGM используется в клинико-диагностических лабораториях для обнаружения и выделения вирусов при лабораторной диагностике вирусных инфекций, а также контроля вирусов в воде и объектах окружающей среды.
1 флакон – 150 млн. кл.
Область применения: вирусология, клеточная биология.
Описание: культура клеток амниона человека перевиваемая FL используется в клинико-диагностических лабораториях для обнаружения и выделения таких вирусов как: полиовирус 1; аденовирусы; Коксаки; ЕСНО; коровья оспа; реовирусы; арбовирусы; риновирусы; корь; респираторно-синцитиальный вирус; парагрипп, герпес. Культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде 199, содержащей 10% сыворотки эмбрионов крупного рогатого скота.
1 флакон – 150 млн. кл.
Область применения: вирусология, клеточная биология.
Описание: культура клеток почки собаки перевиваемая MDCK используется в клинико-диагностических лабораториях для обнаружения и выделения вирусов везикулярного стоматита; коровьей оспы; Коксаки В-5; реовирусов 2, 3 типов; арбовирусов; аденовирусов 4, 5 типа; гриппа А, В, С; чумы собак; аренавирусов; везикулярной экзантемы свиней; инфекционного гепатита собак.
Культура клеток почки собаки MDCK представляет собой взвесь клеток желтовато-розового цвета в ростовой среде DМЕМ, содержащей 10% сыворотки эмбриональной бычьей (250-300 тыс. клеток/мл). Обладает высокой пролиферативной активностью.
1 флакон -150 млн. клеток
Область применения: вирусология, клеточная биология
Описание: культура клеток эпидермоидной карциномы человека используется для выделения полиовирусов 1, 2 и 3 серотипов, вируса Коксаки В, вируса простого герпеса, аденовируса, респираторно-синцитиального вируса и для последующей дифференциации инфекционных агентов.
Находит широкое применение для лабораторной диагностики вирусных инфекций, решения научно-исследовательских задач в области медицины, клеточной и молекулярной биологии, биотехнологии.
Культура клеток эпидермоидной карциномы человека выпускается в виде суспензии клеток с рабочей дозой 300 350 тысяч клеток в 1 мл в ростовой среде ДМЕМ, содержащей 10% сыворотки эмбрионов крупного рогатого скота, и представляет собой опалесцирующую жидкость желтовато-розового цвета. Культура клеток обладает высокой пролиферативной активностью на носителе с образованием монослоя через 12 - 24 ч при температуре плюс 37 0 C.
1 флакон – 150 млн. кл.
Область применения: вирусология, клеточная биология.
Описание: культура клеток RD используется в клинико-диагностических лабораториях для выделения вирусов широкого спектра из вируссодержащего материала с целью последующей дифференциации инфекционного агента. Находит широкое применение для решения научно-исследовательских задач в области медицины, клеточной и молекулярной биологии, биотехнологии. Культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде 199, содержащей 10% сыворотки эмбрионов крупного рогатого скота.
1 флакон – 150 млн. кл.
Область применения: вирусология, клеточная биология, канцерогенез
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде ДМЕМ или МЕМ, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Клетки имеют эпителиоподобную морфологию. Культура клеток HeLa чувствительна к следующим вирусам: полиовирусы, аденовирусы, энтеровирусы, респираторно-синтициальный вирус, вирус простого герпеса 1, 2 типа.
1 флакон – 150 млн. кл.
Область применения: вирусология, клеточная биология.
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде ДМЕМ или МЕМ, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Клетки имеют эпителиоподобную морфологию. Культура клеток СПЭВ чувствительна к арбовирусам, энтеровирусам свиней, вирусу гриппу, рото-, коронавирусам, вирусу энцефаломиокардита свиней и др.
1 флакон – 150 млн. кл.
Область применения клеточная биология, вирусология, биотехнология.
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде ДМЕМ, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Клетки имеют эпителиоподобную морфологию. Культура клеток МА-104 чувствительна к альфавирусам, вирусам парагриппа 2 и 3 типа, ротавирусам, флавивирусам, респираторно-синцитиальному вирусу, возбудителям краснухи, коровьей оспы, ветряной оспы.
1 флакон – 150 млн. кл.
Область применения клеточная биология, вирусология.
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде ДМЕМ, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Клетки имеют эпителио- и фибробластоподобную морфологию. Культура клеток Vero E6 чувствительна к вирусам геморрагических лихорадок: Мачупо, Джунин, Ласса, Марбург, Эбола, вирусу карельской лихорадки, арбовирусам, вирусам простого герпеса 1 и 2 типа, цитомегаловирусу, вирусу гепатита А, энтеровирусам.
1 флакон – 150 млн. кл.
Область применения вирусология, клеточная биология.
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде ДМЕМ, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Клетки имеют эпителиоподобную морфологию. Культура
клеток FRhK-4 чувствительна к вирусу гепатита А.
Получена из синовиальной жидкости пациента с остеоартрозом, контаминированная мышиными фибробластами.
1 флакон – 150 млн. кл.
Область применения вирусология, клеточная биология.
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде ДМЕМ, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Клетки имеют фибробластоподобную морфологию. Культура клеток McCoy B чувствительна к хламидиям и вирусу везикулярного стоматита.
1 флакон – 150 млн. кл.
Область применения: вирусология, иммунология, иммунофармакология.
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде RPMI-1640, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Линия клеток, полученная из периферической крови пациента с лимфобластным лейкозом. Характеризуется лимфобластной морфологией, имеет экспрессирует поверхностные маркеры CD1a, CD2, CD4, CD25, CD45, CD123, HLA-ABC, HLA-DR. Клетки чувствительны к вирусу иммунодефицита человека.
1 флакон – 150 млн. кл.
Область применения: вирусология, иммунология, иммунофармакология.
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде RPMI-1640, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Линия клеток, полученная из периферической крови пациента с лимфобластным лейкозом.Характеризуется лимфобластной морфологией, имеет экспрессирует поверхностные маркерыCD1aCD2, CD3,CD5, CD7, CD28, CD43, CD45, CD45RA, CD69, CD90, HLA-ABC, TCRαβ. Клетки чувствительны к вирусу иммунодефицита человека.
1 флакон – 150 млн. кл.
Область применения: вирусология, иммунология, иммунофармакология.
Описание: культура клеток выпускается в виде взвеси (250-300 тыс. клеток/мл) в ростовой среде RPMI-1640, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Линия клеток, полученная из периферической крови пациента с лимфомой Беркитта. Характеризуется лимфобластной морфологией, имеет экспрессирует поверхностные маркерыCD10, CD19, CD27, CD43, CD45, CD54, CD62L, CD69, CD79a, CD80, CD86, HLA-DR.Наличие генетических маркеров, а также ядерного и капсидного антигенов вируса Эпштейн-Барра.
1 флакон – 5 млн. кл.
Область применения: иммунология, иммунофармакология.
Описание: культура клеток выпускается в виде взвеси (500 тыс. клеток/мл) в ростовой среде RPMI-1640, содержащей 10% сыворотки эмбрионов крупного рогатого скота. Культура моноцитарных интерферон-альфа-индуцированных дендритных клеток получена из периферической крови доноров. Клетки экспрессируют молекулы гистосовместимости HLA-ABC, HLA-DR, костимуляторные молекулы CD80, CD86, широкий спектр паттерн-ассоциированных поверхностных и внутриклеточных рецепторов.
Аннотация научной статьи по биотехнологиям в медицине, автор научной работы — Генералов Сергей Вячеславович, Ерохин П.С., Красовская Т.Ю., Осина Н.А., Абрамова Е.Г.
Похожие темы научных работ по биотехнологиям в медицине , автор научной работы — Генералов Сергей Вячеславович, Ерохин П.С., Красовская Т.Ю., Осина Н.А., Абрамова Е.Г.
A STUDY OF THE ULTRASTRUCTURE OF THE SURFACE OF THE TRANSPLANTABLE LINE VERO CELLS INFECTED WITH THE RABIES VIRUS (RABV, LISSAVIRUS, RHABDOVIRIDAE)
Генералов С.В., Ерохин П.С., Красовская Т.Ю., Осина Н.А., Абрамова Е.Г., Никифоров А.К., Щербакова С.А.
изучение ультраструктуры поверхности клеток линии vero,
инфицированных вирусом бешенства (rabv, LISSAVIRUS, rhabdoviridae)
Ключевые слова: вирус бешенства; клеточная культура Vero; атомно-силовая микроскопия; шероховатость,
ультраструктура поверхности клетки. Для цитирования: Генералов С.В., Ерохин П.С., Красовская Т.Ю., Осина Н.А., Абрамова Е.Г., Никифоров А.К., Щербакова С.А. Изучение ультраструктуры поверхности клеток линии Vero, инфицированных вирусом бешенства (RABV, Lissavirus, Rhabdoviridae). Вопросы вирусологии. 2017; 62(5): 227-232.
Generalov S.V., Erokhin P.S., Krasovskaya T.Yu., Osina N.A., Abramova E.G., Nikiforov A.K.,
A STUDY OF THE ULTRASTRUCTURE OF THE SURFACE OF THE TRANSPLANTABLE LINE VERO CELLS INFECTED WITH THE RABIES VIRUS (RABV, LISSAVIRUS, RHABDOVIRIDAE)
K e y w o r d s: Rabies virus; cell culture Vero; atomic force microscopy; roughness; surface ultrastructure of cells.
Acknowledgments. The study had no sponsorship.
Conflict of interest. The authors declare no conflict of interest.
Received 03 February 2017 Accepted 28 February 2017
Вирус бешенства, принадлежащий к семейству Rhab-doviridae и роду Lyssavirus, способен вызывать смертельно опасное заболевание, характеризующееся поражением центральной нервной системы. Проникновение вируса бешенства в клетку происходит главным образом путем эндоцитоза, а размножение — в цитоплазме клеток восприимчивого организма или тканевой культуры [1]. При изучении взаимодействия вируса бешенства и клеточных культур экстраневрального происхождения методом фазово-контрастной микроскопии далеко не всегда наблюдается цитопатическое действие [2, 3], которое обычно предполагает деструктивные изменения отдельных клеток и клеточного монослоя. Тем не менее некоторые штаммы вируса бешенства проявляют цито-патические свойства, которые обнаруживаются методом фазово-контрастной микроскопии в поздние сроки культивирования вируса [4]. На наш взгляд, при исследовании цитопатического действия вируса бешенства методом фазово-контрастной микроскопии инфицированный клеточный монослой в ряде случаев сложно отличить от интактного, особенно в поздние сроки культивирования, когда происходит отмирание и не инфицированных вирусом клеток.
Более полную характеристику взаимодействия вируса с клеткой позволяют получить методы атомно-силовой микроскопии (АСМ), которые в последние годы находят все большее применение для изучения поверхностной структуры микрообъектов: бактерий [5—7], вирусов и эукариотических клеток [8—12]. Эта технология дает возможность изучить процессы, происходящие на поверхности микрообъектов (экспрессию биомолекул, адгезивные свойства, упругость и шероховатость) при различных условиях, а также оценить и описать изменение морфофункциональных характеристик микрообъекта в целом в зависимости от влияния различных условий (изменение pH, температуры, присутствие антибиотиков и т. д.) [5, 7]. Методы АСМ широко используются для изучения процессов взаимодействия вирусов как с эукариотическими, так и с прокариотическими клетками [6, 8—12].
Цель исследования заключалась в изучении изменения ультраструктуры поверхности клеток перевиваемой линии Vero, инфицированных вирусом бешенства, методом АСМ в зависимости от длительности и степени воздействия вируса на клетку.
Материал и методы
Культивирование клеток и вируса осуществляли на питательной среде Игла МЕМ с добавлением 10% сыворотки крупного рогатого скота (КРС) во флаконах с площадью поверхности 25 см2, а также 24- и 96-луночных
планшетах при 37°C и 5% CO2. Состояние клеточного монослоя оценивали методом фазово-контрастной микроскопии с помощью инвертированного микроскопа Биомед-3И (Россия). После формирования монослоя, занимающего от 80 до 90% ростовой поверхности, клетки открепляли от поверхности флакона раствором трипсина и версена, взятых в соотношении 1:2, и суспендировали в питательной среде. Затем к клеточной суспензии добавляли вируссодержащую жидкость. Для инфицирования клеток вирус вносили в дозе от 0,01 до 1 ИД50/кл. Конечная концентрация клеток при этом составляла от 1,5 • 105 до 2,2 • 105 кл/мл. Отрицательным контролем являлась культура клеток, подготовленная аналогичным образом, но без добавления вируссодержащей жидкости. Активность вируссодержащей жидкости (титр) и специфичность взаимодействия вируса с клеточной культурой Vero оценивали методом иммунофлюоресценции с помощью люминесцентного микроскопа Nikon (Япония) [13, 14]. Для окрашивания использовали специфичный к вирусу бешенства иммуноглобулин, меченный ФИТЦ (г. Владимир).
Атомно-силовая микроскопия. Исследования проводили с помощью сканирующего зондового микроскопа Solver P47-PRO (NT-MDT, Россия) в режиме прерывистого контакта полуконтактным методом и методом рассогласования [5]. При этом использовали кремниевые зонды серии NSG01 (NT-MDT, Россия) жесткостью 5,1 Н/м с радиусом кривизны 10 нм и резонансной частотой 150 кГц. Исследования проводили при оптимальных значениях основных параметров сканирования: амплитуды колебаний кантилевера Resonance 22 ед., начальной фазы его колебаний Phase 240°, скорости сканирования Frequency 0,75 Гц, коэффициента усиления цепи обратной связи FB Gain 0,3 ед., Set Point 19 ед. (величина Set Point и начальный уровень сигнала DFL определяли величину силы взаимодействия зонда с поверхностью образца). Среднюю арифметическую шероховатости поверхности клеточной стенки определяли методом Roughness analysis по 10 значениям, полученным в эксперименте, с указанием абсолютной погрешности [7].
Образцы для исследования методом АСМ готовили следующим образом. В стерильную пробирку из флакона переносили питательную среду, на которой культивировали клетки. Затем клетки промывали раствором DPBS, открепляли раствором трипсина и версена (1:2) и переносили в указанную пробирку. После центрифугирования при 1500 об/мин удаляли супернатант, а осадок для фиксации суспендировали в растворе глутарового альдегида (2,5%) и инкубировали в течение 2 ч при 4°C. Затем клетки осаждали центрифугированием в течение 5 мин при 1500 об/мин, удаляли надосадочную жидкость и добавляли бидистиллированную воду в объеме 1 мл, ресуспендировали и повторно центрифугировали. На покровное стекло наносили 4 мкл суспензии и высушивали при комнатной температуре.
Обработку и анализ изображений проводили с использованием программы Image Analysis (NT-MDT, Россия). Статистическую обработку результатов осуществляли с помощью программ Nova (NT-MDT, Россия), Microsoft Excel.
На первом этапе эксперимента оценивали динамику изменений исследуемых параметров с момента инфицирования клеточного монослоя до гибели клеток. Среднее время наблюдения составляло 96 ч.
Рис. 1. Фазово-контрастная микроскопия интактного и инфицированного вирусом бешенства монослоя клеточной культуры Vero (ув. 100): а — интактный монослой (отрицательный контроль), 72 ч культивирования; б — интактный монослой (отрицательный контроль), 96 ч культивирования; в — инфицированный монослой, 72 ч культивирования; г — инфицированный монослой, 96 ч
При оценке клеточного монослоя методом фазово-контрастной микроскопии через 48 ч культивирования не установлено различий между интактными и инфицированными клетками. Начало отмирания клеток инфицированного монослоя регистрировали на 3—4-е сутки культивирования (рис. 1). В интактном монослое мертвые клетки появлялись на 1 или 2 сут позже, при этом процесс отмирания инфицированного клеточного монослоя происходил быстрее. Методом люминесцентной микроскопии обнаруживали появление фокусов флюоресценции в инфицированном монослое через 48 ч после заражения, что свидетельствовало о репродукции вируса в клетке (рис. 2).
При анализе клеток Vero методом АСМ установлено, что вирус бешенства вызывал изменение ультраструктуры поверхности клетки (рис. 3). Уже после нескольких часов инфицирования на поверхности клетки регистрировали изменения, вызванные адсорбцией вируса и его внедрением в клетку. Через несколько суток после инфицирования наблюдали выпячивания клеточной мембраны, разрушения мембранной границы и экструзию содержимого клетки. Размеры инфицированной клетки варьировали на протяжении всего периода наблюдения в сторону как увеличения, так и
уменьшения, превышая при этом размеры интактной клетки (табл. 1).
Значения шероховатости клеточной стенки возрастали при воздействии вируса бешенства на протяжении всего эксперимента начиная с первых часов взаимодействия вируса с клеткой (рис. 4).
В первые 4 ч значение шероховатости инфицированных клеток возрастало в 2,5 раза относительно интактных клеток. К завершению эксперимента шероховатость инфицированных клеток увеличивалась более чем в 8 раз относительно исходного значения. При этом у интактных клеток Vero происходило незначительное изменение шероховатости. Таким образом, возраст культуры практически не оказывал влияния на состояние шероховатости клеточной мембраны.
Следующим этапом эксперимента являлся анализ изменений исследуемых параметров в зависимости от дозы вируса. Для заражения клеток использовали вируссо-держащую жидкость, активность которой составила 4,8 lg ИД50/мл. Из указанной вируссодержащей жидкости готовили серию десятикратных разведений на питательной среде Игла МЕМ с 10% содержанием сыворотки
ЦП Щя-'jf ■ TIL Ik i .^j-L^rr " P- ДГ*• ' <¡fat
ir. ЗтЖШтЦк. те-Ж''^ Ж SMEfiHo* *5¡lr «¿¿to:
Рис. 2. Люминесцентная микроскопия интактного (а) и инфицированного вирусом бешенства монослоя (б) клеточной культуры Vero после 48 ч культивирования (ув. 200; окрашивание специфической сывороткой, меченной ФИТЦ).
Рис. 3. АСМ интактного и инфицированного вирусом бешенства монослоя клеточной культуры Vero: а, г — интактные клетки Vero (отрицательный контроль) после 72 ч культивирования; б, д — клетки Vero через 4 ч после инфицирования; в, е — клетки Vero
через 72 ч после инфицирования. Стрелками показаны изменения на поверхности клеток, вызванные вирусом бешенства.
КРС в разведениях от 100 до 10-7. Затем к вируссодержа-щей жидкости в указанных выше разведениях добавляли клеточную суспензию до конечной концентрации от 0,5 • 105 до 1,0 • 105 кл/мл. Значения геометрических размеров клетки и шероховатости поверхности клеточной мембраны оценивали через 4 ч. Результаты представлены в табл. 2 и на рис. 5.
мой линии Vero способствовал изменению их размеров. Установлено, что увеличение инфицирующей дозы приводило к более резким изменениям геометрических размеров клеток. Следует отметить, что увеличение размеров эукариотических клеток при их взаимодействии с вирусами, зарегистрированное методами АСМ, описано в ряде работ [10, 11]. Так, G. Lee и соавт. [10] наблюдали увеличение диаметра и периметра клеток Sf9 при инфицировании бакуловирусами, M. Moloney и соавт. [11] описывают увеличение геометрических размеров клетки BHK-21, инфицированной вирусами леса Семлики и энцефаломиелита мышей. Увеличение размеров ин-
Время, ч Длина (M ± m), мкм Ширина (М± m), мкм Высота (M ± m), мкм
интактные клетки инфицированные клетки интактные клетки инфицированные клетки интактные клетки инфицированные клетки
0 8,5 ± 0,8 8,5 ± 0,8 2,5 ± 0,1 2,5 ± 0,1 0,80 ± 0,01 0,80 ± 0,01
1 8,5 ± 0,9 8,5 ± 0,7 3,0 ± 0,1 5,5 ± 0,2 1,70 ± 0,03 2,00 ± 0,01
4 9,0 ± 1,0 9,5 ± 1,1 5,5 ± 0,2 4,3 ± 0,1 1,90 ± 0,02 1,60 ± 0,01
24 13,0 ± 0,5 25,0 ± 1,1 6,5 ± 0,3 8,0 ± 0,3 2,10 ± 0,02 3,20 ± 0,04
48 15,0 ± 0,9 23,0 ± 1,3 4,0 ± 0,2 8,5 ± 0,1 1,70 ± 0,02 8,50 ± 0,03
72 7,0 ± 0,5 12,5 ± 0,8 3,0 ± 0,1 7,5 ± 0,2 1,40 ± 0,01 6,40 ± 0,02
96 7,0 ± 0,5 9,0 ± 0,5 3,2 ± 0,1 9,0 ± 0,3 2,20 ± 0,02 5,50 ± 0,04
Исследуемый образец Длина (M ± m), мкм Ширина (M ± m), мкм Высота (M ± m), мкм
Исходная (интактная) культура клеток Vero 7,0 ± 0,1 3,6 ± 0,1 0,80 ± 0,01
Отрицательный контроль(интактная культура клеток Vero) 6,0 ± 0,1 3,0 ± 0,1 0,80 ± 0,01
Культура клеток Vero, инфицированная вирусом в разведении 100 41,0 ± 1,1 1,3 ± 0,1 2,8 ± 0,06
Культура клеток Vero, инфицированная вирусом в разведении 10-1 37,0 ± 1,5 9,2 ± 0,3 1,5 ± 0,03
Культура клеток Vero, инфицированная вирусом в разведении 10-2 33,0 ± 1,0 11,5 ± 0,4 2,5 ± 0,04
Культура клеток Vero, инфицированная вирусом в разведении 10-3 18,0 ± 0,7 11,0 ± 0,2 2,5 ± 0,03
Культура клеток Vero, инфицированная вирусом в разведении 10-4 12,0 ± 0,3 8,5 ± 0,2 1,7 ± 0,03
Культура клеток Vero, инфицированная вирусом в разведении 10-5 6,0 ± 0,1 2,5 ± 0,1 1,0 ± 0,01
Культура клеток Vero, инфицированная вирусом в разведении 10-6 8,5 ± 0,3 3,5 ± 0,1 1,5 ± 0,01
Культура клеток Vero, инфицированная вирусом в разведении 10-7 6,5 ± 0,2 2,5 ± 0,1 1,7 ± 0,02
фицированной клетки, по-видимому, связано с изменением структуры клеточной мембраны и как следствие с нарушением водно-солевого обмена. Увеличение размеров клетки также может быть обусловлено изменениями строения цитоскелета, нарушением цикла деления клетки, накоплением и выходом вирусных частиц [9, 12].
Интересным фактом, выявленным при изучении поверхности инфицированной клетки Vero, является резкое возрастание ее шероховатости в течение первых часов после заражения. Значительное увеличение шероховатости, на наш взгляд, можно объяснить адсорбцией вируса и проникновением его в клетку, а дальнейшее повыше-
ние значений шероховатости связано с выходом вируса из клетки и разрушением мембраны. В аналогичных исследованиях, посвященных изучению взаимодействия вирусов с клетками методами АСМ, также зарегистрированы различные изменения в морфологии мембраны [8—12], в том числе факт увеличения ее шероховатости [10, 11]. При этом М. Moloney и соавт. [11] отмечали сначала уменьшение значений шероховатости в течение первых часов взаимодействия клетки BHK-21 с вирусом, а затем ее возрастание, связав это с репродукцией вирусов. В исследованиях G. Lee и соавт. [10] также продемонстрировано увеличение шероховатости клеточной мембраны при культивировании бакуловируса на клетках Sf9, при этом авторы предложили использовать изменения значений шероховатости мембраны клетки для оценки выхода образующихся вирусных частиц.
В настоящем исследовании изменение шероховатости клеточной мембраны наглядно демонстрирует зависимость данного показателя от дозы заражения: ее повышение приводило к более заметному увеличению шероховатости. При анализе исследуемых образцов вирус-содержащей жидкости установлено, что максимальное разведение, которое вызывало достоверное изменение шероховатости мембраны клетки, соответствовало 10-5. Следует отметить, что аналогичный результат был получен при исследовании вышеуказанных образцов вирус-содержащей жидкости методом иммунофлюоресценции. Наибольшие разведения, при которых обнаруживали
Читайте также:


