Вирус герпеса эффективность ацикловира

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
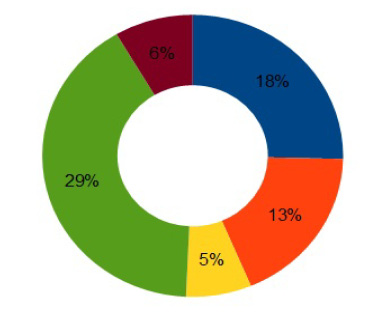

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере ВЭБ и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икоса-дельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека. По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (ВПГ-1, ВПГ-2, ВВЗ, ЦМВ, ВЭБ, ВГЧ-6, ВГЧ-8). Доказаны воздушно-капельный, контактный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции. Таким образом, источником герпетической инфекции является человек, инфицированный вирусом герпеса.
ВПГ – наиболее известные представители герпес-вирусов, так как вызывают поражения практически у каждого человека. Имеются две разновидности ВПГ – ВПГ-1 и ВПГ-2, они обладают генетическим сродством (примерно 50% их ДНК схожи), но различаются антигенным свойством (различие в строении наружной мембраны). Ранее считалось, что штаммы ВПГ-1 чаще удается выделить при поражении кожи лица (лабиальный герпес), верхних конечностей, а штаммы ВПГ-2 – при генитальной локализации высыпаний. В настоящее время установлено, что несмотря на то что ВПГ-2 играет лидирующую роль в герпетическом поражении аногенитальной области, серотип ВПГ-1 при генитальном герпесе стал обнаруживаться все чаще.
Патогенез
Образование антител к оболочечным структурам вируса и мембранам пораженных им клеток является лишь первым этапом в создании организмом защиты от ВПГ [5–9]. Гуморальные механизмы иммунитета не могут полностью предупредить активацию латентного ВПГ и возникновение рецидивов заболевания, развивающихся на фоне значительного содержания специфических к возбудителю антител [5]. В связи с этим диагностическое и прогностическое значение гуморального иммунитета при герпетической инфекции не вызывает сомнения. При этом его контролирующий эффект, выражающийся в способности предупреждать обострения заболевания, сведен к минимуму. Так, C.Lopes и R.O’Relly (1977 г.), наблюдая за больными со злокачественными опухолями, получавшими иммуносупрессивную терапию (цитостатики, глюкокортикостероиды), подавлявшую в основном Т-клеточный иммунитет, отмечали нарастание тяжести течения простого герпеса с частым переходом в генерализованные формы.
L.Rasmussen (1974 г.) указал на связь частых рецидивов герпетической инфекции с низкой интерфероносинтезирующей способностью лейкоцитов. Позднее было установлено, что содержание интерферона (ИФН)-a в сыворотке крови, а также способность к продукции лейкоцитами ИФН-a in vitro у больных ВПГ снижены по сравнению с показателями здоровых доноров в 4–5 раз. Снижение цитотоксичности NK-клеток (нормальных киллеров) определяется в основном в период рецидива, и уровень цитотоксичности близок к норме во время ремиссии [10]. Повышение выработки лейкоцитами ИФН-a происходит главным образом в ответ на заражение или обострение хронической инфекции. В связи с этим ему отводится ведущая роль в естественном иммунитете при купировании клинических проявлений вирусных заболеваний [6, 7, 11]. ИФН-a (лимфоцитарный) имеет решающее значение в предотвращении рецидивов инфекций, вызванных хронически персистирующими возбудителями [6, 7, 12]. Наряду с высокой цитотоксической активностью NK-клетки сами способны продуцировать лимфокины (ИФН-g) и цитокины (фактор некроза опухоли – ФНО). Их также относят к клеткам, осуществляющим контроль иммунной клеточной дифференцировки [5, 13, 14].
Клиническая картина
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах: выявление вируса per se (электронная микроскопия); выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках); выявление и идентификация вирусов с помощью антител (метод флюоресцирующих антител, иммуноферментный анализ – ИФА, реакция агглютинации латекса – РАЛ, иммуноблот – ИБ, реакция нейтрализации– РН, реакция связывания комплемента – РСК); выявление и идентификация нуклеиновых кислот (метод полимеразной цепной реакции – ПЦР, молекулярная гибридизация – МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить герпес-вирусы или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпесвирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке. Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ. Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из разных клеточных культур. Для обнаружения вируса герпеса используют молекулярно-биологические методы: ПЦР и реакцию МГ, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение
Основной целью лечебных мероприятий является: а) подавление репродукции ВПГ в период обострения; б) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции; в) предотвращение развития или восстановление тех нарушений, которые вызывает активация ВПГ в организме.
Наиболее перспективным направлением как в лечении первичного эпизода или рецидива ВПГ, так и профилактики герпес-вирусной инфекции является противовирусная химиотерапия с использованием ациклических нуклеозидов – высокоспецифичных препаратов, обладающих доказанным противовирусным эффектом. Такая этиопатогенетическая терапия является мировым стандартом лечения герпетической инфекции [15–20]. Уникальность противогерпетического действия ациклических нуклеозидов обусловлена несколькими моментами. Во-первых, ациклические нуклеозиды активируются специфическим ферментом герпес-вирусов, что обусловливает их высочайшую избирательность по отношению к ВПГ без вмешательства в биохимию свободных от вируса клеток. Во-вторых, тимидинкиназа (гуанилаткиназа) герпес-вирусов связывается с химиопрепаратами в тысячу раз быстрее, чем клеточная, что приводит к накоплению действующего вещества исключительно в инфицированных клетках и объясняет отсутствие мутагенных, тератогенных, цитотоксических свойств даже при длительном приеме. В-третьих, ДНК-полимераза герпес-вирусов всегда ошибочно включает фосфорилированные ациклические нуклеозиды в концевые участки синтезируемых новых вирусных ДНК вместо естественного дезоксигуанозинтрифосфата, в результате чего блокируется репликация ВПГ [21–23].
В настоящее время в группу ациклических нуклеозидов входят: ацикловир, валацикловир и фамцикловир (см. таблицу).
Основные группы антигерпетических препаратов*
Первым из группы ациклических нуклеозидов был создан ацикловир. Механизм действия препарата основан на нарушении репликации вируса посредством образования ацикловира трифосфата из тимидинкиназы ВПГ в инфицированных клетках. Однако недостатком препарата стала низкая биодоступность ацикловира и вытекающая отсюда необходимость многократного приема в течение 1 сут строго через каждые 4–5 ч.
Фамцикловир трансформируется в организме в активное противовирусное соединение – пенцикловир. Его биодоступность после перорального приема составляет 77%, профиль безопасности близок к ацикловиру. Однако фамцикловир имеет пока малый опыт применения в клинической практике.
Клиническая фармакокинетика и фармакодинамика
Доказанная эффективность
В настоящее время существует два варианта терапии ВПГ с использованием ациклических нуклеозидов: эпизодическая (терапия первичной герпетической инфекции или ее рецидива) и превентивная (супрессивная). Многочисленными наблюдениями показано, что применение валацикловира в дозе 500 мг 2раза в сутки в течение 5 дней значительно уменьшает дискомфорт в зоне поражения, сокращает время рецидива и период вирусовыделения. Длительную терапию рекомендуют людям с частыми рецидивами.
Прием валацикловира в дозе 500мг 1 раз в сутки ежедневно в течение 4–12 мес предотвращает рецидивы заболевания (они становятся достаточно редкими, а у некоторых пациентов возможна ремиссия в течение нескольких лет) и обеспечивает психологическое преимущество над лечением, проводимым во время обострений. Впоследние годы во всем мире широкое применение нашли методики коротких курсов супрессивной терапии – эпизодическая супрессивная терапия, когда лечение назначается на определенный период (например, на период отпуска, экзаменов, косметических или стоматологических процедур). Несмотря на необходимость при супрессивной терапии длительного приема препарата, доказано, что валацикловир обладает оптимальным профилем безопасности (противопоказания связаны с жизнеугрожающими состояниями или тяжелыми инфекциями, побочные эффекты встречаются редко).
Другие показания
Кроме лечения орофациального и генитального герпеса, как впервые выявленного, так и рецидивирующего, препарат Валвир может использоваться в профилактике инфицирования генитальным герпесом здорового партнера, если его принимать в качестве супрессивной терапии в сочетании с использованием барьерной контрацепции; профилактике инфекции ЦМВ, возникающей при трансплантации органов.
Противопоказания
Противопоказаниями являются: клинически выраженные формы ВИЧ-инфекции при содержании СD4+-лимфоцитов менее 100 на мкл; трансплантация костного мозга; трансплантация почки; детский возраст (до 12 лет при ЦМВ, до 18лет – по остальным показаниям); повышенная чувствительность к валацикловиру, ацикловиру и другим компонентам препарата. С осторожностью следует назначать препарат при печеночной недостаточности (в высоких дозах), почечной недостаточности, при беременности и в период лактации.
Побочные эффекты
При примении Валвира из побочных реакций возможны головная боль, тошнота, реже развитие лейкопении, апластической анемии, лейкопластического васкулита, тромботической тромбоцитопенической пурпуры, повышение уровня печеночных ферментов, развитие острой почечной недостаточности и неврологических нарушений. Со стороны дыхательной системы – иногда диспноэ. Со стороны кожи и подкожной клетчатки – иногда высыпания, включая проявления фоточувствительности; редко зуд. Возможно (очень редко) развитие крапивницы, ангионевротического отека.
Лекарственное взаимодействие
Циметидин и пробенецид после приема 1 г валацикловира повышают AUC ацикловира, снижая его почечный клиренс (однако коррекции дозы валацикловира не требуется из-за широкого терапевтического индекса ацикловира). Необходимо соблюдать осторожность в случае одновременного применения валацикловира в высоких дозах (4 г/сут и выше) и лекарственных средств, которые конкурируют с ацикловиром за путь элиминации (последний элиминируется с мочой в неизмененном виде в результате активной канальцевой секреции), поскольку существует потенциальная угроза повышения в плазме уровня одного или обоих препаратов или их метаболитов. При одновременном применении ацикловира с микофенолатом мофетила было отмечено повышение AUC первого и неактивного метаболита второго. Необходимо также соблюдать осторожность при сочетании валацикловира в высоких дозах (4 г/сут и выше) с препаратами, влияющими на функции почек (например, циклоспорин, такролимус).
Заключение
Специфическое лечение необходимо начинать как можно раньше после появления первых симптомов заболевания. Применение ациклических нуклеозидов сокращает длительность эпизода и уменьшает остроту симптомов. Решение о необходимости применения того или иного препарата принимается совместно с пациентом, исходя из удобства применения и стоимости препарата, так как ни один из препаратов не имеет преимущества в эффективности воздействия на заболевание [25].
В алацикловир ускоряет заживление при рецидивирующем генитальном герпесе
Translated, with permission of the American College of Physicians, from “Valaciclovir accelerated healing in recurrent herpes genitalis”. ACP J Club 1997;126:41. Abstract of: Spruance S.L., Tyring S.K., DeGregorio B., Miller C., Beutner K., and the Valaciclovir HSV Study Group. A large-scale, placebo-controlled, dose-ranging trial of peroral valaciclovir for episodic treatment of recurrent herpes genitalis. Arch Intern Med 1996;125:1729—35 and from the accompanying Commentary by Thomas McGinn.
Оценить эффективность приема валацикловира при лечении одного обострения рецидивирующего генитального герпеса.
Рандомизированное двойное слепое плацебо-контролируемое исследование; минимальный период наблюдения — 7 дней.
Учебные, частные и государственные медицинские учреждения, США.
987 больных (медиана возраста 34 года, 62% женщины) с генитальным герпесом вне обострения, у которых было не менее 4 рецидивов в течение предыдущих 12 мес. Критерии исключения: другие заболевания, аллергические реакции, беременность, лактация.
Больных разделили на 3 группы, получавшие либо валацикловир по 1000 мг 2 раза/сут в течение 5 дней (n=368), либо валацикловир по 500 мг 2 раза/сут в течение 5 дней (n=360), либо плацебо 2 раза/сут в течение 5 дней (n=259). Больных проинструктировали о необходимости самостоятельного начала лечения в течение 24 ч после появления первых признаков рецидива.
Продолжительность рецидива, время до заживления герпетических высыпаний, длительность и выраженность болевых ощущений, продолжительность периода выделения вируса, побочные эффекты.
Анализ проводили, исходя из допущения, что все больные получили предписанное лечение. Статистически значимого различия эффективности обеих доз валацикловира не выявлено. Средняя продолжительность рецидива составила 4 дня у больных, получавших низкую дозу препарата, и 5,9 дней у получавших плацебо. Отношение шансов (ОШ) равнялось 1,94 при 95% доверительном интервале (ДИ) от 1,64 до 2,31 (р
У многих больных генитальный герпес переходит в хроническую рецидивирующую форму. В настоящее время средств для его лечения не существует, однако есть эффективные препараты, способные уменьшить частоту, интенсивность и продолжительность обострений. До недавних пор стандартная терапия при рецидивирующем генитальном герпесе ограничивалась назначением ацикловира, принимаемого по 5 раз/сут непрерывно или во время обострения. Хотя в 2 исследованиях [1, 2] продемонстрирована эффективность непрерывного приема ацикловира для предотвращения рецидивов, доказательств эффективности его приема во время обострений очень мало.
Недавно Администрация США по контролю за продовольствием и лекарственными препаратами разрешила применять для лечения генитального герпеса два новых препарата— валацикловир и фамцикловир. Оба препарата обладают более высокой биодоступностью, чем ацикловир, что делает схему их приема (2 раза/сут) более удобной для больного [3]. Валацикловир — пропрепарат ацикловира (превращающийся из неактивной формы в активную в процессе метаболизма в организме больного), а фамцикловир — пероральная форма пенцикловира и может оказаться хорошей альтернативой в случае устойчивости вируса к ацикловиру.
Результаты исследования S.L. Spruance et al. свидетельствуют об эффективности валацикловира, принимаемого во время обострения генитального герпеса. Аналогичные результаты были получены в ходе недавнего хорошо спланированного рандомизированного контролируемого испытания фамцикловира [4].
Таким образом, для ведения больных с генитальным герпесом у врачей имеется 3 лекарственных препарата (ацикловир, фамцикловир и валацикловир) и 2 схемы лечения (прием препарата во время обострений и непрерывная терапия). Непрерывный прием ацикловира (по 400 мг 2 раза/сут) можно рекомендовать больным с частыми обострениями (например, >10 в год). При более редких обострениях достаточно назначать фамцикловир или валацикловир во время рецидива заболевания. До тех пор, пока не будет проведено сравнительное испытание этих двух новых препаратов, назначать можно любой из них, а решающим фактором будет их стоимость.
Thomas McGinn
Montefiore Medical Center Bronx, New York, USA
1. Rooney J.F., Straus S.E., Mannix M.L., et al. Ann Intern Med 1993;118:268—72.
2. Goldberg L.H., Kaufman R., Kurtz T.O., et al. Arch Dermatol 1993;129:582—7.
3. Rolan P. Clin Pharmacokinet 1995;29:333—40.
Десятого сентября на интернет-сайте журнала Cell Host & Microbe появилось поистине удивительное сообщение, подписанное исследователями из США, Канады, Великобритании и Бельгии. Они экспериментально доказали, что антивирусный препарат ацикловир, который уже много лет используют для борьбы с герпесом, можно превратить в эффективное оружие против СПИДа.
Это открытие помог сделать тот самый герпес-вирус, против которого работает ацикловир. Оказалось, что он изменяет молекулярную структуру ацикловира и тем самым заставляет его блокировать размножение вируса человеческого иммунодефицита.
Алексей Левин: Леонид, давайте начнем с ацикловира.
Леонид Марголис: Ацикловир, он же зовиракс, применяют в медицине уже лет тридцать. Он продается без рецепта и прекрасно работает против инфекций, вызванных вирусами простого герпеса первого и второго типа.
Надо сказать, что это поистине удивительное лекарство, которое занимает совершенно особое место в истории фармакологии. Обычно создание новых лекарственных средств начинается с того, что ученые выделяют их активные ингредиенты из бактериальных культур или, скажем, соков растений. А вот ацикловир, если мне не изменяет память, стал первым в мире лекарством, которое было искусственно сконструировано на молекулярном уровне.
Это сделала замечательная уроженка Нью-Йорка Гертруда Элион [Gertrude Belle Elion], которая 20 лет назад получила за свои работы Нобелевскую премию. Она создала, единолично или в соавторстве, много синтетических лекарств против менингита, лейкемии, бактериальных инфекций дыхательных путей и других патологий. И при этом не имела никаких научных степеней, только университетский диплом.
Ацикловир – тоже ее детище. Механизм его действия изучен до тонкостей. Этот препарат совершенно нетоксичен, его можно принимать внутрь граммами без всякого риска. Более того, сам по себе он абсолютно инертен и не оказывает никакого влияния на физиологические процессы. Он включается в работу только в клетках, зараженных герпес-вирусами. Как это происходит, хорошо известно.
Ацикловир активируется лишь в том случае, его молекула присоединяет три фосфатные группы, каждая из которых состоит из атома фосфора, трех кислородных атомов и двух атомов водорода. Молекулярные перестройки, приводящие к заякориванию таких групп, называются фосфорилированием и играют огромную роль в биохимии. Чтобы они осуществлялись, необходимы специальные ферменты.
Один из таких ферментов, тимидинкиназу, производит вирус герпеса. Тимидинкиназа подцепляет к молекуле ацикловира первую фосфатную группу, а другие две потом присоединяются к ней другими ферментами, которые уже присутствуют в клетках. По этой причине ацикловир может работать лишь в клетках, атакованных вирусом герпеса, и никак не воздействует на клетки, свободные от этой инфекции.
А.Л.: Как в точности он действует?
Л.М.: Весьма хитроумно. Активированный ацикловир встраивается в вирусную ДНК и блокирует ее дальнейший синтез. Можно сказать, что он действует в качестве затычки, останавливая удлинение ДНК. Однако до сих пор считалось, что против других вирусов он совершенно бесполезен.
А.Л.: Это, как я понимаю, только присказка, а сказка впереди?
Л.М.: Совершенно верно. Пока была предистория, теперь можно перейти к нашей работе. Мы изучали, как взаимодействуют между собой вирусы герпеса и иммунодефицита. Чтобы собрать такую информацию, мы одновременно заражали ими кусочки живой человеческой ткани, выделенной из миндалин и шейки матки, поскольку оба вируса там хорошо размножаются. А чтобы поставить контрольный эксперимент, мы решили отключить вирус герпеса с помощью ацикловира. К нашему великому удивлению, в этих тканях тут же перестал размножаться и вирус СПИДа.
Тогда мы стали копать глубже. Взяли новые ткани тех же типов, по отдельности заразили их обоими вирусами и тогда уже ввели ацикловир. Размножение вируса герпеса, как и ожидалось, сразу застопорилось, но то же самое случилось и с вирусом иммунодефицита. Это уже не лезло ни в какие ворота.
А.Л.: Действительно, парадокс…
Л.М.: В том-то и дело. Сначала мы просто не знали, что и думать. Решили повторить те же опыты уже не на кусочках тканей, а на чистых культурах клеток Т-лимфоцитов. Там уже все было по учебнику, ацикловир действовал только против герпеса. Тогда мы вернулись к тканям и проверили, нет ли в них герпес-вируса. Сами-то мы их, конечно, не инфицировали, но ведь вирусы герпеса могли там появиться и в результате спонтанного заражения.
И вот оказалось, что во всех тканях, с которыми мы работали, имеются вирусы герпеса, только не те, против которых применяют ацикловир. Герпес-вирус ведь существует в восьми вариантах, некоторые из которых совершенно безобидны. Американцы заражены ими почти поголовно и даже не замечают их присутствия в организме. Мы получаем ткани для опытов из больниц, где они остаются после хирургических операций. Так что не приходится удивляться, что наши образцы были изначально инфицированы сравнительно безвредным герпесом.
А вот лабораторные клеточные культуры, на которых мы ставили контрольные эксперименты, никаких вирусов, конечно, не содержали. Тут уж пришлось признать, что ацикловир блокирует вирус СПИДа при каком-то участии вируса герпеса. Это подтвердили контрольные эксперименты.
А.Л.: И что же, удалось узнать, как герпес-вирусу удаются такие подвиги?
Л.М.: Ну, пробный ответ напрашивался сам собой. Поскольку вирус герпеса вызывает тройное фосфорилирование молекул ацикловира, было естественно предположить, что такие модифицированные молекулы обладают антиспидовым потенциалом. И мы не ошиблись…
Оказалось, что фосфорилированный ацикловир вмешивается в работу фермента, который позволяет вирусу СПИДа копировать свою генетическую информацию. В самом вирусе она записана на молекулах рибонуклеиновых кислот, но чтобы встроиться в клеточные ядра, вирус должен ее переписать на молекулах ДНК. Такую задачу выполняет фермент обратная транскриптаза, который и блокируется модифицированным ацикловиром.
Естественно, сначала мы ничего этого не знали. Пришлось обратиться за помощью к профессору университета Эмори Раймонду Шинази [Raymond Schinazi], крупнейшему специалисту по обратной транскриптазе. Сначала он заявил, что ацикловир никак не может воздействовать на вирус СПИДа, иначе это давно бы открыли. Но уже через неделю он мне позвонил и подтвердил нашу гипотезу. Он выделил в чистом виде вирусную обратную транскриптазу и обнаружил, что она угнетается трижды фосфорилированным ацикловиром. Шинази также выяснил, как именно это происходит на молекулярном уровне. После этого сомнений уже не осталось.
А.Л.: В таком случае, Леонид, разрешите Вас поздравить с крупным открытием. Что за ним последует?
Л.М.: Во-первых, есть все основания надеяться, что обычным ацикловиром можно лечить носителей ВИЧ-инфекции, зараженных вирусом простого герпеса. Так это или нет, покажут клинические испытания, которые уже начались. Кроме того, трижды фосфорилированный ацикловир уже удалось получить в лаборатории. Не исключено, что он станет самостоятельным средством против СПИДа. Оправдаются ли эти надежды, покажут будущие исследования.
. Поговорив с доктором Марголисом, я порадовался и собственному везению. Не так уж часто журналисту удается выслушать рассказ о только что сделанном открытии, которому, возможно, будет суждено стать основой лечения тяжелейшей болезни. Надеюсь, он заинтересует и посетителей нашего сайта.
Читайте также:


