Вирус эхо 1 при лечении рака
Как вирусы провоцируют раковые опухоли
Среди направлений, которые современная медицина разрабатывает в поиске средств для борьбы с раком, важное место принадлежит вирусологии. С начала XX века известно, что онкозаболевания и инфицирование вирусами могут быть связаны друг с другом, но лишь теперь становится ясно, как именно и в каких случаях проникновение вируса в тело человека приводит к появлению злокачественной опухоли. Редакция N + 1 приготовила для своих читателей рассказ о том, что на сегодняшний день известно об этой теме.
О причинах возникновения опухолей ходили догадки начиная с античных времен, и некоторые из них оказались удивительно проницательными для своего времени. Так еще в 1775 году английский врач Персифаль Пот обнаружил, что у трубочистов подозрительно часто встречается рак мошонки и связал это с канцерогенными свойствами сажи. Позже появились и другие подтверждения того, что некоторые вещества — позже их назовут канцерогенами — способны провоцировать образование опухолей.
Примерно в то же время российский ветеринар Мстислав Новинский продемонстрировал передачу болезни при переносе раковых клеток от больной собаки здоровой, показав тем самым, что рак может возникать и от контакта с живыми клетками. Тем не менее, эти два способа не объясняли всех случаев, и врачи продолжали искать возможные причины. Поэтому неудивительно, что после того, как в начале XX века были открыты вирусы, их тоже кинулись проверять на причастность к этой болезни.
Впервые доказательство их вины удалось получить Фрэнсису Пейтону Роусу и его датским коллегам Вильгельму Эллерману (Vilhelm Ellermann) и Олафу Бангу (Olaf Bang). Они продемонстрировали, что кур можно заразить раком при помощи бесклеточных фильтратов из опухолей больных птиц, но сделала это на разных примерах. Роус обнаружил вирусную природу птичьей саркомы, а датчане открыли вирус лейкоза птиц. Открытие оказалось настолько важным, что спустя полвека Роусу вручили за него Нобелевскую премию по медицине.
Обидно, но его датские коллеги, хоть и выступили со своим открытием на два года раньше, остались без премии, а их статья долгое время оставалась незамеченной. Возможно, причина этого заключалась в том, что раковая природа лейкемии долго оставалась неизвестной. Аналогичным образом остались без внимания работы итальянца Джузеппе Чуффо (Giuseppe Ciuffo), который в 1907 году продемонстрировал вирусную природу бородавок — связь папилломы и рака обнаружили гораздо позже.

Та самая курица с саркомой, с которой начались исследования Роуса
P. Rous / J. Exp. Med., 1911
Идея вирусного происхождения рака оказалась слишком новой для того времени, и должна было пройти еще пара десятков лет, прежде чем у нее появились новые поклонники. В тридцатых годах в аналогичных экспериментах на кроликах и мышах была подтверждена онкогенность других вирусов. На Западе наибольшую известность приобрели эксперименты Джона Биттнера (John Bittner), а в Советском Союзе его идеи были проверены Львом Зильбером — ученым с очень непростой судьбой.
Жизнь кидала Зильбера от Парижа до Печоры, а основные постулаты своей вирусной теории канцерогенеза он сформулировал в тюрьме. Работая в шарашке (НИИ тюремного типа при НКВД), ученый много экспериментировал с вирусом папилломы у кроликов — после заражения и дополнительной стимуляции канцерогенами у животных развивались опухоли.
Зильбер заметил, что к моменту появления внешних признаков опухоли вирус в тканях уже не обнаруживается. Это позволило предположить, что вирус папилломы только провоцирует клетку к злокачественной трансформации, а потом может элиминироваться из-за неспособности жить в условиях опухоли. Догадка насчет папилломы оказалась отчасти верна и получила мощное развитие уже в XXI веке, но попытка Зильбера в целом представить вирусы чуть ли не основными и единственными двигателями канцерогенеза не подтвердилась.
Со временем накопилось немало свидетельств того, что разные вирусы могут провоцировать развитие рака у животных, и начиная с шестидесятых годов аналогичные случаи начали массово описывать у людей.
Ниже представлены основные онкогенные вирусы и соответствующие им опухоли (источник).

Вирус папилломы, или HPV, — самый известный и хорошо изученный пример онкогенного вируса, провоцирующего у людей рак шейки матки и опухоли головы и шеи. Рак шейки матки — это четвертое по распространенности и смертности онкозаболевание среди женщин. Хуже всего с ним в Африке, но и в России его частота выше, чем во многих других странах, — 17 заболевших на 100 тысяч женщин. Фотография из работы первооткрывателя этой связи Гаральда цур Хаузена (Harald zur Hausen), получившего за свои работы Нобелевскую премию.
H. zur Hausen, Current Topics in Microbiology and Immunology 1977

Клетки с необычной цветочной формой ядра — характерный признак лейкемии, вызванной HTLV-1, Т-лимфотропным вирусом. Этот вирус довольно распространен в тропических странах и Японии. Обычно он ведет себя тихо, но в 5-10 процентах случаев может провоцировать опухолеобразование. У HTLV-1 есть много способов это сделать: как и другие ретровирусы, он умеет встраивать (и встаивает) свою ДНК в геном хозяина, а его белки могут взаимодействовать с CTCF — важным клеточным регулятором активности генов и организации хроматина.
American Society of Hematology, Blood Journal 2010

Гепатоцеллюлярная карцинома, по-простому рак печени, в 75 процентах случаев развивается на фоне хронического поражения вирусами гепатита B и С. Несмотря на сходный результат своей деятельности, эти вирусы вообще не родственны друг другу и ведут себя по-разному. HBV сделан на основе ДНК, может встраиваться в человеческий геном и дестабилизировать его. У HCV вместо ДНК РНК, он живет в цитоплазме и провоцирует рак за счет того, что мешает клетке чинить свою ДНК и тем самым увеличивает количество мутаций.
Delaney, Antiviral Research 2013
Среди других онковирусов — относительно редкий вирус герпеса 8 типа (KSHV), провоцирующий саркому Капоши и обычный обитатель нашей кожи вирус клеток Меркеля (MCV). Несмотря на широкое распространение, его открыли лишь в 2008 году благодаря метагеномному анализу кожи пациентов с карциномой клеток Меркеля.
После того как ученые наткнулись в образцах на последовательность ДНК неизвестного им раньше вируса, им удалось найти его самого, а заодно разработать аккуратный метод детекции. К их удивлению, этот вирус обнаружился практически у всех больных.
Действие онколитических вирусов основано на том, что они заражают преимущественно раковые клетки. В этом случае они ведут себя довольно агрессивно и убивают зараженную клетку, кроме того, их присутствие привлекает внимание иммунной системы.
Такими свойствами в отношении разных типов опухолей обладают парвовирусы, вирус везикулярного стоматита и другие, например созданный в лаборатории онколитический вирус герпеса. Последний получается путем удаления у обычного вируса герпеса первого типа гена ICP-34.5. Из-за этой манипуляции тот теряет способность размножаться в нервной ткани и ополчается на клетки опухоли.
Сейчас сразу несколько препаратов, основанных на этом принципе, находятся на разных стадиях клинических испытаний.
Сразу стоит отметить, что связь между заражением вирусом и канцерогенезом не столь однозначна, как можно представить. Сам по себе рак не заразен — известно всего несколько исключений из этого правила, вроде лицевой опухоли у тасманийского дьявола, но все они обнаружены не у людей, а у других животных и не связаны с вирусами. Тем не менее, можно легко заразиться вирусом, деятельность которого в дальнейшем может привести к раку.
Есть несколько типов опухолей, напрямую связанных с вирусами. Так, саркому Капоши находят только у KSHV+ людей, а такие распространенные опухоли, как рак шейки матки или рак печени, в 70-90 процентах случаев спровоцированы соответствующими вирусами.
Аналогичным образом, MCV провоцирует образование опухолей далеко не во всех случаях и становится агрессивным только после приобретения ряда мутаций — и то не у любых людей.
Для некоторых вирусов их онкогенный статус находится под вопросом — бывает, что их обнаруживают в пациентах с определенными видами раков, но такие совпадения находятся недостаточно часто, чтобы однозначно клеймить вирус. Например, вирус SV40 долгое время находился под подозрением, поскольку он вызывает рак у других видов животных. После многочисленных проверок ученые пришли к выводу, что для людей такой ассоциации не существует, и сейчас он полностью оправдан.
Шансы, что малозаметная вирусная инфекция приведет к онкогенезу, зависят от разных факторов. Во-первых, очень большую роль играет штамм вируса. Так, среди множества папиллом есть вирусы высокого и низкого риска, а около 70 процентов случаев опухолей — дело рук всего двух штаммов HPV16 и HPV18.

На текущий момент известно больше сотни штаммов вируса папилломы, освоивших самые разные ткани. На филогенетическом дереве хорошо видно, что онкогенность — как и специализация к отдельным тканям — возникала несколько раз независимо и свойственна лишь отдельным штаммам.
Ma et al., Journal of Virology 2014
Заякоривание вируса в организме может иметь свои причины — ослабленный иммунитет больного или усугубляющее действие канцерогенов вроде курения и других вирусов. Так, коинфекция вирусами гепатита B, C и ВИЧ в любых комбинациях повышает риск развития хронического гепатита и смертность от рака печени.
На молекулярном уровне переход инфекции в хроническую стадию часто сопровождается интеграцией ДНК вируса в человеческий геном. При этом сам вирус может давно покинуть хозяина, но застрявшие в геноме сломанные реплики будут продолжать мешать клетке нормально функционировать. По-видимому, именно это и наблюдал Лев Зильбер, когда видел, что у излечившихся от папилломы животных всё равно возникали опухоли.
Альтернативный путь — научиться манипулировать клеточным жизненным циклом, подталкивая ее к делению и синтезу ДНК. В большинстве случаев вирусы достигают этого, мешая работать белку Rb, который как раз ограничивает переход клетки к делению.
Кроме того, вирусам выгодно увеличивать продолжительность жизни клетки и не допускать ее апоптоза — самоубийства зараженных или просто больных клеток во имя здоровья всего организма. Для этого они давят работу классического онкосупрессора p53. Это регулятор клеточного цикла, который может запретить клетке переходить к делению при обнаружении каких-то патологий.
Та же интеграция вируса это тупиковый варинт развития событий. Из-за появления ошибок в ДНК при вставке вирус теряет способность к размножению и оказывается навсегда похоронен в человеческом геноме. Регуляция генов в них нарушена, и обычно малоактивные вирусные онкогены — например E6 у папилломы — включаются на полную мощность. В итоге плохо становится всем — и вирусу, и клетке.

Несмотря на то, что MVC открыли недавно, довольно быстро в общих чертах стало ясно, как и почему он провоцирует онкогенез. При сравнении MCV+ и MCV— раковых больных со здоровыми носителями MCV выяснилось: в опухоли вирус обычно интегрирован в человеческий геном так, что теряет способность к нормальному размножению (справа). Это приводит к тому, что самого вируса нет, но его белки по-прежнему синтезируются и вмешиваются в клеточные процессы. Второе обязательное изменение, которое должно произойти, это поломка гена LT. Из-за нее синтезируется укороченная версия этого белка, которая умеет влиять на экспрессию других генов и стабилизирует другие онкопротеины. В отсутствие вируса злокачественная трансформация клеток Меркеля достигается за счет множества мутаций из-за воздействия ультрафиолета (слева).
Harms et al., Nature Reviews Clinical Oncology 2018
Как и в случае с другими вирусами, онковирусы с трудом поддаются лечению. Хорошие противовирусные лекарства есть для гепатита С и герпесов, а в остальных случаях лечат уже не вирусы, а саму опухоль. Поэтому профилактика заражения часто эффективнее. Тут работают классические приемы: вакцинация и соответствующий образ жизни.
Основные пути передачи папилломы и гепатитов B и C половой, через кровь, и вертикальный, от матери к ребенку. Так же как и ВИЧ, ими невозможно заразиться бытовым путем, и меры предосторожности для них для всех примерно одинаковые. Вирус Эпштейна-Барр передается в основном через слюну, но его тотальное распростанение делает превентивные меры малоэффективными.
Работы по созданию вакцин ведутся практически для всех онковирусов, но готовые препараты, успешно прошедшие клинические испытания, есть только для двух разновидностей. Прививка от вируса гепатита В включена в национальный календарь прививок РФ и делается по умолчанию всем детям в самом раннем возрасте.
Вакцины от онкогенных штаммов HPV — Гардасил и ее продвинутая версия Гардасил 9 — в России имеют рекомендательный характер и лишь в некоторых регионах включены в бесплатные программы. Такая избирательность связана с дороговизной прививки, а не с сомнениями в ее пользе: вопреки опасениям антипрививочников вакцинация от HPV не связана с появлением аутоиммунных заболеваний.
Основная целевая группа для вакцинации — это девочки 12-13 лет: если успеть привиться до начала половой жизни, то шансы получить рак шейки матки в будущем значительно снижаются. Кроме того, недавно FDA проверила эффективность этой прививки для взрослых людей и по результатам испытаний повысила максимальный рекомендуемый возраст вакцинации с 26 до 45 лет.
Для непривитых ВОЗ рекомендует проходить тесты на HPV и, в случае заражения онкогенным типом, тоже регулярно проходить проверки — это позволяет обнаружить рак на ранней стадии, когда высока вероятность полного излечения. Мониторить другие онковирусы и вирус иммунодефицита тоже может оказаться полезным.
В мире интенсивно идет разработка лекарств от онкозаболеваний на основе вирусов. В нашей стране такие работы ведутся в Новосибирском университете, ГНЦ "Вектор", Институте химической биологии и фундаментальной медицины СО РАН и Институте молекулярной биологии РАН. Нами получены рекомбинантные штаммы различных вирусов, показавшие перспективность их использования для уничтожения раковых клеток. Проблема сейчас в получении финансирования на доклинические исследования и клинические испытания.
Прогнозы писателей-фантастов редко сбываются буквально. Но с рассказом Игоря Росоховатского "Шутка госпожи природы" именно так и произошло. В нем бедняк излечился от рака, съев батат, зараженный вирусом батата, в то время как богач умирает, хотя его лечили самыми современными методами. Рассказ был опубликован в 1962 году. А в 2015 году Управление по контролю пищи и лекарств США (FDA) разрешило применение рекомбинантного герпесвируса для лечения рецидивирующей меланомы (рака кожи) и рекомбинантного ортопоксвируса для лечения опухолей печени.
Да, конечно, нынешние онколитические вирусы — не вирусы растений. Но мы видим начало сознательного использования вирусов против онкозаболеваний: к списку методов лечения рака официально добавился метод разрушения опухолей с помощью вирусов.
Сомнения и перестраховка
Метод нельзя назвать новым, потому что первая посвященная ему научная публикация появилась еще в 1904 году. В ней было описано использование так называемого "фиксированного" (ослабленного) штамма вируса бешенства для лечения онкобольных. Но широкого распространения метод не получил как из-за непредсказуемости результатов, так и весьма значительной реактогенности тогдашней вакцины против бешенства.
Тем не менее в течение всего ХХ века к этому методу неоднократно возвращались. В частности, начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы. При этом порой онкобольные полностью выздоравливали, наблюдались и временные улучшения. Но опять же отсутствие предсказуемости результатов, научно обоснованных принципов действия вирусов на опухоли и предубеждение контролирующих органов привели почти к полному прекращению применения этого подхода.
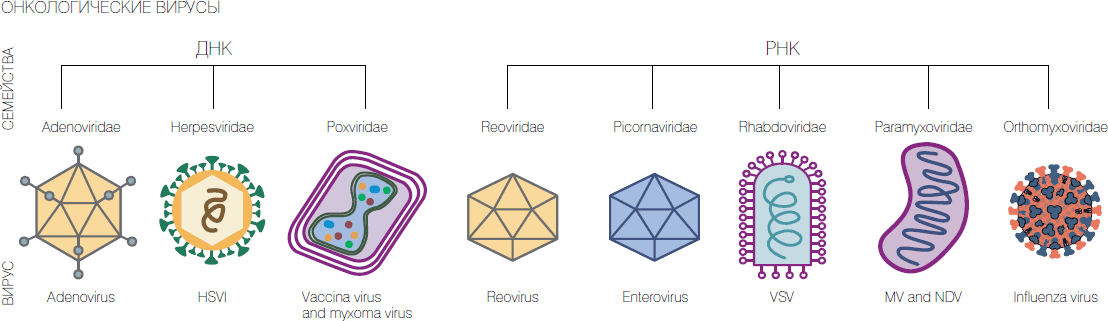
У нас работы в данном направлении были начаты в 1970-х годах профессором М.К. Ворошиловой в Институте полиомиелита и вирусных энцефалитов под Москвой. Она применяла для лечения онкозаболеваний вакцинные штаммы вируса полиомиелита и другие штаммы непатогенных энтеровирусов и в ряде случаев добилась серьезных успехов. Но предубеждения руководящих онкологов привели к запрету ее работ.
И в нашей стране, и в ряде других стран недоверие к потенциально полезным противораковым вирусам до недавнего времени превалировало из-за боязни их патогенных свойств. При этом врачи хорошо знают, что многие химиотерапевтические препараты для борьбы с онкозаболеваниями дают массу вредных побочных реакций. Но их применяют, и никакого предубеждения у врачей к ним нет. Между тем механизм действия большинства таких препаратов рассчитан на разницу в метаболизме раковых и нормальных клеток. Так что поражают эти препараты и раковые, и некоторые здоровые, но активно метаболизирующие, делящиеся клетки.
1. Хирургическое удаление опухоли.
2. Радиотерапия — направленное разрушение опухоли специально введенными в клетки радиоактивными препаратами или направленным лучевым воздействием.
3. Химиотерапия — уничтожение опухолевых клеток специфичными к особенностям метаболизма опухолевых клеток химиопрепаратами.
4. Терапия с помощью высокоспецифичных к опухолевым антигенам или к определенным клеточным белкам моноклональных антител, которые отличают клетки с этими маркерами от нормальных клеток, метят их собой и привлекают к ним клетки иммунной системы, которые благодаря этим меткам разрушают раковые клетки.
5. Терапия с помощью антител, ингибирующих блокаторы иммунной системы (immune check-points). При этом выключаются "тормоза", не позволяющие иммунной системе бороться с опухолью, и начинает разворачиваться противоопухолевый иммунный ответ.
6. Иммунотерапия с помощью своих же Т-клеток, активированных особым образом.
7. Различные варианты лечения комбинациями упомянутых выше методов.
Первые официально испытанные вирусные онколитики
С 1990-х годов появилась теоретически намного более обоснованная концепция специальных онколитических вирусов. Впервые был выяснен, как тогда считали, механизм противораковой специфичности делеционного варианта аденовируса пятого серотипа с названием ONYX-015.
Дело в том, что в клетках человека и практически всех млекопитающих есть белок р53, который при начале каких-либо необычных процессов в клетке (в том числе при появлении в ней вирусов) запускает процесс апоптоза (запрограммированной клеточной смерти), чтобы не дать вирусу или вообще всей этой вдруг ставшей необычной клетке размножиться. Однако во многих опухолевых клетках ген белка р53 поврежден, а сам белок становится дефектным по этой своей функции, и в таких клетках ничто не сдерживает размножение вируса.
Но у аденовируса, в свою очередь, есть белок Е1В-55К, который связывает р53 и не дает ему запускать апоптоз. Таким образом, если из генома вируса удалить часть гена Е1В, где закодирован белок 55К, то такой вирус будет размножаться только в опухолевых клетках, где р53 и так не работает, а в нормальных он этого делать не сможет, так как клетки будут уходить в апоптоз и саморазрушаться.
Однако, как выяснилось позднее — в 2004 году, удаление части или целого гена E1B приводит к тому, что белок E1B-55K не выполняет еще ряд функций для размножения аденовируса. В опухолевых же клетках в его отсутствие эту функцию берет на себя не установленный до сих пор фактор. Также выяснилось, что есть много и других дефектов в клетках, которые приводят к их перерождению в раковые, и тогда такие аденовирусы не работают как лечебные препараты.
В конце 1990-х эта тематика по ряду причин пошла на спад. Тем не менее аналог ONYX-015, названный Н101 (онкорин), был официально разрешен для лечения больных с опухолями головы и шеи в Китае. Другой полученный в Китае рекомбинантный аденовирус, также с делецией гена Е1В, но с дополнительной вставкой человеческого гена р53 сейчас там также применяется для лечения онкобольных под названием гендицин.
С 1998 по 2003 год в ГНЦ вирусологии и биотехнологии "Вектор" силами лаборатории автора этой статьи был получен вариант аденовируса пятого серотипа с полностью удаленным геном Е1В и частично геном Е1А. Препарат на его основе был назван канцеролизином, было показано, что он обладает сходными с американским штаммом ONYX-015 и китайским онкорином онколитическими свойствами.
Данный штамм был проведен через полный цикл доклинических испытаний под руководством профессора ГНЦ ВБ "Вектор" А.Н. Сергеева. На основе их результатов канцеролизин был допущен к клиническим испытаниям первой фазы, которые в 2007 году прошли в РОНЦ им. Н.Н. Блохина с участием восьми пациентов-добровольцев. Испытания показали хорошую переносимость пациентами канцеролизина, а в двух случаях наблюдался и лечебный эффект, несмотря на то что у всех больных добровольцев была четвертая стадия развития болезни. К сожалению, финансирования на последующие испытания выделено в те годы так и не было, а позднее это потеряло актуальность из-за публикаций по разработкам вирусных онколитиков следующих поколений.
Канада: рекомбинантные аденовирусы и вирусы осповакцины.
Китай: препараты на основе рекомбинантных аденовирусов онкорин и гендицин.
Россия: рекомбинантные поксвирусы и аденовирусы, парамиксовирусы, энтеровирусы.
США: вирусы болезни Ньюкасла, природный и рекомбинантный вирус миксомы кроликов, рекомбинантный аттенуированный герпесвирус, рекомбинантные аттенуированные поксвирусы и аденовирусы, реовирус, вакцинный штамм вируса кори, рекомбинантный вирус везикулярного стоматита, вакцинные штаммы вирусов гриппа.
Финляндия: рекомбинантные аденовирусы.
Япония: рекомбинантные герпесвирусы.
Препараты нового поколения
В 2010 году Новосибирский государственный университет получил мегагрант на исследования под руководством известного российского молекулярного биолога П.М. Чумакова, одним из ведущих исполнителей которого стал и автор настоящей статьи. В НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, подготовлен и опубликован ряд обзорных статей по онколитическим вирусам, и еще в 2012 году были получены и охарактеризованы первые кандидатные онколитические штаммы.
К настоящему времени уже вне рамок мегагранта усилиями неформального коллектива из сотрудников НГУ, ГНЦ ВБ "Вектор" и ИХБФМ СО РАН получен ряд рекомбинантных штаммов вируса осповакцины с высокими онколитическими характеристиками, которые на моделях in vivo показали хорошую перспективность. Кроме того, были охарактеризованы и паспортизованы онколитические штаммы парамиксовируса Сендай и сконструированы бактериальные плазмиды с полноразмерным геномом аденовируса 6 серотипа, крайне перспективные для получения новых рекомбинантных онколитических штаммов со встройками усиливающих онколизис генов.
Таким образом, имеются все основания для проведения дальнейших работ и особенно — для полноразмерных доклинических исследований, а впоследствии и клинических испытаний этих и подобных им перспективных онколитических вирусных штаммов. Сейчас наступило время преодолеть предубеждения и дать зеленый свет для финансирования разработок этих крайне перспективных препаратов, разработанных в России.
Работы в этом направлении продолжаются не только в НГУ, профессор П.М. Чумаков развивает эти исследования на энтеровирусах и парамиксовирусах в своей лаборатории в Институте молекулярной биологии РАН имени В.А. Энгельгардта в Москве. Заинтересовались ими и в ряде клиник России.
Могут ли вирусы быть полезными
Данное направление работ за рубежом в последние десять лет получило очень мощное развитие. В октябре 2015 года в США произошел кардинальный сдвиг в отношении этого направления разработок: как уже было сказано, FDA разрешило широкие клинические испытания третьей фазы генно-инженерного штамма герпесвируса с названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой.
В том же 2015 году аналогичное разрешение на проведение третьей фазы клинических испытаний было получено для препарата на основе рекомбинантного штамма вируса осповакцины пекса-век (Pexa-Vec), или JX-594, в отношении лечения гепатоцеллюлярной карциномы (рака печени). Данный препарат сконструирован на основе исходного штамма вируса осповакцины Wyeth, у которого для уменьшения реактогенности удален ген тимидинкиназы и встроен ген ГМ-КСФ человека. Его сейчас интенсивно исследуют на добровольцах. Результаты нескольких независимых клинических испытаний первой и второй фазы уже известны, они положительны, и поэтому клинические испытания третьей фазы для этого препарата проходят уже в нескольких десятках стран в 86 больницах, что говорит о его большой перспективности.
На последнем, 17-м Международном конгрессе по вирусологии в Сингапуре онколитическим вирусам была посвящена пленарная лекция профессора Гранта Макфаддена из США и две секции: "Вирусы как троянские кони" и "Вирусы и рак". Так что интерес к этому направлению возрос колоссально, и финансируется оно, как никогда ранее, в Канаде, США, Японии, Финляндии и других странах.
В этой связи возникает вопрос: а не может ли быть такого, что роль по крайней мере некоторых из вирусов для человеческого организма как раз и состоит в защите от раковых клеток, и лишь иногда они вызывают заболевания, выходя из-под контроля?
Такое предположение заслуживает внимания. Человечество уже очень много полезного создало из весьма вредоносных, на первый взгляд, веществ и микробов. А вирусы как лекарства очень интересны, поскольку являются высокоспецифичными микромашинами. Некоторые из них люди уже приспособили для своих нужд и применяют в качестве живых вакцин, лечебных препаратов (например, бактериофаги — вирусы бактерий вместо антибиотиков) и для избирательной борьбы с вредными насекомыми.
Сергей В. Нетесов, член-корреспондент РАН, Новосибирский государственный университет
Лечением злокачественных новообразований женской половой сферы занимается специальная отрасль медицины – онкогинекология.
К онкогинекологическим заболеваниям относятся:
- Рак яичников
- Рак влагалища
- Рак шейки матки
- Рак эндометрия (рак матки)
Онкогинекологи МЕДСИ успешно занимаются диагностикой и лечением злокачественных опухолей женских половых органов. Применение комплексной диагностики, малотравматичных и высокоточных методов хирургического вмешательства, комбинированных схем лечения значительно повышает шансы пациенток на выздоровление.
Рак яичника
Опасность рака яичника заключается в том, что вплоть до поздних стадий развития заболевания его проявления могут отсутствовать или скрываться под видом других хронических заболеваний мочеполовой сферы (например, воспаления придатков матки). Вовремя обнаружить опухоль можно, регулярно посещая гинеколога и проходя ультразвуковое исследование органов малого таза либо магнитно-резонансную томографию малого таза.
Женщинам важно учитывать следующие факторы риска развития рака яичника:
- Отсутствие беременностей
- Наследственную предрасположенность (у сестер, мамы или бабушек по материнской или отцовской линии также был рак яичников)
- Рак молочной железы
- Длительное лечение половыми гормонами
- Хронические воспалительные заболевания половых органов
- Рано или поздно наступившую постменопаузу
Лечение рака яичника
В современной онкогинекологии широко применяются щадящие и малотравматичные способы хирургического вмешательства, когда операция проводится через проколы на передней брюшной стенке.
В Клинических больницах МЕДСИ в Боткинском проезде и в Отрадном при выявлении злокачественной опухоли удаление яичника проводится наиболее щадящим способом. Благодаря этому на следующий день после операции пациентки могут двигаться, не испытывая дискомфорта в области операции. Конечно, это возможно лишь на ранней стадии развития болезни. Онкогинекологи МЕДСИ помогут и при более запущенных формах рака яичника, которые в государственных медицинских учреждениях нередко признают не поддающимися лечению. И в этих ситуациях специалисты делают все возможное, чтобы подобрать наиболее эффективный тип лечения.
Используемые в Клинических больницах МЕДСИ современные методы системной и внутрибрюшной химиотерапии в сочетании с комплексными циторедуктивными операциями позволяют остановить рост опухоли и максимально уменьшить ее перед хирургическим вмешательством.
Рак влагалища
Злокачественные новообразования влагалища характерны для женщин преклонного возраста.
Вероятность развития рака влагалища повышается в следующих ситуациях:
- Лучевая терапия органов малого таза
- Рак шейки матки
- Аденоз влагалища (появление участков слизистой оболочки, характерных для шейки матки, на стенках влагалища)
- Хроническое раздражение слизистой влагалища (например, при хронических инфекциях или длительном использовании маточного кольца)
- Курение
Рак влагалища достаточно легко выявляется в ходе гинекологического осмотра, поэтому к группе риска в первую очередь относятся пациентки, редко посещающие врача.
Лечение рака влагалища
Хирургическое лечение возможно на ранних стадиях заболевания, когда новообразование ограничено пределами органа. В этом случае производится удаление опухоли, влагалища или влагалища вместе с маткой.
Если болезнь затронула окружающие ткани и стенки малого таза, проводится лучевая терапия, в т. ч. в сочетании с лекарственным (химиотерапевтическим) лечением.
Рак шейки матки
Это заболевание в нашей стране занимает среди всех новообразований у женщин второе место после рака молочной железы. Чаще всего рак шейки матки выявляется у женщин среднего возраста (35-55 лет).
На начальных стадиях заболевание никак себя не обнаруживает. О себе может дать знать уже далеко зашедшая опухоль. Причина – отсутствие болевых рецепторов в ткани шейки матки. Поэтому заблаговременно выявить заболевание можно только благодаря регулярным профилактическим осмотрам.
Симптомы рака шейки матки:
- Кровотечения при половом акте или осмотре у гинеколога
- Изменение характера менструаций
- Боль в области малого таза
Гинеколог может выявить различные изменения шейки матки: эктопию, дисплазию, лейкоплакию, эрозию, которые расцениваются как предраковые состояния и требуют пристального внимания врача.
К развитию рака шейки матки предрасполагают следующие факторы:
- Инфицирование вирусом папилломы человека
- Большое количество половых партнеров
- Курение
Диагностика и лечение рака шейки матки
Основными методами диагностики рака шейки матки являются осмотр шейки матки гинекологом при помощи специального оптического прибора (кольпоскопия) и цитологическое исследование (ПАП-тест). Выявление заболевания на ранней стадии значительно повышает вероятность излечения. Залогом успеха при раке шейки матки является применение специалистами МЕДСИ на ранних стадиях малотравматичных лапароскопических операций, а при более распространенных формах болезни сочетания химиотерапии, лучевой терапии и хирургического лечения.
Рак эндометрия (рак матки)
Эта опухоль развивается в эпителиальном слое матки (эндометрии). По причине гормональных возрастных изменений рак матки чаще всего развивается у женщин после наступления менопаузы.
Раковые клетки способны прорастать изнутри вглубь матки, а также давать метастазы (отсевы) в соседние органы и лимфатические узлы.
Наиболее характерным симптомом заболевания является появление кровотечений из половых путей при отсутствии менструаций.
Факторы, повышающие риск развития рака эндометрия:
- Раннее начало менструаций и поздний климакс
- Ожирение и сахарный диабет
- Бесплодие, отсутствие беременностей и родов
- Онкологические заболевания (рак толстой кишки или рак эндометрия) у ближайших родственников
- Гиперплазия эндометрия, диагностированная ранее
- Прием гормональных контрацептивов на основе эстрогена (без прогестерона)
- Лучевая терапия органов малого таза в прошлом
Лечение рака эндометрия (рака матки)
Основным методом лечения рака эндометрия является хирургическое удаление матки вместе с придатками и ближайшими лимфатическими узлами.
Онкологи МЕДСИ применяют малотравматичные лапароскопические методики, сокращающие период восстановления пациентки после операции и имеющие минимальный риск осложнений. После щадящей операции, которая легко переносится пациентками, не остается грубых шрамов, процесс восстановления проходит быстро и с минимальным дискомфортом. Иногда, при достаточно далеко зашедших опухолях, пациенткам дополнительно назначаются курсы лучевой терапии или лекарственного лечения.
Преимущества лечения онкогинекологических заболеваний в МЕДСИ
В МЕДСИ внедрена программа раннего выявления онкологических заболеваний, в том числе и женской половой сферы. Высокопрофессиональные специалисты, многие из которых проходили обучение в европейских клиниках и признаны экспертами в онкогинекологии, проводят качественную диагностику и подбирают эффективные схемы лечения.
Основные преимущества диагностики и лечения злокачественных опухолей женской половой сферы в МЕДСИ:
- Профессионалы в сфере онкогинекологии, постоянно повышающие свою квалификацию
- Современное оборудование
- Высокоточные методы диагностики
- Щадящие техники хирургического вмешательства
- Комплексные и эффективные схемы лечения опухолей
- Комфортные условия пребывания для пациентов
Читайте также:


