Вирус бактериофаг вирус уничтожающий бактерии

Середина прошлого века была ознаменована серьёзным открытием в медицине: появились первые антибиотики и зазвучали оптимистичные прогнозы о скорой и окончательной победе человечества над большинством инфекций. Однако на тот период эта мечта оказалась несбыточной, поскольку медики столкнулись с неприятным сюрпризом: мутации и изменение морфологических и функциональных свойств позволили бактериям приобрести устойчивость (резистентность) к самым мощным антибиотикам.
Кто открыл бактериофаги?
В это же время вдали от Франции, в Трапезунде (Турция), грузинский врач Георгий Элиава обнаружил бактерицидное действие воды в реке Кура и, благодаря публикации д’ Эреля, сделал вывод, что причина этого явления - бактериофаг. В 1920 году он открыл в Тбилиси научно-исследовательский институт, специалисты которого приступили к изучению фагов с целью их терапевтического применения. История применения бактериофагов в медицине на протяжении полувека была бы более богатой, если бы не стремительное распространение антибиотиков на Западе, которое привело в середине прошлого века к потере интереса к фагам у большинства фармацевтических компаний.
Однако грузинский НИИ бактериофагов не прекратил свою деятельность и превратился в единственный в мире центр для исследования фагов. В последние десятилетия интерес к теме бактериофагов разгорелся вновь, что, вероятно, можно объяснить развитием лекарственной устойчивости у бактерий к большинству антибиотиков.
Механизм действия бактериофагов
У каждой бактерии есть определённый вирус-фаг, который способен её разрушить. Посредством жгутиков фаги протыкают стенку бактерии и, сокращаясь, впрыскивают свой генетический материал внутрь клетки. С этого момента начинается инфекционный цикл: вначале переключаются механизмы жизнедеятельности бактерии на обслуживание бактериофага, размножается его геном, развивается ДНК вируса. В итоге бактериальная клетка разрушается и множество фагов устремляется наружу.
Бактериофаги отличаются специфичностью: поражая определённую бактерию, для всех остальных микроорганизмов они безвредны.
Лечение бактериофагами
Благодаря уникальным свойствам избирательного уничтожения болезнетворных бактерий, фаги стали применять для лечения и профилактики некоторых инфекционных заболеваний.
Против каких болезней врачи используют бактериофаги сегодня?
Наиболее широко применяется стафилококковый, стрептококковый, холерный бактериофаги, эффективные в терапии как острых, так и хронических форм заболевания, а также бактерионосительства. Кроме того, существуют фаги для лечения брюшного тифа, дизентерии, сальмонеллезов. Бактериофаги оказываются единственным эффективным средством в тех случаях, когда вышеуказанные инфекции вызываются не традиционными, а устойчивыми к антибиотикам штаммами.
Использование бактериофагов не ограничивается лишь медицинской сферой. К примеру, с 2007 года в Соединённых Штатах после серии исследований фаги были признаны безвредной добавкой и стали использоваться в качестве консерванта при производстве сыров и других скоропортящихся продуктов.
Открытые вопросы
Бактериофаги не всесильны: как оказалось, бактерии могут быть устойчивы не только к антибиотикам, но и к фагам. В связи с этим применяются методы определения чувствительности бактерий, полученных от пациента, к имеющимся в арсенале доктора бактериофагам.
Другой изучаемой сегодня проблемой является роль бактериофагов в приобретении бактериями генов устойчивости к антибиотикам.
В качестве заключения
Для оценки преимуществ и широких возможностей фаготерапии, несправедливо отвергнутой в определённую эпоху большинством исследователей, потребовалось достаточно много времени. Однако забытый метод переживает в настоящее время второе рождение и имеет все шансы стать эффективным оружием в борьбе человека с миром болезнетворных микроорганизмов. Это позволит фаготерапии развиваться и завоёвывать новые горизонты в современной медицине.

Бактериофаги – одни из самых загадочных препаратов аптечного ассортимента. Сейчас они переживают второе рождение – и в нашей стране, и за рубежом снова возник к ним интерес, в журналах появляется не только пересмотр старых результатов, но и масса новых публикаций. Что можно рассказать покупателю, который заинтересовался именно этими средствами?
Ученые обнаруживали следы жизнедеятельности бактериофагов задолго до того, как возникла вирусология. Британский бактериолог Эрнест Ханкин еще в 1896 году обратил внимание, что некий агент, способный проходить через очень тонкий фарфоровый фильтр, убивает возбудителя холеры. Развитию науки в новом направлении помешала Первая мировая, поскольку финансирование было перенаправлено разработчикам боевых газов, взрывчатых веществ и других более актуальных вещей.
За рубежом бактериофагами интересовались в первую очередь микробиологи, так что их находки не имели прикладного значения. Очень долгое время, например, фаг считался не вирусом, а ферментом. В СССР работы изначально велись медиками, в Грузии в 1923 году был создан будущий Всесоюзный центр фаготерапии, собравший на пике своего расцвета коллекцию из более чем 3 тыс. образцов. Однако затем и у нас, и за рубежом дело фаготерапии было практически уничтожено появившимися антибиотиками. Их массовое распространение после Второй мировой создавало впечатление, что изобретена панацея против инфекций и остальные направления исследований – тупиковые.
О бактериофагах ученые вспомнили, когда перед ними в полный рост встала проблема антибиотикорезистентности. Вирусы снова стали объектом экспериментов, в них увидели реальную альтернативу морально и иногда даже физически устаревшим противомикробным препаратам.
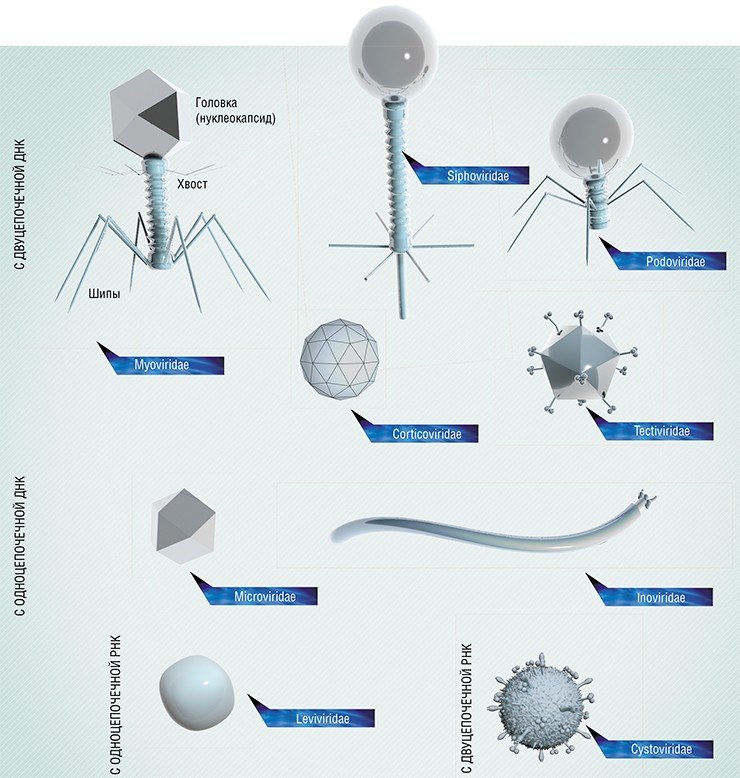
Фаги гораздо разнообразнее, чем какие-либо другие известные вирусы, нельзя сказать, что они выглядят однотипно. Чаще всего в качестве иллюстрации используется изображение вирусов группы А по классификации Бредли, она же – группа V по классификации Тихоненко. Такие вирусы устроены сложнее всего, в них имеется головка и отросток с множеством дополнительных элементов (рис. 1). Всего групп выделяют шесть, только в одной из них геном фага представлен одноцепочечной РНК, во всех остальных случаях – это одна- или двухцепочечная ДНК.
Бактериофаги нельзя назвать гигантами, но по своим размерам они, скорее, относятся к крупным и занимают промежуточное положение между самыми большими вирусами табачной мозаики и вирусом иммунодефицита человека 1-го типа (рис. 2).

По механизму действия все бактериофаги можно разделить на две большие группы. Первая – литические, или вирулентные фаги, которые в 100% случаев убивают инфицированную клетку сразу. В случае, показанном на рисунке 3, вирус сразу же уничтожает геном бактерии, используя его исключительно для целей собственной репликации. После наработки максимально возможного числа новых вирусных частиц микроб либо сразу гибнет в момент их выхода, просто разрываясь на части, либо погибает в ближайшее время из-за того, что все критически важные внутренние механизмы физически уничтожены.

По той же причине у фагов либо меньше побочных эффектов, либо их совсем нет. С резистентностью история схожая, она если и развивается, то только у конкретной бактерии-мишени. С помощью генной инженерии реально перепрограммировать вирус и натравить его на какого-нибудь другого возбудителя, еще не знакомого с вирусом.
Немаловажным фактором в пользу бактериофагов можно считать дешевизну и простоту их производства, особенно по сравнению с новыми перспективными антибиотиками. Действительно получается не менее, а иногда и более эффективная альтернатива с кратно меньшими вложениями.
Недостатки тоже есть, и они тесно связаны с вирусной природой фагов. Прежде всего, их сложно хранить и перевозить, они весьма требовательны к условиям содержания. Кроме того, фаги способны нападать только на свободно плавающие бактерии, внутрь человеческих клеток их никто не пустит. Агрессивная среда желудка уничтожает многие вирусы, не разбирая, кто пришел с миром, а кто нет. И главное, для достижения максимального эффекта терапии бактерию-возбудителя нужно фаготипировать, то есть выделить и в лабораторных условиях доказать, что против нее может быть применен вот этот конкретный вирус.

В СССР активно изучали медицинское применение бактериофагов, но публикации были либо на русском, либо на грузинском языках, поэтому мировая наука о них не знала и с удивлением изучает и цитирует их уже в наше время.
Работы по бактериофагам удостоены Нобелевской премии. В 1969 году она была присуждена американским исследователям Максу Дельбрюку, Альфреду Херши и Сальвадору Лурия за открытия, касающиеся механизма репликации и генетической структуры вирусов.
В ГРЛС зарегистрированы и обращаются на российском рынке следующие разновидности бактериофагов: брюшнотифозный, дизентерийный, против клебсиелл и отдельно – против клебсиеллы пневмонии, против кишечной палочки, протейный, сальмонеллезный, стафилококковый и против синегнойной палочки. Самый часто используемый в амбулаторной практике препарат – стафилококковый фаг.
Все знают вирусы, которые поражают человека: вирус гриппа, вирус иммунодефицита человека, из самых известных еще вирус оспы, от которого, к счастью, удалось избавиться, вирус полиомиелита — много-много разных вирусов. Полезно понимать, что вирусы — это не изобретение эукариотического мира. До того как появились вирусы, заражающие эукариоты, существовало множество вирусов, которые заражают бактерии. Вирусы бактерий называются бактериофагами или просто фагами и существуют очень давно.
Картинка ровно такая же, как с нашими вирусами. Бактериофаг не сам проникает в бактерию, а впрыскивает туда свою ДНК, переключает все информационные процессы бактериальной клетки на изготовление новых бактериофагов. То есть он отключает синтез собственных белков и заставляет бактерию синтезировать белки фага. Постепенно бактерия превращается в мешочек с вирусными частицами, который затем лопается, бактериофаги выходят наружу, заражают новые бактерии — это довольно эффективный процесс. Ясно, что если бы так было, то бактерий бы не осталось: фаги заразили бы все бактерии, и они бы умерли. Этого не происходит, потому что у бактерий есть множество разнообразных механизмов защиты. Это еще одно проявление войны, которая происходит в микромире, теперь уже между бактериями и бактериофагами. Механизмы защиты есть очень разные и довольно остроумные. Примерно понятно, как они могли выработаться в ходе эволюции: можно наблюдать промежуточные стадии, которые оказались полезными, поэтому сохранились до наших времен.

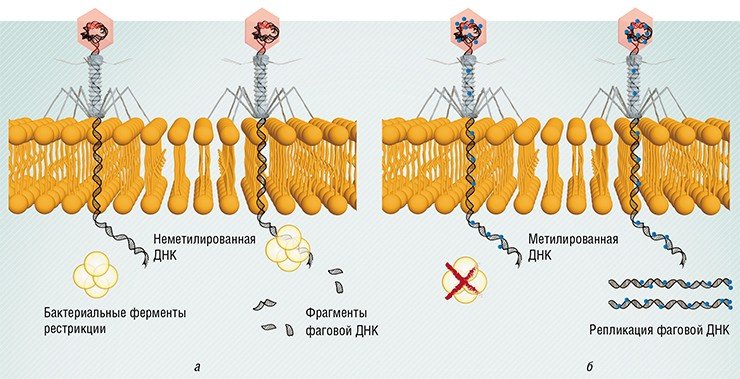
Можно разрушить вирусную ДНК. Вирус присоединяется к белку на поверхности клетки, опознает таким способом бактерию, впрыскивает туда свою собственную ДНК, а клетка ее тут же разрушает. Для того чтобы разрушить ДНК вируса, надо ее узнать, отличить ДНК вируса от своей собственной ДНК, бактериальной. Это делается разными способами, например при помощи системы рестрикции-модификации, которую мы очень интенсивно используем в генной инженерии.
Второй способ. Есть фаги, которые модифицируют всю ДНК целиком. После этого ДНК такого фага не может узнать вообще никакая клеточная система. Клетки модифицируют свои системы, чтобы, наоборот, узнавать модифицированные буквы и не узнавать немодифицированные. За счет маленьких изменений белков и того, что они узнают, все время происходит гонка вооружений.
Для того чтобы опознать ту бактерию, которую ему надо заразить, фаг связывается с каким-то конкретным белком на поверхности бактерии. Это белок бактериальный, он для чего-то нужен (например, белок, транспортирующий что-то полезное). Но в ситуации, когда много фагов, которые узнают этот рецептор, он становится вредным, потому что это те ворота, через которые проникает фаг. Бактериальная клетка может либо вообще избавиться от такого белка, либо его модифицировать за счет точечных мутаций. Имеется в виду не то, что бактериальная клетка задумалась и решила поменять свой рецептор, чтобы фаги ее не узнавали. Происходят случайные мутации, и те из них, которые препятствуют распознаванию фагом, оказываются полезными в ситуации большой зараженности, и такие бактерии получают эволюционное преимущество.

Наконец, самый красивый и альтруистический пример ― это самоубийство, когда бактерия, которая заражена фагом, не продуцирует новых фаговых частиц, а просто совершает самоубийство, разлагается. Для этого тоже есть специальные молекулярные механизмы, что называется системой токсин-антитоксин. Представьте себе, что у вас есть два белка. Один ядовитый, его в клетке мало, он продуцируется с маленькой интенсивностью, но он долгоживущий, то есть молекул мало, но каждая из них живет долго. Второй белок — антитоксин, он может связаться с токсином и его заингибировать, то есть токсин больше не действует. Молекул антитоксина много, так чтобы свободных молекул токсина не образовалось даже случайно, но они короткоживущие. Молекулы в избытке, они быстро разлагаются, и клетка все время много их делает.
На первом этапе заражения фаг переключает все клеточные механизмы на синтез новых фагов, в частности механизмы синтеза токсина и антитоксина. Клетка перестает продуцировать собственные белки, заканчивается продукция токсина и продукция антитоксина. Что происходит? Токсин долгоживущий, значит, молекулы токсина как были, так и остались, они никуда не делись. Антитоксин разлагается, это происходит быстро, а новые молекулы антитоксина не производятся. Теперь появились свободные молекулы токсина, токсин отравляет клетку, и она умирает, не успев сделать новых фагов.
Почему такой механизм эволюционно мог закрепиться? Как может закрепиться такой механизм самоубийства? Казалось бы, клетке от этого ничего хорошего, она бы в любом случае умерла. Дело в том, что обычно бактериальные клетки не существуют изолированно. Бактериальные клетки живут колониями, и все клетки в колонии идентичны генетически. Метафорически можно рассматривать такую колонию как генетически однородный единый организм. Тогда отдельным клеткам оказывается полезно совершить самоубийство, потому что с точки зрения набора генов они все одинаковы. Если какая-то из клеток умерла, но ценой этого сохранились все остальные, то эволюционно это очень полезно, они все генетически идентичны. Для бактерии как вида неважна судьба отдельных клеток, вид все равно сохранил штамм — набор идентичных бактерий. Можно это сопоставить с обычной иммунной системой людей: наши иммунные клетки погибают в процессе борьбы с заражением, но благодаря этому сохраняется весь организм.
Еще один механизм, по времени открытый самым последним. Он будет очень широко использоваться, в генной инженерии уже используются отдельные компоненты этого механизма. Это очень похоже на человеческий иммунитет, потому что система адаптивная. Система рестрикции-модификации и система токсин-антитоксин работают всегда, но в индивидуальной бактерии адаптации под новые фаги не происходит. Бактерии адаптируются на эволюционных временах, когда за счет точечных мутаций происходит подстройка.

Это действительно удивительная система, она была открыта буквально в последние годы. Она эволюционно очень красивая и оказалась очень полезна в генной инженерии, потому что механизм точного опознавания фрагмента ДНК можно использовать для того, чтобы модифицировать геномы людей, растений, животных — кого угодно. Люди очень много это изучают, в частности в Сколтехе под руководством Константина Северинова, в том числе имея в виду индустриальное применение.

Анатомия бактериофага – убийцы бактерий.
Предоставлено Игорем Красильниковым
Устойчивость возбудителей болезней к антибиотикам, методы иных путей воздействия на микроорганизмы обсуждались на круглом столе, прошедшем в Доме ученых.
Чтобы существовать, приходится приспосабливаться. Это относится не только к венцу мироздания – человеку, но и к мельчайшим организмам. Величайшей победой медицинской науки стало создание антибиотиков. С их помощью спасены миллионы людей. И что же? Бактерии научились приспосабливаться, и антибиотики перестают действовать. Приходится непрерывно синтезировать все новые препараты, а микробы к ним опять становятся нечувствительными. Процесс идет все быстрее.
С этой проблемой сталкиваются во всех странах. Представитель Европейской группы экспертов профессор Ирья Лутсар отметила, что повсеместное применение антибиотиков, а также практическое отсутствие новых препаратов антибиотического спектра действия начиная с 70-х годов XX века привело к тому, что сегодня в Европе около 400 тыс. человек ежегодно заболевают бактериальными инфекциями, обусловленными резистентными к антибиотикам микроорганизмами. Примерно 25 тыс. случаев заканчиваются летальными исходами из-за устойчивости к антибиотикам.
Особенно острая ситуация у нас. Ведь в российских аптеках можно купить без рецепта любое лекарство. Антибиотиками лечатся по собственному разумению и от гриппа, и от насморка, и от чего угодно. Пользы никакой, вред огромный. Многие инфекционные заболевания стали просто неизлечимы. К тому же, как подчеркнул доктор биологических наук Игорь Красильников, в России практически нет производства антибиотических субстанций, а те антибиотики, которые есть на нашем рынке, в основном дженерики, к которым у микроорганизмов давно выработалась устойчивость.
В связи с возросшей за последние десятилетия антибиотикорезистентностью ученые обратили внимание на незаслуженно забытую группу препаратов – бактериофаги. Они были открыты еще в начале ХХ века и сыграли важнейшую роль в фундаментальной науке. Бактериофаги – это вирусы, поражающие бактерии. И антибиотики, и фаги воздействуют непосредственно на бактерии, при этом антибиотики подавляют не только патогенную, но и нормальную микрофлору, нарушая естественный баланс, в то время как бактериофаги воздействуют исключительно на патогенные микроорганизмы.
Заведующая лабораторией бактериофагов НИИ стандартизации и контроля медицинских и иммунобиологических препаратов ГИСК им. Тарасевича Ольга Дарбеева отметила, что в нашей стране накоплен большой опыт исследования бактериофагов в разных областях медицины. Есть препараты практически против всех известных возбудителей инфекционных заболеваний. Стафилококковый жидкий бактериофаг применяется при заболеваниях верхних дыхательных путей, гнойных инфекциях кожи, слизистых оболочек, внутренних органов, вызванных стафилококками. Бактериофаг, в состав которого входят фильтраты фаголизатов шигелл, сальмонелл, энтеропатогенной кишечной палочки, используется для лечения желудочно-кишечных заболеваний, вызванных бактериями дизентерии, сальмонеллой, кишечной палочкой, протеем, энтерококками, стафилококками, синегнойной палочкой или их сочетанием. Разработаны и комбинированные препараты, например секстофаг, в составе которого шесть очищенных фагов: стафилококковый, стрептококковый, синегнойный, клебсиеллезный, коли и протейный. Это значит, что он убивает все эти бактерии.
Главный государственный врач Министерства обороны профессор Василий Акимкин рассказал о том, как в течение 33 месяцев не удавалось справиться с больничной инфекцией сальмонеллеза из-за устойчивости болезнетворных штаммов к традиционным антибиотикам. Заболевание приняло масштабы эпидемии, которая была ликвидирована с помощью бактериофагов за полтора месяца.
В отличие от антибиотиков, уничтожающих массу самых разных бактерий и приводящих к дисбактериозу, каждый бактериофаг, как ключ к замку, подходит к одной какой-то бактерии.
Наша страна была пионером фаготерапии, ставшей сегодня актуальным биомедицинским направлением. Первые отечественные фаговые препараты были разработаны в Тбилиси еще в 1930-е гг., а в настоящие дни они выпускаются в широком ассортименте. В отличие от обычных антибиотиков они обладают высокой избирательностью, не приводят к возникновению лекарственной устойчивости у патогенов и не имеют негативного побочного действия на организм больного. Однако их применение в клинической практике до сих пор ограничено в силу ряда объективных и субъективных причин, от противодействия крупных фармацевтических компаний до отсутствия квалифицированных специалистов и хорошо оборудованных микробиологических центров
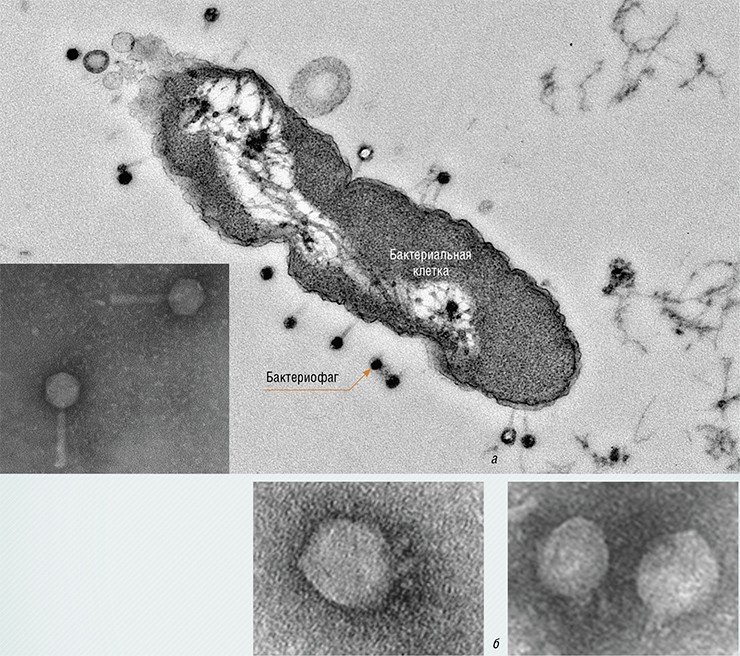
Размер генома у разных фагов может различаться. У некоторых он очень мал – (от 3,5 тыс. пар нуклеотидов), в таком геноме хранится информация всего лишь о 3—4 белках. Более того, гены, кодирующие эти белки, вынуждены перекрываться (накладываться друг на друга). Размер геномов у других фагов сопоставим с размером геномов крупных, сложно организованных вирусов многоклеточных животных, достигая 170 тыс. пар нуклеотидов (самый крупный из известных фагов содержит около 480 тыс. пар оснований!). Такой геном может кодировать уже до двухсот различных белков. Именно такие фаги обычно имеют большие размеры и сложно организованы.
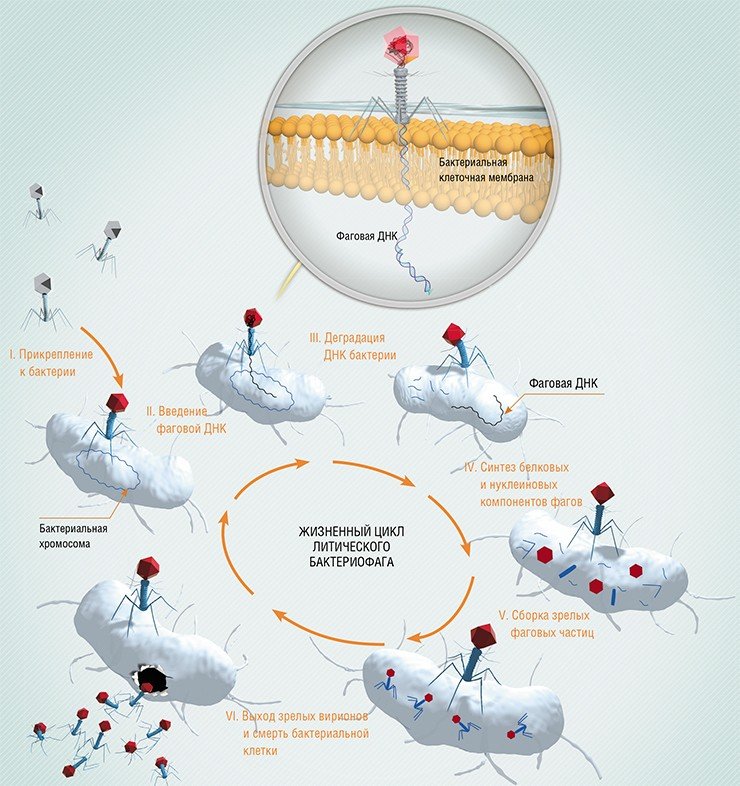
Гонка вооружений
По оценке специалистов, каждые двое суток бактериофаги уничтожают половину мировой популяции бактерий. Вот почему эти быстро размножающиеся организмы не покрыли толстым слоем всю поверхность нашей планеты – в отсутствии фагов они сделали бы это за несколько дней.
Например, ДНК всех бактерий несет на себе особые метки (метилированные основания), и специальные бактериальные ферменты рестрикции расщепляют любую ДНК, на которой таких меток нет, в том числе и фаговую. Однако некоторые фаги научились имитировать такие метки и таким способом обходить защиту.
К слову сказать, с точки зрения медицины, изменение рецепторов болезнетворной бактерии может быть благом для человека, поскольку именно бактериальные рецепторы служат факторами вирулентности, определяющими выживание и размножение возбудителя в организме-хозяине. И устойчивые к фагу мутанты обычно являются менее патогенными по сравнению со своими предшественниками.
Фаготерапия: сквозь тернии
В медицинских целях бактериофаги были впервые применены в 1915 г., когда один из их первооткрывателей, Ф. д’Эрель, использовал такой препарат для лечения дизентерии у детей. Однако дальнейшая история развития фаговой терапии была непростой. Дело в том, что предложения д’Эреля намного опередили свое время, и долгие годы ему пришлось бороться за признание своего открытия. В том числе со знаменитыми французскими коллегами, которые не признавали точку зрения д’Эреля на природу этих бактерицидных агентов, считая их ферментами. Истина восторжествовала лишь в 1940-х гг., но задолго до этого, устав от борьбы, д’Эрель уехал работать в США.
В 1934 г. он приехал в Грузию, в Тбилиси, где к тому времени сложились уникальные возможности для развития фаговой терапии. Еще с 1918 г. там существовала лаборатория (впоследствии − институт) микробиологии, руководитель которой, Г. Элиава, был командирован в знаменитый Институт Пастера для освоения методик и приобретения оборудования. Именно там он и познакомился с д’Эрелем и его удивительным открытием.
С начала 1940-х гг. фаговая терапия начала применяться в странах Европы и США. Такие препараты получили миллионы пациентов, однако результаты лечения оказались противоречивы и невоспроизводимы. Реклама обещала чудеса, но их не было – сама идея фаготерапии была скомпрометирована. Причина заключалась в том, что в то время не только производители препаратов, но и сами ученые не располагали необходимыми знаниями о свойствах фагов и о механизме их действия, да к тому же не имелось и надежных технологий работы с вирусами.
Неудачи следовали за неудачами, поэтому неудивительно, что аптекари и врачи вздохнули с облегчением с появлением антибиотиков. Эти относительно дешевые, с широким спектром антибактериальной активности, хорошо хранящиеся химические вещества, казалось, радикально решили проблему лечения инфекционных заболеваний. Бактериофаги на Западе были забыты на много лет. Основанная д’Эрелем французская компания по выпуску коммерческих фаговых препаратов переключилась на другие проекты (на ее основе выросла знаменитая косметическая компания L’Oreal).
Исследования фагов продолжались только в СССР, Польше и Чехословакии. Самым большим производителем фаговых препаратов был грузинский институт, созданный Элиавой: к 1980-х гг. там работало около 1200 человек, а препараты рассылались для испытаний в клиниках по всему СССР. Производство бактериофагов было организовано также в Уфе и Горьком.
Коктейли из фагов
Новый виток интереса к фаговой терапии пришелся на последние годы. Дело в том, что антибиотики тоже не стали панацеей при лечении бактериальных инфекций: в наши дни разработка новых препаратов не поспевает за ростом числа бактерий с приобретенной устойчивостью к существующим антибиотикам. Уже сегодня в госпиталях Англии около 40 % стафилококковых инфекций вызвано такими штаммами, а в США от госпитальных инфекций, вызванных лекарственно устойчивыми бактериями, ежегодно умирает около 90 тыс. пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год!
Как говорилось выше, спектры активности фагов обычно очень узки и ограничены одним или несколькими близкородственными видами бактерий. С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности.
Такой подход использовал еще д’Эрель. Коктейль д’Эреля, привезенный им из Парижа еще в 1930 г., до сих пор является одним из основных фаговых препаратов: он лежит в основе грузинского пиофага и российского интестифага. В Тбилиси на основе фаговых коктейлей разрабатывались препараты для лечения желудочно-кишечных заболеваний и гнойных ран для массового применения в случае возникновения эпидемий или военных действий. Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов.
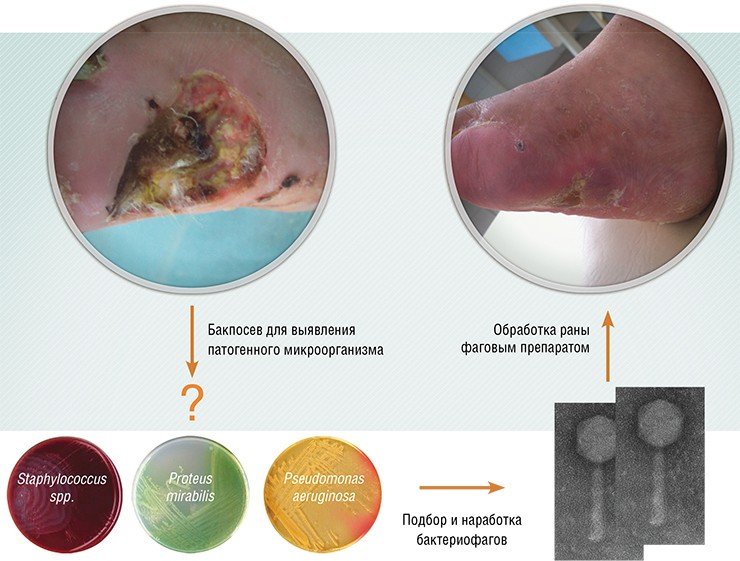
Фаговые коктейли производятся стандартными, и ориентированы они на сообщества бактерий, часто встречающиеся при конкретных заболеваниях. Конечно, более эффективные коктейли получаются в том случае, когда их компоненты подбирают к бактериальному сообществу конкретного пациента. Для получения такого коктейля необходимо протестировать бактерии пациента на чувствительность к фагам из коллекции, чтобы подобрать наиболее эффективные фаговые штаммы. Если нужных фагов в коллекции не окажется, специфичные для бактерий фаги ищут в природных субстратах.
Вообще поиск бактериофагов довольно прост: на бактериальную культуру воздействуют образцами из различных источников: водоемов, почвы, канализационных стоков и т. п. Если бактерии погибают, их отделяют от раствора центрифугированием, а оставшийся раствор тестируют на активность. Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С.
Современная история
К настоящему времени самый большой опыт фаготерапии имеют специалисты из Тбилиси и специализированного центра Института иммунологии и экспериментальной терапии им. Л. Хиршфельда (Вроцлав, Польша), где в небольших количествах производятся препараты бактериофагов для испытаний.
Польские исследователи изначально делали акцент на персонализированную терапию. Они использовали фаготерапию для экспериментального лечения пациентов с хроническими заболеваниями, которым не помогают антибиотики. Через центр прошли уже тысячи пациентов, многие из которых были полностью излечены.
Результаты этих клинических испытаний доказали высокую эффективность фагов при лечении инфекционных легочных заболеваний: для подавления инфекции в горле, носу и в легких достаточно однократного интраназального введения препарата. Не менее эффективно фаги элиминируют патогенные бактерии из желудочно-кишечного тракта. Высокая эффективность бактериофагов была также продемонстрирована практически во всех случаях гноеродной язвы диабетической стопы, заболеваний легких, мастита, урогенитальных инфекциях. Список таких заболеваний можно продолжить, при этом важно отметить, что ни в одном из испытаний не наблюдалось каких-либо побочных эффектов, вызванных бактериофагами.
В Англии фаговые препараты были успешно испытаны для лечения хронического отита, трудно излечимого заболевания вследствие образования так называемых бактериальных биофильмов – лекарственно-устойчивых микробных пленок. Во Франции –колыбели фаговой терапии – исследования в этой области сейчас почти не ведутся, хотя до последнего времени Институт Пастера делал фаговые коктейли на заказ.
В промышленных масштабах фаговые препараты сегодня производит российская компания Микроген. Подобные лекарства можно купить в аптеках в России, Белоруссии и на Украине. Фаговые препараты производства Микроген и Тбилисского центра для лечения ожоговых инфекций были успешно испытаны и в Бельгии.
Тем не менее до сих пор в большинстве стран применение бактериофагов в терапии официально не разрешено: это касается как FDA, американского Управления по контролю качества пищевых продуктов и лекарственных препаратов, так и аналогичных европейских агентств. На территории Евросоюза фаги для лечения больных используют только в вышеупомянутом польском Институте иммунологии и экспериментальной терапии.
Выбираем фаги
Почему же фаговая терапия до сих пор не нашла широкого применения? Ведь очевидно, что антибиотики должны быть препаратом выбора при остром, угрожающем жизни заболевании, когда нет времени для подбора специфичного агента. Зато при хронических инфекциях предпочтение следует отдать бактериофагам, как более дружественным агентам.
Среди причин, сдерживающих применения фагов в медицине, в первую очередь следует отметить скептическое отношение многих специалистов, особенно зарубежных. По сложившейся недоброй традиции западные исследователи, несмотря на свое отставание в этой области, до сих пор выражают недоверие к результатам исследований, в свое время успешно проводимых в СССР.
Но есть и более весомые причины, связанные с тем, что в бактериофагах не заинтересованы большие фармацевтические компании. Им нужны исключительные права на изобретения, но фаги – природные агенты, поэтому запатентовать их не так просто, а сама идея фаговой терапии опубликована давно. Кроме того, эти компании вложили огромные средства в производство антибиотиков, поэтому им не нужна конкуренция с дешевыми фаговыми препаратами.
Что касается самих врачей, то они стандартно обучены применять для достижения максимального эффекта антибиотики широкого спектра действия. При фаговой же терапии нужно иметь большой арсенал препаратов, каждый из которых нужно тестировать и подбирать индивидуально для каждого больного. Это в конечном счете приводит к значительному удорожанию такого персонализированного лечения. К тому же хотя люди продолжают умирать от заражения лекарственно устойчивыми бактериями, однако с экономической точки зрения, этот рынок не слишком велик, а лече-ние таких тяжелых больных чревато юридическими проблемами.
Вместе с тем та же FDA сегодня признает, что благодаря своей высокоспецифичности и нетоксичности фаги помогают там, где альтернативные методы оказываются неэффективными. Поэтому FDA планирует выработать практические рекомендации по использованию литических фагов в терапии. Для этого необходимо секвенировать их геномы, определить безопасные условия культивирования, провести современное стандартное тестирование токсичности на животных. В случае использования фаговых коктейлей каждый их компонент должен быть охарактеризован. И, наконец, для доказательства эффективности этих препаратов необходимы контролируемые клинические испытания.
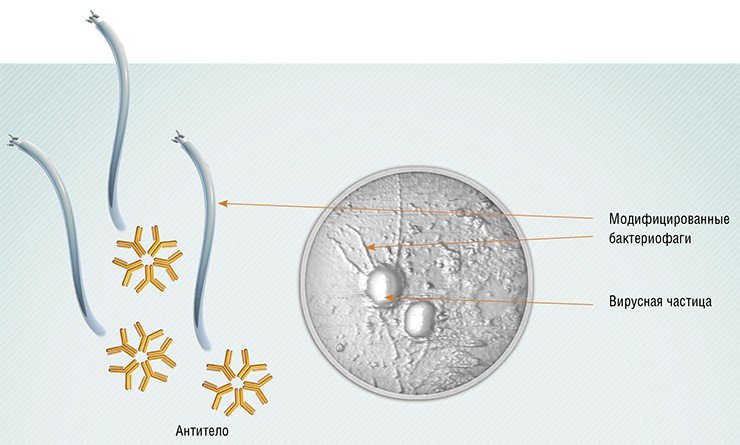
Кстати сказать, применение фагов в медицине может оказаться шире, чем это сегодня представляется. Так, современные технологии позволяют создавать фаги, производящие антибактериальные токсины, которые фаги будут доставлять непосредственно в бактериальную клетку. С помощью генетической инженерии сегодня можно заниматься настоящим дизайном фагов, например, получить фаги с измененной и расширенной специфичностью. Совершенно реалистичной задачей является и полный синтез фаговых геномов.
АНТИБИОТИКИ Достоинства:
широкий спектр действия;
простота патентования
Недостатки:
разрушают собственную микрофлору организма,
что создает угрозу вторичных инфекций;
не способны концентрироваться в области
инфекционного поражения;
вызывают побочные эффекты: аллергии, кишечные
расстройства и т. д.;
приводят к возникновению бактериальных штаммов с лекарственной устойчивостью;
создание новых антибиотиков – длительный
и дорогостоящий процесс БАКТЕРИОФАГИ Достоинства:
специфичность действия, для любой бактерии можно найти убивающий ее бактериофаг;
поиск нового фага занимает несколько дней или недель;
производство недорогое и экологически чистое;
не вызывают дисбактериоза;
не токсичны и не вызывают побочных эффектов;
после уничтожения патогенного агента элиминируются из организма
Недостатки:
слишком высокая избирательность – для гарантии
успеха лечения нужно идентифицировать патоген;
патентование затруднено из-за многообразия агентов
Уже испытываются в качестве противобактериальных средств отдельные компоненты фагов и вещества, используемые ими для поражения бактерий. Например, бактериоцины, фрагменты хвостовой структуры фагов, которые повреждают клеточную стенку бактерий, образуя в ней поры, что приводит к быстрой потере важных для клетки ионов и ее гибели.
Также разрабатываются подходы к применению фагов в качестве носителей лекарств – антител или химических терапевтических препаратов. На одну фаговую частицу можно присоединить до тысячи молекул антител и до нескольких тысяч молекул антибиотика. А благодаря присоединению к поверхности бактериофагов молекул полиэтиленгликоля удается получать фаги, способные долгое время циркулировать в кровотоке. Кроме того, фаги, несущие на поверхности определенные пептидные антигены, можно использовать в качестве вакцин.
Очевидно, что в XXI в. стимуляция дальнейшего развития фаготерапии должна стать делом государственным. Необходимо создать все условия для создания и поддержания коллекции фагов против устойчивых к антибиотикам патогенов. Что касается всевозможных разрешительных документов, то есть простое решение проблемы: рассматривать фаговые препараты наравне с вакцинами от гриппа. Ведь каждый год готовятся живые противогриппозные вакцины, представляющие собой коктейли нескольких вирусных штаммов, при этом их состав постоянно меняется. И разрешение распространяется на все эти вирусные коктейли, – а чем хуже фаги?
Выход в данной ситуации очевиден: нужно обязательно тестировать бактерии пациента на восприимчивость к фаговому препарату. Это можно делать лишь в хорошо оборудованных центрах, располагающих коллекциями фагов и лабораториями для микробиологического тестирования. Если сеть таких центров будет создаваться в рамках планируемого развития персонализированной медицины, то у нашей страны будут все шансы попасть в лидеры этого важнейшего биомедицинского направления.
Козлова Ю. Н., Репин В. Е., Анищенко и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки // Патент RU 2455355 C1. 2011.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acte Naturae. 2009. № 3б. С. 6—15.
Kropinski A., Lingohr E., Moyles D. et al. Endemic bacteriophages: a cautionary tale for evaluation of bacteriophage therapy and other interventions for infection control in animals // Virology J. 2012. V.9. P. 207—215.
Miedzybrodzki R., Borysowski J., Weber-Dabrowska B. et al. Clinical aspects of phage therapy //Advances in virus res. 2012. V. 83. P. 73—121.
Summers W. Bacteriophage therapy // Annu. Rev. Microbiol. 2001. V. 55. P. 437—451.
Читайте также:


