Вирус африканской чумы свиней вирусология
Классическая чума свиней (КЧС, чума свиней) — высококонтагиозная вирусная болезнь, характеризующаяся лихорадкой, поражением кровеносной и кроветворной систем, крупозным воспалением легких и крупозно-дифтеритическим воспалением толстого кишечника.
Первые описания болезни относятся к 1810 г. в Северной Америке, к 1822 г. во Франции, к 1833 г. в Германии. Позже ее регистрировали в Южной Америке и Южной Африке. В настоящее время она встречается повсеместно, за исключением США, Канады, Австралии, Исландии, Новой Зеландии, Норвегии, Швеции. Вирусную природу КЧС установили Швейниц и Дорсет в 1903 г.
Характеристика возбудителя. Вирус классической чумы свиней (ВКЧС) — PHK-содержащий; относится к семейству Flaviviridae, роду Pestivirus. Геном вируса — односпиральная РНК положительной полярности. Он кодирует четыре структурных белка (три гликопротеина — VP1, VP2, VP3 и один капсидный белок — СР) и 3—7 неструктурных белков. Вирионы вируса диаметром 40—60 нм, с суперкапсидной оболочкой. Диаметр нуклеокапсида вириона 29 нм.
Устойчивость к физико-химическим воздействиям. В сыворотке крови больных животных вирус сохраняет активность при температуре 38 °С до 18—20 сут. Кипячение инактивирует его моментально. На стенах свинарников, на полях вирус остается вирулентным в течение года, а в свиных тушах при температуре минус 20—25°С — до 6 мес. Лучшие дезинфицирующие средства для него — 2%-ный раствор NaOH, раствор хлорной извести 1 : 20 и 3—6%-ное крезоловое масло.
Антигенная вариабельность. По вирулентности различают А-, В-, С-варианты вируса. К варианту А относят вирулентные эпизоотические штаммы, вызывающие у свиней всех возрастов остропротекающую болезнь. Вирусы варианта В вирулентны только для поросят, и при циркуляции в стаде вызывают атипичную или хроническую чуму. К варианту С относится американский слабовирулентный штамм.
Антигенная вариабельность вируса не установлена. В то же время имеется антигенное различие среди штаммов ВКЧС. Установлено одностороннее родство между вирусами КЧС и диареи крупного рогатого скота: антитела к вирусу диареи нейтрализуют ВКЧС, но антитела к вирусу КЧС не нейтрализуют вирус диареи.
Антигенная активность. В сыворотке свиней-реконвалесцентов обнаруживают вируснейтрализующие и комплементсвязывающие антитела. Вируснейтрализующие антитела достигают максимума через 3—4 нед после инфицирования или иммунизации и сохраняются более года.
Культивирование вируса. В лаборатории его можно довольно легко проводить на неимунных свиньях. Однако это дорого и небезопасно. Лабораторные животные к ВКЧС невосприимчивы. В то же время возможна адаптация вируса к организму кролика.
ВКЧС удается репродуцировать в первичной культуре клеток легких, селезенки, почки, тестикул и лейкоцитов свиней, однако без выраженного ЦПД. В перевиваемой линии клеток почки поросенка (РК-15) размножение вируса сопровождается проявлением ЦПД. Для репродукции вируса оптимальной является температура 39 °С. В случае отсутствия ЦПД инфекционная активность вируса может быть определена с помощью РИФ методом флуоресцирующих бляшек, учета негативных колоний под агаровым покрытием, с помощью феномена экзальтации вируса ньюкаслской болезни. Для промышленного выращивания вируса может быть использована перевиваемая линия клеток почки эмбриона кролика (ПЭКр).
Гемагглютинирующие и гемадсорбирующие свойства. У ВКЧС они не установлены.
Клинические признаки. Инкубационный период в зависимости от вирулентности вируса и резистентности животного длится 3—9, иногда до 20 дней. Болезнь может протекать сверхостро, остро, подостро и хронически.
Сверхострое течение болезни наблюдают редко и у молодых животных. Оно характеризуется повышением температуры тела до 41—42°С, угнетением, отсутствием аппетита и рвотой, появлением ярко-красных пятен на коже. Гибель наступает через 1 —2 дня.
Острое течение помимо наблюдаемых при сверхостром течении неспецифических признаков болезни сопровождается запором, затем поносом, а также слизисто-гнойным ринитом. На коже живота, внутренней поверхности бедер, шеи и в основании ушных раковин появляются пустулы, заполненные желтоватым экссудатом. Позже на коже можно видеть точечные кровоизлияния, сливающиеся затем в темно-багровые пятна и не исчезающие при надавливании. Дыхание затрудненное, учащенное; в результате сердечной недостаточности пятачок, ушные раковины, кожа живота и конечностей приобретает синюшную окраску. Развивается лейкопения. Больные животные погибают на 7—10-й день.
При остром течении болезни нередко наблюдают нервную форму с судорожными сокращениями групп мышц, манежными движениями, параличами задних конечностей, нервным возбуждением и гибелью через 1—2 дня.
Подострое течение нередко бывает после острого переболевания. При этом болезнь длится до трех недель, иногда животные выздоравливают. Состояние свиней отягощается наслоением вторичных бактериальных инфекций: сальмонеллеза и пастереллеза. В случае осложнения чумы сальмонеллезом вторичные поражения наблюдают в желудочно-кишечном тракте (кишечная форма чумы). Запор сменяется поносом. Животные худеют и гибнут.
Осложнение чумы пастереллезом ведет к развитию легочной формы чумы, сопровождаемой кашлем, признаками бронхопневмонии и заканчивающейся, как правило, гибелью животного.
Хроническое течение болезни наблюдается в течение нескольких месяцев. Проявляется оно тяжелым крупозно-дифтероидным поражением желудочно-кишечного тракта, гнойно-фибринозным воспалением легких и плевритом. Поносы сменяются запорами, прогрессирует исхудание. Температура тела повышена. Осложнение вторичными инфекциями (сальмонеллезом и пастереллезом) ведет к обострению болезни и гибели животного. Возможны аборты, мертворождаемость. Плоды заражаются через плаценту, и у поросят развивается хронически протекающая болезнь с гибелью в возрасте 1—2 мес.
Причина хронического течения чумы — размножение вирулентных штаммов в недостаточно иммунном организме, при использовании инактивированных вакцин.
Латентное течение наблюдают при внутриутробном заражении. У поросят отмечаются угнетение, конъюнктивиты, дерматиты, двигательные нарушения. Гибель наступает через 2—11 мес. На вскрытии отмечают увеличение лимфоузлов и атрофию тимуса. КЧС передается алиментарно, аэрогенно, трансмиссивно (комарами). Мертворождаемость, отставание в росте свидетельствуют о внутриутробном заражении плодов и установлении у них персистентной виремии.
Воротами инфекции чаще являются миндалины и носоглотка. В их лимфоидно-ретикулярной ткани происходят первичная локализация и размножение вируса. Через 16—24 ч вирус проникает в регионарные лимфатические узлы.
Для вируса характерна пантропность, однако он преимущественно репродуцируется и накапливается в органах, богатых лимфоидно-ретикулярными клетками (селезенка, лимфатические узлы, костный мозг, пейеровы бляшки слизистой кишечника, эндотелий кровеносных сосудов). В местах размножения вируса происходят дистрофические и некротические изменения. Патологический процесс в стенках кровеносных сосудов микроциркуляторного русла значительно повышает их проницаемость и приводит к возникновению кровоизлияний, отеков, некродистрофических и воспалительных процессов в различных тканях и органах. Появление геморрагий связывают также с нарушениями в системе свертывания крови.
В результате поражения кроветворных органов развиваются анемия и лейкопения (2500—3000 лейкоцитов/мм 3 ), угнетение опсоно-фагоцитарной реакции и резкое снижение бактерицидности сыворотки крови. Разрушение клеток иммунной системы в результате размножения в них вируса и повышения литической активности макрофагов снижает уровень иммунитета.
Ослабленный организм не может противостоять секундарной бактериальной микрофлоре. Развивается вторичная инфекция, которая отягощает состояние организма.
Воспалительные процессы в мозговой ткани сопровождаются появлением в ней периваскулярных инфильтратов и как следствие — нервных явлений (депрессии, возбуждения, припадков). Смерть наступает в результате поражения клеток, нарушения функции всех систем организма, особенно органов кроветворения и кровообращения.
Виремия и выделения вируса с секретами и экскретами происходят в течение всего периода болезни. У хронически больных животных вирус выделяется до трех месяцев.
Патологоанатомические изменения. При КЧС они очень разнообразны и зависят от течения болезни и наличия осложнений секундарной инфекцией. Кожа ушей, шеи, живота, внутренней стороны бедер багрово-красная с точечно-пятнистыми кровоизлияниями. Лимфатические узлы, особенно головы, шеи, мраморные на разрезе; в различных органах выраженные явления геморрагического диатеза. Кровоизлияния встречаются в корковом слое почек, в слизистой оболочке лоханки, мочеточников и мочевого пузыря. По краям селезенки часто наблюдают инфаркты. На слизистой кишечника и легких — серозно-катаральные или крупозно-геморрагические воспаления.
При чуме, осложненной пастереллезом (грудная форма), основные изменения наблюдают в органах грудной полости: крупозно-геморрагическая пневмония, плеврит, перикардит, кровоизлияния на слизистой гортани, трахеи, в почках и кишечнике.
Гистологические изменения при КЧС неспецифичны. В селезенке, в зоне инфаркта, отмечают некроз ткани, а вне зоны — кровоизлияния, группы незрелых клеток лимфоидного ряда. В ЦНС обнаруживают признаки негнойного лимфоцитарного энцефаломиелита.
Локализация вируса. Вирус пантропен, накапливается во всех органах и тканях, но преимущественно в лимфоузлах, костном мозге, слизистой оболочке кишечника и эндотелии кровеносных сосудов. Наибольшая его концентрация отмечается в тонзиллярных лимфоузлах.
Вирус размножается в лейкоцитах периферической крови и накапливается в крови в максимальной концентрации уже на третий день после подъема температуры тела. Он выявлен также в эпителии миндалин, подчелюстных, заглоточных, мезентериальных и других лимфоузлах, в респираторных путях и кишечном тракте, слизистой мочевого и желчного пузыря, поджелудочной, щитовидной и слюнных железах. Наивысшие титры вируса обнаруживают в период с 3-го по 7-й день болезни.
Трансплацентарная передача ВКЧС приводит к рождению клинически здоровых, но инфицированных поросят, которые в течение 4—6 мес выделяют вирус в больших количествах.
Источник инфекции — больные свиньи и вирусоносители. К КЧС восприимчивы только свиньи независимо от возраста. Особую опасность представляют свиньи с хроническим, инаппарантным и атипичным течением болезни, а также вирусоносители в инкубационном периоде болезни и реконвалесценты. Вирусоносительство сохраняется до гибели животного. Рассеивание вируса происходит с экскретами и секретами.
Главный путь распространения чумы — реализация продуктов убоя свиней-вирусоносителей. Есть данные о передаче вируса комарами. Циркуляция в природе главным образом осуществляется трансплацентарной передачей, обеспечивающей врожденную персистенцию вируса у плодов и новорожденных поросят.
Большое значение для распространения болезни имеет существование резервуаров инфекции среди диких кабанов. Передача вируса от диких свиней домашним происходит в случаях пользования ими одних и тех же кормов (корнеплодов в буртах, соломы в скирдах). Заражению же диких кабанов способствует несоблюдение ветеринарно-санитарных правил в неблагополучных по КЧС хозяйствах (отсутствие скотомогильников, убойных площадок).
Природная очаговость КЧС определяется активным расселением кабанов. Распространению вируса способствует миграция отдельных кабанов на расстояние до 20 км в день, поэтому необходим регулярный эпизоотологический надзор за дикими кабанами.
Чума свиней не имеет сезонности и периодичности. При заносе вируса протекает она в виде эпизоотий. В свежих очагах при наличии неиммунного поголовья через 10—14 дней заболевают почти все. В случае заноса вируса с инфицированным кормом поголовное заболевание наблюдают через 2—3 дня. Заболеваемость составляет 95—100 %, летальность — 60—100 %.
Диагностика. Диагноз ставят на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований. Частая вакцинация свиней против чумы создает иммунный фон, который влияет на клинико-эпизоотологические характеристики болезни, поэтому только лабораторная диагностика позволяет установить правильный диагноз.
Патологическим материалом для лабораторной диагностики служат полученные от больных животных пробы крови, взятой с антикоагулянтом, и от вынужденно убитых животных или трупов — кусочки селезенки, миндалин, лимфатических узлов, почек, легких, поджелудочной железы, грудная кость.
Лабораторная диагностика. Обнаружение вирусной нуклеиновой кислоты. Методы ПЦР и ДНК-зонда позволяют дифференцировать пестивирусы (КЧС и вирусы диареи КРС).
ПЦР. Выделяют рибонуклеиновую кислоту из образцов тканей животных фенольным методом, подвергают обратной транскрипции и амплифицируют. Метод обладает высокой чувствительностью и специфичностью.
ДНК-зонд. В качестве гибридизационного зонда используют комплементарную ДНК к участку гена белка Р125, меченную 22 Р.
Обнаружение вирусного антигена (белка).
РИФ. Из лейкоцитарного концентрата проб крови больных или подозрительных по заболеванию животных, а также из костного мозга грудной кости делают мазки, а из их органов — срезы. На наличие вируса КЧС указывает специфическое свечение цитоплазмы. Следует иметь в виду, что вакцинный вирус сохраняется в организме свиней до 15 дней после вакцинации и в этот период не дифференцируется в РИФ от полевого вируса.
РНГА с антительным эритроцитарным диагностикумом. Вирус считается обнаруженным при наличии гемагглютинации в суспензии из патологического материала в разведениях не менее чем 1 : 8.
ИФА. В иммуноферментных конъюгатах используют иммуноглобулины баранов, инфицированных ВКЧС. Метод позволяет при постмортальной диагностике выявлять вирус со 100%-ной эффективностью без предварительного биологического накопления. Обнаруживают вирус также в культуре клеток и в объектах ветеринарного надзора (зерне, почве, воде). На основе моноклональных антител разработана тест-система, позволяющая дифференцировать вакцинный и полевые штаммы ВКЧС, а также вирус диареи КРС.
РДП слабочувствительна, дает положительный результат в 50 % случаев.
РИОЭФ (реакция иммуноэлектроосмофореза), в которой антигены и антитела движутся строго навстречу друг другу под действием электрического поля. РИЭОФ значительно чувствительнее, чем РДП, и скорее (за 30 мин) выявляет вирус в мезентериальных лимфоузлах и суспензии ткани поджелудочной железы.
Обнаружение вируса биопробой. Биопробу при диагностике КЧС ставят в сомнительных случаях. Она позволяет, с одной стороны, обнаружить ВКЧС, с другой — дифференцировать его от сходно протекающей африканской чумы свиней. Биопробу ставят по схеме иммунологической биопробы.
Из благополучного по инфекционным болезням хозяйства берут иммунизированных и неиммунизированных против КЧС поросят в возрасте 2—3 мес массой 20—30 кг. В качестве материала для заражения используют 10%-ную суспензию органов (селезенки, лимфоузлов, костного мозга) или кровь от павших животных. Материал вводят подкожно. Диагноз на КЧС считают установленным, если неиммунизированные животные на 2—5-й день заболевают и в течение 7—10 дней погибают, а иммунизированные остаются здоровыми. Если же в результате заражения заболевают и иммунизированные животные, то имеются основания для установления африканской чумы свиней, что должно быть подтверждено выделением вируса и его идентификацией.
Выделение вируса проводят на перевиваемой линии культуры клеток РК-15 (почки поросенка), выращенной на покровных стеклах в пробирках. Вирус КЧС в культуре клеток РК-15 не вызывает ЦПД; поэтому индикацию его проводят методом РИФ.
Идентификацию вируса проводят с помощью серологических реакций РИФ и РИГА.
Ретроспективная серологическая диагностика. В настоящее время в лабораторной диагностике используют три метода обнаружения специфических к вирусу КЧС антител:
твердофазный непрямой вариант ИФА. Метод легок в выполнении, дешев, высокочувствителен и рекомендован к использованию при крупномасштабных обследованиях;
непрямой метод РИФ;
PH в сочетании с РИФ. PH ставят в культуре клеток РК-15, выращенной на покровных стеклах в пробирках. Учет реакции проводят через 48 ч. Присутствие вируса обнаруживают в люминесцентном микроскопе — видны флуоресцирующие фокусы (бляшки), состоящие из 20—30 инфицированных клеток. Присутствие антител нейтрализует вирус и вызываемый им эффект. Поэтому реакцию часто называют РНФБ (PH флуоресцирующих микробляшек). Реакция очень трудоемка.
Дифференциальная диагностика. КЧС необходимо отличать от африканской чумы свиней, болезни Ауэски, вирусной диареи, парагриппа и бактериальных инфекций (пастереллеза, сальмонеллеза, рожи).
При африканской чуме свиней все клинические и патологоанатомические признаки выражены ярче. Для дифференциации ставят иммунологическую биопробу. Вирусную диарею у инфицированных свиней устанавливают с помощью ПЦР. Другие предполагаемые вирусные болезни свиней исключают вирусологическими исследованиями.
Бактериальные инфекции дифференцируют по эпизоотологическим особенностям (возрастная чувствительность), клиническим и патологоанатомическим признакам, результатам бактериологических исследований и эффективности лечения антибиотиками.
Иммунитет и специфическая профилактика. Животные-реконвалесценты приобретают стойкий иммунитет, продолжающийся несколько лет. Пассивный иммунитет непродолжителен — до 10— 12 дней.
Иммунитет при КЧС обусловлен вируснейтрализующими антителами. Однако формирование резистентности к заражению вакцинированных свиней происходит до выявления вируснейтрализующих антител. Вероятно, вирус нейтрализуется клетками, в частности естественными киллерами и цитотоксическими лимфоцитами.
С 1980 г. специфическая профилактика КЧС с успехом осуществляется живыми вакцинами из штаммов К и ЛК-ВНИИВВиМ. С помощью живой вакцины ЛК-ВНИИВВиМ можно создавать специфическую защиту от заболевания свиней уже через 48 ч после однократного внутримышечного ее введения. Новорожденных поросят вакцинируют перорально тотчас после рождения до приема молозива. Получена живая вакцина для пероральной иммунизации диких кабанов. Инактивированные вакцины в настоящее время не применяют. Разработаны генно-инженерные вакцины против КЧС, но и они пока не имеют широкого применения.
Лечение поросят осуществлялось гипериммунными сыворотками с различной эффективностью, что зависело от стадии болезни в момент серотерапии.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Полный текст:
1. Дьяконов Л.П. Животная клетка в культуре. - М., 2009. - 120 с.
3. Манин Б.Л. Криоконсервирование и культивирование клеточных линий - две фазы существования биологических объектов // Тр. Федерального центра охраны здоровья животных. - Владимир, 2008. - Т. 6, - С. 390-405.
5. Низкотемпературное консервирование костного мозга / Н.С. Пушкарь, А.М. Белоус, A.A. Цуцаева [и др.]. - Киев: Наук. Думка, 1976. - 288 с.
8. Способы культивирования вирусов. Культура клеток. - URL: medicalplanet.su/1372/html (дата обращения: 20.11.15).
9. Учитель И.Я. Макрофаги в иммунитете. - М.: Медицина, 1978. - 200 с.
10. Шишков В.П. Ветеринарный энциклопедический словарь. - М.: Советская энциклопедия, 1981. - С. 247-248.
11. Alcami A., Carrascosa A.L., Vinuela E. Interaction entry of African swine fever virus with macrophages // Virus Res. - 1990. - Vol. 17, № 2. - P. 93-104.
12. Alcami A., Carrascosa A.L., Vinuela E. Saturable binding sites mediate the entry of African swine fever vi-rusintoVero cells // Virology. - 1989. - Vol. 168, № 2. - P. 393-398.
13. Alcami A., Carrascosa A.L., Vinuela E. The entry of African swine fever virus into Vero cells // Virology. - 1989. - Vol. 171, № 1, -P. 68-75.
14. Apoptosis indused in an early step of African swine fever virus entry into Vero cells does not require virus replication / A.L. Carrascosa, MJ. Bustos, M.L. Nogal [et al.] // Virology. - 2002. - Vol. 294, № 2. - P. 372-382.
15. Cellular processes essential for African swine fever virus to infect and replicate in primary macrophages / S. Basta, H. Gerber, A. Schaub [et al.] // Veterinary Microbiology. - 2010. Vol. 140, № 1 -2. - P. 9-17.
16. Dyakonov L.P. Animal cell in culture. - М., 2009. -120 p.
17. Makarov V.V., Sukharev O.l., Litvinov O.B. Ornitho-doros ticks - African swine fever virus system: Bioecology, virology, epidemiology//Veterinarnaya Patologiya.- 2011. - № 3.-P. 18-19.
18. Manin B.L. Cryopreservation and culturing of cell lines: two phases of biological object existence//Proceedings of the Federal Centre for Animal Health. - Vladimir, 2008.-Vol. 6.-P. 390-405.
20. Low-temperature preservation of bone marrow/ N.S. Pushkar, A.M. Belous, A.A. Tsutsayeva [et al.]. - Kiev: Naukova Dumka, 1976 - 288 p.
23. Virus culture methods. Cell culture. - URL: medical-planet.su/1372/html (reference date: 20.11.15).
24. Uchitel I.Ya. Role of macrophages in immunity. - M.: Meditsina, 1978. - 200 p.
25. ShishkovV.P. Veterinary medicine encyclopedia. -M.: Sovetskaya Entsiklopedia, 1981. - P. 247-248.
26. Alcami A.,Carrascosa A.L.,Vinuela E. Interaction entry of African swine fever virus with macrophages//Virus Res. - 1990. - Vol. 17, № 2. - P. 93-104.
27. Alcami A., Carrascosa A.L.,Vinuela E. Saturable binding sites mediate the entry of African swine fever virus into Vero cells //Virology. - 1989. - Vol. 168, № 2. - P. 393-398.
28. Alcami A., Carrascosa A.L., Vinuela E.The entry of African swine fever virus into Vero cells //Virology. - 1989. -Vol. 171, № 1,-P. 68-75.
29. Apoptosis indused in an early step of African swine fever virus entry into Vero cells does not require virus replication / A.L. Carrascosa, MJ. Bustos, M.L. Nogal [et al.] // Virology. - 2002. - Vol. 294, № 2. - P. 372-382.
30. Cellular processes essential for African swine fever virus to infect and replicate in primary macrophages / S. Basta, H. Gerber, A. Schaub [et al.] //Veterinary Microbiology. - 2010. Vol. 140, № 1-2. - P. 9-17.
Жуков И.Ю., Шевченко И.В., Власова Н.Н., Варенцова А.А., Манин Б.Л., Пузанкова О.С., Гаврилова В.Л., Иголкин А.С. Изучение репродукции вируса африканской чумы свиней на первичной культуре клеток костного мозга свиней до и после криоконсервирования. Ветеринария сегодня. 2016;(1):7-15.
Zhukov I.Y., Shevchenko I.V., Vlasova N.N., Varentsova A.A., Manin B.L., Puzankova O.S., Gavrilova V.L., Igolkin A.S. Study of african swine fevervirus reproduction in porcine primary bone marrow cell culture before and after cryopreservation. Veterinary Science Today. 2016;(1):7-15. (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Африканская чума свиней – контагиозная болезнь, характеризующаяся лихорадкой, геморрагическим диатезом, воспалительными и некротическими изменениями паренхиматозных органов. Впервые зарегестрирована в 1903 году в Южной Африке.
Возбудитель — ДНК-содержащий вирус семейства Asfarviridae. Вирионы округлые, размером 175-215 нм, состоят из плотного нуклеотида, двухслойного икосаэдрического капсида и наружной оболочки. Двухслойный капсид из 1892-2172 капсомеров, тип укладки — кубический.
Устойчивость: исключительно устойчив в широком диапазоне температур и рН среды, включая высушивание, замораживание и гниение, поэтому может длительно сохраняться во внешней среде. Большинство дезсредств не инактивируют его. Наибольшее действие оказывают хлорактивные препараты при 4-часовой экспозиции.
Культивирование: используют подсвинков 3-4 месячного возраста, которых заражают любым способом. К вирусу чувствительны культуры лейкоцитов крови и макрофагов костного мозга свиней с развитием ГАД(гемадсорбция) и ЦПД.
Антигенные свойства: вирус содержит комплементсвязывающий, преципитирующий и гемадсорбирующий антигены, но не обладает иммуногенной активностью. Установлена иммунологическая множественность типов вируса, обусловленная циркуляцией возбудителя между дикими и домашними свиньями.
В сыворотке крови реконвалесцентов появляются преципитирующие, комплементсвязывающие и задерживающие гемадсорбцию антитела, из которых первые два — общие, а третьи используют для типизации вируса. Неспособность вырабатывать вируснейтрализующие антитела вызвана свойствами самого вируса.
Эпизоотологические данные. Восприимчивы дикие и домашние свиньи всех возрастов. Источник — больные животные. Факторы передачи — корм, пастбища, необезвреженные столовые отходы, загрязненные выделениями больных. Насекомые, хищные птицы и звери могут быть переносчиками. Резервуаром в природе служат африканские дикие свиньи и клещи рода орнитодорос.
Патогенез. Вирус проникает в лимфоидную ткань и кровь, репродуцируется, распространяется по всему организму, вызывая генерализованную инфекцию с явлениями токсикоза. В результате возникают тяжелые сосудистые расстройства в виде множественных кровоизлияний, тромбозов сосудов, инфарктов и некрозов тканей,что приводит к массовой гибели.
Клинические признаки. Инкубационный период — 2-7 суток.В зависимости от степени проявления признаков и быстроты развития процесса различают молниеносное, острое, подострое и хроническое течение и латентную форму болезни. При молниеносном течении животные гибнут без характерных признаков; при остром повышается температура до 42,5С, пропадает аппетит,повышается жажда, отмечается одышка, кашель, приступы рвоты, парезы, параличи задних конечностей. Наблюдаются серозные и слизисто-гнойные выделения из носа и глаз, иногда понос с кровью, чаще запор. Развивается цианоз кожи на ушах, пятачке, в подмышечной области. В крови отмечается лейкопения.
Патолого-анатомические изменения. Многочисленные кровоизлияния на коже, слизистых и серозных оболочках. Лимфатические узлы увеличены. В грудной и брюшной полости экссудат. Селезенка увеличена, с множественными кровоизлияниями, в легких отек.
Диагноз. Комплексный. Необходимо дифференцировать от классической чумы свиней, болезни Ауески, пастерелеза и рожи.
Лабораторная диагностика. Пат.материал: кровь, кусочки сердца, легких, печени, селезенки, почек и лимфоузлов.
- выдереление в культуре клеток лейкоцитов и костного мозга свиней, на подсвинках 2-4 месяцев
- идентификация в РИФ, РДП, РСК, радиоиммунологическим методом (метод количественного определения биологически активных веществ в биологических жидкостях, основанный на конкурентном связывании искомых стабильных и аналогичных им меченных радионуклидом веществ со специфическими связывающими системами, с последующей детекцией на специальных счетчиках — радиоспектрометрах), методом рестрикционного анализа (данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонуклеазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям)
ретроспективная диагностика — РНИФ (непрямая иммунофлюоресценция), РЗГАД (задержка гемадсорбции), РДП, иммуноэлектрофорез, РИД
Иммунитет и специфическая профилактика. Средства специфической профилактики не разработаны из-за отсутствия вируснейтрализующих антител. В организме переболевших животных могут присутствовать комплементсвязывающие, преципитирующие и типоспецифичные, задерживающие гемадсорбцию, антитела. В организме, таким образом, циркулируют вирус и различные типы антител.

Вирус Африканской Чумы свиней
(только для пользования студентами при подготовке к экзамену. )
Африканская чума свиней – очень опасная высококонтагиозная вирусная инфекция свиней, характеризующаяся лихорадкой, цианозом кожи и обширными геморрагиями во внутренних органах. Относится к списку A согласно Международной классификации заразных болезней животных.
Африканская чума свиней (АЧС, African swine fever - ASFV) вызывается ДНК-содержащим вирусом ASFV (сокр. A frican S wine F ever V irus) из семейства Asfarviridae. Данный вирус является единственным представителем этого вида.
Геном вируса ASFV содержит около 150 генов, причем их количество незначительно отличается в зависимости от изолята. Также как и для других геморрагических вирусов, клеткой-мишенью для вируса ASFV являются макрофаги, в цитоплазме которых вирус реплицируется в перинуклеарной зоне клетки. Сборка вируса осуществляется на модифицированной мембране эндоплазматической сети. Суперкапсид вируса образуется в момент почкования вируса через цитоплазматическую мембрану. В ходе репликации вирус синтезирует протеины, ингибирующие апоптоз макрофага, а также протеины, подавляющие активизацию генов клетки, участвующих в развитии иммунного ответа. Таким образом, вирус ASFV обладает значительным иммунодепрессивным действием, сходным с действием некоторых вирусов, в частности герпесвирусов. Кстати, подобное обстоятельство в последнее время породило много научных споров о возможном родстве вируса АЧС с отдельными герпесвирусами (см. Appendix I ) .
Иммунодепрессивные свойства возбудителя делают на современном этапе невозможным создание вакцин против данной болезни .
Вирус ASFV характеризуется чрезвычайно большой изменчивостью , как в плане патогенности, серологической изменчивости, так и в структуре генома (не менее 22 генотипических вариантов). По сути дела ASFV представляет собой очень разнообразный вид, что и послужило основанием для названия семейства Asfar ( A frican S wine F ever A nd R elated – вирус АЧС и связанные с ним вирусы ). При этом даже рассматривается возможность присутствия в популяции асфарвирусов таких его разновидностей, которые представляют определенную опасность для человека
Вирус ASFV при репродукции в культурах клеток способен вызывать развитие феномена гемадсорбции эритроцитов. Первоначально РЗГАд использовалась при идентификации вируса – она также позволяла определять серотип вируса. Сейчас для этого используется более чувствительная и специфичная реакция – ИФА.
Естественными хозяевами для вируса ASFV являются домашние свиньи , ди-
кие свиньи, обитающие в Африке (Phacochoerus africanus, Potamochoerus larvatus), а
также клещи рода Ornithodoros, являющиеся векторами переноса вируса. При этом в
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2011)

Вирус Африканской Чумы свиней
(только для пользования студентами при подготовке к экзамену. )
организме диких кабанов вирус способен вызывать развитие состояние вирусоносительства без клинического проявления.
Вирус ASFV является единственным ДНК-геномным вирусом, передающимся членистоногими . При этом установлено, что вирус при способности передачи от одной домашней свинью другой, не может распространяться от диких свиней к домашним, так как в этом случае передача осуществляется только через кровососущих членистоногих. В тех регионах, где дикие кабаны не обитают, вирус способен адаптироваться к домашним животным, обусловливая развитие бессимптомного вирусоносительства, что отмечено в отдельных африканских странах (Малави, Замбия, Мозамбик и Ангола).
После кровососания на инфицированном животном вирус попадает в организм клещей, где вирус проходит этап активной репликации. Кроме того, вирус способен сохранятся в популяции членистоногих, так как передается следующей генерации трансовариально. Также установлена передача вируса среди клещей половым путем. Таким образом, длительная сохранность вируса в популяции клещей играет наиважнейшую роль в сохранении вируса в природе и поддержании эндемичности региона. Домашние свиньи после инфицирования способны непосредственно распространять возбудитель другим домашним свиньям, при этом назально-оральный путь является самым принципиальным в передаче вируса. У таких животных развивается очень высокий уровень вирусемии, при этом вирус выделяется из организма инфицированной свиньи за 2 дня до развития клинических признаков. Вирусовыделение отмечается также после клинического выздоровления свиньиТак. же как и в случае с классической чумой свиней, вирус ASFV способен длительно сохранятся в необработанном контаминированном мясе (сохраняется до 140 дней в свиной ветчине и до 150 дней в мясе, сохраняемом при 4°C/ 39°F).
Вирус ASFV является эндемическим на африканском континенте, где постоянно циркулирует в дикой природе между многочисленной популяцией диких свиней и клещей. Африканская чума свиней впервые описана европейскими переселенцами среди привезенных ими домашних свиней (Кения, 1921). Изначально АЧС присутствовала только на африканском континенте до 1957 года, когда инфекция возникла в Лиссабоне (Португалия). В последующие несколько лет инфекция установилась на Иберийском полуострове, распространяясь далее в восточном направлении до Франции и Бельгии вплоть до 1980-х гг. Благодаря национальным программам болезнь была ликвидирована в Испании и Португалии в середине 1990-х гг. В середине 1970-х гг. инфекция попала в Западное полушарие, когда первые ее вспышки отмечались на Кубе и Доминиканской республике.
Инфекция регулярно регистрируется на африканском континенте Всемирной организацией здоровья животных (World Organization for Animal Health, первоначальное название Международное эпизоотическое бюро – МЭБ, l'Office International des Épizooties - OIE). Одной из последних крупных вспышек АЧС за пределами Аф-
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2011)

Вирус Африканской Чумы свиней
(только для пользования студентами при подготовке к экзамену. )
рики была эпизоотия в Грузии (2007), распространившаяся в Армению, Азербайджан, Иран и Россию (см. Appendix II ) .
Вирус ASFV так же как и вирус КЧС рассматривается WOAH как потенциальный агент для создания бактериологического оружия . При этом во многих благополучных по инфекции регионах мира хранение и изучение этого вируса запрещено (в частности в США, где разрешается работа с вирусом только в единственной лаборатории на острове Плам - Plum Island Animal Disease Center).
АЧС проявляется в трех формах – острой, подострой и хронической. Острая форма развивается при попадании высоковирулентных штаммов. При этом болезнь характеризуется высокой лихорадкой, быстрой смертностью, истечением кровянистой жидкости из глаз и носа, покраснением участков кожи особенно в области ушей, пяточка, живота, конечностей.
Подострое течение болезни вызывается средневирулентным вирус и характеризуется аналогичными клиническими признаками, но с более длительным течением. Хроническое течение вызывается попаданием низковирулентых вирусов и характеризуется потерей веса, истощением, периодическими лихорадками, появлением язв и некрозов кожи, развитием респираторных нарушений и перикардита.
При подозрении на АЧС немедленно информируется ветеринарная служба страны. В качестве патматериала отбирают пробы стабилизированной крови (ЭДТА), а также пробы внутренних паренхиматозных органов.
Диагностика африканской чумы может проводиться по двум направлениям:
1. Выделение и идентификация вирусного антигена в патматериале. Данный способ диагностики должен быть обязательно использован при постановке диагноза в благополучных по АЧС регионах. При этом проводят одновременное заражение культуры клеток лейкоцитов свиней или клеток костного мозга и первичную идентификацию вируса в мазках из присланного материала. Инфицированную культуру клеток исследуют на наличие феномена гемадсорбции и ЦПД; идентификацию вирусного антигена проводят в РИФ и (при возможности) в ПЦР.
2. Выявление специфических антител в сыворотке крови или экстрактов тканей больных животных. Этот способ диагностики используется преимущественно в неблагополучных регионах или при возникновении вспышек, вызванных слабовирулентным вирусом, трудно выявляемым при идентификации вирусного антигена. Основной серологической реакцией является ИФА.
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2011)

Вирус Африканской Чумы свиней
(только для пользования студентами при подготовке к экзамену. )
ВИРУС ASFV В ВОЗМОЖНОМ РОДСТВЕ С ГЕРПЕСВИРУСАМИ ЧЕЛОВЕКА, ЛИБО ЕГО ПАТОГЕННОСТЬ ДЛЯ ЧЕЛОВЕКА?
Вирус ASFV не обладает патогенностью в отношении человека, однако серологическими исследованиями в некоторых случаях установлено присутствие антител к этому вирусу у человека. Иммунодепрессивное действие вируса ASFV во многом сходное с таким же действием герпесвируса человека 6А типа (Human Herpesvirus 6а, HHV-6а). С другой стороны, исследованиями проводимыми еще в начале 1980-х гг вирус ASFV часто изолировали от пациентов с синдромом приобретенного иммунодефицита (СПИД), вызванного действием еще одного вируса – ВИЧ (HIV, human immunodeficiency virus) Таким образом постулируется либо взаимодействие трех вирусов и их потенциальная роль в развитии иммунодефицитов, либо родство и даже идентичность вируса АЧС и герпесвируса человека-6а. При этом считается, что вирус ASFV произошел от предка, единого для цитоплазмореплицирующихся ДНК-геномных поксвирусов, иридовирусов и фикоднавирСдругойсов. стороны, сам вирус ASFV представляет собой чрезвычайно гетерогенную популяцию вируса, при этом в последнее время от человека (сыворотка крови, Ближний Восток; сточные воды, Испания, 2009) изолируются вирусные последовательности со значительным генетическим родством с вирусом ASFV. Поэтому вопрос о потенциальной роли вируса в патологии или тем более инфицировании человека в последнее время приобрел особый научный интерес, так же как и обсуждается гипотетическая возможность наличия еще одного вируса в данном семействе.
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2011)

Вирус Африканской Чумы свиней
(только для пользования студентами при подготовке к экзамену. )
АФРИКАНСКАЯ ЧУМА СВИНЕЙ В РОССИИ
Неблагополучие отдельных регионов европейской России началось с конца 2007 года (Шатойский район, Чечня) после появления этой болезни на территории Грузии. При этом Глава Роспотребнадзора Геннадий Онищенко неоднократно обвинял грузинскую сторону в распространении вируса АЧС с секретной лаборатории, в которой якобы работают американские вирусологи.
Большинство вспышек АЧС на территории РФ отмечается в южных регионах страны. Одной из наиболее тяжелых явилась эпизоотия в Ростовской области в 2010 году, когда было зарегистрировано 25 очагов болезни в пяти районах и в Гукове (на границе с Украиной).
Примечательной является вспышка болезни в Ленинградской области в январе 2011 года, когда были обнаружены мертвые свиньи на территории одной из птицеводческих ферм. Ранее в Ленинградской области вспышка АЧС была зарегистрирована в сентябре 2009. Оба случая были связаны с заносом возбудителя из южных регионов России. Таким образом, за пределами южных областей России вспышки АЧС зарегистрированы в Ленинградской, Нижегородской, Мурманской и Тверской областях. Есть опасность появления вируса и в Москве, что обусловлено плотными транспортными потоками.
Один из последних случаев АЧС был выявлен в ноябре 2011 г в Оренбургской области, где очагом инфекции стала свиноферма индивидуального предпринимателя, в которой начался падёж свиней. Инфекция распространилась из воинской части, где 24 ноября была обнаружена инфицированная мясная продукция. 7 ноября 2011 года в столовую воинской части завезли свиной солёный шпик, изготовленный в Ставропольском крае - на неблагополучной по африканской чуме свиней территории. Это сало использовалось для питания военнослужащих, а пищевые отходы из столовой воинской части - для корма свиней, содержащихся на ферме, расположенной на территории полигона воинской части.
6 декабря 2011 года был отобран патматериал от павших свиней и образцы солёного сала, отобранного в столовой воинской части. Исследование проб в испытательной лаборатории "Оренбургский референтный центр Россельхознадзора" показало наличие патматериале и в образцах сала возбудителя африканская чума свиней. В настоящее время очаг африканской чумы в Тоцком районе полностью локализован.
Эта вспышка АЧС возможно стала причиной появления другого очага АЧС на территории Саратовской области в подсобной хозяйстве одной из исправительных колоний. Причиной заноса вируса стала посылка для одной из заключенных из Оренбургской области, содержащая контаминированное вирусом сало.
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2011)

Вирус Африканской Чумы свиней
(только для пользования студентами при подготовке к экзамену. )
Рис 1. Дикие кабаны Phacochoerus africanus – естественный хозяин вируса
ASFV (Танзанийский национальный паркТarangire National Park, Tanzania)
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2011)

Вирус Африканской Чумы свиней
(только для пользования студентами при подготовке к экзамену. )
Рис. 2. Дикий кабан (P. larvatus koiropotamus) – естественный хозяин вируса
ASFV (зоопарк города San Diego )
Рис. 3. Клещи Ornithodoros moubata, являющиеся переносчиками вируса
Рис. 4. Вирус африканской чумы
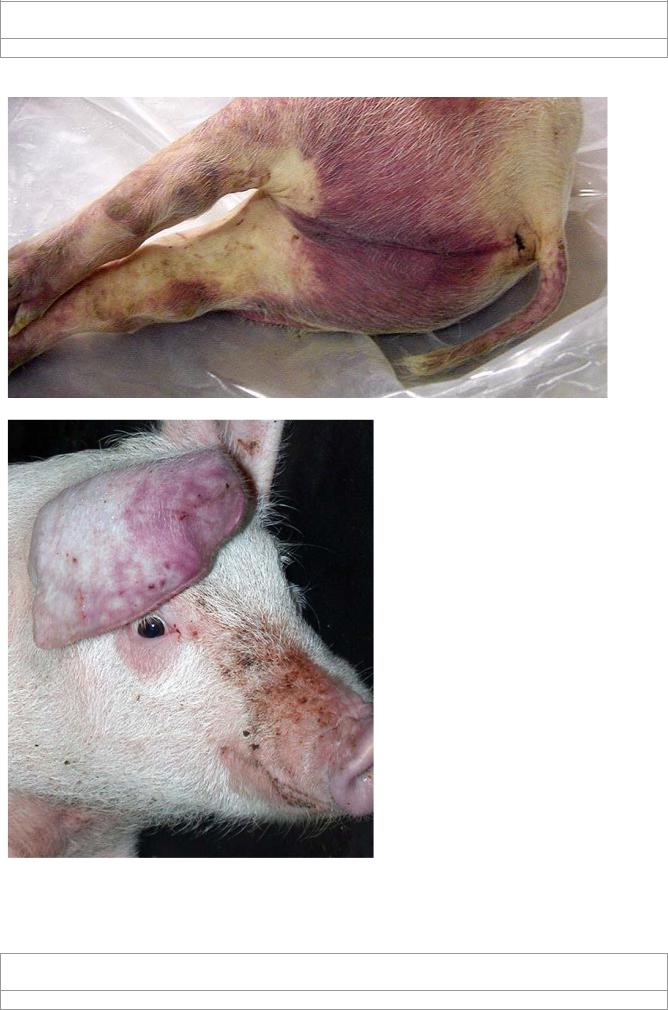
Рис. 5. Геморрагии на поверхности кожи ушей –
свиней ASFV при электронной
один из характерных клинических признаков
микроскопии. Обратите внима-
при африканской чуме свиней. Характер гемор-
ние на характерную шестиуголь-
рагичских поражений в целом аналогичен тако-
ную форму вириона, что я вляет-
вым при классической чуме свиней (рис 6-7 –
ся свойственным для асфарвиру-
сов и иридовирусов
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2011)
Вирус Африканской Чумы свиней
(только для пользования студентами при подготовке к экзамену. )
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2011)
Читайте также:


