Вакцина инактивированная комбинированная против вирусных болезней крс
Шемелькова Г.О., Верховская А.Е., Соболева Г.Л.
ООО "Ветбиохим", г. Москва
Шемельков Е.В., Иванов Е.В., Непоклонова И.В.
АНО "Научно-исследовательский институт диагностики и
профилактики болезней человека и животных", г. Москва
Алипер Т.И. "НПО НАРВАК",
"ФГБУ НИИ вирусологии им. Д.И. Ивановского" МЗ РФ, г. Москва
Аденовирус крупного рогатого скота широко распространен среди поголовья и часто, в сочетании с другими вирусными агентами (вирусы инфекционного ринотрахеита, парагрип-па-3, вирусной диареи, респираторно-синцитиальным, рота- и коро-навирусами), является первопричиной возникновения и развития основных респираторных и кишечных инфекционных заболеваний телят, которые, в дальнейшем, осложняются вторичными инфекциями бактериальной этиологии [2, 5, 7, 10].
Установлено, что аденовирусы являются иммунодепрес-сантами и способствуют развитию других инфекционных патологий. Из-за сходства с другими инфекционными заболеваниями вирусной этиологии клинико-эпизоотологическая диагностика аденовирусной инфекции крупного рогатого скота затруднена [4].
Ввиду частой полиэтиологичности первичных вирусных инфекций и невозможности разграничения ведущей роли того или иного агента в развитии патологии, наиболее эффективным методом специфической профилактики таких заболеваний является применение комбинированных вакцин, содержащих антигены сразу всех или нескольких из указанных возбудителей [3, 7]. Вакцинации подвергают стельных коров для создания у новорожденного потомства пассивного колострального иммунитета, а также телят с 2-3-х недельного возраста для создания активного поствакцинального иммунитета [9].
В настоящее время имеется ряд поливалентных вакцин против двух, трех и более указанных респираторных и/или кишечных вирусных заболеваний телят, но отсутствуют зарегистрированные биопрепараты, предназначенные для специфической профилактики аденовирусной инфекции крупного рогатого скота. Однако, наряду с другими вирусными агентами, аденовирусы играют значительную роль в этиологии указанных заболеваний [1, 2, 8, 11].
В ранее проведенных исследованиях нам удалось выделить и идентифицировать методом секвенирования фрагмента генома аденовирус крупного рогатого скота I-го типа. Выделенный штамм аденовируса был адаптирован к перевиваемой культуре клеток и депонирован в государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского МЗ РФ. В ходе проведенных исследований установили, что выделенный аденовирус обладает выраженными антигенными свойствами и пригоден для использования в составе инактивированных вакцин [6].
Целью настоящей работы была разработка комбинированной вакцины против аденовирусной инфекции, инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальной, рота- и коронавирусной болезнях крупного рогатого скота, а также оценка эффективности ее применения в производственных условиях.
Материалы и методы. Для проведения серомониторинга использовали пробы сыворотки крови крупного рогатого скота, полученные из разных субъектов РФ, которые исследовали на наличие ви-руснейтрализующих антител к аденовирусу, вирусам инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальному, рота- и коронавирусам крупного рогатого скота. Наличие специфических антител к возбудителям инфекционного ринотрахеита и респираторно-синцитиальной инфекции, так же определяли методом ИФА, с использованием соответствующих диагностических ИФА-наборов: "ИРТ-СЕРОТЕСТ" и "РСИ-СЕРОТЕСТ", производства ООО "Ветбиохим".
В качестве прототипа использовали инактивированную комбинированную вакцину "КОМБОВАК", производства ООО "Ветбиохим".
Экспериментальные образцы вакцины готовили из одной партии инактивированного аденовируса крупного рогатого скота I-го типа, штамм "Альфа" (выделен от 17-и суточного теленка) [6], а также инактивированных антигенов производственных штаммов вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи, рес-пираторно-синцитиального, рота- и коронавирусов крупного рогатого скота.
При выборе адъюванта для вакцины провели исследования шести различных коммерческих и экспериментальных препаратов: ISA 50, ISA 71, ISA 206, ISA 773 (SEPPIC, Франция), адъювантный комплекс Акрум-С (комплекс высокомолекулярного синтетического полиэлектролита со смесью поверхностно-активных гликозидов), гель гидроокиси алюминия (ГОА). Соотношения антигенной части и адъюванта брали в пропорциях, рекомендованных производителем адъюванта или подбирали опытным путем.
В качестве лабораторной модели, для оценки безвредности использовали группы морских свинок и белых мышей (n = 5 и n = 10, соответственно, на каждый образец). Морским свинкам вакцину вводили внутримышечно в дозе 2,0 мл, белым мышам - подкожно в дозе 0,5 мл. За животными вели наблюдение в течение 15 суток.
Антигенную активность образцов на лабораторной модели, оценивали путем проведения однократной внутримышечной вакцинации группы морских свинок (n = 10, на каждый образец), сформированной по принципу аналогов в дозе 1,0 мл, с последующим исследованием сыворотки крови, полученной до и через 21 сутки после вакцинации, на наличие специфических антител в реакции нейтрализации (РН).
Безвредность и антигенную активность изготовленных образцов в опыте на естественно восприимчивых животных оценивали путем проведения двукратной внутримышечной иммунизации коров за 1-2 месяца до осеменения (n=30 на каждый образец вакцины), сформированных в соответствующие группы по принципу аналогов, в дозе 3,0 мл. Кровь брали выборочно по 10 голов из каждой группы перед вакцинацией (Д0) и через 21 сутки после первой (Д21) и второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН.
Для определения оптимальной иммунизирующей дозы вакцины использовали три группы коров за 1-2 месяца до осеменения (n = 15 в каждой группе), которых иммунизировали внутримышечно двукратно с интервалом 21 сутки в дозах 2,0 мл (первую группу), 3,0 мл (вторую группу) и 4,0 мл (третью группу). А также две группы телят в возрасте 2,5-3 месяца (n = 15 в каждой группе), которых иммунизировали двукратно внутримышечно в дозах 1,0 мл (первую группу) и 2,0 мл (вторую группу). Кровь у животных брали перед вакцинацией (Д0) и через 21 сутки после второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН. В качестве контроля использовали группы невакцинированных животных (по 10 голов коров и телят).
Постановку и учет результатов РН осуществляли по стандартным методикам с использованием соответствующих контрольных штаммов вирусов.
Оценку эффективности применения вакцины в производственных условиях проводили в животноводческом хозяйстве, неблагополучном по респираторным и кишечным инфекционным заболеваниям телят. В хозяйстве вакцинировали стельных коров - дважды: первый раз - за 50-60 суток до отела, второй - через 14-21 сутки в дозе 3,0 мл. Полученных телят первый раз вакцинировали в возрасте 25-30 суток, повторно через 20-25 суток в дозе 2,0 мл. В качестве контроля использовали группы невакцинированных стельных коров и телят, которые содержались в другом помещении. Эффективность применения вакцины определяли по эпизоотологическим показателям: заболеваемость телят респираторными и кишечными инфекциями, смертность телят, а также их вынужденная выбраковка в опытной и контрольной группах.
Статистическую обработку данных выполняли общепринятыми методами (компьютерные программы Microsoft Excel 2010, Stat Plus 2005).
Результаты исследований. На первом этапе работы (20102012 г.) мы провели исследование 869 проб сыворотки крови коров и телят, полученных от невакцинированных животных, из 12 неблагополучных по основным респираторным и кишечным инфекционным заболеваниям хозяйств Вологодской, Воронежской, Калужской, Московской, Тамбовской областей, Алтайского и Краснодарского краев, Республики Башкирия. В ходе проведенного серомониторинга было выявлено наличие специфических антител к возбудителям: аденовирусной инфекции (АВ) в 24% исследуемых проб, инфекционного ринотрахеита (ИРТ) - в 47%, парагриппа-3 (ПГ-3) - в 85%, вирусной диареи (ВД) - в 86%, респираторно-синцитиальной болезни (РС) - в 62%, ротавирусной болезни (РВ) - в 89%, коронавирусной болезни (КВ) - в 87% исследуемых проб (рисунок 1).
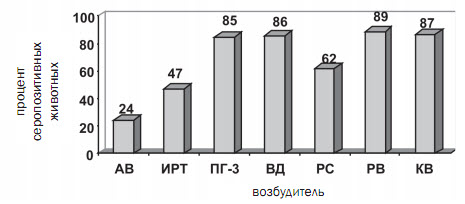
Рис. 1. Количество положительных проб сыворотки крови крупного рогатого скота
к соответствующему вирусу (в процентах от общего числа исследованных)
Результаты проведенных исследований свидетельствуют о широком распространении аденовирусной инфекции крупного рогатого скота в животноводческих хозяйствах, при этом, в подавляющем большинстве случаев, она встречается в сочетании с другими вирусными заболеваниями. Таким образом, аденовирус крупного рогатого скота играет существенную роль в этиологии основных вирусных заболеваний телят. Полученные результаты согласуются с данными других ученых, показывающими широкое распространение вирусных инфекций, в том числе и аденовирусной, среди поголовья крупного рогатого скота [1, 2, 5].
Кроме того, при проведении серологических исследований, установлена корреляция результатов по выявлению антител к вирусам ИРТ и РС, полученных в РН и ИФА.
На основании проведенных исследований, с учетом имеющихся литературных данных, мы пришли к заключению о целесообразности создания комбинированной вакцины против основных респираторных и кишечных вирусных заболеваний телят, включающей в себя аденовирус крупного рогатого скота.
Поскольку, по сравнению с прототипной вакциной "КОМБОВАК", в новой вакцине увеличивается количество вирусных антигенов и, следовательно, снижается объемная доля каждого отдельного антигена, то для нее требуется более иммунологически эффективный адъювант, способный обеспечить выраженный иммунный ответ на каждый антиген.
В ходе данной работы исследовали шесть адъювантов, с которыми изготовили экспериментальные образцы вакцины. Оценку изготовленных образцов проводили по показателям безвредности и антигенной активности в опытах на лабораторных и естественно восприимчивых животных.
Изучение безвредности показало, что экспериментальные образцы вакцины не вызывали заболевания или гибели подопытных животных, при этом у отдельных особей наблюдали образование плотных ограниченных припухлостей на месте введения образцов с масляными адъювантами.
В опытах на лабораторных и естественно восприимчивых животных установлено, что введение экспериментальных образцов вакцины вызывало развитие выраженного иммунного ответа (Р Таблица 1. Сравнительная оценка антигенной активности вакцины с разными адъювантами в опыте на лабораторных животных
МЕТОДЫ ВАКЦИНОПРОФИЛАКТИКИ ПРИ ОРВИ КРУПНОГО РОГАТОГО СКОТА
И.М.Донник, Е.Н.Шилова, М.А.Исаев, В.А.Михляев, Е.В.Печура Уральский научно-исследовательский ветеринарный институт
Введение. Острые респираторные вирусные инфекции крупного рогатого скота до сих пор являются одной из наиболее актуальных проблем в ветеринарии. Сложные ассоциации вирус-хламидия-бактерия, широкий нозоареал, разнообразие спектр поражений, латенция возбудителей, иммуносупрессия микроорганизма - все эти факторы делают ОРВИ крупного рогатого скота одним из важных сдерживающих факторов развития животноводства и ключевым ограничением в торговле [1].
Вакцинопрофилактика ОРВИ крупного рогатого скота является обычной превентивной мерой и занимает важное место в методологической схеме оздоровления хозяйств. В основу формирования научно-обоснованной схемы специфической профилактики положен принцип создания у восприимчивых животных постоянной напряженной иммунной защиты против циркулирующих в популяции возбудителей ОРЗ КРС, и на базе этой защиты со временем вытеснение эпизоотических штаммов вирусов ОРВИ КРС в неблагополучных хозяйствах.
В условиях животноводческих хозяйств Свердловской области для профилактики ОРВИ крупного рогатого скота применяется инактивированная комбинированная вакцина Комбовак против ИРТ, ВД-БС, ПГ-3, респираторно-синци-тиальной инфекции, рота-коронавирусной болезни телят (производство НПО "Нарвак", г. Москва), а в хозяйствах, неблагополучных по пастереллезу - Комбовак П. Согласно аннотации, данные вакцины применяются подкожно либо внутримышечно.
В настоящее время много споров вызывает интрадермальный метод введения вакцин. Разработка метода внут-рикожной вакцинации была связана, прежде всего, с возможным повышением эффективности вакцинации вследствие применение другого метода доставки низкомолекулярных веществ в организм, а также возможным снижением затрат на проведение специфической профилактики ОРВИ в хозяйствах, т.к. дозы для внутрикожного введения в несколько раз меньше, чем для подкожного и внутримышечного. Исследования, проведенные Петровой О.Г.с соавт. (2007,2008) [2,3] свидетельствуют о высокой эффективности данного способа введения вакцины у быков-производителей, телят и коров. На основании данных исследований была предложена усовершенствованная схема оздоровления хозяйств при ОРВИ КРС.
Поэтому целью нашего исследования была оценка эффективности данного способа вакцинации в хозяйствах Свердловской области современными методами диагностики.
Материалы и методы:
Нами было проведено эпизоотологическое обследование 6-ти сельскохозяйственных предприятий, где применялась разработанная ранее схема профилактики ОРВИ КРС, в том числе, с применением внутрикожного метода вакцинации.
Нами также на базе лаборатории инфекционных болезней крупного рогатого скота ГНУ Уральский НИВИ РАСХН проведена оценка напряженности поствакцинального иммунитета к инфекционному ринотрахеиту крупного рогатого скота (ИРТ КРС) и парагриппу-3 (ПГ-3) у телят при применении разных способов введения вакцины "Комбовак" и "Комбовак-Р" в 13-ти сельскохозяйственных предприятиях Свердловской области.
Эффективность вакцинации оценивали по титру сывороточных антител к вирусам инфекционного ринотрахеита КРС и парагриппа-3. Антитела к ИРТ определяли исследованием сыворотки крови методом иммуноферментного анализа (ИФА), с использованием "Набора для выявления антител к вирусу инфекционного ринотрахеита крупного рогатого скота иммуноферментным методом ИРТ-СЕРОТЕСТ" (производство АНО "НИИ ДПБ"),. Антитела к парагриппу-3 определяли в реакции торможения гемагглютинации (РТГА) с использованием диагностического набора производства ФГУП "Курская биофабрика".
Постановку реакции, учет и интерпретацию полученных данных проводили согласно инструкции каждого из наборов, рекомендованных фирмой-производителем, утвержденной в установленном порядке.
Протективным титром антител к инфекционному ринотрахеиту в ИФА считали 1/400 и выше, к парагриппу-3 в РТГА - 1/16 и выше.
Проведено исследование 153 проб сыворотки крови от телят.
Установлено, что у крупного рогатого скота, содержащихся в данных хозяйствах, отмечены клинические признаки, характерные для разных форм ОРВИ КРС (табл. 1).
Табл. 1. Выявление клинического проявления ОРВИ в сельскохозяйственных предприятиях
Внутрикожный метод вакцинации в полном объеме реализуется в СПК "Мезенское" (в качестве иммуномодулятора применяется видор), где 100% обследованных коров имеют пустулезную сыпь в половых путях, заболеваемость телят в возрасте 1-1,5 мес. ОРВИ составляет 98-100%.
Установлено, что наличие поствакцинальных антител к инфекционному ринотрахеиту при подкожном способе введения вакцины без применения иммуномодулятора отмечали у 45% телят, при внутрикожном введении - у 20%. При этом средний титр антител у телят при подкожном методе введения вакцины был в 2,62 выше, чем при внутрикожном введении, при этом являясь протективным.
Таб. 2. Эффективность вакцинации против ОРВИ при разных способах введения вакцины без применения иммуномодулятора
У телят при внутрикожном способе введения вакцины уровень антител к возбудителю инфекционного ринотрахеита был недостаточным (1/160).
Титр поствакцинальных антител к парагриппу, а также количество животных с протективными титрами популяции были на одном уровне и при внутрикожном, и при подкожном введении вакцины "Комбовак".
При применении иммуномодуляторов (миксоферон, ви-дор, риботан, иммунофан) средний титр антител к возбудителю ИРТ КРС при подкожном методе ведения у телят в 1,7 раз выше, чем при внутрикожном введении вакцины (табл.3), число животных с протективным иммунитетом выше при подкожном методе введения вакцины. Средний титр к возбудителю ПГ-3 при подкожном введении вакцины также выше в 2 раза.
Таб. 3. Эффективность вакцинации против ОРВИ при разных способах введения вакцины с применением разных иммуномодуляторов
В целом, можно отметить, что у телят, содержащихся в хозяйствах Свердловской области уровень поствакцинального иммунитета при применении инактивированной вакцины "Комбовак" довольно низкий и недостаточный для защиты популяции от вирусных инфекций в связи с неполным ее охватом. Вероятно, именно этим объясняется значительное распространение данных инфекций, сопровождающееся клиническим проявлением.
Таким образом, исследования показали, что применение инактивированной вакцины "Комбовак" внутрикожно в меньших дозировках является малоэффективным и недостаточным для образования протективного иммунитета к возбудителю инфекционного ринотрахеита крупного рогатого скота. Поэтому необходимо следовать инструкции, предложенной производителем, согласно которой вакцину необходимо вводить подкожно либо внутримышечно.
Кроме этого, можно отметить, что иммунизация телят против ОРВИ вакциной "Комбовак" в хозяйствах Свердловской области даже с применением иммунотропных препаратов (риботан, миксоферон, иммунофан, видор) не формирует иммунитет у всего восприимчивого поголовья.
Список литературы
- Глотов А.Г. Инфекционный ринотрахеит крупного рогатого скота/ А.Г.Глотов, А.Ф. Шуляк, Т.И.Глотова, А.Н.Сергеев// РАСХН, Сиб. отделение, ГНУ ИЭВСиДВ. - Новосибирск, 2006.- 196 с.
- Петрова О.Г. Острые респираторные заболевания крупного рогатого скота и система оздоровительных мероприятий/ О.Г.Петрова, А.Т.Татарчук, И.А.Рубинский, Е.В.Печура и др.// Современное состояние и перспективы исследований по инфекционной и протозойной патологии животных, рыб и пчел.- Материалы Междунар. научно-практ. конф. - ГНУ ВИЭВ, 2008. - с. 236.
- Петрова О.Г. Острые респираторные заболевания крупного рогатого скота/ О.Г.Петрова, А.Т.Татарчук и др.// Монография. - Екатеринбург: Уральское изд-во, 2007 г. - 278 с.
Summary: Methods of vaccinal prevention of respiratory virus infections of cows
I.Donnik, E.Shilova, M.Isaev, V.Mihlyaev, E.Pechura
The Urals State Scientific-Research Institute of the Veterinary Medicine
Application of vaccine "KOMBОVАК" intraskin in smaller dosages is insufficient for formation of immunity to bovine herpesvirus. Therefore the vaccine is necessary for entering hypodermically or intramuscularly.
Key words: bovine herpesvirus, immunity, vaccination, intraskin introduction
Сведения об авторах
Донник Ирина Михайловна, директор ГНУ Уральского научно-исследовательского ветеринарного института (УрНИ-ВИ), член-корреспондент РАСХН, доктор биологических наук, профессор
Адрес: 620142, г.Екатеринбург, ул.Белинского, 112а, Тел. (343)257-20-44, факс (343)257-82-63
Ответственная за переписку с редакцией: Шилова Евгения Николаевна, Зав. отделом инфекционной патологии ГНУ УрНИВИ, Кандидат ветеринарных наук, доцент Адрес: 620142, г.Екатеринбург, ул.Белинского, 112а, Тел. (343)257-20-44, факс (343)257-82-63
Подготовлено коллективом авторов под редакцией П.А.Красочко.

Пособие позволит ветеринарным специалистам животноводческих хозяйств, ветеринарных станций и другим категориям ветеринарных специалистов проводить выбор вакцин с учетом сложившейся эпизоотологической ситуации и соответствующей этиологической структуры возбудителей инфекционных болезней животных.
- В пособии представлена единая общепринятая схема описания болезней, которая позволяет в краткой форме дать цельное представление о конкретной болезни.
- Дан перечень вакцин, используемых в Республике Беларусь.
- Для профилактики вирусных инфекций крупного рогатого скота названы 29 вакцин,
- 10 вакцин для профилактики вирусно-бактериальных инфекций крупного рогатого скота,
- 30 вакцин для профилактики бактериальных инфекций крупного рогатого скота,
- 22 вакцины для профилактики вирусных инфекций свиней,
- 20 вакцин для профилактики вирусно-бактериальных инфекций свиней
- 29 вакцин для профилактики бактериальных инфекций свиней.
- Изложены инструкции по применению вакцин для специфической профилактики инфекционных болезней крупного рогатого скота и свиней.
- Описывается состав биопрепаратов, их биологические свойства, способ применения, форма выпуска и транспортировка, адреса изготовителей.
- Приведены рекомендуемые схемы вакцинаций крупного рогатого скота и свиней, а также схемы применения вакцин, утвержденные Министерством сельского хозяйства и Департаментом ветеринарного и продовольственного надзора Минсельхозпрода Республики Беларусь.
Данное пособие имеет важную практическую значимость в работе ветеринарного врача. Представленная в нем информация позволит своевременно провести оптимальный выбор вакцин из перечня биопрепаратов, составить схему их применения.
Содержание
Инфекционный ринотрахеит – пустулезный вульвовагинит крупного рогатого скота 10
Парагрипп-3 крупного рогатого скота. 12
Вирусная диарея крупного рогатого скота . 14
Респираторно-синцитиальная инфекция крупного рогатого скота 17
Аденовирусная инфекция . 20
Ротавирусная инфекция крупного рогатого скота. 23
Kоронавирусный энтерит крупного рогатого скота. 25
Парвовирусная инфекция крупного рогатого скота. 28
Оспа овец и коз. 30
Хламидиоз крупного рогатого скота. 34
Сибирская язва. 40
Эмфизематозный карбункул. 47
Брадзот овец. 50
Инфекционная анаэробная энтеротоксемия овец . 51
Злокачественный отек. 54
Протейная инфекция. 71
Инфекционный кератоконъюнктивит . 73
Классическая чума свиней. 76
Цирковирусная инфекция свиней. 79
Болезнь Ауески. 82
Парвовирусная инфекция свиней. 85
Эпизоотическая (эпидемическая) диарея свиней. 88
Вирусный (трансмиссивный) гастроэнтерит свиней. 91
Репродуктивно-респираторный синдром свиней. 94
Ротавирусная болезнь свиней. 96
Рожа свиней . 100
Aнаэробная энтеротоксемия свиней. 102
Пастереллез свиней. 104
Лептоспироз свиней. 107
Бордетеллез свиней . 109
Стрептококкоз свиней. 110
Листериоз свиней. 113
Сальмонеллез свиней. 115
Гемофилезный полисерозит свиней. 119
Актинобациллярная плевропневмония свиней . 121
Микоплазмоз свиней. 124
Колибактериоз свиней. 127
Вакцина трехвалентная живая культуральная против инфекционного ринотрахеита, вирусной диареи и парагриппа-3 крупного рогатого скота. 133
Вирус-вакцина трехвалентная сухая живая культуральная против инфекционного ринотрахеита, вирусной диареи и парагриппа-3 крупного рогатого скота. 134
Вакцина бивалентная инактивированная против инфекционного ринотрахеита и вирусной диареи крупного рогатого скота. 136
Вакцина трехвалентная инактивированная против вирусной диареи, рота- и корона вирусной инфекций крупного рогатого скота. 137
Вакцина ассоциированная против рота- и коронавирусной инфекций новорожденных телят 138
Вирус-вакцина инактивированная против инфекционного ринотрахеита, вирусной диареи, парвовирусной инфекции крупного рогатого скота . 140
Вакцина инактивированная против вирусной диареи крупного рогатого скота 141
Вакцина инактивированная против парвовирусной инфекции крупного рогатого скота 142
Вакцина сухая инактивированная против инфекционного ринотрахеита крупного рогатого скота 143
Вакцина инактивированная эмульгированная против инфекционного ринотрахеита крупного рогатого скота. 145
Вакцина живая культуральная против инфекционного ринотрахеита крупного рогатого скота 146
Вакцина живая культуральная против вирусной диареи крупного рогатого скота 148
Вакцина живая культуральная против парагриппа-3 крупного рогатого скота 150
Вирус-вакцина культуральная живая сухая против оспы овец164
Вирус-вакцина ВГНКИ сухая культуральная против болезни Ауески 165
Вакцина сухая культуральная ассоциированная против инфекционного ринотрахеита и парагриппа-3 крупного рогатого скота. 169
Вакцина ассоциированная эмульсионная инактивированная против парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота . 170
Вакцина сорбированная инактивированная против рота- и коронавирусной инфекций крупного рогатого скота . 171
Вакцина сорбированная инактивированная против парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота . 173
Вакцина ассоциированная эмульсионная инактивированная против парагриппа-3, инфекционного ринотрахеита и коронавирусной инфекции крупного рогатого скота 174
Вакцина ассоциированная эмульсионная инактивированная против парагриппа-3, инфекционного ринотрахеита и вирусной диареи крупного рогатого скота 176
Вакцина ассоциированная эмульсионная инактивированная против вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота. 177
Вакцина эмульгированная инактивированная против вирусной диареи, клебсиеллеза, ротавирусной и протейной инфекций телят. 180
Вакцина поливалентная инактивированная эмульгированная против инфекционного ринотрахеита, вирусной диареи, парвовирусной инфекции, эшерихиоза и протеоза крупного рогатого скота 181
Вакцина инактивированная эмульгированная против ротавирусной инфекции и колибактериоза крупного рогатого скота. 183
Вакцина инактивированная эмульгированная КСКП для профилактики колибактериоза, сальмонеллеза, клебсиеллеза и протеоза крупного рогатого скота. 200
Вакцина поливалентная против колибактериоза телят и ягнят203
Вакцина формолквасцовая концентрированная против сальмонеллеза телят 204
Вакцина живая сухая против трихофитии крупного рогатого скота 207
Вакцина инактивированная эмульгированная против пастереллеза крупного рогатого скота 209
Вакцина инактивированная эмульгированная для профилактики колибактериоза и клебсиеллеза телят 210
Формолвакцина концентрированная гидроокисьалюминиевая против эмфизематозного карбункула крупного рогатого скота и овец . 220
Формолвакцина поливалентная гидроокисьалюминиевая против колибактериоза (эшерихиоза) телят, ягнят. 221
Формолвакцина гидроокисьалюминиевая против пастереллеза жвачных 222
Концентрированная поливалентная гидроокисьалюминиевая вакцина против брадзота, инфекционной энтеротоксемии, злокачественного отека овец и дизентерии ягнят 223
Вакцина формолквасцовая против сальмонеллеза телят. 224
Вакцина инактивированная против некробактериоза животных 230
Вакцина сухая живая против листериоза сельскохозяйственных животных 231
Вакцина концентрированная масляная против лептоспироза животных 232
Формолвакцина концентрированная гидроокисьалюминиевая против эмфизематозного карбункула крупного рогатого скота и овец. 234
Вакцина эмульгированная против пастереллеза крупного рогатого скота, буйволов и овец 236
Вакцина ОКЗ ассоциированная инактивированная против колибактериоза, сальмонеллеза, клебсиеллеза и протейной инфекции молодняка сельскохозяйственных животных и пушных зверей 238
Вакцина живая сухая из штамма СТИ против сибирской язвы животных 240
Вакцина живая жидкая из штамма 55-ВНИИВВиМ против сибирской язвы животных 243
Вакцина ассоциированная против репродуктивно-респираторного синдрома и парвовирусной инфекции свиней. 249
Вакцина живая против болезни Ауески свиней. 250
Вакцина ассоциированная против трансмиссивного гастроэнтерита и ротавирусной болезни свиней 254
Вирус-вакцина культуральная сухая ЛК-ВНИИВВиМ против классической чумы свиней 255
Набор вакцин против трансмиссивного гастроэнтерита и ротавирусной болезни свиней (ТР-1) 269
Вакцина инактивированная концентрированная эмульгированная БАК против болезни Ауески 272
Вакцина инактивированная концентрированная против парвовирусной болезни и репродуктивно-респираторного синдрома свиней (ПР) . 274
Вакцина инактивированная концентрированная против репродуктивно-респираторного синдрома свиней. 274
Вакцина ассоциированная инактивированная против репродуктивно-респираторного синдрома и пастереллеза свиней. 283
Вакцина инактивированная против болезни Ауески и рожи свиней 285
Вакцины инактивированные концентрированные против парвовирусной болезни, лептоспироза, болезни Ауески (ПЛА), репродуктивно-респираторного синдрома (ПЛАР) и хламидиоза свиней (ПЛАХ)286
Вакцина ассоциированная инактивированная против лептоспироза, рожи и парвовирусной инфекции свиней. 288
Вакцина ассоциированная против гемофилезного полисерозита и сальмонеллеза поросят 296
Вакцина поливалентная против лептоспирозасвиней. 297
Вакцина депонированная против рожи свиней. 299
Вакцина живая сухая поливалентная против сальмонеллеза поросят 301
Вакцина против сальмонеллеза поросят. 303
Вакцина поливалентная с адгезивными антигенами К88, К99, F41, 987Р против колибактериоза поросят. 304
Вакцина сухая против рожи свиней. 306
Вакцина живая сухая из штамма ТС-177 против сальмонеллеза свиней 307
Вакцина ассоциированная поливалентная против сальмонеллеза, пастереллеза и стрептококкоза свиней. 309
Формолвакцина поливалентная гидроокисьалюминиевая против колибактериоза (эшерихиоза) поросят. 325
Депонированная вакцина против рожи свиней. 326
Вакцина против сальмонеллеза, пастереллеза и стрептококкоза поросят 327
Вакцина ассоциированная инактивированная против сальмонеллеза, пастереллеза и энтерококковой инфекции поросят. 328
Вакцина эмульгированная против рожи свиней. 329
Вакцина живая сухая из штамма ВР-2 против рожи свиней 330
Вакцина ассоциированная против анаэробной энтеротоксемии и эшерихиоза поросят 331
Читайте также:


