Увеличились лимфоузлы 3 см вирус
Приводится клинический случай лимфогранулематоза у больного с ВЭБ-инфекционным мононуклеозом, который подтверждает возможность формирования лимфопролиферативных заболеваний и гемобластозов после перенесенной острой ВЭБ-инфекции и показывает необходимость широкого использования вирусологических и иммунологических методов исследования.
Вирус Эпштейна–Барр (ВЭБ) обладает выраженным тропизмом к В-лимфоцитам, где происходит его размножение, Т-клеткам и лимфоидным образованиям. В отличие от других герпесвирусов он способствует пролиферации пораженных клеток (генерализованная лимфаденопатия). ВЭБ является представителем онкогенных ДНК-содержащих вирусов и выступает этиологическим агентом лимфомы Беркитта, рака носоглотки, некоторых вариантов лимфогранулематоза, аутоиммунных заболеваний и др.
Инкубационный период продолжается от 4 до 14 дней, реже — до месяца. Чаще отмечается острое начало — повышение температуры тела, головная боль, мышечные и суставные боли. Беспокоят также боли в горле, усиливающиеся при глотании, затрудненное носовое дыхание, гиперплазия лимфатических узлов. Интенсивность клинических симптомов нарастает к 4–6-му дню, но уже к 3–4-му дню отмечается гепатолиенальный синдром, в крови выявляются атипичные мононуклеары. Основными симптомами являются: лихорадка, тонзиллит, генерализованная лимфаденопатия, гепатоспленомегалия, экзантемы (пятнистые, розеолезные, папулезные и др.). Чаще поражаются углочелюстные и заднешейные лимфоузлы, реже — подмышечные, паховые, кубитальные. У некоторых больных может наблюдаться довольно выраженная картина острого мезаденита.
Характерные изменения в периферической крови появляются после 5-го дня болезни: развивается лейкоцитоз (возможен гиперлейкоцитоз — до (18–20)·10 9 /л), лимфомоноцитоз, возрастает количество плазматических клеток, появляются атипичные мононуклеары (10–60% и выше). Выздоровление наступает через 2–4 нед, но могут сохраняться лимфоаденопатия, гепатоспленомегалия, атипичные мононуклеары, что указывает на затяжное течение заболевания.
Возможны несколько вариантов исходов острого инфекционного процесса: выздоровление, бессимптомное вирусоносительство или латентная инфекция, хроническая рецидивирующая инфекция, возникновение синдрома хронической усталости, развитие аутоиммунного заболевания и развитие онкологического (лимфопролиферативного) процесса (лимфогранулематоз, множественные поликлональные лимфомы, назофарингеальная карцинома, лейкоплакии языка и слизистых оболочек ротовой полости, рак желудка и кишечника и др.).
Лимфогранулематоз — злокачественное новообразование лимфоидной ткани, характеризующееся ее гранулематозным строением с наличием гигантских клеток Березовского–Штернберга, поражением лимфатических узлов и внутренних органов.
Микроскопическая картина лимфогранулематоза характеризуется разрастанием лимфоидных и плазматических клеток, гистиоцитов, фибробластов, нейтрофильных лейкоцитов, напоминающих гранулематозную ткань. На фоне гранулематоза обнаруживаются гигантские клетки Березовского–Штернберга, основными отличительными особенностями которых являются гигантский размер цитоплазмы и ядер; признаки деления ядра без деления цитоплазмы; крупные ядрышки, напоминающие внутриядерные включения; ядра клеток с нежной сетью хроматина, сгущающейся к периферии, что создает внутри ядра центральную зону просветления.
Приводим клинический случай, который подтверждает возможность формирования лимфопролиферативных заболеваний и гемобластозов после перенесенной острой ВЭБ-инфекции.
На использование данных было получено информированное согласие пациента.
Больной К., 24 года. При поступлении — жалобы на боли в горле при глотании. Болен в течение месяца: два дня держалась высокая температура (38–39°С), через несколько дней появились боли в горле при глотании, неделю назад увеличились надключичные и шейные лимфоузлы.
При поступлении состояние оценивалось как удовлетворительное, кожные покровы — физиологической окраски. Пальпируются надключичные и шейные лимфоузлы, увеличенные до 1,5–2 см, плотно-эластической консистенции, болезненные (рис. 1). Увеличены также аксиллярные и паховые лимфоузлы (0,5–1 см), мягко-эластической консистенции, безболезненные. В ротоглотке определяются гиперемия и гипертрофия миндалин, гнойные налеты в области лакун (рис. 2). Печень увеличена и выступает на 2–3 см из-под реберной дуги, мягко-эластической консистенции, пальпируется нижний полюс селезенки (перкуторно, в 9–11-м межреберье).
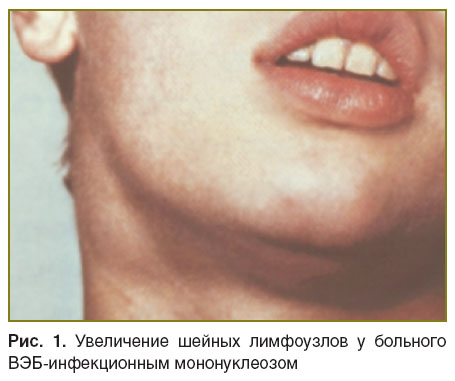 Рис. 1. Увеличение шейных лимфоузлов у больного ВЭБ-инфекционным мононуклеозом |
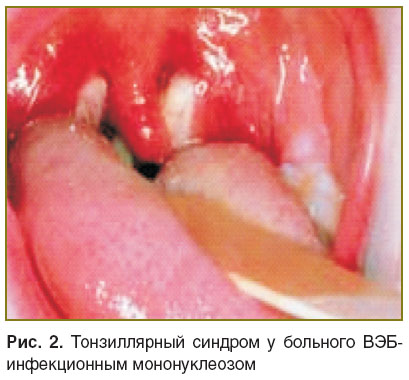 Рис. 2. Тонзиллярный синдром у больного ВЭБ-инфекционным мононуклеозом |
Общий анализ крови: Hb — 128 г/л; эр. — 4,0·10 12 /л; цв. пок. — 0,96; СОЭ — 11 мм/ч; ле. — 6,4·10 9 /л; с.-яд. — 75%; эоз. — 3%; лимф. — 18%; моноц. — 4%. Общий билирубин — 20 (5/15) ммоль/л; АЛТ — 0,6 мкмоль/л·ч.
Методом полимеразно-цепной реакции обнаружена ДНК ВЭБ в лейкоцитах крови и в соскобе со слизистой оболочки ротоглотки. Маркеры ВИЧ-инфекции были отрицательными.
УЗИ органов брюшной полости: в селезенке отмечаются несколько гипоэхогенных очагов с неровными контурами округлой формы (5 × 6 × 7 мм).
Проведена консультация в онкологическом диспансере. Выполнена пункционная биопсия надключичного лимфоузла слева. Заключение: гиперплазия лимфоидной ткани инфекционно-аллергического генеза. Больной осмотрен фтизиатром: элементы специфического воспаления и злокачественного новообразования не обнаружены. Консультация гематолога: клинико-лабораторные данные в настоящее время заболевания крови не показывают.
На основании клинико-лабораторных показателей и данных инструментальных методов исследования был диагностирован ВЭБ-инфекционный мононуклеоз средней степени тяжести. Пациент получал симптоматическую и патогенетическую терапию: Оксамп (7 дней), Циклоферон (14 дней), Диазолин, аскорбиновую кислоту, хлористый кальций. Общее состояние больного улучшилось. Был выписан из стационара с положительной динамикой (нормализовалась температура, лимфоузлы уменьшились в размерах).
Дальнейшее наблюдение и лечение больного проводилось в онкологическом диспансере.
В приведенном наблюдении лимфогранулематоз можно расценить как исход ВЭБ-инфекционного мононуклеоза. Поэтому для точной диагностики и правильного прогнозирования исходов ВЭБ-инфекции необходимо учитывать и оценивать все разнообразие клинических симптомов и биохимических, иммунологических, морфологических показателей.
Лимфогрануломатоз - это опухолевое заболевание лимфатической системы. Впервые описано Ходжкиным в 1832 году.
Лимфогрануломатоз (ЛГМ) может возникнуть в любом возрасте, однако существует два пика этого заболевания: один в возрасте 20-29 лет(гистологический вариант, главным образом, нодулярный склероз [НС], другой - в возрасте 60 лет и старше(гистологический вариант в большинстве случаев - лимфоидное истончение[ЛИ]). В США более 90% больных ЛГМ - люди белой расы. Заболевание возникает обычно в малочисленных семьях с высоким уровнем жизни и высоким уровнем образования у матери.В России мужчины заболевают несколько чаще. ЛГМ встречается чаще в 3 раза в семьях, где зарегистрированы случаи болезни.
Этиология. Точно неизвестна, однако имеются ассоциации с рядом инфекционных возбудителей и вирусом Эпштейна-Барра. Заболевание сопровождается угнетением клеточного иммунитета. ОсобенностьюЛГМ является обнаружение клеток Рид-Березовского-Штернберга(РБШ), их предшественников, клеток воспаления и клеток, появляющихся в ответ на выделение цитокинов РБШ клетками.
Клетки РБШ - это гигантские клетки с двух и более дольчатым ядром и огромными, эозинофильными, похожими на включение ядрышками. Классические РБШ клетки имеют зеркально симметричные ядра, выглядящие как глаза совы.
Установлены варианты предшественников клеток РБШ. При гистологическом варианте, называемом нодулярным склерозом, встречаются лакунарные клетки - вариант мелких клеток РБШ. Вариант, называемый клетками "воздушной кукурузы", можно встретить при лимфоидном преобладании, а саркоматозный вариант клеток РШБ - при таком гистологическом варианте болезни Ходжкина, как лимфоидное истощение
Экспрессия общего антигена лейкоцитов (LCA или CD45) при большинстве случаев БХ отсутствует, что позволяет отличить ЛГМ от неходжкинской лимфомы (НХЛ).
В редких случаях клетки РБШ можно увидеть при других вариантах рака (например, раке молочной железы, раке легких и меланоме); их также видели при некоторых воспалительных состояниях (например, миозите, инфекционном мононуклеозе). РБШ клетки являются диагностическими при болезни Ходжкина только при наличии соответствующей гистологической структуры.
Морфологами принято четыре типа гистологических варианта ЛГМ.
1. При лимфогистиоцитоидном (ЛС) варианте пораженная ткань состоит, главным образом, из мелких лимфоцитов и эпителиоидных гистиоцитов. Диагностические клетки РБШ встречаются редко. Преобладает вариант РБШ клеток со складчатыми, скрученными или дольчатыми ядрами, называемых "клетками воздушной кукурузы". Встречаются два подварианта: нодулярный и диффузный. При нодулярном варианте болезни Ходжкина иногда может иметь место прогрессия в лимфоидное истощение или крупноклеточную НХЛ.
. 2.Нодулярный склероз (НС) -наиболее распространенный гистологический вариант , обычно имеет более хороший прогноз. При окраске гематоксилином и эозином выявляются эозинофильные коллагеновые волокна различной ширины, окруженные голубыми лимфоидными узелками. Некоторые клетки кажутся окруженными прозрачными участками. Они называются лакунарным вариантом РБШ клеток и образуются в результате фиксации клеток. НС делится на две степени - 1 и 11. При II степени встречаются области, обедненные лимфоцитами, или большое число различных по форме гигантских РБШ клеток. Она сопровождается более плохим прогнозом, чем 1 степень.
3. Смешанно-клеточный вариант - 2-й по частоте встречаемости. Характеризуется большим количеством РБШ клеток, окруженных реактивными гистиоцитами, мелкими лимфоцитами и мелкими очагами некроза. Часто встречается фокальное или частичное поражение лимфатических узлов.
4. Лимфоидное истощение, как свидетельствует название, характеризуется снижением числа лимфоцитов и часто - очагами некрозов. Этот вариант может быть связан с синдромом истощающей лихорадки, который наблюдается, главным образом, при поражении тканей ниже диафрагмы и инфильтрации костного мозга
Клинические проявления ЛГМ весьма разнообразны. Наиболее частым первым признаком ЛГМ является обнаружение увеличенных лимфоузлов (опорный симптом №1 ФНОО), преимущественно в шейно- наключичной зоне (до 75%).Как правило лимфоузлы при ЛГМ плотноэластичные, безболезненные, неспаянные. У 15-20% больных заболевание начинается с увеличения лимфоузлов средостения, что проявляется кашлем, реже болями за грудиной и синдромом сдавления нижней полой вены.
Значительно реже опухолевый процесс развивается ниже диафрагмы и в частности в забрюшинном пространстве, проявляясь вздутием, болями в животе и пояснице.
В период развернутых проявлений ЛГМ возможно поражение всех лимфоидных органов. Среди других органов может быть поражение легких,костной системы, печени. Возможно поражение ЦНС.Специфических изменений в общем анализе крови не существует, за исключением СОЭ, отражающей активность процесса.
До 30% наблюдений ЛГМ сопровождается кожным зудом. Нередко болезнь сопровождается симптомами интоксикации(симптомы В)- лихорадка, потливость, похудание, ухудшающими прогноз заболевания.
- Физикальный осмотр с пальпацией всех доступных лимфоузлов
- Биопсия увеличенного лимфоузла (эксцизионная) всеми доступными подходами.
- Рентгенологическое исследование органов грудной клетки и средостения.
- УЗИ органов брюшной полости и забрюшинного пространства
- Фиброларингоскопия с биопсией при подозрении кольца Вальдейера
- Трепанобиопсия костного мозга (подвздошная область)
При сомнении в стадии(I,II,III-а) и выборе метода терапии- лапаротомия со спленэктомией и биопсией забрюшинных лимфоузлов.
Классификация ЛГМ по стадиям, принятая в 1971г в АннАрбор
2. Чем отличаются клинические проявления болезни Ходжкина от неходжкинской лимфомы? ЛГМ часто проявляется увеличением шейных лимфоузлов. Лимфоузлы могут оставаться изолированными или сливаться с соседними. Для НХЛ нехарактерно это спаивание лимфоузлов в конгломераты. Генерализованная лимфоаденопатия редко является проявлением ЛГМ, но часто встречается при НХЛ низкой степени злокачественности.
При значительном увеличении лимфоузлов брюшной полости или поражении Вальдейерова кольца следует предполагать скорее НХЛ, чем ЛГМ.
3. Что позволяет заподозрить ЛГМ? Больные ЛГМ часто предъявляют жалобы на генерализованный кожный зуд. Они также могут жаловаться на боли в лимфоузле, возникающие после принятия алкоголя .
ЛГМ в вопросах и ответах
1.Чем характеризуются В-симптомы, используемые в стадировании болезни Ходжкина?
В-симптомы являются проявлением специфического процесса и имеют прогностическое значение. К ним относятся: Необъяснимая лихорадка (38,5 С) или выше
Профузные ночные поты
Потеря более чем 10% веса за последние 6 месяцев.
Стадия определяется в соответствии с числом пораженных областей (не отдельных) лимфоузлов и расположением по одну или обе стороны диафрагмы. Буква Е означает, что поражение имеет прямое распространение из пораженного лимфоузла на сопряженные нелимфоидные структуры и может быть потенциально включено в одно поле облучения.
Классификация ЛГМ, принятая в Анн Арбор*
Вовлечение одной области лимфоузлов (I) или одного
Нелимфоидного органа или области (IE)
Вовлечение двух или более областей лимфоузлов по одну сторону диафрагмы (II) или одной или более областей лимфоузлов с нелимфоидной областью (IIE).
Вовлечение областей лимфоузлов по обе стороны диафрагмы (III), иногда с одновременным вовлечением нелимфоидного органа или области (IIIЕ), селезенки (IIIs) или обоих (IIISE)
Диффузное или диссеминированное поражение одного или более нелимфоидных органов с сочетанным поражением лимфатических узлов или без него
* Все стадии подразделяются на А (бессимптомные) и В (лихорадка, ночные поты, потеря более чем 10% веса за 6 месяцев)
Анамнез и осмотр
Симптомы: потеря веса 10% за предшествующие 6 месяцев, докумонтированная лихорадка
Тщательное физикальное исследование
Тесты, оценивающие функцию печени
Альбумин, ЛДГ кальций
При особых обстоятельствах УЗИ
Рентгенография грудной клетки
Компьютерная томография (КГ) грудной клетки, живота и таза
Лимфангиография нижних конечностей
Радиоизотопное сканирование с галлием, технецием
Полный анализ крови
Особый вид сканирования пула крови
В 1989 году международный многопрофильный комитет модифицировал стадирующую классификацию Анн Арбор. Эта модификация, называемая рекомендацией Котсволд, делает значимыми КГ и другие исследования в оценке распространенности и объема опухоли.
Классификация стадий Котсволда
Вовлечение одной области лимфоузлов или одной лимфоидной структуры (например, селезенки, тимуса, Вальдейерова кольца)
Вовлечение двух или более областей лимфоузлов по одну сторону диафрагмы: средостение - одна область поражения, латерально ограниченная лимфоузлами ворот легких, количество анатомических областей должно быть указано цифрой (например, IIз)
Вовлечение лимфоузлов или лимфоидных структур по обе стороны диафрагмы III 1/3 расширения, > 10 см максимального размера массы узла; Е - вовлечение единичного экстранодального участка по протяженности или проксимально к известному нодальному участку; CS - клиническая стадия; PS - патологическая стадия
11. Каков современный взгляд на роль лапаротомии? На лапаротомии оккультные поражения при ЛГМ обнаруживаются, по крайней мере, у 25% больных, имеющих по клиническим данным поражение, ограниченное наддиафрагмальными областями. Сомнения в необходимости стадирующей лапаротомии могут быть уменьшены, если следовать той философии, что в целом лапаротомии следует избегать, кроме тех случаев, когда обнаруженные находки значительно изменят вариант терапии. Стадирующая лапаротомия показана больным с I, II и IIIА стадией, которым в качестве терапии планируется облучение. Если на лапаротомии будут обнаружены в значительном количестве лимфоузлы в воротах селезенки (4 лимфоузла и более) или парааортальные лимфоузлы, то преимущество для таких больных будет иметь комбинированная терапия.
4. Каким пациентам лапаротомия не показана?
1. Больным с четко верифицированной стадией IIIВ или IV, которым планируется проведение химиотерапии
2. Больным с большой опухолью средостения (1/3 диаметра грудной клетки), для которых преимуществом обладает комбинированная терапия
3. Больным с изолированным поражением шейных лимфоузлов или не имеющим большого объема поражения средостения с гистологическим вариантом 2 )

Лимфаденопатия является одним из симптомов многих заболеваний, различных как по клинической картине, так и по методам диагностики и лечения [1]. Одна из основных функций лимфатических узлов - барьерная, снижена у детей раннего возраста, что объясняет генерализацию инфекции в данной возрастной группе. В большинстве случаев причиной увеличения лимфатических узлов различной локализации у детей и подростков являются процессы, не связанные ни с гематологическими, ни с онкологическими заболеваниями, причиной гипертрофии лимфоидной ткани является инфекционный процесс 3. Чаще всего на детский возраст приходится инфицирование герпесвирусами, в особенности вирусом Эпштейна-Барр [4].
По данным ВОЗ, герпесвирусная инфекция занимает второе место после гриппа и ОРВИ в структуре заболеваемости вирусными инфекциями [5]. Известно, что большинство жителей нашей планеты в разные периоды жизни инфицируются хотя бы одним, а чаще несколькими типами вирусов, относящимися к семейству герпесвирусов (ГВ). У половины из них заболевание протекает с рецидивирующим течением. Особенностью герпесвирусной инфекции является сохранность вируса в организме в течение всей жизни и развитие транзиторных нарушений иммунной регуляции, обусловленных недостаточностью различных звеньев иммунной системы [2; 4; 5].
Среди изученных герпесвирусных инфекций (более 80) патогенными для человека являются лишь 8. Они классифицируются на: альфа- (вирус простого герпеса человека 1-го типа, вирус простого герпеса человека 2-го типа, варицелла зостер вирус 3-го типа), бета- (цитомегаловирус 5-го типа, вирус герпеса человека 6-го типа, вирус герпеса человека 7-го типа) и гамма- (вирус Эпштейна–Барр 4-го типа, вирус герпеса человека 8-го типа) герпесвирусы [3].
α-Герпесвирусы характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпесвирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в нервных ганглиях [6; 7].
β-Герпесвирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму; в культуре клеток легко возникает персистентная инфекция [7].
γ-Герпесвирусы характеризуются тропностью к лимфоидным клеткам (Т- и В-лимфоцитам), в которых они длительно персистируют и могут трансформировать, вызывая лимфомы, саркомы (таблица) 8.
Клинические формы заболеваний, вызываемых герпесвирусами [3; 11]
Вирус простого герпеса 1-го типа
Вирус простого герпеса 2-го типа
Варицелла зостер вирус
Вирус герпеса человека 6 типа
Вирус герпеса человека 7 типа
Экзантема у детей
Нейроинфекция при СПИДе
Цитомегалия у больных после трансплантации органов
Системные болезни после трансплантации
Вирус герпеса человека 8 типа
Энцефалит у новорожденных
Из всех известных герпесвирусов, по данным литературы, наиболее часто у детей с лимфаденопатией встречаются: вирус Эпштейна-Барр (ВЭБ), цитомегаловирус (ЦМВ), вирус простого герпеса человека 1-го и 2-го типов, вирус герпеса человека 6-го типа [12].
Таким образом, представляет определенный научный интерес изучение вклада герпесвирусных инфекций как этиологического фактора в развитие синдрома лимфаденопатии для проведения эффективной терапии [13].
Цель исследования: выявить особенности клинико-лабораторных параметров и инфекционной нагрузки у детей и подростков с лимфаденопатией инфекционной этиологии.
Материал и методы исследования
Все пациенты с лимфаденопатией инфекционной этиологии были разделены на 2 группы: первую группу составили дети раннего и дошкольного возраста (с 1 года 7 месяцев до 6 лет) – 58 человек, вторую группу - дети школьного возраста (с 7 лет и старше) – 60 человек. Всем детям было проведено серологическое исследование сыворотки крови методом иммуноферментного анализа (ИФА): определены специфические антитела класса IgM, IgG к следующим возбудителям: цитомегаловирусу, вирусу Эпштейна-Барр, вирусу простого герпеса 1 и 2 типов, вирусу герпеса 6 типа.
Проведена оценка анамнеза (особенности течения пре-, пери- и постнатального периодов, генеалогического анамнеза), клинических (характеристика лимфатических узлов, наличие увеличения и/или других изменений паренхиматозных органов - печени и/или селезёнки (по результатам УЗИ), выраженность симптомов интоксикации) и лабораторных параметров (особенности гемограммы).
Лейкоцитозом у детей старше 1 года считали уровень лейкоцитов выше 10*109/л. Оценка лейкоцитарной формулы проведена в относительных величинах: эозинофилией - уровень эозинофилов более 4%, нейтрофилезом - у детей 1-4 лет считали увеличение нейтрофилов более 50%, 5 лет и старше – выше 60%. За нормальное содержание моноцитов принимали 4-12%. Лимфоцитозом считали для детей 1-4 года – относительное количество лимфоцитов выше 60%; 5 лет и старше – выше 50% Ускоренным считался уровень СОЭ выше 10 мм/ч.
Все расчеты выполнены в операционной системе Windows XP с использованием пакета Microsoft Office XP. Исследования проведены на сертифицированном оборудовании: гематологический анализатор Syswex KX-21N, Япония (клинический анализ крови); автоматический анализатор для ИФА EVOLIS BIO-RAD, Франция (иммуноферментный анализ); аппарат Hitachi HI VISION Avius, Япония (ультразвуковое исследование).
Результаты исследования и их обсуждение
У преимущественного большинства детей, вошедших в исследование, определены специфические IgG к герпесвирусам, лишь у 16 человек (13,6%) - IgM. У детей раннего и дошкольного возраста (1 группа) чаще встречались антитела к цитомегаловирусу – 43 человека (74,1%), на втором месте по частоте встречаемости - к вирусу Эпштейна-Барр – 37 человек (63,8%). Реже встречались антитела к вирусу герпеса 1-го и 2-го типов – у 22 человек (37,9%) и вирусу герпеса 6-го типа – у 18 детей (31%).
Во второй группе (школьников) преобладали антитела к вирусу Эпштейна-Барр – 55 человек (91,7%), реже – к цитомегаловирусу – у 46 человек (76,7%), к вирусу герпеса 1-го и 2-го типов - у 29 человек (48,3%), к вирусу герпеса 6-го типа – у 10 детей (16,7%).
По данным анамнеза, более половины детей раннего и дошкольного возраста были отнесены в группу часто болеющих (частота заболеваемости в год 5 и более раз) - 60,3%, в отличие от школьников, среди которых часто болеющими были 41,7% человек.
У значительного числа детей и подростков отмечена гепато- и/или спленомегалия (по результатам УЗИ). При этом у детей раннего/дошкольного возраста данные изменения встречались чаще, чем у школьников (58,6% и 48,3% соответственно) (рис. 1).
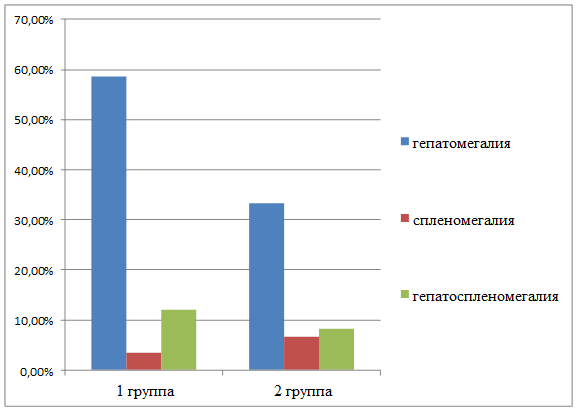
Рис. 1. Частота встречаемости гепатолиенального синдрома
Выраженность интоксикационного синдрома имеет незначительные возрастные различия. Практически у половины пациентов первой группы (дети раннего возраста и дошкольники) (41,3%) определялись симптомы интоксикации: в 10,3% - субфебрильная температура, у 31% детей – другие симптомы интоксикации, такие как снижение аппетита, слабость, вялость, утомляемость, головная боль. Во второй группе (школьников) наблюдалась такая же ситуация: 48,3% человек имели симптомы интоксикации: субфебрилитет и другие (18,3% и 30% соответственно) (рис. 2).
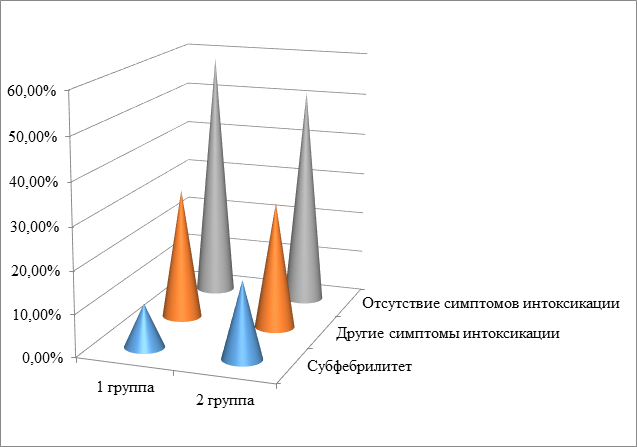
Рис. 2. Частота встречаемости интоксикационного синдрома
По данным клинического обследования, больше чем у половины детей раннего/дошкольного возраста встречалось увеличение тонзиллярных (55,2%) лимфоузлов, практически у половины – подчелюстных (44,8%), реже - переднешейных (27,6%) и заднешейных (25,9%) лимфатических узлов. Тогда как больше чем у половины школьников (56,7%) наблюдалось увеличение подчелюстных, реже – переднешейных (45%), заднешейных (41,7%) и тонзиллярных (35%) лимфатических узлов.
У детей раннего/дошкольного возрастов очень редко встречалось увеличение затылочных, заушных и подбородочных лимфоузлов (1,7%). В данной группе пациентов не наблюдалось увеличения надключичных и подключичных лимфоузлов. В то время как у школьников отмечено увеличение подбородочных (3,3%), подключичных (3,3%) и надключичных (1,7%) лимфоузлов, увеличения заушных лимфатических узлов не наблюдалось.
По данным гемограммы, у равного количества детей обеих групп встречался лейкоцитоз и увеличение СОЭ (24,1%). Лимфоцитоз определялся в 44,8% и в 55% у детей первой и второй групп соответственно.
У детей раннего и дошкольного возраста (1 группа) моноцитопения отмечена у 29,3% детей, эозинофилия - 25,9%. Нейтрофилез наблюдался у 9 детей (15,5%), наличие мононуклеаров – у 5 детей (8,6%).
В группе школьников (2 группа) - в равной степени отмечены эозинофилия и моноцитопения (по 20%). Наличие мононуклеаров определено у 3 человек (5%). Значительно реже наблюдался нейтрофилез (3,3%) и лейкоцитоз (1,7%).
Таким образом, подтверждена важная роль вирусов семейства Herpesviridae в развитии лимфаденопатий у детей и подростков. Лидирующая роль в развитии лимфаденопатии принадлежит вирусам Эпштейна-Барр, цитомегаловирусу. Меньшее значение имеют вирусы простого герпеса 1 и 2 типов и вирус герпеса 6 типа. Отмечена высокая частота вирусных ассоциаций у детей и подростков с лимфоаденопатией - 74,6% (88 детей из 118). Наиболее часто у детей раннего и дошкольного возрастов с лимфаденопатией определялись антитела к цитомегаловирусу, тогда как у детей 7 лет и старше - к вирусу Эпштейна-Барр. Наряду с лимфаденопатией, у детей, вошедших в исследование, с большой частотой наблюдалась гепатомегалия, особенно у детей дошкольного и школьного возраста группы. У школьников чаще по сравнению с детьми раннего и дошкольного возраста выявлен длительный субфебрилитет. В гемограмме детей и подростков с лимфаденопатией в половине случаев отмечен лимфоцитоз, в 25% - ускорение СОЭ, в 20% - эозинофилия.
В связи с вышеизложенным в лечении детей и подростков с лимфаденопатией эффективным является определение вирусной нагрузки с последующей соответствующей терапией. Выявление причины гепатоспленомегалии и её возможная коррекция является важной составляющей комплексной индивидуализированной терапии и профилактики. Необходим постоянный клинико-лабораторный мониторинг состояния здоровья детей данной группы. При неэффективности комплексного лечения, включающего противовирусную направленную терапию, ребёнок должен быть проконсультирован онко-гематологом с целью уточнения диагноза.
Артюшкевич А.С., зав. кафедрой челюстно-лицевой хирургии БелМАПО, д.м.н., профессор
Миранович С. И., доцент, к.м.н., кафедры челюстно-лицевой хирургии БГМУ
Черченко Н. Н. доцент, к.н.м., кафедры челюстно-лицевой хирургии БГМУ
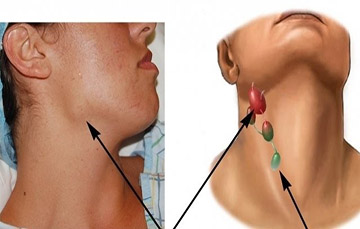
Лимфаденопатии - это большая группа заболеваний, отличающихся как по характеру возбудителя, эпидемиологическим, этиологическим, патогенетическим особенностям, так и клиническим проявлениям и прогнозу. Изменения в лимфатических узлах свидетельствуют об активности и состоянию ответа организма на патологический агент. Поэтому так трудна диагностика и так важна своевременная постановка диагноза, так как от этого зависит и прогноз.
За последние годы значительно увеличилось количество пациентов с лимфаденитами, особенно это увеличение отмечается в детском возрасте. Довольно часто причину проявления лимфаденита бывает непросто выявить. Увеличение лимфоузлов отмечается при заболеваниях крови, злокачественных опухолях, а также при хронических специфических воспалительных процессах.
Анатомия лимфатического аппарата лица и шеи. Лимфа из области головы и шеи собирается в яремные лимфатические стволы, проходя через регионарные лимфатические узлы, в которые впадают поверхностные лимфатические сосуды (рис.1) [1,2].
Классификация лимфаденопатий. В теле человека насчитывается около 600 лимфатических узлов, однако в норме пальпаторно могут определяться только подчелюстные, подмышечные и паховые лимфоузлы [5,6].
В зависимости от распространенности различают такие варианты лимфаденопатий (ЛАП):
- локальную ЛАП – увеличение одного ЛУ в одной из областей (единичные шейные, надключичные и т. д.);
- регионарную ЛАП – увеличение нескольких ЛУ в одной или двух смежных областях (надключичные и подмышечные, шейные и надключичные и т. д.);
- генерализованную ЛАП – увеличение ЛУ более чем в трех областях (шейные, надключичные, подключичные, подмышечные и др.).
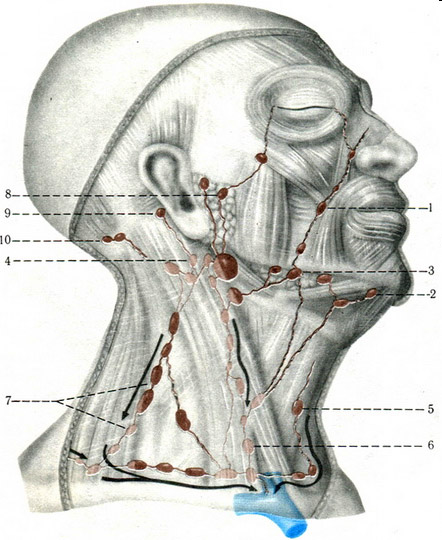
Рис. 1. Лимфатические узлы головы и шеи:
1 – щечные лимфатические узлы;
2 – подбородочные лимфатические узлы;
3 – поднижнечелюстные лимфатические узлы;
4, 5, 6, 7 – шейные лимфатические злы;
8 – внутрижелезистые лимфатические узлы;
9 – заушные лимфатические узлы;
10- затылочные лимфатические узлы.
Регионарная ЛАП отмечается при стрептококковой, стафилококковой инфекции, туляремии, туберкулезе, сифилисе, генитальном герпесе. Генерализованное увеличение ЛУ описано при инфекционном мононуклеозе, цитомегаловирусной инфекции, токсоплазмозе, бруцеллезе, туберкулезе, ВИЧ/СПИДе, болезнях накопления и др. При этом ЛАП возникает в результате попадания в ЛУ бактерий либо вирусов и их токсинов лимфогенным, гематогенным и контактным путями.
В клинической практике также часто выделяют острую ЛАП, которая характеризуется коротким продромальным периодом, лихорадкой, локальной болезненностью при пальпации, и хроническую ЛАП, отличающуюся большей длительностью, как правило, отсутствием болезненности или ее малой выраженностью. При хроническом воспалении, в отличие от острого, ЛУ обычно не спаяны с окружающими тканями. При развитии острой ЛАП отмечается серозный отек, а воспалительные явления не выходят за пределы капсулы ЛУ, однако при деструктивных процессах воспаление может переходить на окружающие ткани и по характеру быть серозным и/или гнойным [5,6].
Инфекционные заболевания, наиболее часто протекающие с вовлечением лимфоидной ткани:
- Бактериальные (все пиогенные бактерии, сифилис, туляремия, болезнь кошачьих царапин).
- Микобактериальные (туберкулёз, лепра).
- Грибковые (гистоплазмоз, кокцидиомикоз).
- Хламидийные (венерическая лимфогранулёма).
- Паразитарные (токсоплазмоз, трипаносомоз, филяриоз).
- Вирусные (вирус Эпштейна — Барр, цитомегаловирус, корь, гепатит, ВИЧ).
Клиника лимфаденопатии. Основным симптомом лимфаденопатии является увеличение лимфатических узлов, которое может быть локальным, регионарным либо генерализованным. Дополнительными симптомами могут быть:
- ночная потливость;
- потеря веса;
- сопутствующее длительное повышение температуры тела;
- частые рецидивирующие инфекции верхних дыхательных путей (фарингиты, тонзиллиты, ангины и т. п.);
- патологические изменения на рентгенограмме легких;
- гепатомегалия;
- спленомегалия.
Клиническое обследование. При наличии локализованной ЛАП необходимо исследовать области, от которых лимфа оттекает в данную группу лимфоузлов, на предмет наличия воспалительных заболеваний, поражений кожи, опухолей. Необходимо также тщательное обследование всех групп лимфоузлов, в том числе несмежных для исключения генерализованной лимфаденопатии. В случае обнаружения увеличенных лимфоузлов необходимо отметить следующие их характеристики: размер, болезненность, консистенция, связь между собой, локализация.
У пациентов с генерализованной ЛАП клиническое обследование должно фокусироваться на поиске признаков системного заболевания. Наиболее ценным является обнаружение высыпаний, поражения слизистых оболочек, гепато-, спленомегалии, поражения суставов. Спленомегалия и ЛАП встречаются при многих заболеваниях, включая мононуклеозоподобный синдром, лимфоцитарную лейкемию, лимфому, саркоидоз.
Алгоритм параклинического обследования пациента с синдромом ЛАП
При первичном осмотре пациента проводится обязательное лабораторно-инструментальное обследование, включающее в себя:
- общий анализ крови;
- общий анализ мочи;
- определение маркеров гепатита В и С, ВИЧ, RW;
- биохимическое исследование крови с определением острофазных белков;
- рентгенографию органов грудной клетки;
- УЗИ органов брюшной полости.
Так, лейкоцитоз и сдвиг формулы влево свидетельствуют в пользу бактериального поражения ЛУ (стафилококковой, стрептококковой, синегнойной, гемофильной этиологии); лимфоцитоз и моноцитоз обычно характерны для заболеваний вирусной этиологии (герпес, цитомегаловирус, вирус Эпштейна–Барр и др.).
При углубленном обследовании пациента с ЛАП возникает необходимость в использовании дополнительных инструментальных и лабораторных методов исследования. Одним из них является ультразвуковое исследование (УЗИ) ЛУ, которое позволяет уточнить их размеры, определить давность патологического процесса и его остроту. При остром воспалении определяется гипоэхогенность и однородность ЛУ. Спаянные ЛУ позволяют предположить продолжительность заболевания более 2 мес. При хроническом течении процесса эхогенность ЛУ повышается.
В биоптатах ЛУ могут обнаруживаться различные по своей природе морфологические изменения: явления гиперплазии при антигенной стимуляции; признаки острого и хронического воспаления с диффузным поражением ЛУ или очаговыми специфическими и неспецифическими изменениями вследствие реакции на вирусы, бактерии, грибы или паразитов; изменения, характерные для разнообразных опухолей ЛУ и метастазов в них опухолей из других органов.
Таким образом, в практической деятельности врачам различных специальностей часто приходится сталкиваться с синдромом лимфаденопатии, для диагностики которого необходимо использовать комплекс клинических, лабораторных и инструментальных методов исследования, правильный выбор которых позволит оптимизировать этиологическую диагностику заболевания.
ЛИТЕРАТУРА
- Марков А.И., Байриков И.М., Буланов С.И. Анатомия сосудов и нервов головы и шеи. – Ростов н/Д: Феникс, 2005. – С. 41-46.
- Будылина С.М. Физиология челюстно-лицевой области: Учебник / Под ред. С.М. Будылиной, В.П. Дегтярева. – М.: Медицина, 2000. – С. 23.
- Пасевич И.А. Инфракрасное низкоинтенсивное лазерное излучение в диагностике и комплексном лечении острого неспецифического лимфаденита лица и шеи у детей. Автореф. дис… канд. мед. наук. – Смоленск, 1996. – 18 с.
- Шаргородский А.Г. Клиника, диагностика, лечение и профилактика воспалительных заболеваний лица и шеи (руководство для врачей) / Под ред. А.Г. Шаргородского. – М.: ГЭОТАР-МЕД, 2002. – С. 347-356.
- Дворецкий Л.И. Дифференциальный диагноз при лимфаденопатиях // Справочник поликлинического врача. - 2005. - Т. 3. - № 2. - С. 3–9.
- Зайков С.В. Дифференциальная диагностика синдрома лимфаденопатии // Клиническая иммунология. Аллергология. Инфектология. - 2012. – №4. - С. 16-24.
Читайте также:


