Трансплантация почки при гепатите с
Похожие темы научных работ по клинической медицине , автор научной работы — Ватазин А. В., Прокопенко Е. И., Зулькарнаев А. Б., Щербакова Е. О., Кантария Р. О.
применяют общий мазок. У женщин исследуют выделения из влагалища, у мужчин - выделения из мочеиспускательного канала и секрет предстательной железы. Результат общего мазка подтверждают более точными методами исследования - ПИФ, ПЦР или посев.
Лечение трихомониаза должно быть комплексным и индивидуальным. Очень важно довести лечение до конца, либо недолеченный трихомониаз может приобрести хроническую форму и проявить себя через несколько лет.
Лечение трихомониаза сводится к назначению противотрихомонадных препаратов для приема внутрь. Местное лечение (влагалищные таблетки и свечи) неэффективно.
В ряде случаев назначают лечение, дополняющее противотрихомонадные препараты (иммунотерапия, общеукрепляющие препараты, массаж предстательной железы, инстилляции уретры, физиотерапия и т. д.).
Контроль излеченности: излеченными считают только тех больных, у которых прекращаются выделения из уретры, нормализуется моча, рассасываются инфильтраты в воспаленных половых железах, восстанавливается нормальный состав их секрета, не выявляются патологические изменения при уретроскопии.
ВИРУСНЫЕ ГЕПАТИТЫ В И С У БОЛЬНЫХ ПОСЛЕ ТРАНСПЛАНТАЦИИ ДОНОРСКОЙ ПОЧКИ
А.В. Ватазин, Е.И. Прокопенко, А.Б. Зулькарнаев, Е.О. Щербакова, Р.О. Кантария, А.С. Пасов
Московский ОНИКИ им. М.Ф.Владимирского, Россия
E-mail авторов: 7059899@gmail.com
Вирусные гепатиты - до сих пор одна из самых часто встречаемых инфекций у больных с хронической почечной недостаточностью (ХПН) на до-отрансплантационном этапе. При этом срок пребывания на гемодиализе прямо пропорционален риску инфицирования вирусными гепатитами. Инфициро-ванность вирусными гепатитами В и С (ВГС и ВГВ) является независимым фактором риска смерти у больных на гемодиализе.
ВГС - не только самая часто встречаемая инфекция среди реципиентов почек, но и является основной причиной хронических заболеваний печени после аллотрансплантации почки (АТП). Наличие ВГС приводит к достоверному увеличению риска развития сахарного диабета у реципиентов почечного аллотрансплантата (ПАТ) и инфекций. Однако поскольку даже у серопозитивных пациентов АТП является методом выбора лечения ХПН (так как летальность у инфицированных реципиентов ПАТ ни-
же, чем у больных в листе ожидания), необходима тщательная оценка состояния до операции.
По нашим данных отсроченная выживаемость как реципиентов, так и ПАТ значимо ниже у больных, инфицированными вирусными гепатитами.
Аллотрансплантация почек у больных, инфицированных вирусными гепатитами, представляет собой серьезную проблему. На данный момент нет единого протокола лечения вирусных гепатитов после АТП, недостаточно изучено влияние различных протоколов иммуносупрессии на их активность. Применение после АТП протоколов лечения вирусных гепатитов, которые используются в общей популяции сопряжено с высоким риском утраты почечного аллотрансплантата (ПАТ) в связи с развитием резистентного криза отторжения из-за выраженного иммуномодулирующего действия противовирусных препаратов.
Известно, что достижение быстрого полного и/или устойчивого вирусологического ответа при вирусном гепатите значительно улучшает долгосрочный прогноз. Благодаря внедрению экстракорпоральных методик достигнуты некоторые успехи в лечении вирусных гепатитов. В настоящее время широко применяется плазмаферез, при помощи которого можно эффективно удалить аутоантитела и патологические метаболиты, что способствует торможению прогрессирования поражений печени. Однако недостаточная селективность этого метода часто делает применение его затруднительным: проведение плазмафереза при гипоальбуминемии затруднительно, а динамка концентрации ингибиторов кальциневрина во время курса плазмафереза трудно предсказуема.
При сравнимой эффективности указанных недостатков лишен высокоселективный метод каскадной плазмофильтрации (КПФ), который способен непосредственно удалять вирионы, тем самым, понижая вирусную нагрузку. КПФ является безопасным и высокоэфеективным методом, способным значительно улучшить результаты лечения вирусных гепатитов после АТП: сократить сроки достижения устойчивого вирусного ответа и снизить риск активизации хронического процесса, что значительно улучшает долгосрочный прогноз.
Высокая эффективность КПФ в лечении ВГС также подтверждена и у реципиентов печени. Применение КПФ приводит к быстрому снижению концентрации ИСУ-РНК, что позволяет достигнуть устойчивого вирусологического ответа в комбинации с медикаментозной терапией.
Повышение эффективности лечения вирусных гепатитов путем разработки эффективных и безопасных схем лечения с применением различных экстракорпоральных методик, является перспективным направлением и способно значительно улучшить результаты трансплантации почки.
КАСКАДНАЯ ПЛАЗМОФИЛЬТРАЦИЯ КАК СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ ОСЛОЖНЕНИЙ

Оглавление диссертации Шмарина, Нонна Валерьевна :: 2003 :: Москва
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Эпидемиология и пути инфицирования вирусными гепатитами 12 В, С у больных с терминальной ХПН
1.2. Структура вирусов гепатитов В, С
1.3. Классификация, патогенез и диагностика хронических вирусных 18 гепатитов В,С
1.4. Клиника и особенности течения хронических гепатитов В и С у 24 больных с терминальной ХПН
1.5. Трансплантация почки у больных с терминальной ХПН с 28 сопутствующими вирусными гепатитами
1.6. Трансплантация почки, от доноров инфицированных вирусными 33 гепатитами В и С
1.7. Профилактика и методы лечения вирусных гепатитов В, С у 37 больных с терминальной ХПН до пересадки почки
1.8. Лечение хронических вирусных гепатитов В, С у больных после 46 АТТП
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Общая характеристика клинических наблюдений
2.2. Лекарственные препараты, используемые в исследовании
2.3. Лекарственные препараты, используемые для лечения 61 хронических вирусных гепатитов
2.4. Клинико-лабораторный мониторинг
2.5. Статистическая обработка данных
ГЛАВА 3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ И
ИХ ОБСУЖДЕНИЕ. ОСОБЕННОСТИ ВЕДЕНИЯ
ПОТЕНЦИАЛЬНЫХ РЕЦИПИЕНТОВ ДЛЯ АТТП С СОПУТСТВУЮЩИМИ ХРОНИЧЕСКИМИ ВИРУСНЫМИ ГЕПАТИТАМИ В, С В ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
3.1. Частота встречаемости вирусных гепатитов у больных с 68 терминальной стадией хронической почечной недостаточности, получающих заместительную терапию гемодиализом и у потенциальных доноров
3.2. Эффективность применения рекомбинантного интерлейкина - 1 (3 69 (беталейкина) в комплексной терапии хронических вирусных гепатитов В, С в предоперационном периоде у пациентов с терминальной стадией ХПН
3.3. Сравнительный анализ результатов трансплантации почки у 75 больных исследуемых групп с сопутствующими хроническими вирусными гепатитами В, С, пациенты одной из которых, получали в предоперационном периоде комплексную терапию, направленную на лечение гепатитов
ГЛАВА 4. ОСОБЕННОСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ 78 РАННЕГО ПОСЛЕОПЕРАЦИОННОГО ПЕРИОДА У БОЛЬНЫХ С ПЕРЕСАЖЕННОЙ ПОЧКОЙ С СОПУТСТВУЮЩИМИ ХРОНИЧЕСКИМИ ВИРУСНЫМИ ГЕПАТИТАМИ ОТ ИНТАКТНОГО ИЛИ АНТИ-НСУ- ИЛИ HBsAg-ПОЗИТИВИОГО ДОНОРА
4.1. Сравнительный анализ частоты, длительности и тяжести 78 ишемического повреждения трансплантата
4.2. Сравнительный анализ острых кризов отторжения
4.3. Проявления печеночной дисфункции в исследуемой и 82 контрольной группах
4.4. Гематологические осложнения
4.5. Инфекционные осложнения
ГЛАВА 5. ВАРИАНТЫ ИММУНОССУПРЕССИВНОЙ ТЕРАПИИ
У РЕЦИПИЕНТОВ ПОЧЕЧНОГО АЛЛОТРАНСПЛАНТАТА С
СОПУТСТВУЮЩИМИ ХРОНИЧЕСКИМИ ВИРУСНЫМИ
5.1. Сравнительный анализ результатов применения азатиоприна и 97 селлсепта в качестве второго компонента иммуноссупрессии после пересадки почки у больных с ХВГ
5.1.1. Частота и особенности течения острого отторжения
5.1.2. Оценка влияния двух режимов иммуносупрессии на функцию 99 печени
5.2. Сравнительный анализ результатов пересадки почки с 106 использованием четырех режимов индуктивной иммуносупрессии
5.2.1. Частота и особенности течения острого отторжения
5.2.2. Оценка влияния исследуемых четырех режимов 108 иммуносупрессии на функцию печени
Введение диссертации по теме "Трансплантология и искусственные органы", Шмарина, Нонна Валерьевна, автореферат
Трансплантация почки, на сегодняшний день является наиболее перспективным методом лечения больных с терминальной стадией хронической почечной недостаточности. Ежегодно в мире выполняется около 30 тысяч подобных операций, из которых более 600 осуществляется в России. [Шумаков В.И. и соавт. 2001]. Однако за последние 10 лет рост количества трансплантаций почек был минимальный, поскольку число доноров остается относительно постоянным. Рост числа проводимых трансплантаций почек не успевает за увеличением количества больных с терминальной стадией хронической почечной недостаточности, который составляет 6-8% в год. Вследствие этого число пациентов, нуждающихся в трансплантации трупной почки, и срок ожидания операции неуклонно растут. [D.E.Hricik et al., 2001].
Увеличение заболеваемости вирусными гепатитами как среди реципиентов, так и среди доноров еще более осложняет проблему аллотрансплантации почки.
По суммарному распространению диагностируемых острых и хронических форм HBV-инфекция превосходит другие парентеральные вирусные гепатиты человека. Согласно материалам ВОЗ, каждый год первично заражаются более 50 млн. человек, из этого числа у 5-10% острый гепатит трансформируется в хронический. В нашей стране показатели заболеваемости острым ГВ остаются на высоком уровне - 35,3 на 100 тыс. населения в 2001 г, что вдвое превышает заболеваемость в 1992г. Инфицирование ГС в России составляет 16,7 на 100 тыс. населения в 2001г. К настоящему времени в мире выявлено около 500 млн. носителей HCV [36, 40].
В группу высокого риска инфицирования гепатитами с парентеральным путем передачи возбудителя инфекции, входят пациенты отделений гемодиализа, ожидающие АТТП.
Пересадка почки у больных с терминальной стадией ХПН, находящихся на заместительной терапии ГД и инфицированных гепатитами, дает возможность не только улучшить качество жизни пациентов, провести медицинскую и социальную реабилитацию, но и уменьшить риск инфицирования вирусными гепатитами других пациентов получающих терапию ГД.
Поскольку потребность в органах для трансплантации по-прежнему велика, вновь обсуждается допустимость трансплантации почки, взятой у анти-НСУ-положительных или HBsAg-положительных доноров, реципиентам с аналогичными гепатитами. Отсутствие четкой позиции по отношению к донорам с наличием маркеров гепатита В приводит к значительному снижению числа потенциальных доноров и количеству трансплантируемых органов.
В настоящее время нет однозначного мнения относительно схем лечения ГВ и ГС ни до ни после ТП, мало изучена эффективность использования препаратов влияющих на иммунореактивность больного в схеме лечения вирусных гепатитов. Единичные публикации свидетельствуют о применении человеческих или рекомбинантных интерферонов после ТП, однако данные таких исследований неутешительны, у многих реципиентов АТТП возникают кризы острого отторжения трансплантата.
Прогностическое значение различных вариантов иммуносупрессии у HBsAg- и анти-НСУ-позитивных реципиентов аллогенного почечного трансплантата изучено недостаточно; публикации на эту тему единичны. С началом циклоспориновой эры в трансплантологии возросла вероятность токсических поражений печени, способных усугублять течение хронических гепатитов. Кроме того, иммуносупрессивная терапия, снижая иммунореактивность организма, способствует усилению репликации вируса.
Ведение больных с терминальной стадией ХПН и сопутствующими вирусными гепатитами как до, так и после трансплантации почки сопряжено с рядом трудностей, которые связывают с наличием многих нерешенных вопросов патогенеза вирусных гепатитов.
Разработать тактику ведения и определить оптимальную схему иммуносупрессии у больных с терминальной стадией ХПН с сопутствующими вирусными гепатитами В и С, оценить возможность пересадки почки данным пациентам от инфицированных аналогичным вирусом доноров.
1. Установить возможность пересадки почки больным с тХПН с хроническими гепатитами В и С от инфицированных аналогичным вирусом доноров.
2. Выявить особенности течения раннего послеоперационного периода у больных с пересаженной почкой с сопутствующими хроническими вирусными гепатитами от интактного или HBsAg или анти-НСУ-позитивного донора.
3. Изучить влияние хронической HBV и HCV-инфекции на функцию печени в раннем послеоперационном периоде после трансплантации почки.
4. Оценить эффективность применения препарата беталейкин в комплексной терапии хронических гепатитов у пациентов с терминальной стадией ХПН.
5. Оценить результаты трансплантации почки и функции печени у больных с сопутствующими хроническими вирусными гепатитами В, С, получавших в предоперационном периоде комплексную терапию, направленную на лечение гепатитов.
6. Разработать оптимальную схему иммуносупрессивной терапии у больных с хроническими вирусными гепатитами после трансплантации почки.
Показана возможность пересадки почки больным с хроническими гепатитами В и С от доноров, инфицированных аналогичными вирусами.
Разработан комплексный подход лечения хронических вирусных гепатитов В и С у больных с терминальной ХПН.
Впервые применен рекомбинантный ИЛ-1|3 (беталейкин) с целью лечения хронических вирусных гепатитов у больных с терминальной ХПН.
Разработана оптимальная схема иммуносупрессии для больных с сопутствующими хроническими вирусными гепатитами В и С.
Установлена возможность пересадки почки больным тХПН с сопутствующим хроническим вирусным гепатитом В от HBsAg-позитивного донора. (Для пересадки почки от анти-НСУ-позитивного донора реципиенту с хроническим гепатитом С с таким же генотипом необходимо определение генотипов вируса гепатита С.)
Разработан новый метод комплексной терапии хронических вирусных гепатитов В и С у больных с терминальной ХПН, позволяющий снизить\нормализовать биохимические показатели функции печени у большинства больных и добиться отсутствия репликации вируса более чем у половины больных.
Показана предпочтительность использования препарата беталейкин в комплексной терапии хронических гепатитов В и С у больных с тХПН до трансплантации почки для снижения частоты клинических проявлений ХВГ и снижения\нормализации биохимических показателей функции печени в посттрансплантационном периоде.
Предложена оптимальная схема иммуносупрессии у больных с сопутствующими хроническими вирусными гепатитами В и С.
РЕАЛИЗАЦИЯ РЕЗУЛЬТАТОВ РАБОТЫ.
Основные положения и материалы диссертации внедрены в клиническую практику отделения пересадки почки и поджелудочной железы ГУ НИИ трансплантологии и искусственных органов МЗ РФ, отделения по пересадки почки ЦМСЧ №119, отделения уронефрологии пересадки почки и гемодиализа НИИ Урологии МЗ РФ.
По теме диссертации опубликовано 6 печатных работ, из них 5 работ в центральной печати.
Материалы и основные положения диссертации доложены и обсуждены на II Всероссийском съезде по трансплантологии и искусственным органам (г. Москва 17-19 октября 2002г).
ОБЪЕМ И СТРУКТУРА ДИССЕРТАЦИИ
Диссертация изложена на 145 страницах текста и состоит из введения, обзора, четырех глав, заключения, выводов, практических рекомендаций и списка литературы, включающего 45 отечественных и 162 зарубежных источников. Работа иллюстрирована 22 таблицами, 8 диаграммами и 2 рисунками.
Заключение диссертационного исследования на тему "Особенности ведения больных с хроническими вирусными гепатитами В, С до и после пересадки почки"
1. Показана возможность пересадки почки HBsAg-позитивным реципиентам от HBsAg-позитивного донора. Необходимо определение генотипов вируса гепатита С для пересадки почки от анти-НСУ-позитивного донора реципиенту с хроническим гепатитом С с таким же генотипом.
2. Установлено, что в раннем послеоперационном периоде у больных с пересаженной почкой с сопутствующими вирусными гепатитами от интактного или HbsAg- или акти-НСУ-позитивного донора наблюдаются более тяжелые нарушения функции печени, увеличение частоты гематологических и инфекционных вирусных осложнений. Не выявлено разницы в частоте, тяжести и длительности течения ишемического повреждения трансплантата, частоте безкризового течения.
3. Выявлено отсутствие достоверной разницы в течение раннего послеоперационного периода у больных с сопутствующими хроническими вирусными гепатитами от интактного или инфицированного вирусами гепатитов В или С.
4. Определено увеличение риска развития тяжелых нарушений функции печени у реципиента ПАТ на фоне массивной лекарственной терапии в раннем послеоперационном периоде при наличии сопутствующего хронического гепатита В или С.
5. Показано, что применение рекомбинантного ИЛ-1|3 (беталейкина) у больных с терминальной стадией ХПН для лечения хронических вирусных гепатитов В и С приводит к нормализации биохимических и иммунологических показателей, снижению частоты клинических проявлений и отсутствию репликации вируса у 56 % больных.
6. Выявлено, что применение беталейхина в комплексной терапии в предоперационном периоде снижает частоту тяжелых нарушений функции печени (по клиническим и биохимическим данным) после проведения трансплантации почки.
7. Определено, что применение селлсепта на фоне сниженных доз СуА у больных с сопутствующими хроническими вирусными гепатитами приводит к уменьшению частоты острого и повторного отторжения, гормонорезистентных вариантов кризов и токсического влияния на функцию печени, оказываемого иммуносупрессивной терапией.
8. Установлено, что применение рекомбинантных гуманизированных антител к рецепторам ИЛ-П (Зенапакс) у больных с сопутствующими хроническими вирусными гепатитами после трансплантации почки приводит к уменьшению частоты острых кризов отторжения, оказывает минимальное влияние на функцию печени.
2. Для достижения оптимальных результатов трансплантации почек и с целью минимального влияния на функцию печени у больных с хроническими вирусными гепатитами В или С целесообразно использование в стандартной трехкомпонентной схеме иммуносупрессии низких доз СуА и селлсепта в качестве второго компонента.
4. У больных с хроническими вирусными гепатитами В или С с нормальной функцией трансплантата и нормальными или незначительно повышенными показателями функции печени в раннем послеоперационном периоде необходимо применять, не дожидаясь клинических проявлений, препараты противовирусного ряда (ганцикловир, ацикловир).
Полный текст:
В статье приведен опыт лечения гепатита С лекарственными средствами с прямым противовирусным действием у больных после трансплантации печени. Терминальная стадия заболевания печени вследствие хронического гепатита C является основным показанием для ортотопической трансплантации печени. В 2013 г. в клиническую практику внедрен первый в своем классе препарат с прямым противовирусным действием на HCV – ингибитор полимеразы HCV софосбувир, который возможно применять в безинтерфероновом режиме.
Материал и методы. В исследование включены 33 реципиента печени с возвратным гепатитом С. Были проведены 35 курсов противовирусной терапии, одним из компонентов которой являлся софосбувир.
Результаты. На момент проведения анализа 21 пациент завершил противовирусную терапию. У всех пациентов наблюдался первоначальный ответ на противовирусную терапию, была получена авиремия HCV. У 3 больных, у которых была возможна оценка стойкого вирусологического ответа, отмечено возобновление репликации HCV в первые недели после завершения противовирусной терапии.
Заключение. Появление новых лекарственных препаратов прямого действия позволяет проводить эффективную противовирусную терапию всем реципиентам печени, инфицированным HCV.
акад. РАН, профессор, директор
4. Crespo G., Marino Z., Navasa M. et al. Viral hepatitis in liver transplantation. Gastroenterology. 2012; 142 (6): 1373–1383, e1371. PMID:22537446 DOI:10.1053/j.gastro.2012.02.011
5. Berenguer M., Ferrell L., Watson J. et al. HCV-related fibrosis progression following liver transplantation: increase in recent years. J. Hepatol. 2000; 32 (4): 673–684. PMID:10782918
6. Prieto M., Berenguer M., Rayon J.M. et al. High incidence of allograft cirrhosis in hepatitis C virus genotype 1b infection following transplantation: relationship with rejection episodes. Hepatology. 1999; 29 (1): 250–256. PMID:9862874 DOI:10.1002/hep.510290122
7. Carrion J.A., Navasa M., Garcia-Retortillo M. et al. Efficacy of antiviral therapy on hepatitis C recurrence after liver transplantation: a randomized controlled study. Gastroenterology. 2007; 132 (5): 1746–1756. PMID:17484872 DOI:10.1053/j.gastro.2007.03.041
8. Belli L.S., Volpes R., Graziadei I. et al. Antiviral therapy and fibrosis progression in patients with mild-modera te hepatitis C recurrence after liver transplantation. A randomized controlled study. Dig. Liver Dis. 2012; 44 (7): 603–609. PMID:22424641 DOI:10.1016/j.dld.2012.01.017
9. Berenguer M. Systematic review of the treatment of established recurrent hepatitis C with pegylated interferon in combination with ribavirin. J. Hepatol. 2008; 49 (2): 274–287. PMID:18571272 DOI:10.1016/j.jhep.2008.05.002
10. Burton J.R. Jr., O'Leary J.G., Verna E.C. et al. A US multicenter study of hepatitis C treatment of liver transplant recipients with protease-inhibitor triple therapy. J. Hepatol. 2014; 61 (3): 508–514. PMID:24801415 DOI:10.1016/j.jhep.2014.04.037
11. Nair S.P. Protease inhibitor therapy post-liver transplantation in the treatment of hepatitis C virus infection. Gastroenterol. Hepatol. (NY). 2013; 9 (6): 388–390. PMID:23935546
12. Faisal N., Yoshida E.M., Bilodeau M. et al. Protease inhibitor-based triple therapy is highly effective for hepatitis C recurrence after liver transplant: a multicenter experience. Ann. Hepatol. 2014; 13 (5): 525–532. PMID:25152985
13. Koff R.S. Review article: the efficacy and safety of sofosbuvir, a novel, oral nucleotide NS5B polymerase inhibitor, in the treatment of chronic hepatitis C virus infection. Aliment. Pharmacol. Ther. 2014; 39 (5): 478–487. PMID:24387618 DOI:10.1111/apt.12601
14. Mathias A., Cornpropst M.T., Clemons D. et al. No clinically significant pharmacokinetic drug-drug interactions between sofosbuvir (GS-7977) and the immunosuppressants, cyclosporine A or tacrolimus in healthy volunteers. Hepatology. 2012; 56 (Suppl S1): 1063A–1064A.
15. Charlton M., Gane E., Manns M.P. et al. Sofosbuvir and ribavirin for treatment of compensated recurrent hepatitis C virus infection after liver transplantation. Gastroenterology. 2015. 148 (1): 108–117. PMID:25304641 DOI:10.1053/j.gastro.2014.10.001
16. Forns X., Charlton M., Denning J. et al. Sofosbuvir compassionate use program for patients with severe recurrent hepatitis C after liver transplantation. Hepatology. 2015; 61 (5): 1485–1494. PMID:25557906 DOI:10.1002/hep.27681
17. Nguyen N.H., Yee B.E., Chang C. et al. Tolerability and effectiveness of sofosbuvir and simeprevir in the posttransplant setting: systematic review and meta-analysis. BMJ Open Gastroenterology. 2016; 3 (1): e000066. PMID:26966549 DOI:10.1136/bmjgast-2015-000066
18. Punzalan C.S., Barry C., Zacharias I. et al. Sofosbuvir plus simeprevir treatment of recurrent genotype 1 hepatitis C after liver transplant. Clin. Transplant. 2015; 29 (12): 1105– 1111. PMID:26358816 DOI:10.1111/ctr.12634
19. Saab S., Greenberg A., Li E. et al. Sofosbuvir and simeprevir is effective for recurrent hepatitis C in liver transplant recipients. Liver Int. 2015; 35 (11): 2442–2447. PMID:25913321 DOI:10.1111/liv.12856
20. Nair S., Satapathy S.K., Gonzalez H. Sofosbuvir and Simeprevir for Treatment of Recurrent Hepatitis C Infection After Liver Transplant. Exp. Clin. Transplant. 2016. Epub ahead of print PMID:26926117 DOI:10.6002/ect.2015.0289
21. Issa D., Eghtesad B., Zein N.N. et al. Sofosbuvir and Simeprevir for the Treatment of Recurrent Hepatitis C with Fibrosing Cholestatic Hepatitis after Liver Transplantation. Int. J. Organ Transplant. Med. 2016; 7 (1): 38–45. PMID:26889372
22. Ouwerkerk-Mahadevan S., Snoeys J., Peeters M. et al. Drug-Drug Interactions with the NS3/4A Protease Inhibitor Simeprevir. Clin. Pharmacokinetics. 2016; 55 (2): 197–208. PMID:26353895 DOI:10.1007/s40262-015-0314-y
23. Kirby B.J., Symonds W.T., Kearney B.P. et al. Pharmacokinetic, Pharmacodynamic, and Drug-Interaction Profile of the Hepatitis C Virus NS5B Polymerase Inhibitor Sofosbuvir. Clin. Pharmacokinetics. 2015; 54 (7): 677–690. DOI:10.1007/s40262-015-0261-7. PMID:25822283
24. Bifano M., Adamczyk R., Hwang C. et al. An open-label investigation into drug-drug interactions between multiple doses of daclatasvir and single-dose cyclosporine or tacrolimus in healthy subjects. Clin. Drug Investig. 2015; 35 (5): 281–289. DOI:10.1007/s40261-015-0279-5. PMID:25896946
25. Poordad F., Schiff E.R., Vierling J.M. et al. Daclatasvir with sofosbuvir and ribavirin for hepatitis C virus infection with advanced cirrhosis or post-liver transplantation recurrence. Hepatology. 2016; 63 (5): 1493–1505. PMID:26754432 DOI:10.1002/hep.28446
26. Fontana R.J., Brown R.S., Jr., Moreno-Zamora A. et al. Daclatasvir combined with sofosbuvir or simeprevir in liver transplant recipients with severe recurrent hepatitis C infection. Liver Transpl. 2016; 22 (4): 446–458. PMID:26890629 DOI:10.1002/lt.24416
27. Charlton M., Everson G.T., Flamm S.L. et al. Ledipasvir and Sofosbuvir Plus Ribavirin for Treatment of HCV Infection in Patients With Advanced Liver Disease. Gastroenterol. 2015; 149 (3): 649–659. PMID:25985734 DOI:10.1053/j.gastro.2015.05.010
28. Manns M., Samuel D., Gane E.J. et al. Ledipasvir and sofosbuvir plus ribavirin in patients with genotype 1 or 4 hepatitis C virus infection and advanced liver disease: a multicentre, open-label, randomised, phase 2 trial. Lancet Infect. Dis. 2016; 16 (6): 685–697. PMID:26907736 DOI:10.1016/S1473-3099(16)00052-9
30. Lawitz E., Lalezari J.P., Hassanein T. et al. Sofosbuvir in combination with peginterferon alfa-2a and ribavirin for non-cirrhotic, treatment-naive patients with genotypes 1, 2, and 3 hepatitis C infection: a randomised, doubleblind, phase 2 trial. Lancet Infect. Dis. 2013; 13 (5): 401–408. PMID:23499158 DOI:10.1016/S1473-3099(13)70033-1
31. Lawitz E., Mangia A., Wyles D. et al. Sofosbuvir for Previously Untreated Chronic Hepatitis C Infection. N. Engl. J. Med. 2013; 368 (20): 1878–1887. PMID:23607594 DOI:10.1056/NEJMoa1214853
32. Zeuzem S., Dusheiko G.M., Salupere R. et al. Sofosbuvir and ribavirin in HCV genotypes 2 and 3. N. Engl. J. Med. 2014; 370 (21): 1993–2001. PMID:24795201 DOI:10.1056/NEJMoa1316145
33. Coilly A., Fougerou-Leurent C., De Ledinghen V. et al. Multicentre experience using daclatasvir and sofosbuvir to treat hepatitis C recurrence after liver transplantation – The CO23 ANRS CUPILT study. J. Hepatol. 2016; 65 (4): 711–718. PMID:27262758 DOI:10.1016/j.jhep.2016.05.039

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Гемодиализ, пересадка почки, 14 госпитализаций за 2 года и осторожная длительная терапия вирусных гепатитов
По материалам: Sustained eradication of hepatitis C virus by low-dose long-term interferon therapy in a renal transplant recipient with dual infection with hepatitis B and C viruses: a case report
Ming-Ling Chang, Ping-Chin Lai and Chau-Ting Yeh
Journal of Medical Case Reports20115:246
51‑летнему мужчине с терминальной стадией хронической почечной недостаточности, получавшему в течение 6 лет гемодиализ 3 раза в неделю, была проведена трансплантация почки. Еще на начальном этапе гемодиализа у него были выявлены поверхностные антигены вируса гепатита В (HBV), а через три года — антитела к вирусу гепатита С (HCV). В этот момент в крови: количество ДНК HBV — 4,1×10 6 копий/мл, количество РНК HCV — 5,9×10 5 копий/мл.
После трансплантации пациенту была назначена иммуносупрессивная терапия преднизолоном, микофенолата мофетилом, циклоспорином и такролимусом. В последующие два года после операции пациент 14 раз был госпитализирован в клинику по разным причинам, в том числе с цитомегаловирусной пневмонией, грибковой инфекцией мочевыводящих путей, лабиальным герпесом, острым кризом отторжения аллотрансплантата, туберкулезом легких, туберкулезным циститом, стриктурой уретры с обструктивной уропатией. Противотуберкулезную терапию проводили через год после трансплантации почки — в течение первых трех месяцев комбинацией препаратов изониазида, рифампицина и этамбутола, в фазе продолжения терапии еще на следующие семь месяцев был назначен изониазид.
Функциональные пробы печени (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин) в первый год после трансплантации были в норме, однако позже появилось умеренное повышение трансаминаз (1–3‑кратное). На этом фоне преднизолон отменили. Еще через год у пациента уровень трансаминаз превышал в 7 раз нормативные показатели, билирубин был 3–4 мг/дл (норма до 1 мг/дл), отмечалась желтуха. Количество ДНК HBV в сыворотке было ниже предела обнаружения ( 6 копий/мл (высокая вирусная нагрузка). Назначена монотерапия противовирусным препаратом рибавирином в дозе 200 мг/сут в первые 9 месяцев, а затем 200 мг через день в течение двух месяцев.
По завершении схемы лечения рибавирином выполнена биопсия печени, которая выявила у пациента хронический активный гепатит умеренной активности согласно индексу гистологической активности Knodell (перипортальный некроз — 3 балла из 10, внутридольковый некроз — 1 балл из 4, портальное воспаление — 3 балла из 4, фиброз — 3 балла из 4), а также жировой гепатоз. Кроме того, иммуногистохимически в биоптате печени обнаруживался HBs-антиген.
Пациенту назначен рибавирин повторно (200 мг/сут или через сут) и интерферон альфа-2b (3×10 6 ЕД подкожно 1–2 раза в неделю). Доза корригировалась с учетом состояния пациента и биохимических показателей его крови (рисунок 1) в течение 4 лет. Для профилактики реактивации HBV был назначен ламивудин (100 мг/сут), который пациент принимал в течение двух лет.
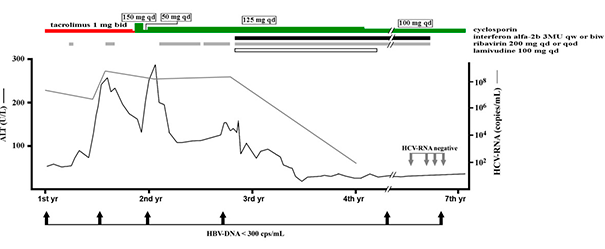
7th yr — с первого по седьмой год лечения;
серая линия и стрелки — количество РНК HCV (HCV RNA);
жирная линия и стрелки — количество ДНК HBV (HBV DNA);
красный отрезок — такролимус (tacrolimus);
зеленый отрезок — циклоспорин (tacrolimus);
черный отрезок — интерферон альфа 2b (interferon a-2b);
серый отрезок — рибавирин (ribavirin);
пустой отрезок — ламивудин (lamivudine)
В первые два года после описанного пика активности трансаминаз уровень АЛТ был в диапазоне 100–260 Ед/л, а затем постепенно стал снижаться. В конечной точке наблюдения активность АЛТ превышала норму не более чем в два раза. Состояние печени оценивалось как удовлетворительное: по данным эластометрии выявлялась только начальная стадия фиброза печени с умеренной жировой дистрофией. За год до окончания противовирусной терапии и уже после завершения курса, который в общей сложности длился почти 4 года, РНК HCV в сыворотке отсутствовала. Показатель количества ДНК HBV был ниже предела обнаружения еще на момент отмены преднизолона и в течение последующих шести лет наблюдения в крови пациента не выявлялся.
Обсуждение
Случаи коинфекции гепатита В (HBV) и гепатита С (HCV) представляют собой серьезную проблему в тех местах, где преобладает HBV. Прежде всего это касается Азиатского региона. Сочетанная инфекция HBV и HCV ускоряет прогрессирование поражения печени [3]. У пациентов, которым проводится трансплантация органов, из‑за необходимости назначения иммуносупрессивной терапии очень сложно контролировать состояние печени. При трансплантации печени пациентам с носительством HBV рекомендован длительный курс ламивудина для предупреждения реактивации инфекции [4]. Для реципиентов трансплантата почки подобная тактика в литературе не описана.
Сочетанное HBV- и HCV-инфицирование пациентов и взаимное влияние этих вирусов друг на друга наблюдалось ранее несколькими авторами [2, 3]. Так, описан случай снижения активности HBV при HCV-коинфекции у пациентов с трансплантированной почкой [3]. В приведенном клиническом случае изначально пациент был с высокой вирусной нагрузкой HBV (ДНК HBV до 4,1×10 6 копий/мл), но количество ДНК HBV стало ниже предела обнаружения на фоне активации HCV. Можно предположить, что подавление репликации HCV с помощью противовирусной терапии могло бы послужить триггером для реактивации HBV. В связи с этим было принято решение назначить пациенту ламивудин, который используется в лечении вируса гепатита В.
Несмотря на то что комбинированная терапия рибавирином и интерфероном — это стандарт лечения хронического HCV, общепринятой тактики, которая была бы эффективна в посттрансплантационном периоде до сих пор не разработано [1]. В описываемом клиническом случае биопсия печени, выполненная до начала противовирусной терапии, выявила наличие фиброза и признаки воспаления и некроза. При отсутствии должного лечения данное состояние могло трансформироваться в цирроз печени или привести к развитию гепатоцеллюлярной карциномы [5].
У пациента был диагностирован HCV генотипа 2а, который успешно лечится [6, 7]. Ранее были описаны случаи ведения HCV-больных с трансплантированной почкой. Режимы терапии были различны — монотерапия рибавирином, комбинированная терапия рибавирином и амантадином [7], интерферон в сочетании с рибавирином [2, 8], а также монотерапия препаратами интерферона [9]. Как оказалось, сочетание рибавирина и амантадина по эффективности не превосходило режим монотерапии рибавирином. Обе схемы лечения сопровождались нормализацией биохимических показателей, однако не снижали вирусную нагрузку у пациентов [2]. Ежедневные внутривенные инъекции препаратов интерферона бета в течение 6 недель приводили к снижению количества маркеров репликации HCV у реципиентов почки при условии хорошего функционального резерва трансплантированного органа [9].
Режим терапии низкими дозами интерферона альфа в комбинации с рибавирином может быть достаточно эффективным уже через полгода после начала лечения, но, к сожалению, плохо переносится большей частью пациентов и нередко приводит к дисфункциям трансплантата [2]. Схема лечения ультранизкими дозами интерферона альфа (1×10 6 ЕД подкожно 3 раза в неделю) и рибавирином (600 мг/сут) в течение 48 недель позволила добиться серонегативных результатов у 5 из 11 пациентов с HCV. Однако на фоне такой терапии у одного пациента развилось острое отторжение трансплантата и у двух пациентов — сепсис [8]. Как показывает опыт, комбинированная терапия интерфероном и рибавирином приводит к элиминации HCV-инфекции, однако дозы препаратов необходимо подбирать индивидуально для предупреждения реакции отторжения трансплантата. С другой стороны, недавно проведенные исследования свидетельствуют о том, что HCV-пациентам с устойчивой вирусной нагрузкой можно назначать длительный курс низких доз препаратов интерферона в качестве поддерживающей терапии, не забывая при этом о дополнительных мерах для поддержания почечной функции [10, 11].
За этот период не произошло реакции отторжения трансплантата, а также не было зафиксировано выраженных эпизодов присоединения каких‑либо инфекций. Важно отметить, что к концу терапии удалось подавить активность HCV, и до настоящего времени реактивации вируса не наблюдалось. Врачами был выбран препарат интерферона альфа, а не пегилированный интерферон, поскольку последний имеет более длительный период полувыведения и, следовательно, высока вероятность спровоцировать отторжение трансплантата. После окончания терапии у пациента уровень активности АЛТ оставался умеренно повышенным. Учитывая, что ДНК HBV и РНК HCV в сыворотке отсутствовали, высокий уровень трансаминаз был скорее связан с жировыми изменениями в печени пациента, а не с вирусом.
Заключение
Терапия низкими дозами препаратов интерферона может быть эффективной в лечении HCV у пациентов с коинфекцией HBV и HCV, перенесших трансплантацию почки.
Публикация клинического случая и сопутствующие иллюстрации осуществлялись с одобрения пациента. Копия подписанного информированного согласия находится у главного редактора журнала Journal of medical case reports.
- Terrault NA, Adey DB: The kidney transplant recipient with hepatitis C infection: pre- and posttransplantation treatment. Clin J Am Soc Nephrol 2007, 2:563–575.
- Sharma RK, Bansal SB, Gupta A, Gulati S, Kumar A, Prasad N: Chronic hepatitis C virus infection in renal transplant: treatment and outcome. Clin Transplant 2006, 20:677–683.
- Yen TH, Huang CC, Lin HH, Huang JY, Tian YC, Yang CW, Wu MS, Fang JT, Yu CC, Chiang YJ, Chu SH: Does hepatitis C virus affect the reactivation of hepatitis B virus following renal transplantation? Nephrol Dial Transplant 2006, 21:1046–1052.
- Freshwater DA, Dudley T, Cane P, Mutimer DJ: Viral persistence after liver transplantation for hepatitis B virus: a cross-sectional study. Transplantation 2008, 85:1105–1111.
- El-Serag HB: Hepatocellular carcinoma and hepatitis C in the United States. Hepatology 2002, 36 (5 Suppl 1):S74‑S83.
- Matthews-Greer JM, Caldito GC, Adley SD, Willis R, Mire AC, Jamison RM, McRae KL, King JW, Chang WL: Comparison of hepatitis C viral loads in patients with or without human immunodeficiency virus. Clin Diagn Lab Immunol 2001, 8:690–694.
- Bräu N: Treatment of chronic hepatitis C in human immunodeficiency virus/hepatitis C virus-coinfected patients in the era of pegylated interferon and ribavirin. Semin Liver Dis 2005, 25:33–51.
- Shu KH, Lan JL, Wu MJ, Cheng CH, Chen CH, Lee WC, Chang HR, Lian JD: Ultralow-dose α-interferon plus ribavirin for the treatment of active hepatitis C in renal transplant recipients. Transplantation 2004, 77:1894–1896.
- Konishi I, Horiike N, Michitaka K, Ochi N, Furukawa S, Minami H, Onji M: Renal transplant recipient with chronic hepatitis C who obtained sustained viral response after interferon-β therapy. Intern Med 2004, 43:931–934.
- Shiffman ML, Hofmann CM, Contos MJ, Luketic VA, Sanyal AJ, Sterling RK, Ferreira-Gonzalez A, Mills AS, Garret C: A randomized, controlled trial of maintenance interferon therapy for patients with chronic hepatitis C virus and persistent viremia. Gastroenterology 1999, 117:1164–1172.
- Alric L, Duffaut M, Selves J, Sandre K, Mularczyck M, Izopet J, Desmorat H, Bureau C, Chaouche N, Dalbergue B, Vinel JP: Maintenance therapy with gradual reduction of the interferon dose over one year improves histological response in patients with chronic hepatitis C with biochemical response: results of a randomized trial. J Hepatol 2001, 35:272–278.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Читайте также:


