Токсоплазмоз при гепатите с
Исследование для выявления возбудителя токсоплазмоза (Toxoplasma gondii), в ходе которого с помощью метода полимеразной цепной реакции определяется генетический материал (ДНК) токсоплазмы в образце крови.
Токсоплазма гондии – одноклеточный паразит, который обнаруживается в земле и в организме некоторых животных. Он способен вызывать инфекционное заболевание токсоплазмоз. Токсоплазма очень распространена во всём мире, инфицированность населения в некоторых странах составляет 95 %. Этот паразит способен поражать млекопитающих, грызунов и птиц.
Путь инфицирования обычно пероральный. Микроорганизм может попасть в организм человека с водой и едой, заражённой паразитами, чаще всего при употреблении в пищу сырого или недостаточно термически обработанного мяса, а также при очистке кошачьего туалета инфицированного животного и при несоблюдении личной гигиены. Возможна также передача инфекции от матери к ребенку и при переливании крови либо пересадке донорских органов.
Жизненный цикл микроорганизма проходит со сменой хозяев. Домашний кот – окончательный хозяин – заражается при поедании грызунов и птиц. В кишечнике котов токсоплазма делится и формирует ооцисты. При активной инфекции миллионы микроскопических ооцист в течение нескольких недель выделяются с кошачьими экскрементами. Ооцисты становятся заразными через пару дней и сохраняют жизнеспособность месяцами. В организме других хозяев, в том числе и людей, они проходят ограниченный период жизненного цикла и формируют неактивные цисты в мышцах, головном мозге и глазах. Иммунная система организма хозяина способна сохранять цисты в покоящемся состоянии и защищать от развития инфекции. "Стадия покоя" может длиться всю жизнь хозяина, пока не возникнет иммунодефицит.
У большинства здоровых людей инфекция может протекать бессимптомно или под видом легкой простуды. По некоторым научным данным, токсоплазменная инфекция играет роль в развитии психических заболеваний, таких как шизофрения, психозы. При токсоплазменном поражении органов зрения возникает хориоретинит.
У пациентов с ослабленной иммунной системой активная инфекция может протекать достаточно тяжело и вызывать осложнения. Это пациенты с ВИЧ, первичными иммунодефицитами, больные, проходящие химиотерапию или иммуносупресивную терапию после трансплантации органов.
Симптомытоксоплазмоза: длительная лихорадка, головная боль, увеличение лимфатических узлов, боль в мышцах, увеличение печени, гепатит. Внутриутробное инфицирование может приводить к слепоте, энцефаломиелиту, задержке роста и даже к гибели новорождённых. У пациентов с иммунодефицитами инфекция вызывает энцефалит (воспаление головного мозга с нарушением сознания, головной болью, лихорадкой и локальными неврологическими дефектами).
Ранняя диагностика играет решающую роль в эффективности лечения. Уничтожение паразита при хронической инфекции трудноосуществимо.
При инфицировании во время беременности риск передачи инфекции плоду составляет 30-40 %. Заражение в ранние сроки опасно выкидышем, мертворождением или серьезным неврологическим нарушением у новорождённого. У большинства детей, инфицированных в поздние сроки беременности, симптомы токсоплазмоза проявляются только через несколько лет после рождения: потеря слуха, серьезная инфекция глаз и неврологический дефицит.
Токсоплазмоз является одной из так называемых TORCH-инфекций (TORCH – по первым буквам латинских названий инфекций: токсоплазма, краснуха, цитомегаловирус, герпес), являющихся опасными для плода.
Для чего используется анализ?
- Для определения активности токсоплазмоза у беременных.
- Чтобы оценить риск заражения плода при беременности.
- Для исследования токсоплазмозной инфекции у пациентов с иммунодефицитами.
- Для дифференциальной диагностики заболеваний, протекающих с лихорадкой, энцефалитом и поражением органов зрения.
Когда назначается анализ?
- При подозрении на токсоплазмоз у беременных и пациентов с патологией иммунной системы.
- При планировании беременности (в целях профилактики заражения плода).
- При положительных результатах теста на антитела к токсоплазмам.
- При обследовании детей, родившихся от матерей, больных токсоплазмозом.
- При обследовании на токсоплазмоз необходим комплексный подход врача с учетом уровня антител IgG и IgM для выявления первичного заражения или вероятной хронизации инфекционного процесса.
- Результаты ПЦР-диагностики являются основным критерием активности токсоплазмозной инфекции, но не могут подтвердить отсутствие токсоплазм в организме.
Токсоплазмоз — широко распространенное инфекционное заболевание человека и животных, характеризующееся длительным хроническим течением, полиморфностью клинической картины (от бессимптомного носительства до летальных форм болезни) и возможностью внутриутробного инфицирования плода.
Возбудитель токсоплазмоза — Toxoplasma gondii — внутриклеточный паразит, размером 4—7 мкм. Если взглянуть на этот живой организм под микроскопом, он напоминает дольку апельсина (рис.1).
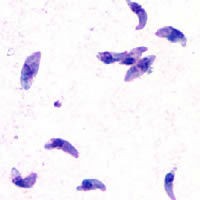
Рис. 1 Toxoplasma gondii –окрашенный препарат по Романовского-Гимзе
Можно ли заразиться токсоплазмозом от домашних животных? Да, ведь токсоплазмозом болеют около 60 видов птиц и 300 видов млекопитающих (одомашненных и диких), которые с фекалиями попадают во внешнюю среду выделяют цисты и приводят к заражению других организмов.
Но имея сложный путь развития (половой и бесполый) и тот факт, что половой процесс происходит только лишь в кишечнике животных семейства кошачьих, с образованием устойчивых форм (цист), которые долгое время сохраняются во внешней среде (до 2 лет), не боятся действия низких и высоких температур, высушивания. Бесполое размножение не приводит к образованию стойких форм паразита.
Источником инфекции выступают больные животные, которые выделяют паразитов со слюной, молоком, мочой, фекалиями. Люди лишь промежуточные хозяева этого простейшего.
Заражение возбудителем токсоплазмоза происходит:
- при употреблении в пищу сырого или плохо прожаренного мяса;
- при контакте с сырым или недостаточно термически обработанным мясом слизистой оболочки полости рта (многие хозяйки пробуют сырой фарш);
- при уходе за зараженными животными, например, уборка кошачьего туалета;
- при употреблении в пищу немытых овощей, фруктов, зелени, на которых могут быть цисты паразита;
- при пересадке внутренних органов или переливание крови.
В подавляющем большинстве случаев при токсоплазмозе наблюдается бессимптомное носительство паразита, сопровождающееся наличием специфических антител в крови. Инфицированность населения колеблется от 10 до 90%.
Клинические симптомы токсоплазмоза у человека отличаются разнообразием. Выделяют врожденный и приобретенный токсоплазмоз.
Врожденный токсоплазмоз протекает тяжелее всего. При заражении на ранних сроках беременности происходит внутриутробная гибель плода, так как у него формируются уродства, которые несовместимы с жизнью. Если инфицирование наступает во второй половине беременности, ребенок рождается с генерализованным поражением всех органов и систем. Для него характерны повышение температуры тела, желтушность кожи, слабость, низкий тонус мышц, увеличение печени, лимфатических узлов, селезенки, кожная сыпь, патологии нервной системы (энцефаломиелит). Также возможно развитие косоглазия, слепоты, нарушение формирования головного или спинного мозга.
Токсоплазмоз входит в группу TORCH- инфекций, считающихся потенциально опасными для внутриутробного развития плода. Только первичное заражение женщины во время беременности может привести к инфицированию плода. Таким образом, практически важным является вопрос о моменте инфицирования беременной: задолго до, непосредственно перед, либо во время беременности.
При попадании токсоплазм в организм человека через 7—14 дней начинается первичный гуморальный иммунный ответ — продуцируются специфические IgM. Максимальный уровень их концентрации достигается к 20— 30-му дню от момента инфицирования. Полное их исчезновение в большинстве случаев (около 70%) происходит в течение 3—4 месяцев, однако, возможно присутствие специфических IgM и более длительное время — до 1 года и более (около 10% случаев). Следовательно, присутствие в крови специфических IgM предполагает, но не доказывает свежее инфицирование, поскольку они могут находиться в крови от 3 мес. до 1,5 лет. Дифференцировать первичную инфекцию от паст-инфекции помогает комплексный подход к диагностике — это сопоставление данных всего спектра серологических маркеров инфекции, а именно:
- результатов выявления специфических IgM, IgA;
- определения индекса авидности IgG и концентрации IgG в динамике.
Анализ серологического профиля пациента позволяет определить вероятный срок инфицирования T.gondii.
В случае отрицательного результата беременные относятся к группе риска по инфицированию Toxoplasma gondii во время беременности и каждые 1—2 месяца должны обследоваться на токсоплазмоз. В случае положительного результата иммуноферментного анализа на поздние специфические антитела IgG у беременных важно определить срок инфицирования.
Приобретенный токсоплазмоз у человека чаще всего имеет латентное течение. Инкубационный период длится от 5 до 23 дней. Больные жалуются на высокую температуру тела, озноб, слабость, головные боли, болезненные ощущения в суставах и мышцах, увеличение печени, селезенки, шейных лимфатических узлов. Возможно развитие пневмонии, энцефалита, эндокардита, поражения глаз.
Течение хронического токсоплазмоза бессимптомное или характеризуется незначительными клиническими проявлениями на протяжении многих лет. Наиболее распространенные симптомы этой формы болезни:
- повышение температуры до субфебрильных цифр;
- слабость, которая возникает даже после сна, ухудшение памяти, апатия к окружающему миру, раздражительность;
- тупые головные боли;
- болезненные ощущения в мышцах и суставах, затруднение передвижения;
- увеличение в размерах селезенки, печени и лимфатических узлов;
- при поражении желудочно-кишечного тракта: тупые боли в животе, сухость во рту, снижение аппетита, метеоризм;
- патологии сердечно - сосудистой системы, которые сопровождаются снижением артериального давления, давящими болями в сердце и изменениями его ритма;
- нарушения эндокринной системы: болезни поджелудочной железы, сбои менструального цикла, импотенция;
- расстройства зрения, близорукость.
В то же время возможны и клинически выраженные варианты течения первичной инфекции (как правило, возникающие у лиц с нарушением иммунитета) с развитием энцефалита, миокардита, миозита, увеита, формированием хронической инфекции.
Весьма актуальна проблема генерализации латентного токсоплазмоза у ВИЧ-инфицированных с развитием тяжелого некротического энцефалита с большой вероятностью летального исхода.
Среди возможных осложнений токсоплазмоза выделяют: инфекционно-токсический шок, поражения центральной нервной системы (энцефалит, арахноидит, отек мозга, эпилептиформный синдром, параличи, парезы, отставание детей в развитии), болезни глаз (атрофия зрительного нерва), патологии сердца (эндокардит), недуги дыхательных органов (пневмония).
Так как клинические симптомы недуга очень разнообразны, диагностика токсоплазмоза на основании жалоб больного невозможна. Следует обязательно собрать эпидемиологический анамнез, выяснить, употреблял ли больной сырое иди недостаточно прожаренное мясо, контактировал ли с больными животными (в особенности кошками).
В лабораторной диагностике токсоплазмоза широко используются иммунологические методы, которые выявляют антитела к токсоплазмозу. Наиболее распространенным среди них является иммуноферментный анализ. Для его проведения у человека берут кровь на токсоплазмоз. Также можно применять и другие биологические жидкости. На основании выявления антител двух разных классов данное исследование позволяет судить о давности заражения, так как иммуноглобулины класса M появляются сразу после инфицирования и в течение года после него, а иммуноглобулины класса G сохраняются в крови на всю последующую жизнь.
Можно ли вылечить токсоплазмоз? У здоровых людей болезнь заканчивается полным выздоровлением с формированием иммунитета на всю дальнейшую жизнь и не имеет каких-либо последствий. Тяжелые поражения разных органов и систем при токсоплазмозе развиваются у людей с дефектами иммунитета, например, ВИЧ-инфицированных. Последствия токсоплазмоза особенно тяжелые при врожденной форме болезни. Она приводит к внутриутробной гибели плода или наличию у него выраженных патологий.
Профилактика токсоплазмоза также включает следующие мероприятия:
- тщательное мытье фруктов, овощей и зелени;
- употребление в пищу достаточно термически обработанных мясных блюд;
- мытье рук после земельных работ и ухода за животными;
- в период беременности следует избегать контакта с кошками;
- уничтожение мух, тараканов и грызунов, которые могут переносить цисты паразитов.
С целью предупреждения врожденного токсоплазмоза необходимо проводить обследование с определением уровня антител в крови всем женщинам, которые планируют беременность.
ПОЛУЧЕНИЕ РЕЗУЛЬТАТОВ
АНАЛИЗОВ ОНЛАЙН
Теперь вы можете получить результаты
анализов не выходя из дома на нашем сайте!
Доступно каждому!
Подарочные сертификаты
Новости, статьи, полезная информация
Расширение возможностей в лечении и профилактике инфекционных заболеваний нуждается в быстрой и точной диагностике. Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические (профилактические) мероприятия. Установление первичного инфицирования возбудителями внутриутробных инфекций играет существенную роль в предотвращении врожденных патологий.
Традиционные иммунодиагностические методы, используемые для серологической диагностики острой фазы вирусных, бактериальных и паразитарных инфекций, имеют ряд ограничений. Часто невозможно провести четкую дифференциацию между первичной инфекцией, реинфекцией или обострением инфекционного процесса, особенно при серодиагностике инфекций с нетипичной динамикой антителообразования, когда наличие иммуноглобулинов класса М (IgM) не является достоверным и достаточным признаком для дифференциации стадий заболевания.
Определение IgM, как показателя первичной инфекции, в ряде случаев утратило свое значение, так как было доказано, что их можно выявить в сыворотке периферической крови спустя месяцы или даже годы после наступления сероконверсии (так называемые хронические IgM). Кроме того, выявление IgM может дать ложнопозитивные результаты. Например, вследствие вторичной инфекции (экзогенная реинфекция или эндогенная реактивация инфекции). Было показано, что специфические IgA также могут присутствовать в сыворотке периферической крови через 2-3,5 года с момента зарегистрированной сероконверсии.
Серологическая диагностика, основанная на определении титра специфических иммуноглобулинов класса G (IgG) может быть полезной при дифференциации активного периода болезни от перенесенной в прошлом и уже неактивной инфекции. Однако этот метод имеет ряд ограничений: не позволяет дифференцировать первичную и реинфекцию; у пациентов с реактивацией хронического процесса не всегда наблюдается достоверный рост уровня IgG; метод экономически невыгоден.
Для того, чтобы установить точный момент инфицирования и разграничивать первичную, реинфекцию или реактивацию инфекционного процесса, был предложен тест на определение авидности IgG антител.
Различают два понятия: аффинность антител (или аффинитет) и авидность (или авидитет).
Аффинность — это степень специфического сродства активного центра к антигенной детерминанте. Авидностью антител или функциональной аффиностью называется прочность связи между антителом и антигеном. Величина авидности зависит от аффиности специфических антител (выше аффиность — выше авидность) и количества связывающих центров. Первичный иммунный ответ на ранее не встречаемые организмом антигены начинается с продукции иммуноглобулинов класса М. Специфические IgG появляются позже. При первичном иммунном ответе они сменяют ранние антитела IgM и накапливаются в организме в больших количествах.
Под воздействием антигена происходит процесс отбора и стимуляции В-клеток, что приводит к увеличению аффинности IgG антител, низкой после первого контакта с антигеном и возрастающей в течение последующих недель или месяцев (от 1 до 7).
Уровень авидности пропорционален дозе и природе антигена, а также индивидуальному уровню соматических мутаций. Низкие дозы антигена приводят к более быстрому возрастанию авидности, а высокие дозы — к более медленному. Таким образом, низкоавидные антитела продуцируются в течение первой стадии инфекции, когда содержание антигенов обычно высокое.
С возрастом эффективность селекции специфических антител падает, а следовательно процесс созревания антител замедляется, этим объясняется меньшая устойчивость к инфекциям лиц старше 60-65 лет и неэффективность вакцинации в этом возрасте. Выявление в испытуемой сыворотке антител с индексом авидности ниже 15-50% (у разных производителей и разных возбудителей этот показатель разный и указывается в бланке исследования) указывает на свежую первичную инфекцию. Показатель авидности. равный или превышающий 50%, свидетельствует о наличии в сыворотке высокоавидных антител — маркеров перенесенной в прошлом инфекции или персистирующей инфекции. Показатель авидности антител в интервале 31-49% может свидетельствовать о поздней стадии первичной инфекции или недавно перенесенной инфекции только при условии выявления антител в высокой концентрации. Интерпретацию результатов определения индекса авидности необходимо проводить в соответствии с рекомендациями фирмы — производителя, так как величина ИА для одной и той же стадии заболевания может колебаться в широких пределах.
Если в исследуемой сыворотке крови при наличии или отсутствии IgM обнаруживаются IgG с низкой авидностью, то это свидетельствует о первичной (недавней) инфекции. Наличие же высокоавидных антител IgG говорит о вторичном иммунном ответе в случае попадания возбудителя в организм или обострения (реактивации).
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ОПРЕДЕЛЕНИЯ НИЗКОАВИДНЫХ АНТИТЕЛ
Применение метода определения авидности антител представляет интерес при диагностике инфекций.
Краснуха обладает бесспорным тератогенным действием, т.е. приводит к формированию пороков развития эмбриона и плода. У беременных краснуха может протекать тяжело, легко и бессимптомно. Внутриутробное заражение плода возможно при любой форме краснушной инфекции. Распознавание инфекции, особенно в период вспышек, больших затруднений не вызывает.
Однако для точной диагностики необходимо выделение вируса, которое технически не всегда выполнимо. Лабораторная диагностика обычно заключается в определении IgG и IgM антител, в основном у беременных, так как риск рождения неполноценного или мертвого ребенка у инфицированной матери очень высок и обычно рекомендуется прерывание беременности. Однако диагностика, основанная на определении антител, может давать ложноположительные и ложноотрицательные результаты. Так, при повторной инфекции у вакцинированных, которая может произойти в случаях низкого иммунного ответа при вакцинации, или может быть вызвана мутантными штаммами вируса, IgM антитела не образуются, возрастание титров IgG антител также наблюдается не всегда. У новорожденных с первичной инфекцией вследствие внутриутробного инфицирования, IgM антитела могут не синтезироваться в силу ряда причин:
незрелость иммунной системы; блокирование вирусного антигена материнскими антителами; инфицирование на поздних стадиях беременности; иммунная толерантность. Если происходит стимуляция клонов лимфоцитов вируса краснухи, может возникать ложноположительный антительный ответ, особенно для антител класса IgM. Было показано, что IgM антитела могут персистировать в течение года или возникать в случаях реинфекции, особенно у иммунодепрессивных пациентов. Кроме того, могут возникать ложноположительные результаты вследствие наличия ревматоидного фактора или подобных соединений, даже в ловушечном варианте теста. Только определение низкоавидных антител может быть диагностическим маркером первичной инфекции вирусом краснухи, что особенно важно при диагностическом обследовании беременных, когда необходимо дифференцировать первичную инфекцию от вторичной или реактивации инфекции.
Токсоплазмоз. Известно, что проявление клинических симптомов при приобретенном токсоплазмозе имеет низкое диагностическое значение для точного определения длительности инфекционного процесса.
Увеличение лимфоузлов может возникать в разное время с момента первичной инфекции, а нередко может сохраняться длительное время или даже возобновляться в более поздний период болезни, независимо от применения специфического противопаразитарного лечения.
До настоящего времени единственными доступными серологическими тестами для определения острой фазы токсоплазмоза являлись определение IgM антител и определение IgG антител в возрастающих титрах в двух или трех образцах сывороток, что, однако, приводит к задержке постановки диагноза. Кроме того, у пациентов с реактивацией хронического токсоплазмоза значительный рост уровня антител IgG отмечается не всегда, особенно это касается детей и подростков с поражением глаз при врожденном токсоплазмозе.
Интерпретация результатов исследований других иммуноглобулинов также вызывает затруднения. Основной недостаток определения IgM антител — длительная персистенция в крови, в связи с чем возникают трудности в установлении окончания острой фазы заболевания. У 40% пациентов IgM антитела выявляются в течение года с момента заражения при использовании ИФА, у 60% — при использовании высокочувствительного метода иммуноадсорбции. Также как IgM, специфические IgA присутствовали в сыворотке периферической крови через 45 месяцев с момента зарегистрированной сероконверсии, в течение 2-летнего периода серологического наблюдения и через 8 месяцев с момента появления признаков лимфоаденопатии. С другой стороны, у определенных категорий пациентов, например у детей, IgM антитела вообще не образуются.
Определение авидности IgG антител является высокоспецифичным и чувствительным методом диагностики острого первичного токсоплазмоза, что особенно важно при обследовании беременных для устранения потенциального риска появления врожденного токсоплазмоза у детей.
Недавно была разработана методика измерения антигенсвязывающей авидности (функциональной аффинности) IgG антител к Toxoplasma gondii, позволяющая разделить низкоаффинные антитела от высокоаффинных, которые указывают на перенесенную в прошлом инфекцию. С помощью этой методики первичная инфекция может быть идентифицирована с использованием единственной порции сыворотки.
Инфекции, вызываемые вирусом простого герпеса. Частота инфицирования новорожденных у женщин субклинической формой простого герпеса составляет 3-5% при хронической инфекции и доходит до 30-50% при заражении во время беременности (первичная инфекция). Инфекции, вызываемые вирусами простого герпеса, цитомегаловирусом относятся к инфекциям с нетипичной динамикой антителообразования (когда наличие IgM не является достоверным и достаточным признаком для дифференциации стадий заболевания). Определение IgM антител может давать ложноотрицательные результаты, поскольку они могут вообще не образовываться, или присутствовать в количествах, трудных для определения.
Ложноположительные результаты могут возникать по следующим причинам: длительная персистенция IgM антител или их присутствие может быть не связано с инфекцией; IgM антитела могут определяться при реактивации инфекции или при вторичной инфекции, например, вирусом иммунодефицита человека; различные вирусы могут иметь общие эпитопы (например, вирус простого герпеса и вирус варицелла-зостер), что приводит к возникновению перекрестных реакций. Диагностика активной фазы инфекции по 4-кратному возрастанию титра IgG также может вызывать затруднения, поскольку титр IgG антител может увеличиваться достаточно быстро (в течение 1-2 суток) после проявления симптомов заболевания.
Таким образом, определение серологических маркеров этих инфекциях не может служить специфичным тестом для дифференциации между первичной инфекцией и реактивацией. Заражение вирусом простого герпеса (ВПГ) ведет к пожизненной персистенции с возможностью реактивации вируса и перекрестного заражения другим серотипом ВПГ. Преобладание хронических и бессимптомных форм течения болезни, а также возможность атипичных проявлений ставит под сомнение диагностику по внешним признакам. Приблизительно 20% больных ВПГ-2 не имеют симптомов вообще, а 60% лиц имеют признаки, которые невозможно диагностировать и которые не принимаются врачом и самими больными за герпес (нетипичные проявления). Обе эти группы имеют риск заразить своих партнеров. Специфические IgM не могут быть использованы в качестве достоверного маркера для диагностики острой и, особенно, первичной инфекции, так как IgM к ВПГ могут образовываться как при первичном инфицировании, так и при реинфекции и реактивации вируса, но в то же время они способны вырабатываться в достаточном для диагностики количестве только у 30% людей.
Единственным способом, позволяющим сразу и достоверно диагностировать первичную инфекцию, является определение индекса авидности специфических антител.
Цитомегаловирусная инфекция (ЦМВИ) — самая распространенная внутриутробная инфекция и одна из наиболее частых причин невынашивания беременности. Риск внутриутробного инфицирования и характер поражения плода зависят от наличия антител у матери и срока инфицирования плода. При первичном инфицировании серонегативной беременной риск передачи плоду составляет примерно 50%.
Диагностика первичной ЦМВИ обычно основывается на определении сероконверсии, наличия высокого титра специфичных IgM или четырехкратного возрастания титра специфических IgG. В связи с тем, что момент сероконверсии и возрастание титров IgG диагностировать достаточно трудно, IgM антитела являются наиболее часто используемым маркером для диагностики острой инфекции. Однако у некоторых больных IgM антитела сохраняются длительное время, что приводит к гипердиагностике острой инфекции.
Определение авидности антител IgG рассматривается как наиболее важный серологический маркер, поскольку низко- и высокоавидные антитела IgG доминируют соответственно при недавней или длительно текущей инфекции.
Использование теста на авидность IgG при позитивной реакции на IgM антитела помогает подтвердить или исключить наличие первичной ЦМВИ и в ряде случаев помогает избежать необоснованных инвазивных процедур.
Вирусный гепатит С. Лабораторная диагностика гепатита С (ВГС) основана на выявлении специфических маркеров инфицирования (IgM и IgG антитела к ВГС, РНК ВГС). lgM-ответ в острой фазе гепатита С не следует классическому пути антителообразования: IgM анти-HCV могут выявляться одновременно и даже позднее, чем анти-ВГС класса IgG. Поэтому обнаружение IgM анти-ВГС не может быть использовано как маркер острой HCV-инфекции. Вместе с тем, длительность циркуляции антикор-lgM (3-5 месяцев) является фактором, прогнозирующим персистентную инфекцию, а их появление при хроническом гепатите С свидетельствует о реактивации вируса, т.е. об обострении процесса. Единственным достоверным фактором подтверждения первичной инфекции ВГС является сероконверсия.
Индекс авидности IgG при первичной ВГС инфекции имеет низкие значения и возрастает с течением времени, что подтверждает целесообразность использования определения авидности IgG антител для дифференциальной диагностики первичной инфекции от хронической или перенесенного гепатита С.
Сдавайте анализы постоянно в одной и той же лаборатории – и вашему врачу будут примерно известны Ваши личные показатели нормы и любое отклонение от нормы будет сразу им замечено.
ПОЛУЧЕНИЕ РЕЗУЛЬТАТОВ
АНАЛИЗОВ ОНЛАЙН
Теперь вы можете получить результаты
анализов не выходя из дома на нашем сайте!
Доступно каждому!
Подарочные сертификаты
Новости, статьи, полезная информация
Расширение возможностей в лечении и профилактике инфекционных заболеваний нуждается в быстрой и точной диагностике. Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические (профилактические) мероприятия. Установление первичного инфицирования возбудителями внутриутробных инфекций играет существенную роль в предотвращении врожденных патологий.
Традиционные иммунодиагностические методы, используемые для серологической диагностики острой фазы вирусных, бактериальных и паразитарных инфекций, имеют ряд ограничений. Часто невозможно провести четкую дифференциацию между первичной инфекцией, реинфекцией или обострением инфекционного процесса, особенно при серодиагностике инфекций с нетипичной динамикой антителообразования, когда наличие иммуноглобулинов класса М (IgM) не является достоверным и достаточным признаком для дифференциации стадий заболевания.
Определение IgM, как показателя первичной инфекции, в ряде случаев утратило свое значение, так как было доказано, что их можно выявить в сыворотке периферической крови спустя месяцы или даже годы после наступления сероконверсии (так называемые хронические IgM). Кроме того, выявление IgM может дать ложнопозитивные результаты. Например, вследствие вторичной инфекции (экзогенная реинфекция или эндогенная реактивация инфекции). Было показано, что специфические IgA также могут присутствовать в сыворотке периферической крови через 2-3,5 года с момента зарегистрированной сероконверсии.
Серологическая диагностика, основанная на определении титра специфических иммуноглобулинов класса G (IgG) может быть полезной при дифференциации активного периода болезни от перенесенной в прошлом и уже неактивной инфекции. Однако этот метод имеет ряд ограничений: не позволяет дифференцировать первичную и реинфекцию; у пациентов с реактивацией хронического процесса не всегда наблюдается достоверный рост уровня IgG; метод экономически невыгоден.
Для того, чтобы установить точный момент инфицирования и разграничивать первичную, реинфекцию или реактивацию инфекционного процесса, был предложен тест на определение авидности IgG антител.
Различают два понятия: аффинность антител (или аффинитет) и авидность (или авидитет).
Аффинность — это степень специфического сродства активного центра к антигенной детерминанте. Авидностью антител или функциональной аффиностью называется прочность связи между антителом и антигеном. Величина авидности зависит от аффиности специфических антител (выше аффиность — выше авидность) и количества связывающих центров. Первичный иммунный ответ на ранее не встречаемые организмом антигены начинается с продукции иммуноглобулинов класса М. Специфические IgG появляются позже. При первичном иммунном ответе они сменяют ранние антитела IgM и накапливаются в организме в больших количествах.
Под воздействием антигена происходит процесс отбора и стимуляции В-клеток, что приводит к увеличению аффинности IgG антител, низкой после первого контакта с антигеном и возрастающей в течение последующих недель или месяцев (от 1 до 7).
Уровень авидности пропорционален дозе и природе антигена, а также индивидуальному уровню соматических мутаций. Низкие дозы антигена приводят к более быстрому возрастанию авидности, а высокие дозы — к более медленному. Таким образом, низкоавидные антитела продуцируются в течение первой стадии инфекции, когда содержание антигенов обычно высокое.
С возрастом эффективность селекции специфических антител падает, а следовательно процесс созревания антител замедляется, этим объясняется меньшая устойчивость к инфекциям лиц старше 60-65 лет и неэффективность вакцинации в этом возрасте. Выявление в испытуемой сыворотке антител с индексом авидности ниже 15-50% (у разных производителей и разных возбудителей этот показатель разный и указывается в бланке исследования) указывает на свежую первичную инфекцию. Показатель авидности. равный или превышающий 50%, свидетельствует о наличии в сыворотке высокоавидных антител — маркеров перенесенной в прошлом инфекции или персистирующей инфекции. Показатель авидности антител в интервале 31-49% может свидетельствовать о поздней стадии первичной инфекции или недавно перенесенной инфекции только при условии выявления антител в высокой концентрации. Интерпретацию результатов определения индекса авидности необходимо проводить в соответствии с рекомендациями фирмы — производителя, так как величина ИА для одной и той же стадии заболевания может колебаться в широких пределах.
Если в исследуемой сыворотке крови при наличии или отсутствии IgM обнаруживаются IgG с низкой авидностью, то это свидетельствует о первичной (недавней) инфекции. Наличие же высокоавидных антител IgG говорит о вторичном иммунном ответе в случае попадания возбудителя в организм или обострения (реактивации).
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ОПРЕДЕЛЕНИЯ НИЗКОАВИДНЫХ АНТИТЕЛ
Применение метода определения авидности антител представляет интерес при диагностике инфекций.
Краснуха обладает бесспорным тератогенным действием, т.е. приводит к формированию пороков развития эмбриона и плода. У беременных краснуха может протекать тяжело, легко и бессимптомно. Внутриутробное заражение плода возможно при любой форме краснушной инфекции. Распознавание инфекции, особенно в период вспышек, больших затруднений не вызывает.
Однако для точной диагностики необходимо выделение вируса, которое технически не всегда выполнимо. Лабораторная диагностика обычно заключается в определении IgG и IgM антител, в основном у беременных, так как риск рождения неполноценного или мертвого ребенка у инфицированной матери очень высок и обычно рекомендуется прерывание беременности. Однако диагностика, основанная на определении антител, может давать ложноположительные и ложноотрицательные результаты. Так, при повторной инфекции у вакцинированных, которая может произойти в случаях низкого иммунного ответа при вакцинации, или может быть вызвана мутантными штаммами вируса, IgM антитела не образуются, возрастание титров IgG антител также наблюдается не всегда. У новорожденных с первичной инфекцией вследствие внутриутробного инфицирования, IgM антитела могут не синтезироваться в силу ряда причин:
незрелость иммунной системы; блокирование вирусного антигена материнскими антителами; инфицирование на поздних стадиях беременности; иммунная толерантность. Если происходит стимуляция клонов лимфоцитов вируса краснухи, может возникать ложноположительный антительный ответ, особенно для антител класса IgM. Было показано, что IgM антитела могут персистировать в течение года или возникать в случаях реинфекции, особенно у иммунодепрессивных пациентов. Кроме того, могут возникать ложноположительные результаты вследствие наличия ревматоидного фактора или подобных соединений, даже в ловушечном варианте теста. Только определение низкоавидных антител может быть диагностическим маркером первичной инфекции вирусом краснухи, что особенно важно при диагностическом обследовании беременных, когда необходимо дифференцировать первичную инфекцию от вторичной или реактивации инфекции.
Токсоплазмоз. Известно, что проявление клинических симптомов при приобретенном токсоплазмозе имеет низкое диагностическое значение для точного определения длительности инфекционного процесса.
Увеличение лимфоузлов может возникать в разное время с момента первичной инфекции, а нередко может сохраняться длительное время или даже возобновляться в более поздний период болезни, независимо от применения специфического противопаразитарного лечения.
До настоящего времени единственными доступными серологическими тестами для определения острой фазы токсоплазмоза являлись определение IgM антител и определение IgG антител в возрастающих титрах в двух или трех образцах сывороток, что, однако, приводит к задержке постановки диагноза. Кроме того, у пациентов с реактивацией хронического токсоплазмоза значительный рост уровня антител IgG отмечается не всегда, особенно это касается детей и подростков с поражением глаз при врожденном токсоплазмозе.
Интерпретация результатов исследований других иммуноглобулинов также вызывает затруднения. Основной недостаток определения IgM антител — длительная персистенция в крови, в связи с чем возникают трудности в установлении окончания острой фазы заболевания. У 40% пациентов IgM антитела выявляются в течение года с момента заражения при использовании ИФА, у 60% — при использовании высокочувствительного метода иммуноадсорбции. Также как IgM, специфические IgA присутствовали в сыворотке периферической крови через 45 месяцев с момента зарегистрированной сероконверсии, в течение 2-летнего периода серологического наблюдения и через 8 месяцев с момента появления признаков лимфоаденопатии. С другой стороны, у определенных категорий пациентов, например у детей, IgM антитела вообще не образуются.
Определение авидности IgG антител является высокоспецифичным и чувствительным методом диагностики острого первичного токсоплазмоза, что особенно важно при обследовании беременных для устранения потенциального риска появления врожденного токсоплазмоза у детей.
Недавно была разработана методика измерения антигенсвязывающей авидности (функциональной аффинности) IgG антител к Toxoplasma gondii, позволяющая разделить низкоаффинные антитела от высокоаффинных, которые указывают на перенесенную в прошлом инфекцию. С помощью этой методики первичная инфекция может быть идентифицирована с использованием единственной порции сыворотки.
Инфекции, вызываемые вирусом простого герпеса. Частота инфицирования новорожденных у женщин субклинической формой простого герпеса составляет 3-5% при хронической инфекции и доходит до 30-50% при заражении во время беременности (первичная инфекция). Инфекции, вызываемые вирусами простого герпеса, цитомегаловирусом относятся к инфекциям с нетипичной динамикой антителообразования (когда наличие IgM не является достоверным и достаточным признаком для дифференциации стадий заболевания). Определение IgM антител может давать ложноотрицательные результаты, поскольку они могут вообще не образовываться, или присутствовать в количествах, трудных для определения.
Ложноположительные результаты могут возникать по следующим причинам: длительная персистенция IgM антител или их присутствие может быть не связано с инфекцией; IgM антитела могут определяться при реактивации инфекции или при вторичной инфекции, например, вирусом иммунодефицита человека; различные вирусы могут иметь общие эпитопы (например, вирус простого герпеса и вирус варицелла-зостер), что приводит к возникновению перекрестных реакций. Диагностика активной фазы инфекции по 4-кратному возрастанию титра IgG также может вызывать затруднения, поскольку титр IgG антител может увеличиваться достаточно быстро (в течение 1-2 суток) после проявления симптомов заболевания.
Таким образом, определение серологических маркеров этих инфекциях не может служить специфичным тестом для дифференциации между первичной инфекцией и реактивацией. Заражение вирусом простого герпеса (ВПГ) ведет к пожизненной персистенции с возможностью реактивации вируса и перекрестного заражения другим серотипом ВПГ. Преобладание хронических и бессимптомных форм течения болезни, а также возможность атипичных проявлений ставит под сомнение диагностику по внешним признакам. Приблизительно 20% больных ВПГ-2 не имеют симптомов вообще, а 60% лиц имеют признаки, которые невозможно диагностировать и которые не принимаются врачом и самими больными за герпес (нетипичные проявления). Обе эти группы имеют риск заразить своих партнеров. Специфические IgM не могут быть использованы в качестве достоверного маркера для диагностики острой и, особенно, первичной инфекции, так как IgM к ВПГ могут образовываться как при первичном инфицировании, так и при реинфекции и реактивации вируса, но в то же время они способны вырабатываться в достаточном для диагностики количестве только у 30% людей.
Единственным способом, позволяющим сразу и достоверно диагностировать первичную инфекцию, является определение индекса авидности специфических антител.
Цитомегаловирусная инфекция (ЦМВИ) — самая распространенная внутриутробная инфекция и одна из наиболее частых причин невынашивания беременности. Риск внутриутробного инфицирования и характер поражения плода зависят от наличия антител у матери и срока инфицирования плода. При первичном инфицировании серонегативной беременной риск передачи плоду составляет примерно 50%.
Диагностика первичной ЦМВИ обычно основывается на определении сероконверсии, наличия высокого титра специфичных IgM или четырехкратного возрастания титра специфических IgG. В связи с тем, что момент сероконверсии и возрастание титров IgG диагностировать достаточно трудно, IgM антитела являются наиболее часто используемым маркером для диагностики острой инфекции. Однако у некоторых больных IgM антитела сохраняются длительное время, что приводит к гипердиагностике острой инфекции.
Определение авидности антител IgG рассматривается как наиболее важный серологический маркер, поскольку низко- и высокоавидные антитела IgG доминируют соответственно при недавней или длительно текущей инфекции.
Использование теста на авидность IgG при позитивной реакции на IgM антитела помогает подтвердить или исключить наличие первичной ЦМВИ и в ряде случаев помогает избежать необоснованных инвазивных процедур.
Вирусный гепатит С. Лабораторная диагностика гепатита С (ВГС) основана на выявлении специфических маркеров инфицирования (IgM и IgG антитела к ВГС, РНК ВГС). lgM-ответ в острой фазе гепатита С не следует классическому пути антителообразования: IgM анти-HCV могут выявляться одновременно и даже позднее, чем анти-ВГС класса IgG. Поэтому обнаружение IgM анти-ВГС не может быть использовано как маркер острой HCV-инфекции. Вместе с тем, длительность циркуляции антикор-lgM (3-5 месяцев) является фактором, прогнозирующим персистентную инфекцию, а их появление при хроническом гепатите С свидетельствует о реактивации вируса, т.е. об обострении процесса. Единственным достоверным фактором подтверждения первичной инфекции ВГС является сероконверсия.
Индекс авидности IgG при первичной ВГС инфекции имеет низкие значения и возрастает с течением времени, что подтверждает целесообразность использования определения авидности IgG антител для дифференциальной диагностики первичной инфекции от хронической или перенесенного гепатита С.
Сдавайте анализы постоянно в одной и той же лаборатории – и вашему врачу будут примерно известны Ваши личные показатели нормы и любое отклонение от нормы будет сразу им замечено.
Читайте также:


