Смешанные вирусных и бактериальных инфекций
Вирусы являются внутриклеточными инфекционными агентами. Весь репликативный цикл вируса осуществляется с исполь зованием метаболических и генетических ресурсов клеток. Поэтому патогенез вирусных инфекций, в первую очередь, следует рассматривать на молекулярном и клеточном уровнях (В.И. Покровский, О.И. Киселев, 2002). Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Поэтому характер развития внутритканевых процес сов при вирусных инфекциях, с одной стороны, определяется, как правило, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты от вирусной инфекции. Последние не редко носят деструктивный характер и усугубляют течение забо левания и его последствия. Поэтому понимание патогенеза вирусных инфекций представляется исключительно важным для создания рациональных схем лечения, основанных на гармоничном сочетании симптоматического лечения и противовирусной химиотерапии.
Стадии репликативного цикла вируса гриппа представлены на рис. 1. Такой же репликативный цикл свойствен большинству РНК- и ДНК-содержащих вирусов, кроме тех, кото рые обладают особыми механизмами хронизации процесса, латенции и способностью к интеграции в клеточный геном (например, ВИЧ, гепатит С, вирус папилломы и.т.). Ключевыми стадиями репликативного цикла вируса являются проникновение в клетки, декапсидация, активация процессов транскрипции и трансляции, собственно репликация вирусного генома и созревание зрелых вирусных частиц с выходом нового потомства инфекционного вируса.
Проникновение вируса в клетки - одна из ключевых стадий патогенеза инфекционного процесса. Для большинства вирусов степень цитопатического действия вируса прямо зависит от множественности заражения. В естественных условиях инфицирова ние клеток вирусами не происходит обычно с высокой множе ственностью. Исключение составляют респираторные вирусы, которые передаются воздушно-капельным путем с высокой инфицирующей дозой. ВИЧ и гепатиты, наоборот, эффективно передаются с кровью в самых незначительных трудно определяе мых титрах. Такие вирусы имеют особые свойства, определяющие их контагиозность.
Для проникновения вируса в клетку, необходимо: высокое сродство к вирусоспецифическому рецептору; множественность рецепторов; эффективность слияния вируса с клетками при инфицировании; способность к образованию синцития, к образованию гигантских синпластов, состоящих из множества слившихся клеток, в которых вирусный нуклеопротеид без эндоцитоза беспрепятственно переходит от одной зараженной клетки к множеству других через цитоплазму.
Такими свойствами из респираторных вирусов обладает респираторно-синцитиальный вирус, а среди ретровирусов – вирус иммунодефицита человека.
Стадии жизненного цикла вируса гриппа и соответствующие ингибиторы репродукции в известной степени могут быть экстраполированы на многие другие вирусы, за исключением тех, жизненный цикл которых включает интеграцию в клеточный геном. В процессе репликации вирусов обычно происходит селективная блокада трансляции клеточных мРНК и активация экспресси клеточных генов, кодирующих провоспапительные лимфокины. Многократные раунды репликации вирусного генома приводят к истощению энер гетических ресурсов клеток и пула предшественников азотистых оснований. Повышенное содержание провоспалительных лимфокинов приводит к развитию воспалительной реакции и локально му генерированию свободных радикалов, оказывающих, в свою очередь, повреждающее действие на клетки и ткани через перекисное окисление липидов клеточных мембран, инактивацию жизненно важных ферментов. Поэтому одним из важнейших факторов патогенности вирусов является их репликативный потенциал: чем активнее происходит репликация, тем сильнее цитопатическое действие вирусов на клетки и пораженную ткань (орган).
Значительный вклад в цитопатическое действие вирусов вносит репродукция вирусов в митохондриях, что сопровождается нарушением функций этих органоидов, падением продукции АТФ и индукцией опосредованного митохондриями пути апоптоза.
Впервые возможность репродукции вирусов в митохондриях была доказана выдающимся отечественным вирусологом В.М. Ждановым. Узкий тропизм вирусов, в известной степени, спасителен для организма, так как инфекционный процесс ограничен одним органом.
Это обстоятельство позволяет, проводит рациональную симптоматическую терапию, направленную на защиту данной ткани или органа и ориентировать противовирусные средства в данный орган, например, легкие.
Возбудители гриппа относятся к семейству ортомиксовирусов (Orthomyxo-viridae) и являются пневмотропными вирусами. Схематическое строение вируса гриппа представлено на рис. 2.1. Геном вируса складывается из 8-ми фрагментов однонитчатой РНК, которые кодируют
10 вирусных белков. Фрагменты РНК имеют общую белковую оболочку, соединяющую их, образуя антигенно-стабильный рибонуклеопротеид (S-антиген), который определяет принадлежность вируса к серотипу А, В или С. Снаружи вирус покрыт двойным липидным слоем с внутренней стороны которого находится слой мембранного белка.
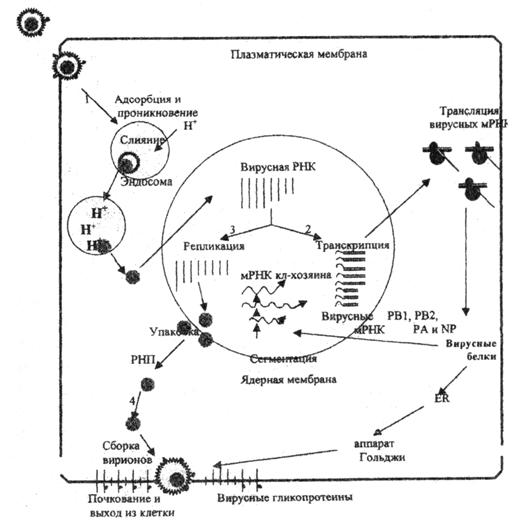
Рис. 1. Репликативный цикл вируса гриппа (В.И.Покровский, О.И.Киселев, 2002)
Представлены 4 основные фазы репликативного цикла вируса гриппа: 1 – адсорбция и проникновение вируса в клетку хозяина; 2 – транскрипция вирусной РНК и трансляция вирусных белков; 3 – репликация вирусной РНК и 4 – самосборка вирионов и последующий выход их из клетки.
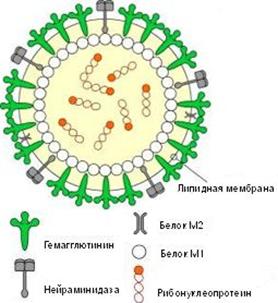
Рис. 2. Схематическое строение вируса гриппа
Гемаглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемаглютинина, а нейраминидаза обладает выраженным иммунодепресивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемаглютинины 1, 2, 3 типов и нейраминидазы 1, 2 типов содержат вирусы, которые поражают человека. Другие антигены характерные для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.).
Вирусы гриппа А. Эти возбудители более вирулентны и контагиозны, чем вирусы гриппа В и С. Это обусловлено тем, что вирус А содержит 2 типа нейраминидазы (N1, N2) и 4 –гемаглютинина (H0, H1, H2, H3); вирус В – 1 и 1 соответственно, поэтому он имеет лишь антигенные варианты внутри одного серотипа; вирус С содержит только гемаглютинин и не содержитнейраминидазу, но он имеет рецептор, который разрушает энзим. Вирусу С не свойственная изменчивость.
Одновременно циркулируют и имеют эпидемическое распространение 2 подтипа вируса гриппа А H3N2 и H1N1. На сегодняшний день во всем мире доминирует вариант А/Сидней/05/97, А/Берн/07/95 и А/Пекин/262/95. Характерной чертой современных вирусов гриппа А (H3N2) является изменение ряда их биологических свойств: тяжело размножаются в куриных эмбрионах, не агглютинируют эритроциты кур, взаимодействуют только с эритроцитами человека или морской свинки, имеют низкую иммуногенную активность.
Вирусы гриппа В выделяются только от людей. По вирулентности и эпидемиологической значимости они уступают вирусам гриппа А. По антигенным свойствам гемаглютинин инейраминидазу вируса В можно разделить на 5 подтипов. Их изменчивость носит более постепенный и медленный характер, что объясняет эпидемиологические особенности вируса гриппа В (эпидемии возникали 1 раз в 3-4 года до 1988 г.). В мире сейчас циркулируют 2 варианта вируса гриппа В: В/Пекин/184/93 (Европа, Америка, Африка, Австралия) и В/Виктория/2/87 (Юго-Восточная Азия). Характерной чертой современных вирусов гриппа А и В является их высокая чувствительность к ингибиторам гемаглютинирующей и инфекционной активности, которые содержатся в сыворотке крови нормальных животных.
Вирусы гриппа С . Вирусы гриппа С, в отличие от вирусов А и В, не вызывают эпидемий, но они могут быть причиной вспышек в организованных детских коллективах. Подъемы заболеваемости гриппом С нередко предшествуют или сопровождают эпидемии гриппа А и В. У детей раннего возраста и более старших возрастных группах он приводит к заболеваниям в легкой ибессимптомной форме.
Для вирусов гриппа С характерна значительно большая стабильность антигенных и биологических свойств. По ряду биологических характеристик эти возбудители отличаются от других представителей семейства ортомиксовирусов. Им присуща низкая репродуктивная активность в разных клеточных системах и наличие других, чем у вирусов гриппа А и В, рецепторов на поверхности эритроцитов. Рецептор-деструктирующая активность связана не с нейраминидазой, как у вирусов гриппа А и В, а с ферментом нейраминат-0-ацетилестеразою.
Сложность этиологии усиливают факты выделения от людей вирусов, которые не свойственные человеку. Гены вируса гриппа (H5N1), выделенные в 1997 году от человека в Гонконге, оказались подобными генам птичьего вируса, который преодолел межвидовой барьер. Оказалось, что человеческие и птичьи вирусы гриппа были реасортантами (рекомбинантные штаммы), которые получили внутренние гены РВ1 и РВ2 от перепелиного вируса гриппа А (H9N2) – штаммы А/перепел/Гонконг/61/97.
Вирусы гриппа малоустойчивы во внешней среде, в течение нескольких часов при комнатной температуре разрушаются. Под действием дезинфицирующих растворов (спирта, формалина, сулемы, кислот, щелочей) они быстро погибают. Нагревание до 50-60°С инактивирует вирусы в течение нескольких минут, в замороженном состоянии при температуре -70° С они сохраняются годами, не теряя инфекционных свойств, быстро погибают под воздействием ультрафиолетового излучения. Оптимум размножения вируса происходит при +37°С в слабощелочной среде. Как и другие вирусы, возбудитель гриппа отнюдь не чувствительный к антибиотикам и сульфаниламидам.
Вирус гриппа не растет на обычных питательных средах. Его можно выделить из материала, который получен от больного в первые дни болезни (смывы из носоглотки, мокроты), путем заражения культур или клеток куриных эмбрионов.
Традиционно считалось, что человеческий организм освобождается от возбудителя в ближайшие дни после выздоровления. Однако постепенно накапливались косвенные свидетельства, которые опровергают эту точку зрения. И в 1985 г. были получены прямые доказательства формирования длительной персистенции вируса гриппа. У одного человека удалось многократно выделять вирус гриппа в течение 9-ти месяцев и дольше. Возможность пожизненной персистенции вируса в организме человека продолжает изучаться.
1. Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. – СПб. – 2003.
2. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. – Санкт-Петербург. – 2003.
3. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. – Санкт-Петербург. – 2007. – 254 с.
4. Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. – М., 2006. –С. 226-247.
5. Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. – М., 2005. – С.159-175.
6. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). – М., 2005. – С. 287-292.
7. Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. – М., 2002.
8. Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. – М., – 2004. – С.5-9.
9. Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
10. Романцов М.Г., Ершов Ф.И. Часто болеющие дети: Современная фармакотерапия. – М., 2006. – 192 с.
11. Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. – СПб. – 2004. – С. 82-95.
12. Лекарственные средства в фармакотерапии патологии клетки / под редакцией Т.Г. Кожока.-М., 2007.

Как реагируют на ослабленный иммунитет человека вирусы и бактерии? Примерно так же, как бык на красную тряпку: стремятся атаковать и победить.
Когда болезнь неожиданно выбивает из привычного ритма жизни, вы первым делом идете в аптеку и по существующим симптомам пытаетесь самостоятельно назначить себе лечение. Если ваш организм приглянулся вирусам или бактериям, то такая игра в доктора может быть опасна - ошибочный выбор препарата только усугубит ситуацию. Чем отличаются бактериальные инфекции от вирусных?
В поисках вируса
В бесконечной борьбе человека с вирусами пока ничья. В то время как ученые создают механизмы защиты от инфекций, вирусы тоже не скучают - они развиваются, учатся преодолевать новые барьеры. Пример эволюции налицо. Чаще всего человек сталкивается с вирусами, приводящими к простуде (герпес, ОРВИ, грипп), кишечным инфекциям, гепатиту, а также вирусу папилломы. Мы не живем в условиях стерильной лаборатории, поэтому всевозможные микроорганизмы поджидают нас на каждом шагу. Если иммунитет в какой-то момент дал слабину, то вирус пробивает защиту организма, и вот вы уже лежите в постели с высокой температурой, ломотой в теле и головной болью. Это и есть основные признаки, указывающие на наличие в организме внутриклеточного “агента”.
- Вирус - это чистый паразит, который не может размножаться без других клеток, - объясняет Виктор ЛЕНШИН, врач-эпидемиолог, директор диагностического центра “Элиса”. - Он проникает в клетку и вынуждает ее производить копии, так как своей структуры для самостоятельного размножения у него нет и скопировать сам себя он не может. Что происходит с клеткой? Чаще всего она погибает, и появляются симптомы болезни. Человек больше всего подвержен именно вирусным инфекциям – герпес, ОРВИ и грипп в этом рейтинге на первых позициях. Впрочем, с ними наш организм знаком давно и борется весьма успешно.
Тандем с бактериями
Бактерии - это более высокоразвитый и менее уязвимый живой организм, перехитрить который сложнее. Однако не стоит воспринимать бактерии как абсолютное зло - в тандеме с ними человек живет постоянно, микробных тел в нашем организме даже больше, чем собственных клеток. Пример полезных бактерий - микрофлора кишечника. Что касается бактериальной инфекции, то механизм запускается следующим образом: патогенная бактерия чаще всего получает доступ внутрь организма через дыхательные пути или желудочно-кишечный тракт. Это могут быть и порезы на кожи, и загрязненная вода, и контакт с зараженным человеком. Иными словами, такую инфекцию можно подхватить, например, взявшись за грязную ручку двери. Многие патогенные бактерии успешно могут размножаться и вне организма, комфортно существуя и на неодушевленных поверхностях, вирусу же для размножения обязательно нужен живой организм.
Чаще всего человек имеет шанс познакомиться со следующими бактериальными инфекциями: стафилококк и стрептококк, инфекции дыхательных путей (ангина, фарингит, ларингит), кишечная палочка.
Зачем отличать инфекции?
Все мы прекрасно знаем, что первые признаки болезни - повод записаться на прием к врачу, но почему-то предпочитаем ставить себе диагноз с помощью интернета. К чему приводит самолечение? И должен ли вообще человек уметь отличать бактериальную инфекцию от вирусной?
- Безусловно, человек должен знать основные признаки бактериальной и вирусной инфекции, - рассказывает Андрей НЕВЕРОВ, терапевт, врач высшей категории. - Например, ОРВИ - это вирусные инфекции, которые лечатся противовирусными препаратами. Что касается антибиотиков, то их применяют для борьбы с бактериальной инфекцией. Специфика лечения разная, поэтому и нужно обращаться к врачу. Если вовремя не начать противовирусную терапию, то вероятны осложнения. На этом фоне может развиться и бактериальная инфекция - пневмония, бронхит, эндокардит.
Проблема и в том, что инфекции бывают смешанные. Как только иммунитет снижается, в организме между бактериями и вирусами начинается “борьба за еду”. Для них человеческий организм - ресурс. Поэтому болезнь может начаться с вирусной инфекции, а к ней потом присоединяется бактериальная. Способ лечения в таком случае может подобрать только врач, а не фраза “окей, гугл”. Как определить инфекцию? Есть внешние признаки, по которым врач без проблем отличит вирусы от бактерий. В некоторых случаях для этого необходим и анализ крови - это поможет, например, выбрать подходящий антибиотик для бактериальной инфекции.
Напрягаем иммунитет
От чего зависит наша восприимчивость к инфекция? Почему в равных условиях один человек то и дело болеет, а другого ровным счетом ничего не берет? Все дело в иммунитете и способности организма противостоять “темным силам” в виде микроорганизмов. - Работа всего организма человека зависит от иммунитета, - комментирует Виктор Леншин. - Даже негативные мысли могут снизить защитные функции организма. Нервничаете? Переживаете? Чего-то боитесь? Организм все чувствует и начинает реагировать. Ничто не убивает иммунитет так, как страх. Однако принимать иммуностимулирующие препараты стоит исключительно по рекомендации врача. Опасны ли постоянные столкновения человека с вирусами и бактериями? Нет, иммунитет должен постоянно работать и тренироваться, чтобы в случае опасности отразить любую атаку. В этом отношении стерильные условия намного хуже для организма. Хотя, конечно, переоценивать собственные ресурсы не стоит и в период эпидемий гриппа не пренебрегайте мерами предосторожности и хотя бы носите простую марлевую повязку.
ОРВИ у ЧДБ детей нередко характеризуются затяжным течением и присоединением осложнений в виде обострений хронических очагов бактериальной инфекции ЛОР-органов, респираторного и урогенитального тракта. В ряде случаев пациенты из группы ЧДБ нуждаются в помощи клинического иммунолога, поскольку имеют серьезные нарушения функционирования иммунной системы и интерферонового статуса. Таким пациентам, как правило, показана адекватная иммунодиагностика, исследование интерферонового статуса, микробиоценоза слизистых (ПЦР, бакпосевы) с последующим проведением интерфероно- и/или иммунотерапии, санации хронических очагов инфекции на фоне диагностического мониторинга.
Наиболее часто педиатрами для формирования групп детей ЧДБ используются возрастные критерии, предложенные Барановым А. А. и Альбицким В. Ю. (1986): на первом году жизни — 4 и более острых и обострений хронических заболеваний в год, на втором-третьем годах жизни — 6 и более ОРЗ в год, на четвертом году — 5 и более, на пятом-шестом годах — 4 и более, на седьмом году жизни и старше — 3 и более ОРЗ в течение года.
Именно с персистенцией вирусных и бактериальных антигенов, возникающей на фоне нарушений иммунитета и в то же время их усугубляющей, в последние годы связывают рецидивирующее течение респираторных заболеваний. Причем у 40–60% детей ОРЗ имеют вирусную природу. Среди вирусов ведущее место занимают риносинцитиальные (РС) вирусы, аденовирусы, риновирусы, вирусы гриппа и парагриппа. При неосложненном течении ОРЗ главенствующая роль отводится, как правило, моновирусной инфекции. Элиминация вирусных антигенов значительно затрудняется при частых рецидивах ОРЗ, особенно при наличии вторичной иммунной недостаточности. Так, вирусы гриппа, парагриппа, РС-вирусы, риновирусы, аденовирусы удается идентифицировать в течение продолжительного времени после острого периода болезни — от 2 недель до нескольких месяцев. От 10% до 30% ОРЗ у детей имеют бактериальное происхождение. Из бактериальных возбудителей, вызывающих острые заболевания органов дыхания, доминирующая роль принадлежит пневмококкам, гемофильной палочке. Однако развитие бактериального процесса может быть обусловлено и такими условно-патогенными микроорганизмами, как золотистый стафилококк, клебсиелла, представителями семейства кишечных палочек.
Особую настороженность вызывает возросшая частота заболеваний дыхательных путей, вызванных хламидиями, микоплазмами, уреаплазмами. Эти внутриклеточные паразиты способны к длительной персистенции в клетках эпителия респираторного тракта, особенно у иммунокомпрометированных детей, что и служит причиной инициации бронхообструктивного синдрома, а в дальнейшем формирования хронических воспалительных заболеваний легких, в том числе бронхиальной астмы.
Этиологическая значимость вирусно-бактериальных ассоциаций установлена в 25–30% острых заболеваний респираторного тракта. Клинически смешанная инфекция обусловливает неосложненное и осложненное течение ОРЗ. В случаях развития у детей острого воспалительного процесса нижних дыхательных путей смешанной этиологии вирусный компонент обычно предшествует бактериальному. Наслоение микробной инфекции нередко связывают с агрессией аутофлоры. При повторных ОРЗ, наряду с инфицированием новыми микроорганизмами, происходит активация латентной, персистирующей инфекции вирусного и бактериального генеза, что утяжеляет течение болезни, способствует хронизации процесса.
Ведущими отличительными признаками в клинической картине у ЧДБ детей являются: 1) резистентность (неотвечаемость) к традиционной терапии ОРЗ вирусной или бактериальной этиологии в соответствии с российскими формулярами; 2) проводимое традиционное лечение не предотвращает упорного рецидивирования (повтора) респираторных инфекций; 3) частота повторных инфекций превышает допустимый возрастной уровень и колеблется от 4–6–10 до 12–24 и более в год; 4) длительность ОРЗ превышает 7 дней и может колебаться от 8 до 14 и более дней; 5) ОРЗ вирусной этиологии провоцируют обострение хронических очагов бактериальной инфекции: хронического тонзиллита, хронических риносинуситов, хронического фаринготрахеита, хронического обструктивного бронхита и т. д.; 6) ОРЗ вирусной этиологии осложняется повторными пневмониями, резистентными к традиционной терапии.
Респираторные вирусы — облигатные внутриклеточные паразиты. Они различаются по своему строению и способам размножения. Одни из них вызывают острые инфекции и достаточно быстро элиминируются из организма хозяина, другие способны к персистенции.
К основным механизмам противовирусной защиты респираторного тракта относят: локальный иммунитет слизистых респираторного тракта (секреторный IgA, ИФН альфа, ИФН бета, провоспалительные цитокины, секретируемые эпителиальными клетками респираторного тракта), систему ИФН (ИФН альфа, ИФН бета, ИФН гамма), естественные киллерные клетки (CD3 + CD16 + CD56 + ), Т-клеточное звено иммунитета (CD3 + CD8 + ; CD3 + CD56 + ; CD8 + CD25 + ; CD3 + CD4 + ; CD8 + HLA-DR; CD4 + CD25 + ), гуморальные механизмы (нейтрализующие противовирусные антитела класса IgG). В настоящее время известно три основных типа ИФН: ИФН альфа, ИФН бета, ИФН гамма. В инфицированных вирусами клетках респираторного эпителия возрастает продукция ИФН альфа и ИФН бета. Эффекты ИФН альфа и ИФН бета: 1) активация противовирусных механизмов в неинфицированных клетках респираторного эпителия — протективный эффект, клетки приобретают невосприимчивость к вирусной инфекции; 2) активация генов с прямой противовирусной активностью. Антивирусные эффекты ИФН альфа и ИФН бета развиваются через несколько часов и длятся 1–2 дня.
Формирование иммунной системы и становление противовирусного иммунитета является результатом реализации генетической программы онтогенеза, для полноценного завершения которой необходима внешняя и внутренняя антигенная стимуляция. В этом аспекте неизбежные инфекции респираторного тракта у детей раннего возраста должны вести к иммунному тренингу организма. Склонность детей, особенно первых лет жизни, к ОРЗ отчасти обусловлена возрастными особенностями развития их ИС, в том числе и местного иммунитета. В свою очередь, слишком частые ОРЗ не могут негативно не влиять на становление ИС растущего организма, так, постоянная вирусно-бактериальная стимуляция ИС у детей ЧДБ ведет к возникновению нарушений ее функционирования, что сопровождается формированием стойкой иммунной недостаточности — вторичного иммунодефицита (ВИД). ВИД может быть представлен нарушениями как общего, так и местного иммунитета и носить комбинированный или изолированный характер.
В таблице приведена частота встречаемости нарушений различных механизмов противовирусного иммунитета у ЧДБ детей.
С целью повышения функциональной активности ИС, системы ИФН и ускорения восстановления их нарушенных функций, направленных на элиминацию вирусных и бактериальных антигенов, необходимо проведение заместительной и/или модулирующей иммунотерапии, восстанавливающей и модулирующей силу иммунного ответа, что должно обеспечить адекватный иммунный ответ на присутствие инфекционного патогена с последующей его элиминацией.
Тактика иммунотропной терапии при ВИД с синдромом вирусных и вирусно-бактериальных инфекций отличается тем, что в основе восстановления системы интерферонов и иммунной системы лежит базисная терапия отечественным рекомбинантным ИФН альфа-2 — Вифероном. Далее проводится необходимая иммунотерапия заместительного или модулирующего характера. При этом тактика иммунотерапии и, в первую очередь, ее длительность зависят от вида ВИД — острого или хронического. У детей ЧДБ, как правило, имеет место хронический или персистирующий ВИД, т. е. нарушения функционирования системы ИФН и иммунной системы существуют достаточно длительное время — от 6 месяцев до нескольких лет. Безусловно, при такой ситуации, в отличие от острых ВИД, когда иммунотерапия может занимать от 10 до 14 дней, проведение иммунотерапии в рамках программы иммунореабилитации детей ЧДБ занимает от 2,5–4,5 месяцев, в редких случаях до 2–3 лет.
Разработанная нами программа иммунореабилитации (Нестерова И. В., 1992) включает следующие положения:
Иммунотерапия, заместительного и модулирующего характера, органично включается в программы иммунореабилитации. К лекарственным препаратам, используемым для заместительной иммунотерапии, относятся внутривенные иммуноглобулины IgG и IgM обогащенные (Интраглобин и Пентаглобин), специфические иммуноглобулины против цитомегаловирусной инфекции (Цитотект), интерфероны (комплексный препарат рекомбинантного ИФН альфа-2 с антиоксидантами — Виферон в различных дозировках), тимические факторы (Тимоген, Тактивин).
С нашей точки зрения иммуномодулирующая терапия, используемая в лечении ЧДБ детей, должна иметь направленный характер: точкой приложения используемого иммуномодулирующего препарата должно являться то или иное поврежденное звено иммунной системы. При этом используется преимущественная направленность влияния(ний) иммуномодулятора. Так, для восстановления Т-клеточного звена предпочтительным является применение Тактивина, Тимогена, Имунофана, для восстановления гуморального звена, ЕКК, НГ Ликопида и Полиоксидония. Для восстановления системы ИФН — Виферона, который при определенных условиях обладает и иммуномодулирующими свойствами, направленными на восстановление Т-клеточного звена, системы нейтрофильных гранулоцитов. Для иммунопрофилактики и иммунотерапии бактериальных инфекций у детей ЧДБ может проводиться пролонгированная (в течение 5–6 месяцев) терапия топическими иммуномодуляторами — низкоиммуногенными вакцинами (ИРС 19, Имудон, Рибомунил, Бронхо-мунал и т. д.).
Интерферонотерапия с использованием Виферона обладает не только интерферонкорригирующей, иммуномодулирующей, но и противовирусной активностью и в большинстве случаев при возникновении ОРВИ может использоваться локально и системно, без синтетических противовирусных препаратов. Синтетические противовирусные препараты (Арбидол, Ремантадин) лучше использовать в остром периоде ОРВИ при среднетяжелом или тяжелом течении. При необходимости синтетические противовирусные препараты хорошо сочетаются с Вифероном. Хорошо известным фактом является повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, что по данным В. В. Малиновской (1998) служит основной причиной снижения противовирусной активности интерферона. С целью восстановления взаимоотношений между антиокислительной активностью плазмы крови и перекисным окислением липидов в состав препарата Виферон введены токоферола ацетат и аскорбиновая кислота — антиоксиданты, являющиеся мембраностабилизирующими компонентами. В сочетании с ними противовирусная активность рекомбинантного ИФН альфа-2 возрастает в 10–14 раз, при этом отсутствуют побочные эффекты (повышение температуры тела, лихорадка, гриппоподобные явления, психогенная депрессия), возникающие при парентеральном введении препаратов других природных и рекомбинантных ИФН. Ректальное введение Виферона и комбинация с антиоксидантами, по-видимому, обеспечивают эти позитивные эффекты, также как и быструю высокую концентрацию и длительную циркуляцию в крови ИФН альфа-2. Следующим позитивным моментом является установленный факт: при применении Виферона в течение двух лет не выявлены антитела, нейтрализующие противовирусную активность рекомбинантного ИФН альфа-2. Особенности лекарственной формы Виферона — мазь, гель, ректальные суппозитории в различных дозах создают возможность проведения локальной и системной интерферонотерапии.
Нами разработаны основные принципы дифференцированной терапии Вифероном при вторичных ВИД с синдромом повторных ОРВИ, т. е. для детей ЧДБ (Нестерова И. В., 2003; 2005; 2007):
Ниже приведена разработанная нами ранее программа терапии Вифероном для детей ЧДБ с повторными ОРВИ:
- Местное: обработка ротоглотки и интраназальное использование Виферон-мази: от 2–3 до 4–7 раз в день в течение 2–2,5 месяцев, возможно в сочетании с антисептиками.
- Системное: ректальное введение свечей в возрастной дозе (Виферон 150 000 МЕ — детям до 7 лет, Виферон 500 000 МЕ — детям старше 7 лет) курсом общей продолжительностью 2–2,5 мес:
• базисный курс 1 свеча, 2 раза в день, ежедневно — 10 дней;
• далее 1 свеча, 2 раза в день, 3 раза в неделю — 2 недели;
• далее 1 свеча, 2 раза в день, 2 раза в неделю — 2 недели;
• далее 1 свеча, 1 раз в день, 2 раза в неделю — 2 недели;
• далее 1 свеча, 1 раз в день, 1 раз в неделю — 2 недели.
Общая продолжительность курса 2,5–3,5 месяца.
NB! При необходимости (значительное снижение уровней индуцированного ИФН альфа!) начальная доза Виферона может увеличиваться в 1,5–2 раза, а курс лечения продлеваться до достижения позитивного клинического эффекта.
Использование описанных выше подходов в лечении детей ЧДБ позволяет получать позитивные результаты, которые можно видеть при оценке клинической эффективности лечения: значительно снижается количество ОРВИ с 10–18 в году до 2–3 в году, сокращается число бактериальных осложнений в 4–6 раз, ускоряется выход в клиническую ремиссию в 6–8 раз, длительность ремиссии увеличивается в 8–10 раз, с 7–10 дней до 100–150 дней, повышается качество жизни детей. Положительные клинические эффекты сопровождаются позитивной динамикой со стороны системы ИФН и иммунной системы.
И. В. Нестерова, доктор медицинских наук, профессор
Учебно-научный медицинский центр Управления делами Президента РФ, Москва
Таблица
Дефекты противовирусного иммунитета у ЧДБ детей (частота встречаемости в %)
- Дефекты продукции цитокинов (96,95%):
1.1. Дефект индуцированной продукции ИФН альфа (96,25%)
1.2. Дефект индуцированной продукции ИФН гамма (48,66%)
1.3. Дефицит сывороточного ИФН (24,33%) - Дефекты гуморального иммунитета (37,47%)
- Дефицит естественных киллерных клеток (ЕКК) (35,75%)
- Дефицит Т-клеточного звена (77,27%)
- Дефекты нейтрофильных гранулоцитов (НГ) (54,86%):
5.1. Нейтропения
5.2. Дефекты фагоцитоза
Читайте также:


