Серологические методы диагностики вирусных инфекций реферат
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.

Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.


Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.

Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.

При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.
При большинстве вирусных инфекций развиваются иммунные реакции, применяемые для диагностики. Клеточные реакции обычно оценивают в тестах цитотоксичности лимфоцитов в отношении инфекционных агентов или заражённых ими клеток-мишеней либо определяют способность лимфоцитов отвечать на различные Аг и митогены. В работе практических лабораторий выраженность клеточных реакций определяют редко. Большее распространение нашли методы идентификации противовирусных AT.
РН основана на подавлении цитопатогенного эффекта после смешивания вируса со специфичными AT. Неизвестный вирус смешивают с известными коммерческими антисыворотками и после соответствующей инкубации вносят в монослой клеток. Отсутствие гибели клеток указывает на несоответствие инфекционного агента и известных AT.
Торможение гемагглютинации
РТГА применяют для идентификации вирусов, способных агглютинировать различные эритроциты. Для этого смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
Торможение цитопатического эффекта интерференцией вирусов
Реакцию торможения цитопатического эффекта за счёт интерференции вирусов применяют для идентификации возбудителя, интерферирующего с известным цитопатогенным вирусом в культуре чувствительных клеток. Для этого в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1-2 дня в неё вносят известный цитопатогенный вирус (например, любой ЕСНО-вирус). При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим применённым AT.
Прямая иммунофлюоресценция
Среди прочих тестов наибольшее распространение нашла реакция прямой иммунофлюоресценции (наиболее быстрая, чувствительная и воспроизводимая). Например, идентификация ЦМВ по цитопатогенному эффекту требует не менее 2-3 нед, а при использовании меченых моноклона л ьных AT идентификация возможна уже через 24 ч. Имея набор подобных реагентов, их можно вносить в культуры, заражённые вирусом, инкубировать, отмывать несвязавшийся реагент и исследовать с помощью люминесцентной микроскопии (позволяет выявить наличие флюоресценции заражённых клеток).
Иммуноэлектронная микроскопия
Иммуноэлектронная микроскопия (аналог предыдущего метода) позволяет идентифицировать различные виды вирусов, выявленные электронной микроскопией (например, различные виды герпесвирусов), что невозможно сделать, основываясь на морфологических особенностях. Вместо антисывороток для идентификации используют помеченные разными способами AT, но сложность и дороговизна метода ограничивают его применение.
В последнее время для экспресс-диагностики вирусных инфекций используют также ряд методов, направленных на выявление вирусов или их компонентов в различных видах клинического материал. По сути их можно отнести к методам вирусологической или серологической диагностике; их отличает высокая специфичность и чувствительность. Реакция иммунофлюоресценции. РИФ применяют в прямом и непрямом вариантах (см. подразд. 1.4.5) для выявления вируса в материале, полученном от больных, в инфицированных культурах клеток и организме животных (табл. 3.2). Иммунная электронная микроскопия. ИЭМ позволяет обнаружить специфически связанные с антителами вирусные частицы. Преимуществом этого метода является одновременная концентрация вируса и его идентификация с помощью специфической сыворотки. Предложенные модификации ИЭМ предусматривают обработку вирусосодержащего материала антисывороткой в высоком титре, добавление к осадку фосфорно-вольфрамовой кислоты или уранилацетата с последующим нанесением на пленку (подложку) и высушиванием. При электронной микроскопии видны скопления вирусных частиц. ИЭМ используют также для выявления в биологическом материале полиовирусов, цитомегаловирусов, вирусов гепатита А и В, некультивируемых аденовирусов в ткани миндалин, некульти- вируемых энтеро- и ротавирусов в фекалиях, вирусов оспы в оспенном детрите. Таблица 3.2 Диагностика вирусных инфекций при помощи РИФ Материал для иммунофлюоресцентного исследования Вирусная инфекция от больных для экспресс- диагностики из инфицированных культур клеток и животных для выявления и идентификации вируса Грипп Парагрипп Аденовирус ная Респиратор но-синци тиальная Корь Спущенные эпителиальные клетки носовых ходов, кусочки легких и трахеи, полученные при аутопсии То же Соскоб с конъюнктивы То же Эпителиальные клетки в осадке мочи, смывы из глотки, лейкоциты крови, биопсийные и секционные препараты мозга
Первичные культуры клеток почек обезьян, эпителиальные клетки носовых ходов от экспериментально зараженных хорьков Культуры клеток почек обезьян, эмбрионов человека, СОЦ, НЕр-2 Культуры клеток (Held, НЕр-2, КВ и др.) Культуры клеток (НЕр-2, Не1а\ диплоидные человека) Краснуха Энтеровирус - ная Секционные препараты миокарда (Коксаки), эпителиальные клетки в осадке мочи Культуры клеток почек кролика, обезьян, RK, Vero, SIRK,ВНК-21 Культуры клеток почек обезьян Культуры клеток почек обезьян Паротит Бешенство Герпетиче ская Биопсийные препараты мозга Мазки из содержимого везикул, соскоба везикул и роговицы, секционные и биопсийные препараты мозга Культуры клеток почек обезьян, амниона человека, куриных фибробластов Мазки-отпечатки мозга и слюнных желез инфицированных мышей Культуры диплоидных клеток WI-38, фибробластов; срезы ткани мозга зараженных мышей Вирусная инфекция Материал для иммунофлюоресцентного исследования от больных для экспресс- диагностики из инфицированных культур клеток и животных для выявления и идентификации вируса Цитомегало- вирусная Ветряная оспа Натуральная оспа Арбовирусная Гепатит В Ротавирусная Лейкоциты крови Мазки из содержимого везикул Соскобы с макул и папул, мазки из содержимого везикул Лейкоциты крови (при крымской геморрагической, денге, колорадской лихорадках) Биопсийные и секционные препараты печени Клетки желудка и кишок в фекалиях Культуры диплоидных кле-ток R7-38, фибробластов То же Культуры клеток эпителиального происхождения Hela, Veroи др. Культуры клеток эмбриона курицы, почек эмбриона свиньи, ВНК-21, СПЭВ, ПЭС; препараты слюнных желез переносчиков, гемолимфа клещей Встречный иммуноэлектрофорез. РВИЭФ в вирусологической диагностике широко применяется для обнаружения в сыворотках больных не антител, а поверхностных антигенов (например, HBsAg у больных гепатитом В), а также для выявления других вирусных антигенов, имеющих отрицательный заряд.
На стеклянную пластину наносят слой агара. После затвердения в нем вырезают два параллельных ряда лунок. Антигены помещают в лунки, расположенные ближе к катоду, а антитела — в лунки, находящиеся ближе к аноду, и проводят электрофорез. HBsAg, имея отрицательный заряд, передвигается к аноду, а антитела — к катоду. Затем стекла помещают во влажную камеру и через 12 — 24 ч учитывают результаты реакции по образованию линий преципитации между искомым антигеном и антителом. Реакция гемадсорбции на твердой основе. РГадсТО можно считать сочетанием ИФА с РНГА. Высокая чувствительность реакции позволяет применять ее для экспресс-диагностики вирусных инфекций. Методика. Лунки полистироловых панелей одноразового использования обрабатывают иммунным глобулином (иммунной сывороткой) и вносят в них суспензию исследуемого материала, содержащего антиген. Через 30 — 60 мин лунки многократно промывают буфером, добавляют взвесь эритроцитов, покрытых специфическим иммуноглобулином, и спустя 30—60 мин определяют наличие гемагглютинации. Если в материале содержится специфический антиген, он соединяется с сывороткой, адсорбированной на поверхности лунок, и, в свою очередь, связывает иммуноглобулины на поверхности эритроцитов. В результате происходит агрегация эритроцитов (гемагглютинация). В описанной модификации реакция применяется для выявления антигенов ротавирусов и других вирусов в фекалиях больных. Молекулярно-биологические методы. ПЦР и другие методы генодиагностики, применяемые для экспресс-диагностики вирусных инфекций, детально описаны в подразд. 1.7. Выбор вышеперечисленных методов лабораторной диагностики отдельных вирусных инфекций определяется характером забо-левания, клиническими особенностями течения, биологически-ми свойствами возбудителя, периодом болезни и возможностями лаборатории.
Инфекционные болезни — это заболевания, вызванные проникновением в организм бактерий, грибков или вирусов. Самая важная часть диагностики инфекций — это определение возбудителя и его концентрации. Для этих целей используются разнообразные лабораторные методы, которые позволяют выяснить, чем именно и как давно атакован организм, а в некоторых случаях — спрогнозировать эффективность лечения тем или иным препаратом.
Особенности диагностики инфекционных заболеваний
В клинической практике данный тип заболеваний встречается очень часто. Именно они, по данным Всемирной организации здравоохранения, становятся причиной 26% всех смертей. В список самых распространенных инфекционных заболеваний входят инфекционная пневмония и другие воспалительные заболевания дыхательных путей, гепатит, ВИЧ, туберкулез, малярия, воспаления органов половой системы и мочевыводящих путей, гистоплазмоз, ротавирусные инфекционные заболевания, ветряная оспа, герпес, вирус папилломы человека и еще несколько десятков болезней. Хотя бы раз в жизни каждый из нас сталкивается с инфекционными заболеваниями и необходимостью быстрой постановки диагноза.
Все инфекционные болезни делятся на пять типов — прионные, вирусные, бактериальные, протозойные и грибковые поражения. Далее будут рассмотрены последние четыре типа как наиболее распространенные. Разные возбудители иногда могут вызывать одно и то же заболевание. В частности, пневмония может быть результатом как вирусной, так и бактериальной инфекции. Лечение зависит не от проявлений, а от возбудителя болезни. Противовирусные препараты бесполезны в борьбе с бактериями и грибками, антибиотики не действуют на вирусы. Поэтому основная задача лабораторной диагностики инфекционных заболеваний — выявление типа возбудителя.
Способы лабораторной диагностики инфекционных болезней можно разделить на два типа: неспецифические и специфические методы.
К неспецифическим относятся общий анализ крови и исследование соотношения ее белковых фракций, печеночные пробы, общий анализ мочи и кала. Эти методы не дают информации о виде возбудителя, но позволяют узнать, в какой мере болезнь затронула органы и системы организма, что именно в их работе нарушено и насколько далеко зашел процесс.
Специфические — вирусологический и бактериологический методы, микроскопическое исследование возбудителей, анализы на антигены и антитела — направлены непосредственно на обнаружение возбудителя.
Современная медицина располагает множеством методов выделения возбудителей бактериальной инфекции:
Бактериоскопический . Исследуется окрашенный специальным образом мазок.
Бактериологический . Биоматериал высеивается в питательную среду, и через некоторое время специалист исследует колонию бактерий, выросшую в ней.
Биологический . Направлен на определение патогенности микроорганизмов.
Серологический . Выявляет антитела и антигены в сыворотке крови — особые вещества, которые вырабатываются организмом при контакте с возбудителем определенной болезни.
Чаще всего для исследований используют кровь или сыворотку крови, реже — слюну, мочу, кал, клетки эпителия (мазок и соскоб) и другой биоматериал.
В лабораторной диагностике вирусных заболеваний используются:
Вирусологическое исследование . Световая и электронная микроскопия дает возможность выявить наличие вирусных включений и сами вирусы и идентифицировать их.
Серологическое исследование для обнаружения антител и антигенов. Этот метод дает возможность быстро выявить агрессора, как и в случае с бактериальными инфекциями. Для диагностики используются разнообразные способы исследования материала — реакции гемадсорбции, гемагглютинации или метод непрямой иммунофлюоресценции. Имунноблоттинг, в частности, позволяет выявлять антитела сразу к нескольким инфекциям и считается современным и точным диагностическим методом.
Молекулярно-генетические методы . Последнее слово в лабораторной диагностике. Позволяют обнаружить вирус даже тогда, когда его концентрация ничтожно мала — то есть на самых ранних стадиях. Самым известным из этих методов является ПЦР, при которой фрагмент вируса многократно копируется до тех пор, пока специалист не получит достаточно материала для определения типа вируса и его изначальной концентрации.
Для выявления вирусов обычно требуется сделать анализ крови.
Так называют инфекции, вызванные простейшими паразитами, например, амебами. Малярия, амёбиаз, токсоплазмоз, лямблиоз, трихомониаз, сонная болезнь — вот неполный список самых распространенных протозойных инфекций. Лабораторная диагностика таких заболеваний включает в себя следующие методы:
Микроскопический . Простейшие паразиты выявляются путем исследования под микроскопом окрашенных образцов биоматериала. Самый простой и надежный метод для многих возбудителей.
Культуральный . Посев биоматериала в питательную следу для дальнейшего исследования размножившихся простейших. У этого метода есть существенный недостаток: результатов нужно ждать долго, сам процесс может занять не менее 5-6-ти дней.
Серологический . Используют редко ввиду малой информативности.
Аллергический . Также не является распространенным. Кожные аллергопробы делают для того, чтобы подтвердить лейшманиоз и токсоплазмоз. Это вспомогательный диагностический метод.
В качестве биоматериала для исследований в основном используется кровь, иногда — – кал или моча.
Микроскопическое исследование . Препарат окрашивается и рассматривается под мощным микроскопом. Посредством иммунофлюоресцентной микроскопии исследуется проба, помеченная флюоресцеинами — специальным красителем. Наиболее быстрый способ выявления грибка по сравнению с другими методами.
Культуральный . Происходит посев пробы на питательную среду и дальнейшее исследование полученной в результате колонии грибков.
Серологический . Используется для выявления грибковых поражений, однако для микозов он считается не особенно точным.
Гибридизация нуклеиновых кислот . Самый современный способ выявления грибковых инфекций, его применяют для идентификации основных возбудителей системных микозов. Из культуры извлекается РНК и вносится особым способом помеченная молекула ДНК. Если в пробе наличествует один из основных патогенных грибков, ДНК объединится с его РНК, создав легко различимую структуру. Несомненным преимуществом метода является возможность определить инфекцию на самых ранних стадиях.
Биоматериалом для исследований являются клетки кожи, волос и ногтей, клетки слизистых оболочек (мазок или соскоб), мокрота, моча, секрет простаты, сперма, грудное молоко.
Современные методики диагностики инфекций позволяет выявить их на начальном этапе, Чем раньше болезнь будет обнаружена, тем проще ее вылечить. Поэтому сдавать анализы на инфекции желательно регулярно, даже если вы ни на что не жалуетесь и не замечаете никаких перемен в самочувствии.

Перед сдачей биоматериала для исследований иногда требуется определенная подготовка. Так, кровь обычно сдают с утра, натощак, а перед забором мазка не рекомендуется принимать душ. Эти требования очень важны: они обеспечивают точность результата, поэтому узнайте у врача заранее о подготовительных мерах и точно следуйте всем его рекомендациям.
С целью лабораторной диагностики вирусных инфекций используют три группы методов:
1. Быстрые (экспресс) методы - прямое обнаружение возбудителя в клиническом материале (от больного).
2. Вирусологический метод - выделение вируса из клинического материала и его идентификация.
3. Серологический метод - определение прироста (динамики) антител к вирусу (за определенный период заболевания) в парных сыворотках больного.
Выбор метода зависит от биологических свойств вируса, периода
заболевания, а также технической оснащенности лаборатории.
Быстрый (экспресс) метод. Основан на быстром обнаружении и
идентификации вируса, его антигенов или включений в биосубстратах (мазках-отпечатках, биоптатах, эпителий осадка, лейкоцитах, гистологических срезах, секционном материале):
а) серологический метод - определение вирусного антигена в исследуемом материале с помощью диагностических противовирусных сывороток в экспресс-реакциях: иммунофлюоресценция (ИФ), иммуноферментный анализ (ИФА), радиоиммунный анализ (РИА), встречный мммуноэлектрофорез (ВИЭФ), иммунная электронная микроскопия (ИЭМ), реакция прямой и обратной пассивной гемагглютинации (РПГА, РОПГА), реакция торможения обратной пассивной гемагглютинации (РТОПГА);
б) микроскопический метод - обнаружение элементарных частиц или включений вирусов с помощью световой, люминесцентной или электронной микроскопии:
в) молекулярная гибридизация - гибридизация комплементарных нитей ДНК или РНК (вируса и зонда).
Вирусологический метод. Основан на культивировании вирусов на
чувствительных клеточных системах (культуре клеток, курином эмбрионе,
1. Забор исследуемого материала.
2. Выбор и получение чувствительной тест-системы, определение ее жизнеспособности.
3. Заражение ее по принципу цитотропизма.
4. Индикация (обнаружение) вируса.
5. Идентификация вируса проводится на основании:
а) определения антигенов вируса в тест-системе с помощью серологических реакций (ИФ, ИФА, РПГА, РТГА, РСК, РН, ВИЭФ и др.);
б) патогистологического исследования органов и тканей;
в) клинических симптомов;
г) биологических проб (кератоконъюнктивальная и др.). Оценка метода: относится к ранним высокочувствительным методам исследования. Недостатки: сложность интерпретации результатов при выделении персистирующих вирусов; техническая сложность. Серологический метод. Основан на нарастании титра (прироста) антител за определенный период заболевания в парных сыворотках больных или переболевших людей - с помощью набора вирусных диагностикумов. Парные сыворотки - две сыворотки, взятые от одного больного в начале заболевания и через 1-4 недели. Серологические реакции (РПГА, РСК, РТГА, РН, ИФА и др.) ставят одновременно с двумя сыворотками для определения и сравнения их титров. Для ранней диагностики заболевания определяют наличие IgM в сыворотке (в непрямой ИФ и ИФА).
3.3. Лабораторная диагностика вирусных гепатитов
В настоящее время известны несколько типов вирусных гепатитов: гепатит А (гА) (синоним: инфекционный гепатит, эпидемический гепатит, болезнь Боткина); гепатит В (гВ) (синоним: сывороточный гепатит); гепатит ни А ни В (синоним гепатит С); гепатит дельта (синоним гепатит Д); гепатит Е.
I. Гепатит А (гА). Лабораторная диагностика гА основывается либо на выявлении самого возбудителя (метод иммунной электронной микроскопии - ИЭМ), его антигенов (радиоиммунный, иммуноферментный, иммунофлюоресцентный метод - РИА, ИФА, ИФ), или антител к вирусу гА (РИА, ИФА).
Для ранней диагностики заболевания, а также выявления источников инфекции, используется определение антигена вируса гА в фекалиях больных, где он появляется за 7-10 дней до клинических симптомов и в первые дни заболевания.
Из определяемых в настоящее время специфических маркеров гА важнейшими являются антитела класса Ig M к вирусу гА, которые появляются в сыворотке крови и слюне уже в начале заболевания и сохраняются в течение 3-6 месяцев. Обнаружение антител класса Ig M к вирусу гА однозначно свидетельствует о гепатите А и используется для диагностики заболевания, в том числе и бессимптомных случаев инфекции и выявления источников инфекции в очагах.
Антитела к вирусу гА класса Ig G выявляются с 3-4-й недели заболевания и сохраняются длительно, что позволяет оценить состояние иммунитета населения, динамику специфического гуморального иммунитета. Вирус гепатита А в материале от больного можно выявить методом иммунной электронной микроскопии. В основе метода лежит смешивание суспензии вируса с антисывороткой, отделение иммунных комплексов и исследование их в электронном микроскопе.
II. Гепатит В (гВ). В организме людей, зараженных вирусом гВ, с разной частотой и на разных этапах могут выявляться серологические маркеры: поверхностный HBs Ag и сердцевинный НВс Ад и НВе Ад, а также антитела к ним (anti-HBc, anti-HBe, anti-HBs). Динамика их появления представлена на рис. 1.
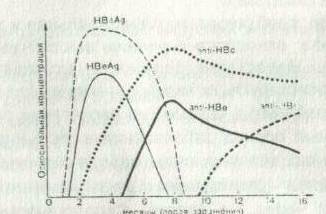
Рис. 1. Динамика появления серологических маркеров гВ
Все антигены и соответствующие им антитела могут служить индикаторами инфекционного процесса.
Наличие HBs Ag, НВс Ag и anti-HBc класса Ig M свидетельствует об остром периоде инфекции. В период реконвалесценции - это НВс-антитела класса Ig G и выявляются они совместно с Hbs-антителами. Длительное присутствие НВе Ад и HBs Ад в крови - неблагоприятный признак, свидетельствующий о формировании хронического процесса. При формировании длительного носительства постоянно определяется HBs Ag. Для обнаружения антигенов и антител используют РПГА, РИА и ИФА. Для обнаружения Hbs Ag широко используется РОПГА - реакция обратной пассивной гемагглютинации с обязательным положительным контролем на HBs Ag.
III. Гепатит С (гС). Вызывается РНК-содержащим вирусом, который относится к Flaviviridae. Диаметр вирионов 30-60 нм, чувствительны к обработке хлороформом. Позитивная одноцепочечная РНК кодирует синтез трех структурных и пяти неструктурных белков. Гепатит С по клинико-биохимическим признакам сходен с гепатитом В. У 50% инфицированных лиц заболевание переходит в хроническую форму, а у 20% хронических больных развивается цирроз печени. Механизм передачи вируса гепатита С в основном парентеральный. Лабораторная диагностика гС основана на определении антител к вирусу гС методами ИФА или РИА.
VI. Возбудитель гепатита дельта (гепатит Д). РНК-содержащий, дефектный вирус, способный реплицироваться в организме хозяина лишь при обязательном участии вируса-помощника, роль которого выполняет вирус гВ. Оболочку вируса-дельта формирует HBs Ag. Присоединение дельта-инфекции к гВ ведет к развитию тяжелых злокачественных форм болезни, хронических форм заболевания с ранним формированием цирроза печени. Лабораторная диагностика гепатита Д проводится путем обнаружения маркеров вируса гВ и дельта-вирусной инфекции, HBs Ag, anti-HBc (Ig M) и дельта Ag. Последние тестируются при помощи ИФА и РИА. Наибольшее диагностическое значение имеют антидельта IgM, которые обнаруживаются в течение всего заболевания.
V. Гепатит Е. Широко распространен в тропических и субтропических странах, распространение заболевания проходит водным путем. Вирион диаметром 27-32 нм содержит однонитчатую РНК, по физико-химическим свойствам схож с вирусами семейства Caliciviridae. Лабораторная диагностика основана на определении AT в сыворотке крови ИФА.
Взятие и вид материала
1 . Время взятия: взятие материала следует проводить в остром периоде инфекции, а в случае серологических исследований также после 2–4 нед. (с целью выявления динамики изменений концентрации антител).
2 . Вид, способ взятия и транспортировка материала: зависит от клинической формы инфекции и этиологического фактора, а также от используемого диагностического метода →табл. 28.2-1 и ниже.


