Сердечно сосудистая система и вирусы

Автореферат диссертации по медицине на тему Роль внутриутробных вирусных инфекций в патологии сердечно-сосудистой системы у новорожденных и детей раннего возраста
•^г На правах рукописи
ЖДАНОВА Лада Игоревна
РОЛЬ ВНУТРИУТРОБНЫХ ВИРУСНЫХ ИНФЕКЦИЙ В ПАТОЛОГИИ СЕРДЕЧНО - СОСУДИСТОЙ СИСТЕМЫ У НОВОРОВДЁННЫХ И ДЕТЕЙ РАННЕГО ВОЗРАСТА.
(14.00.09-Педиатрия) (¡$3.00.07 - Микробиология)
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена в Российском Государственном медицинском университете, г. Москва.
Научные руководители: акад. РАМН,доктор медицинских наук,
доктор медицинских наук,
Официальные оппоненты: доктор медининских наук.
доктор мслииинских наук.
профессор Ю.М. Бел озёр ов
Ведущая ор|анизаиия - Российский Университет дружбы народов им. Патриса Лумумбы
Защита сосгоится " % 199в _ часов на заседании
Диссертационного совс!а Д. 084. 14.02 при Российском Государственном медицинском университете по адресу: 117869, Москва, ул. Островитянова. Д. 1
С диссертацией можно ознакомиться в библиотеке РГМУ
Автореферат разослан "_"_1997 г.
Учёный секретарь Диссертационного совета, доктор медицинских наук,
профессор М. А. Фадеева
Актуальность проблемы. Заболевания сердечно-сосудистой системы представляют одну из актуальных проблем педиатрии. Среди первичпых поражений сердца у новорождённых детей ведущее место принадлежит врождённым порокам (ВПС), частота которых очень высока и доходит до 8 на 1000 живорождённых детей (Nora J.J., 1971, Warkany J., 1971.Bankl G., 1980, Бураковский В.И., 1982). За последние 20 лет значительно возросла также распространённость диагностируемых в раннем возрасте миокардитов и кардиомиопатий (Greenwood RJD., 1976, Woodruff J£., 1980, Goodwin JP., 1982, Белоконь НА., 1984, Yoshida M. et al„ 1995, Wigle E.D., 1995).
Хотя некоторые ВПС, по данным литературы, имеют наследственную природу и наблюдаются при определённых хромосомных и моногенных синдромах (Лазюк Г.И. и соавт., 1983), большинство из них связано с нарушением формирования сердца на 2 - 8-й неделе развития под влиянием различных тератогенных факторов, ведущее месго из которых, по-видимому, занимают вирусные инфекции (Бочаров Е.Ф., 1980. Moller 1., Neal W., 1981. Jacobson iL. et al.f 1991, Цинзерлииг A.B. и соавт., 1992). По литературным данным, в качестве основных карднотропных вирусов, ответственных за развитие ВПС, рассматривают пикорнавнрусы группы Коксаки (Braun G, Kamnas R„ 1972, Burch G.E., 1972, Лозовская Л.С. и соавт., 1978, Королькова ЕЛ. и соавт., 1989, Наговицына Е.Б. и соавт., 1991). Установлена также этиологическая связь пороков сердца, диагностируемых у новорождённых детей, с врождённой краснухой (Cooper L., 1985, Чернова М.П. и соавт., 1987, Бахмут Е.В., 1990). С различными внутриутробными вирусными инфекциями (преимущественно с Коксаки-вирусной и гриппозной), перенесёнными в более поздние сроки гестации или непосредственно перед родами, могут быть связаны также миокардиты и другая врождённая патология сердца (Kibrick S., Benirschke К., 1956, 1958, Ритова В.В., 1967, Overall J., 1980, Cherry JX>„ 1981, Наговицына Е.Б., 1991, HaddadJ, Gut JP., 1993).
Следует подчеркнуть, что поражение сердца, как и других органов плода, может произойти в результате трансплацентарной передачи вирусов не только от матери, перенесшей острое вирусное заболевание во
время беременности, но и от матери с персисгентной (хронической) формой вирусной инфекции (Лозовская Л.С. и соавт., 1985, НапБЬалу ДВ., 1985, ХелленовЭА., 1988, Мишина Н.В., 1992).
В большинстве исследований для оценки роли определённых вирусных инфекций в формировании различной патологии у детей, в том числе поражения сердца, используются результаты серологического и/или вирусологического обследования на определённую вирусную инфекцию, реже на ограниченную группу вирусов. Учитывая широкую распространённость различных вирусов в природе, а также возможность их длительной персисгенции в организме человека, можно предположить одновременное или последовательное заражение плода на протяжении 40 недель гестации вирусами, принадлежащими к разным таксономическим группам.
В связи с этим, представляет интерес изучение вклада различных, в том числе смешанных вирусно-вирусных инфекций, в патологию сердечнососудистой системы плода и новорожденного, а также возможности последующей персиаспции вирусов в организме детей с врождённой патологией сердца.
1. Определить этиологическую структуру вирусных инфекций у новорождённых детей и детей раннего возраста с врождённой патологией сердца.
2. Изучить связь диагностируемых у детей внутриутробных вирусных инфекций с показателями высокого риска вертикальной передачи вирусов, персистирующих в организме матери, а также с трансплацентарной передачей вирусов от матери, перенесшей острую вирусную инфекцию вовремя беременности.
3. Изучить персистенцию кардиотропных вирусов в организме детей с врождённой патологией сердца при катамнестическом наблюдении.
4. Обосновать показания к применению противовирусной терапии в комплексном лечении детей с врождённым поражением сердца.
Впервые проведено параллельное вирусологическое обследование детей с врождённой патологией сердечно-сосудистой системы и их матерей на представительную группу широко распространённых вирусов 5-ти таксономических групп. Установлено, что подавляющее большинство новорождённых детей с патологией сердца имеет смешашгую вирусно-вирусную инфекцию. При этом у детей с тяжёлым, комбинированным поражением сердца выявляются наиболее сложные вирусно- вирусные ассоциации, представленные не менее чем тремя вирусами, а также наиболее высокий уровень активности вирусной инфекции.
Подтверждена ведущая роль энтеровирусов (Коксаки А и В, энтсро 68-71) в этиологии органических поражений сердца у детей (ВПС. кардиомиопатия, кардит). Впервые установлено участие энтеровирусной инфекции в формировании I ипоксической кардиопатии (гранзиторной дисфункции миокарда) у новорожденных. Показано, что вирусы краснухи, кори, цитомегалии. герпеса простого выявляются у дегей с патологией сердца, как правило, только в ассоциации с вирулентными вирусами, преимущественно с эшсровирусами и, реже, с вирусами гриппа.
Доказана противовирусная эффективность высокоочищснного иммуноглобулина и виферона при лечении детей с врождённой вирусной инфекцией, сопровождающейся поражением сердца. Установлено, что достоверное снижение активности вирусной инфекции наблюдается на протяжении 1-го месяца после лечения этими препаратами, с последующим восстановлением уровня активности. .
В процессе катамнестического наблюдения на протяжении первого года жизни установлена персистенция в организме детей с врождённой патологией сердечно- сосудистой системы большинства вирусов, обнаруженных у них в периоде новорождённости, в том числе кардиотропных вирусов Коксаки В типов 1-5 и Коксаки А 13. Показано, что у детей с врождённым поражением сердца и подтверждённой в неонатальном периоде внутриутробной вирусной инфекцией, как правило,
имеется сочетанная патология, включая поражение ЦНС и различные проявления соматических заболеваний.
Полученные данные позволяют рекомендовать метод дифференциальной этиологической диагностики с использованием РНИФ для обследования всех детей с врождённой патологией сердца, а также их матерей на представительную группу вирусных инфекций.
На основании полученных результатов о роли внутриутробных вирусных инфекций в патологии сердца у детей, а также о снижении их активности на фоне лечения противовирусными препаратами, следует считать теоретически обоснованным и практически целесообразным применение иммуноглобулина и виферона в пред- и послеоперационном периодах у дс1сй с врождёнными пороками сердца, а также у детей, не нуждающихся в операции, но имеющих выраженные признаки системной - патоло! ии с поражением ЦНС и других органов. «-■■; Учтивая „читальную персистсннию вирусов, а также наличие
и. различной соматической патологии и частые интсркуррсншыс инфекционные заболевания у детей данной фуппы. рекомендуется включение в их терапию поддерживающих курсов метаболических прспараюв (кокарбоксилаза, рибофлавин, пиридоксаль- фосфа1. липоевая кислота, паптотснат кальция, лимонтар), а 1акже выссжоочищснною иммуно1 лобулина по показаниям: при операционном вмешательстве и других стрессовых сигуациях.
Апробированные методы диагностики и лечения детей с врождённой вирусной инфекцией и патологией сердца используются в работе отделений Городского перинатального кардиологического центра при 67 ГКБ (г. Москва), отделения новорождённых акушерско-
гинекологического корпуса ЦКБ Медицинского центра Управления делами Президента РФ.
Структура диссертации. Диссертационная работа изложена на страницах машинописного текста и состоит из введения, обзора литературы, 6-ти глав собственных исследований, заключения, выводов, указателя литературы, включающего ^в отечественных и -///иностранных источников, иллюстрирована 33 таблицами, 5
рисунками, ¿"выписками из историй болезни.
Материалы и методы исследования.
Под наблюдением находилось 75 детей с клинически выраженной патологией сердца в возрасте от 2 дней до 2 лет жизни и 48 практически здоровых детей соответствующего возраста.
Все дети с врождённой патологией сердца поступали и находились на лечешга в отделениях першттального кардиологичекого центра при 67 ГКБ г. Москвы.
По возрастному критерию все обследованные дети с патологией сердца были разделены на группу новорождённых (45 детей) и старшую группу - от 1 до 24 месяцев жизни (30 детей).
Новорождёшнле дети поступали в отделение из различных родильных домов г. Москвы на 2- 5 сутки жизни. Дети второй возрастной группы с врождённой патологией сердца поступали в отделение впервые или повторно, по направлению районной поликлшппси или из других детских больниц г. Москвы.
Контрольную группу составили 28 здоровых новорождённых детей, родившихся в акушерско-гннекологическом корпусе ЦКБ (гл. врач -Е.Н.Зарубина), а также в физиологическом отделении родильного дома № 25 (гл. врач-Левантовская И.В.), и 20 детей в возрасте от 1 до 24 месяцев, проходивших плановое диспансерное обследование на базе районной поликлиники при 13 ДКБ им. Н.Ф.Филатова.
По нозологическим формам все дети с врождённой патологией сердца были разделены нами на группу детей с оргшшческим поражением сердца (ОПС) - 55 детей и группу детей с преобладанием изменений функционального характера - транзиторной дисфункцией миокарда (ГДМ) - 20 детей.
Абсолютное большинство детей (54) с органическим поражением сердца составили дети с врождёнными пороками сердца (ВПС). Нами была выделена группа новорождённых детей - 16 (29%) - с наиболее сложными, комбинированными ВПС, сопровождавшимися выраженными симптомами недостаточности кровообращения (НК 2 А - 2 Б стадии). Дилатационная кардиомиопатия (ДКМП) диагностирована у 2 (3,6%) детей, у одного из которых имелся ВПС. Диагноз врождённого кардита установлен у 2 (3,6%) детей; оба ребёнка имели также ВПС.
Группу из 20 больных с ТДМ составили дети, перенесшие внутриутробную гипоксию и / или гипоксию в родах, у которых в раннем неонаталыюм периоде наблюдались признаки НК. Клинические симптомы заболевания у детей данной группы имели транзиторный характер и исчезали, в большинстве случаев, в срок от нескольких дней до нескольких недель.
В неонаталыюм периоде тяжесть состояния детей обеих групп была обусловлена, в подавляющем большинстве случаев, сочеташюй патологией. При этом у детей с ОПС достоверно чаще, по сравнению с детьми с ТДМ, наблюдались: патологическая потеря массы тела и плоская весовая кривая (43,6% и 20,0%), общий отёчный синдром (21,8% и 0%), инфекционная патология: пневмония (27,3% и 10,0%), инфекции мочевыводящих путей (14,5% и 0%), а также пороки и аномалии развития других органов (23,6% и 5,0%, соответственно).
Тяжёлая форма внутриутробной инфекции с признаками генерализации процесса - внутриутробной гипотрофией, гепатоспленомегалией, гемолитической анемией, тромбоцитопенией, затяжной желтухой смешанного характера, тяжёлым поражением ЦНС, других органов и систем наблюдалась у 9 (12%) обследованных детей основной группы. При этом у 8 детей с тяжёлой формой инфекции диагностирована ОПС, у 1 ребёнка - ТДМ.
В катамнезе наблюдалось 56 детей основной группы с врождённой патологией сердца, у которых было проведено анкетирование и клиническое обследование в динамике. У 25 детей основной группы с врождённой патологией сердца и подтверждённой в неонаталыюм периоде внутриутробной вирусной инфекцией было проведено повторное
вирусологическое обследование на протяжении первых 6-12 месяцев жизни. Дети обследовались повторно от 1 до 3 раз, в том числе на фоне лечения противовирусными препаратами (иммуноглобулином и/или вифероном).
Всего обследовано 75 детей и 40 матерей. Наряду с общепринятыми методами (общие анализы крови, мочи, биохимические анализы крови, рентгенография органов грудной клетки, ультразвуковое исследование головного мозга и других органов), в обязательные методы исследования включались: электрокардиография, ЭХО - кардиография. При катамнесгическом обследовании 12 детям проведена
С целью выявления риска внутриутробных вирусных инфекций проводилось клинико- эпидемиологическое исследование. В качестве показателей риска внутриутробной инфекции мы рассматривали, во-первых. наличие в анамнезе у матерей обследованных деттй следующих показателей высокого риска вер шкальной передачи энтеровнрусов: самопроизвольных выкидышей. преждевременных родов, мертворождений. хронических заболеваний и таких осложнений течения настоящей беременности, как у!роза прерывания, гестоз, острые инфекции мочевыводящих путей н обострение хронических болезней. Кроме того, регистрировались перенесённые во время беременности острые респираторные и 1риппоподобныс заболевания, контакты с инфекционными больными и рецидивы герпетической инфекции.
Дифференциальная этиологическая диагностика вирусных инфекций у детей и их матерей проводилась, согласно методическим рекомендациям Л.С Лозовской и соавт. (1992), на основании обнаружения различных вирусных антигенов методом непрямой иммунофлюоресценции (РНИФ) в эпителиальных клетках осадка мочи с использованием набора типоспецифических сывороток к 45 вирусам 5 таксономических групп, а именно: к пикорнавирусам (Коксаки А и В, энтеро 68-71, полиомиелита), ортомиксовирусам (гриппа А, В и С), вирусам группы герпеса (цитомегалии, герпеса простого типов 1 и 2), а также к вирусам кори и краснухи. По результатам, полученным в РНИФ, определялись этиология
и морфометрический показатель активности вирусной инфекции у обследуемого ребёнка.
Для анализа полученных данных использовались стандартные методы математической статистики.
Работа выполнена на кафедре детских болезней №2 (зав. каф. -акад.РАМН, д.мл., проф. ВА.Таболин), РГМУ (ректор - акад. РАМН, д.мл, проф. В.НЛрыгин) на базе отделении Городского перинатального кардиологического центра при 67 ГКБ (зам. гл. врача по детству - НА. Чернявская), в лаборатории вирусологии НИИ педиатрии РАМН (руководитель -д.мл.,проф.Л.С.Лозовская).
Результаты исследования и их обсуждение.
При клинико- эпидемиологическом анализе показа!ели высокого риска вертикальной передачи энтеровирусов выявлены в мшсринском анамнезе у подавляющего большинства (98.7%) обследованных нами дс!сй с врожденной патологией сердца, в том числе у 55 (100%) дек-й с ОПС и у 19 (957,.) ДС1СЙ с ТДМ. Острые рсспираюрные и 1рнппоподобнмс заболевания во время беременности были о> мечены у 41 (54.7"Х>) макри. Наличие ОРЗ в 1-м триместре беременности несколько чаше о!мсчалось в анамнезе у ма1срсй. родивших детей с ОПС. чем у ма!срсй. родивших детей с ТДМ (29,0% и 15,0%, соответственно). Рецидивы I српешческой инфекции во время беременности выявлены в материнском анамнезе у 5 (6.7%) дс1сй основной группы. В 2-х наблюдениях (2.7%) отмечался риск заражения плода вирусом краснухи: в одном из них наблюдался кош акт с больным краснухой, в другом - мать перенесла краснуху в 1 триместре беременности.
В целом хотя бы один показатель риска внутриутробной вирусной инфекции обнаружен в анамнезе абсолютно у всех обследованных нами детей с врождённой патологией сердца.
Контрольная группа в нашем исследовании была представлена здоровыми детьми, в материнском анамнезе которых при предварительном отборе не были выявлены показатели риска внутриутробных вирусных инфекций.
Анализ вирусологического обследования больных и здоровых детей двух возрастных групп показал, что вирусная инфекция, преимущественно
смешанная, у детей с врождённой патологией сердца выявлялась нами достоверно чаще, чем у здоровых детей соответствующего возраста (см табл. 1). При этом у подавляющего большинства детей с патологией сердца одновременно обнаруживались от 2 до 10 вирусов. У детей контрольной группы смешанная вирусная инфекция, представленная 2-мя вирусами, выявлялась в единичных случаях.
Наиболее часто у больных детей двух основных возрастных групп мы выявляли энтеровирусы (91,1% и 83,3%, соответственно), достоверно реже - вирусы гриппа, цитомегалии, герпеса простого, кори и краснухи (табл.1). Достоверных различий по частоте выявления антигенов различных вирусов у детей двух возрастных групп с врождённой патологией сердца обнаружено не было. Высокая частота выявления различных вирусных инфекций у больных детей старшей возрастной фуппы косвенно свидсюльсгвуст о персистенцин вирусов в организме детей с врожденной паюлогией сердца. Следус1 отмегигь. что вирус ци I омег алии. 1ак же как вирусы герпеса простого, кори с краснухи обнаруживались нами у больных детей, как правило, в ассоциации с вирулентными энгсровирусами или, реже, с вирусами 1риппа. Вне ассоциации с эигсровирусами и вирусами гриппа перечисленные выше вирусы выделялись с мочой только у практически здоровых дегей контрольных фупп.
Сопоставление параллельного вирусологического обследования 40 матерей и их новорождённых детей позволило сделать заключение о трансплацентарной передаче вирусов, обнаруживаемых у детей с врождённой патологией сердца.
У детей с ОПС, по сравнению с детьми с ТДМ (см табл.2), достоверно чаще (р 2 (10,0 1 (5.о; 1 (5,0 0.02 0.05 0,05
Краснухи 13 (28,9) 0 (0) 0.00 7 (23.3 1 (5,о; 0,05
Шарипова Елена Витальевна – научный сотрудник отдела респираторных (капельных) инфекций, кандидат медицинских наук.
Бабаченко Ирина Владимировна – ведущий научный сотрудник, руководитель отдела респираторных (капельных) инфекций, доктор медицинских наук.
Левина Анастасия Сергеевна – врач, кандидат медицинских наук.
1. Леонтьева, И.В. Лекции по кардиологии детского возраста / И.В. Леонтьева. – М., 2005. – 535 с.
2. Руженкова, Т.А. Состояние миокарда у детей, больных острыми кишечными инфекциями: автореф. дис. … канд. мед. наук / Т.А. Руженкова. – М., 2006. – 24 с.
3. Филиппов, П.Г. Поражение сердечно-сосудистой системы при некоторых инфекционных болезнях: дис. … д-ра. мед. наук / П.Г. Филиппов. – М., 2001. – 185 с.
4. Поражение сердечно-сосудистой системы при инфекционных заболеваниях: клиника, диагностика, лечение / Ю.П. Финогеев [и др.]. – СПб.: Фолиант, 2003. – С. 44-47.
5. Цицилашвили, М.Ю. Состояние сердечно-сосудистой системы и спектр гетерофильных антикардиальных антител у детей на фоне вирусных и бактериальных инфекций: дис. . канд. мед. наук / М.Ю. Цицилашвили. – М., 2006. – 143 с.
7. Dennert R, Crijns HL, Heymans S. Acute viral myocarditis. Eur Heart J. 2008; 29: 2073-82.
8. Дидковский, Н.А. Актуальные вопросы герпетической инфекции у взрослых / Н.А. Дидковский, И.К. Малашенкова, Ж.Ш. Сарсания и др. // Лечащий врач. – 2006. – № 9. – С. 8-12.
9. Симованьян, Э.Н. Хроническая инфекция вируса Эпштейн-Барр у детей: современные аспекты диагностики и лечения / Э.Н. Симованьян [и др.] // Педиатрия (прил. Consilium medicum). – 2006. – № 2. – С. 29–35.
10. Тябут, Т.Д. Некоронарогенные заболевания миокарда. Инфекционный эндокардит: курс лекций / Т.Д. Тябут. – Мн.: БелМАПО, 2004. – 145 с.
11. Reunanen A, et al. Enterovirus, Mycoplasma and other infections as predictors for myocardial infection. J Intern Med. 2002 Nov; 252 (5): 421-9.
13. Руженцова, Т.А. Перспективы изучения поражений сердца при инфекционных заболеваниях / Т.А. Руженцова, А.В. Горелов // Эпидемиология и инфекционные болезни. Актуальные вопросы. – 2014. – № 2. – С. 80–87.
14. Белозеров, Ю.М. Детская кардиология / Ю.М. Белозеров. — М.: МЕДпресс_информ, 2004. – 600 с., илл.
15. Толстикова, Т.В. Клинический случай тяжелого вирусного миокардита с поражением проводящей системы сердца / Т.В. Толстикова, Т.П. Марчук // Сибирский медицинский журнал. – 2012. – № 7. – С. 124–126.
16. Кантемирова, М.Г. Гетерофильные антикардиальные антитела и сердечно-сосудистые изменения у детей с вирусными инфекциями / М.Г. Кантемирова [и др.] // Международный журнал интервенционной кардиоангиологии. – 2008. – №16. – С. 49–54.
17. Kawai C. From myocarditis to cardiomyopathy: mechanism of inflammation and ctll death: Learning from the past for the future. Circulation. 1999: 99: 1091-100.
18. Wynne J, Braunwald E. The cardiomyopathies. In: Braunwald E, Zipes DP, Libby P, eds. Heart Disease: A Textboot of cardiovascular Medicine. 7th edition. Philadelphia: WB Saunders. 2005: 1659-96.
19. Щедрина, А.Ю. Роль парвовируса В19 в развитии воспалительной кардиомиопатии / А.Ю. Щедрина [и др.] // Рациональная Фармакотерапия в Кардиологии. – 2013. – 9 (5). – С. 542–550.
20. Karatolios K, Pankuweit S, Kisselbach C, Maisch B. Inflammatory cardiomyopathy. Hellenic. J Cardiol. 2006. 47 (2): 54-65.
21. Сторожаков, Г.И. Кардиомиопатия: эволюция взглядов на проблему / Г.И. Сторожаков // Лечебное дело. – 2009. – № 1. – С. 3–12.
22. Гиляревский, С.Р. Миокардиты: современные подходы к диагностике и лечению / С.Р. Гиляревский. – М.: Медиа Сфера, 2008. – 324 с.
23. Мутафьян, О.А. Кардиомиопатии у детей и подростков / О.А. Мутафьян. – СПб.: Диалект, 2003. – 271 с.
24. Kuhl U, Pauschinger M, Noutsias M, Seeberg B, Bock T, et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with idiopatic left ventricular dysfunction. Circulation. 2005; 111: 887-93.
25. Wynne J, Baughman KL. Myocarditis. In: Braunwald E, Zipes DP, Libby P, eds. Heart Deasease: A Textbook of cardiovascular Medicine. 7th edition. Philadelphia: WB Saunders. 2005: 1697-718.
26. Magnani JW, Dec GW. Myocarditis: current trend in diagnosis and treatment. Circulation. 2006; 113 (6): 876-90.
27. Bowles NE, Ni J, Kearney DL, et al. Detection of viruses in myocardial tissues by polymerase chain reaction. J Am Coll Cardiol. 2003; 42:466-72.
28. Сторожаков, Г.И. Руководство по кардиологии: учебное пособие в 3 т. / под ред. Г.И. Сторожакова, А.А. Горбаченкова. – М.: ГЭОТАР-Медиа – 2009. – Т. 3. – 512 с.
29. Самсон, А.А. Поражение сердечно-сосудистой системы при инфекционных заболеваниях / А.А. Самсон, Е.П. Кишкурно // Медицина неотложных состояний. – 2008. – №1 (14). – С. 19–24.
30. Гейдарова, Н.Ф. Оценка влияния энтеровирусной инфекции на состояние новорожденных / Н.Ф. Гейдарова // Фундаментальные исследования. – 2014. – № 4. – С. 72–75.
31. Шарипова, Е.В. Клинико-эпидемиологические особенности парвовирусной инфекции В19 у детей / Е.В. Шарипова, И.В. Бабаченко // Педиатрия. Имени Г.Н. Сперанского. – 2015. – Т. 94, № 2. – С. 82–86.
32. Crane J. Parvovirus B 19 infection in pregnancy. J Obstet Gynaecol Can. 2002; 24: 727-43.
33. Tschope C, Bock CT, Kasner M, et al. High prevelence of cardiac parvovirus B19 infection in pacients with isolated left ventricular diastolic disfunction. Circulation. 2005; 111(7): 879886.
34. Bock CT, Klingel K, Kandolf RN. Human B19 associated myocarditis. Engl J Med. 2010; 362; 13.
35. Matsumori A. Hepatitis C virus infection and cardiomyopathies. Circ Res 96: 2005; 96: 144.
36. Поражения сердца при инфекционных болезнях / Ю.П. Финогеев [и др.]. – СПб: Фолиант, 2003. – 251 с.
37. Greaves K, Oxford JS, Price CP, Clarke GH, Crake T. The prevalence of myocarditis and skeletal muscle injury during acute viral infection in adults: measuremrnt of cardiac troponins in 152 patients with acute influenza infection. Arch Intern Med. 2003; 163: 165-8.
38. Rezkalla SH, Kloner RA. Influenza-related viral myocarditis. WMJ. 2010; 109: p.209.
39. Grumbach IM, Heim A, Pring-Akerblom P, et al. Adenoviruses and enteroviruses as pathogens in myocarditis and dilated cardiomyopathy. Acta Cardiol. 1999; 54 (2); 83-8.
40. Sanchez MJ, Bergasa NV. Hepatitis C associated cardimyopathy: Potential pathogenic mechanisms and clinical implications. Med Sci Monit. 2008; 14(5): 55-63.
41. Моисеев, В.С. Внутренние болезни: учебник: в 2 т. / В.С. Моисеев ; под ред. В.С. Моисеева, А.И. Мартынова, Н.А. Мухина. – 3-е изд., испр. и доп. – 2013. – Т2. – 896 с.
42. Толстикова, Т.В. Кардиальные осложнения при инфекционном мононуклеозе у детей / Т.В. Толстикова [и др.] // Сибирский медицинский журнал. – 2010. – № 5. – С. 33–35.
43. Толстикова, Т.В. Атипичная форма Эпштейна-Барр вирусной инфекции у детей / Т.В. Толстикова [и др.] // Сибирский медицинский журнал. – 2011. – № 6. – С. 113–115.
44. Zhiburt EB, Serebrianaia NB, Diakova VV, et al. The Epstein-Barr virus in patient with infectious endocarditis // Ter Arkt. 1977. Vol. 69. №4. P. 42-3.
46. Толстикова, Т.В. Коронариты у детей / Т.В.Толстикова [и др.] // Сибирский медицинский журнал. – 2009. – № 2. – С. 67–69.
47. Толстикова, Т.В. Коронарит и болезнь Кавасаки при Эпштейн-Барр вирусной инфекции / Т.В.Толстикова, Л.В. Брегель, В.М. Субботин // Сибирский медицинский журнал. – 2005. – № 7. Прил. 1. – С. 97–98.
48. Логинова, М.С. Поражение сердца у детей с цитомегаловирусной инфекцией / М.С. Логинова [и др.] // Сибирский медицинский журнал. – 2012. – Т. 110, № 3. – С. 79– 81.
49. Толстикова, Т.В. Осложнения инфекционного мононуклеоза и Эпштейна-Барр-вирусной инфекции / Т.В. Толстикова, Л.В. Брегель // Тюменский медицинский журнал. – 2005. – № 3. – С. 15–17.
50. Казимирчук, В.Е. Диагностика и лечение инфекции, вызванной вирусом герпеса человека 6 типа (методические рекомендации) / В.Е. Казмирчук, Д.В. Мальцев // Клиническая иммунология. Аллергология. Инфектология. – 2011. – № 9–10 – С. 32–48.
51. Ramalho C, Monterroso J, Simões J, et al. Human herpes virus 6 causing myocarditis in a fetus: an infectious cause to a congenital heart defect. J Clin Pathol. 2011; 64(8); 733-4.
52. Зубрицкий, М.Г. Морфологическая диагностика заболеваний, вызванных вирусом простого герпеса / М.Г. Зубрицкий, М.К. Недзьведь // Журнал ГрГМУ. – 2008. – № 4. – С. 136–139.
53. Герасимович, А.И. Структурные изменения миокарда при генерализованной герпетической инфекции / А.И. Герасимович [и др.] // Здравоохранение. – 1995. – № 12. – С. 40–42.
54. Митрофанова, Л.Б. Мезенхимальная дисплазия клапанов сердца, кистозный медианекроз аорты и герпетическая инфекция / Л.Б.Митрофанова [и др.] // Архив патологии. – 2005. – Т. 67, № 5. – С. 20–23.
55. Шарипова, Е.В. Клинико-лабораторная характеристика и возрастные особенности инфекционного мононуклеоза у детей: дис. … канд. мед. наук / Е.В. Шарипова. – СПб., 2012. – 161 с.
57. Friedman HM. Infection of endothelial cells by common human viruses. Rev Infect Dis. 1989. 11(4). 700 -4.
58. Сурнин, С.А. Индуцирующая роль вирусов острых респираторных вирусных инфекции в прогрессии атеросклеротического процесса / С.А. Сурнин [и др.] // Фундаментальные науки и практика. – 2011. – Т. 3, № 1.
59. Ганджа И.М. Механизм влияния вирусной инфекции на поражение сосудов и миокарда / И.М. Ганджа // Медичний Всесвіт. – 2001. – № 1. – С. 23–24.
60. Перемот, С.Д. Влияние представителей семейства Herpes viridae на течение ишемическиой болезни сердца / С.Д. Перемот [и др.] // Український кардіологічний журнал. – 2000. – № 3. – С. 42–46.
- Обратные ссылки не определены.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
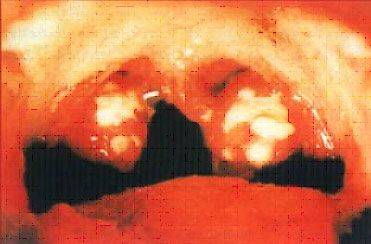
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
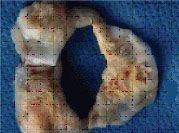
Аортальный клапан
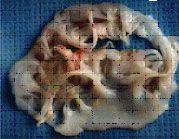
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
Читайте также:


