Ртга для диагностики вирусов
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.

Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.


Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.

Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.

При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.
При большинстве вирусных инфекций развиваются иммунные реакции, применяемые для диагностики. Клеточные реакции обычно оценивают в тестах цитотоксичности лимфоцитов в отношении инфекционных агентов или заражённых ими клеток-мишеней либо определяют способность лимфоцитов отвечать на различные Аг и митогены. В работе практических лабораторий выраженность клеточных реакций определяют редко. Большее распространение нашли методы идентификации противовирусных AT.
РН основана на подавлении цитопатогенного эффекта после смешивания вируса со специфичными AT. Неизвестный вирус смешивают с известными коммерческими антисыворотками и после соответствующей инкубации вносят в монослой клеток. Отсутствие гибели клеток указывает на несоответствие инфекционного агента и известных AT.
Торможение гемагглютинации
РТГА применяют для идентификации вирусов, способных агглютинировать различные эритроциты. Для этого смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
Торможение цитопатического эффекта интерференцией вирусов
Реакцию торможения цитопатического эффекта за счёт интерференции вирусов применяют для идентификации возбудителя, интерферирующего с известным цитопатогенным вирусом в культуре чувствительных клеток. Для этого в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1-2 дня в неё вносят известный цитопатогенный вирус (например, любой ЕСНО-вирус). При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим применённым AT.
Прямая иммунофлюоресценция
Среди прочих тестов наибольшее распространение нашла реакция прямой иммунофлюоресценции (наиболее быстрая, чувствительная и воспроизводимая). Например, идентификация ЦМВ по цитопатогенному эффекту требует не менее 2-3 нед, а при использовании меченых моноклона л ьных AT идентификация возможна уже через 24 ч. Имея набор подобных реагентов, их можно вносить в культуры, заражённые вирусом, инкубировать, отмывать несвязавшийся реагент и исследовать с помощью люминесцентной микроскопии (позволяет выявить наличие флюоресценции заражённых клеток).
Иммуноэлектронная микроскопия
Иммуноэлектронная микроскопия (аналог предыдущего метода) позволяет идентифицировать различные виды вирусов, выявленные электронной микроскопией (например, различные виды герпесвирусов), что невозможно сделать, основываясь на морфологических особенностях. Вместо антисывороток для идентификации используют помеченные разными способами AT, но сложность и дороговизна метода ограничивают его применение.
В последнее время для экспресс-диагностики вирусных инфекций используют также ряд методов, направленных на выявление вирусов или их компонентов в различных видах клинического материал. По сути их можно отнести к методам вирусологической или серологической диагностике; их отличает высокая специфичность и чувствительность. Реакция иммунофлюоресценции. РИФ применяют в прямом и непрямом вариантах (см. подразд. 1.4.5) для выявления вируса в материале, полученном от больных, в инфицированных культурах клеток и организме животных (табл. 3.2). Иммунная электронная микроскопия. ИЭМ позволяет обнаружить специфически связанные с антителами вирусные частицы. Преимуществом этого метода является одновременная концентрация вируса и его идентификация с помощью специфической сыворотки. Предложенные модификации ИЭМ предусматривают обработку вирусосодержащего материала антисывороткой в высоком титре, добавление к осадку фосфорно-вольфрамовой кислоты или уранилацетата с последующим нанесением на пленку (подложку) и высушиванием. При электронной микроскопии видны скопления вирусных частиц. ИЭМ используют также для выявления в биологическом материале полиовирусов, цитомегаловирусов, вирусов гепатита А и В, некультивируемых аденовирусов в ткани миндалин, некульти- вируемых энтеро- и ротавирусов в фекалиях, вирусов оспы в оспенном детрите. Таблица 3.2 Диагностика вирусных инфекций при помощи РИФ Материал для иммунофлюоресцентного исследования Вирусная инфекция от больных для экспресс- диагностики из инфицированных культур клеток и животных для выявления и идентификации вируса Грипп Парагрипп Аденовирус ная Респиратор но-синци тиальная Корь Спущенные эпителиальные клетки носовых ходов, кусочки легких и трахеи, полученные при аутопсии То же Соскоб с конъюнктивы То же Эпителиальные клетки в осадке мочи, смывы из глотки, лейкоциты крови, биопсийные и секционные препараты мозга
Первичные культуры клеток почек обезьян, эпителиальные клетки носовых ходов от экспериментально зараженных хорьков Культуры клеток почек обезьян, эмбрионов человека, СОЦ, НЕр-2 Культуры клеток (Held, НЕр-2, КВ и др.) Культуры клеток (НЕр-2, Не1а\ диплоидные человека) Краснуха Энтеровирус - ная Секционные препараты миокарда (Коксаки), эпителиальные клетки в осадке мочи Культуры клеток почек кролика, обезьян, RK, Vero, SIRK,ВНК-21 Культуры клеток почек обезьян Культуры клеток почек обезьян Паротит Бешенство Герпетиче ская Биопсийные препараты мозга Мазки из содержимого везикул, соскоба везикул и роговицы, секционные и биопсийные препараты мозга Культуры клеток почек обезьян, амниона человека, куриных фибробластов Мазки-отпечатки мозга и слюнных желез инфицированных мышей Культуры диплоидных клеток WI-38, фибробластов; срезы ткани мозга зараженных мышей Вирусная инфекция Материал для иммунофлюоресцентного исследования от больных для экспресс- диагностики из инфицированных культур клеток и животных для выявления и идентификации вируса Цитомегало- вирусная Ветряная оспа Натуральная оспа Арбовирусная Гепатит В Ротавирусная Лейкоциты крови Мазки из содержимого везикул Соскобы с макул и папул, мазки из содержимого везикул Лейкоциты крови (при крымской геморрагической, денге, колорадской лихорадках) Биопсийные и секционные препараты печени Клетки желудка и кишок в фекалиях Культуры диплоидных кле-ток R7-38, фибробластов То же Культуры клеток эпителиального происхождения Hela, Veroи др. Культуры клеток эмбриона курицы, почек эмбриона свиньи, ВНК-21, СПЭВ, ПЭС; препараты слюнных желез переносчиков, гемолимфа клещей Встречный иммуноэлектрофорез. РВИЭФ в вирусологической диагностике широко применяется для обнаружения в сыворотках больных не антител, а поверхностных антигенов (например, HBsAg у больных гепатитом В), а также для выявления других вирусных антигенов, имеющих отрицательный заряд.
На стеклянную пластину наносят слой агара. После затвердения в нем вырезают два параллельных ряда лунок. Антигены помещают в лунки, расположенные ближе к катоду, а антитела — в лунки, находящиеся ближе к аноду, и проводят электрофорез. HBsAg, имея отрицательный заряд, передвигается к аноду, а антитела — к катоду. Затем стекла помещают во влажную камеру и через 12 — 24 ч учитывают результаты реакции по образованию линий преципитации между искомым антигеном и антителом. Реакция гемадсорбции на твердой основе. РГадсТО можно считать сочетанием ИФА с РНГА. Высокая чувствительность реакции позволяет применять ее для экспресс-диагностики вирусных инфекций. Методика. Лунки полистироловых панелей одноразового использования обрабатывают иммунным глобулином (иммунной сывороткой) и вносят в них суспензию исследуемого материала, содержащего антиген. Через 30 — 60 мин лунки многократно промывают буфером, добавляют взвесь эритроцитов, покрытых специфическим иммуноглобулином, и спустя 30—60 мин определяют наличие гемагглютинации. Если в материале содержится специфический антиген, он соединяется с сывороткой, адсорбированной на поверхности лунок, и, в свою очередь, связывает иммуноглобулины на поверхности эритроцитов. В результате происходит агрегация эритроцитов (гемагглютинация). В описанной модификации реакция применяется для выявления антигенов ротавирусов и других вирусов в фекалиях больных. Молекулярно-биологические методы. ПЦР и другие методы генодиагностики, применяемые для экспресс-диагностики вирусных инфекций, детально описаны в подразд. 1.7. Выбор вышеперечисленных методов лабораторной диагностики отдельных вирусных инфекций определяется характером забо-левания, клиническими особенностями течения, биологически-ми свойствами возбудителя, периодом болезни и возможностями лаборатории.
3. Серологические методы диагностики гриппа и других ОРЗ
Серологические реакции, такие как реакция торможения гемагглютинации (РТГА), реакция связывания комплемента (РСК), иммуноферментный анализ (ИФА), используются для определения уровня специфических антител в сыворотках больных ОРЗ с целью ретроспективного подтверждения диагноза. Эти методы используются также для определения уровня коллективного гуморального иммунитета, ретроспективного анализа природы эпидемических вспышек, оценки иммуногенной активности гриппозных вакцин.
3.1. Реакция торможения гемагглютинации (РТГА)
для диагностики гриппа и парагриппозной инфекции
Метод основан на подавлении гемагглютинирующей активности вируса в присутствии специфических антител.
Для проведения РТГА с гриппозными антителами используют диагностикумы из штаммов, резистентных к неспецифическим сывороточным ингибиторам. Перед постановкой реакции парные сыворотки крови от больных, взятые в острой фазе инфекции и в период реконвалесценции, разводят в 10 раз физиологическим раствором (ФР) и прогревают в водяной бане при 56 °С в течение 30 мин. При постановке РТГА с парагриппозными антигенами сыворотки необходимо дополнительно освобождать от неспецифических гемагглютининов. Для этого к сывороткам, разведенным в 10 раз, добавляют по 1 капле осадка эритроцитов морской свинки, смесь встряхивают и оставляют на ночь при температуре +4 °С. В работе используют надосадочную жидкость.
При проведении РТГА с вирусами гриппа используют эритроциты кур или человека 0(1) группы крови, с вирусами парагриппа - эритроциты морской свинки. Для получения эритроцитов морской свинки используют 2,5% раствор лимоннокислого натрия на ФР, который добавляют к цельной крови в соотношении 1:5, эритроцитов кур - раствор Альсевера (1:1), состоящий из глюкозы (2,05 г), хлористого натрия (0,42 г) и лимоннокислого натрия (0,8 г), разведенных в 100 мл дистиллированной воды. Эритроциты хранят при +4 °С до появления первых признаков гемолиза (в течение 1 недели). Перед постановкой опыта эритроциты кур и морских свинок отмывают ФР три раза, человека - 6 раз с помощью центрифугирования при 1000 об/мин в течение 15 мин. В реакции используют 1% суспензию эритроцитов.
В РТГА используют раствор антигена, содержащий 4 ГЕ/0,1 мл.
Предварительно в реакции гемагглютинации (РГА) определяют титр антигена. Для этого вряду лунок планшета, содержащих по 0,1 мл ФР, готовят двукратные разведения антигена (начиная с 1:2 до титра, указанного на этикетке). После этого в каждую лунку вносят дополнительно по 0,1 мл ФР и 0,2 мл 1% суспензии эритроцитов. Для контроля оседания эритроцитов в отсутствие антигена в дополнительном ряду смешивают по 0,2 мл ФР и 0,2 мл эритроцитов. Через 45-60 мин инкубации при температуре 20+-5°С при полном оседании эритроцитов в контрольном ряду учитывают результаты реакции.
Титром антигена считают его последнее разведение, при котором наблюдается полная агглютинация эритроцитов.
Кратность разведения антигена для получения заданной дозы вируса определяют как частное от деления титра антигена на 4. В полученном растворе определяют правильность выбранной дозы повторным титрованием антигена с доведением ее (при несоответствии) до 4 ГЕ добавлением ФР или вирусного антигена. Дополнительно дозу вируса уточняют по результатам его взаимодействия со стандартной иммунной референс-сывороткой, которая должна в повторных опытах нейтрализовать 4 ГЕ в одном и том же разведении.
Парные сыворотки от больного исследуют в одном опыте. Готовят серию двукратных разведений сывороток на ФР (от 1:10 до 1:320) в объеме 0,1 мл. К каждому разведению добавляют по 0,1 мл (4 ГЕ) вируса. Панели встряхивают и инкубируют в течение 1 ч при комнатной температуре. После этого в каждую лунку добавляют по 0,2 мл 1% суспензии эритроцитов. Результаты реакции учитывают после оседания эритроцитов в контрольных лунках (без вируса). Титром сыворотки считают ее наибольшее разведение, в котором наблюдается полное ингибирование гемагглютинации вируса. Диагностически достоверным считается не менее, чем 4-кратное увеличение титров антител в постинфекционной сыворотке по сравнению с сывороткой острой фазы заболевания.
Использование иммуноферментного метода индикации антител к возбудителям острых респираторных вирусных инфекций обеспечивает ряд преимуществ перед традиционными тестами.
К ним относятся:
- высокая чувствительность тестов (титры выявляемых антител в сотни раз превышают регистрируемые в РТГА и РСК);
- специфичность анализа (на результат реакции не влияет присутствие неспецифических ингибиторов сывороток);
- повышенная (на 10-40%) частота распознавания вирусных ОРЗ при гриппе А, аденовирусной и РС-вирусной инфекциях;
- возможность дифференцированной индикации специфических антител классов IgG и IgM и распознавании тем самым острой фазы заболеваний, например, при внутрибольничных инфекциях, при вспышках ОРЗ и др.;
- возможность использования микроколичества сыворотки (1 мкл) для проведения анализа;
- отсутствие необходимости в трудоемких операциях по титрованию антител (при количественной индикации результатов реакции на мультискане).
Для проведения иммуноферментного анализа используют тест-системы, разработанные и выпускаемые НИИ гриппа РАМН.
| 1. Антигены сухие (0,1 мл) вируса А (ВГА (или вируса гриппа В (ВГВ) РС-вируса (РСВ) аденовируса (АВ) парагриппа 3 типа (ПГ3) | 1 амп. |
| 2. Планшеты для иммуноферментного анализа 1 шт. | |
| 3. Контрольные сыворотки, содержание антитела к используемым антигенам, сухие, 0,1 мл (К+) | 1 амп. |
| 4. Контрольные сыворотки, не содержащие антител к используемым антигенам, сухие, 0,1 мл (К-) 1 амп. | |
| 5. Антитела диагностические к иммуноглобулинам человека класса IgG (или IgM), меченные пероксидазой (конъюгат), 0,01 мл 1 фл. | |
| 6. Ортофенилендиамин (ОФД), 10 мг 1 фл. | |
| 7. Перекись водорода, 3% раствор, 0,1 мл 1 фл. | |
| 8. Карбонатно-бикарбонатный буфер (КББ), смесь солей, 45 мг 1 фл. | |
| 9. Фосфатно-солевой буфер (ФСБ), смесь солей, 5,25 г 1 фл. | |
| 10. Твин-20, 0,250 мл 1 фл. | |
| 11. Желатиновая смесь, 4 мл 3 фл. | |
| 12. Натрий фосфорнокислый двузамещенный двуводный 108 мг 1 фл. | |
| 13. Лимонная кислота, 63 мг 1 фл. | |
| 14. Серная кислота - 1 М раствор, 5 мл 1 фл. |
Для получения 0,5 л ФСБ содержимое флакона N 9 растворяют в 500 мл дистиллированной воды.
2. Промывающий раствор (ПР)
Для получения ПР к 500 мл ФСБ добавляют 0,25 мл твина-20.
3. Раствор для разведения К-, К+, конъюгата и исследуемых сывороток (РРК)
Для получения РРК во все флаконы с желатиновой смесью добавляют по 4,0 мл подогретой (50-55 °С) дистиллированной воды, содержимое флаконов объединяют, к смеси добавляют 40 мл ПР.
Для получения раствора КББ содержимое флакона N 8 растворяют в 10 мл дистиллированной воды.
5. К+, К- и исследуемые сыворотки
В ампулы с К+ и К- добавляют дистиллированную воду по 0,1 мл и разводят как указано на этикетке. Исследуемые сыворотки разводят 1:400 и 1:800 на РКК.
6. ОФД. Готовят непосредственно перед употреблением.
Навеску натрия фосфорнокислого двузамещенного двуводного (флакон N 12) растворяют в 3 мл дистиллированной воды (раствор А). Навеску лимонной кислоты (флакон N 13) растворяют в 3 мл дистиллированной воды (раствор В). Смешивают 2,5 мл раствора А и 2,5 мл раствора В, доводят объем до 10 мл дистиллированной водой (цитратно-фосфатный буфер (ЦФБ) рН 5,0+-0,1). Навеску ОФД (флакон N 6) растворить в 10 мл ЦФБ, добавить 0,1 мл 3%-ного раствора перекиси водорода (флакон N 7), перемешать.
7. Конъюгат. Рабочее разведение.
Содержимое ампулы (0,01 мл) растворяют в РКК до титра, указанного на этикетке.
8. Антигены. Антигены регидрируют дистиллированной водой до первоначального объема (0,1 мл), затем добавляют 10 мл КББ.
Проведение иммуноферментного анализа
1. В лунки планшета вносят по 100 мкл раствора антигена. Планшет накрывают крышкой, инкубируют 18 ч при (4-6) °С.
2. По окончании инкубации раствор антигена удаляют, планшеты промывают 3 раза ПР.
3. В лунки планшета А1, В1 вносят по 100 мкл раствора К+, в лунки С1, D1 - по 100 мкл раствора К-, в лунки Е1, F1, G1, H1 - по 100 мкл ФСБ. В остальные лунки планшета вносят по 100 мкл исследуемых сывороток, разведенных каждая 1:400 и 1:800 на РКК.
4. Планшеты накрывают крышкой и инкубируют 2 ч при 37 °С.
5. По окончании инкубации планшеты освобождают от содержимого, промывают 4 раза ПР.
6. Во все лунки вносят по 100 мкл рабочего раствора конъюгата.
7. Инкубируют планшеты в закрытом виде 45 мин при 37 °С.
8. Удаляют содержимое лунок, планшеты промывают 4 раза ПР.
9. Во все лунки вносят по 100 мл раствора ОФБ.
10. Инкубируют 10-20 мин при температуре 20-25 °С в темном месте.
11. Для остановки реакции в каждую лунку добавляют по 50 мкл серной кислоты (флакон N 14).
Учет и интерпретация результатов
Результаты ИФА учитывают спектрофотометрически при длине волны 490 нм. Установку "бланк" спектрофотометра осуществляют по лункам С1-Н1 каждого планшета. Оценку результатов исследования производят только в том случае, если средний показатель оптической плотности (ОП490) в К+ выше, чем в К-, не менее, чем на 0,5 ед. ОП490. Увеличение ОП490 на 0,3 ед. и более в сыворотке реконвалесцента по сравнению с сывороткой в том же разведении, полученной в острой фазе заболевания, расценивается как диагностически достоверное.
Адрес изготовителя: 197376, Санкт-Петербург, ул. проф. Попова, 15/17 НИИ гриппа; тел. 234-12-10, 234-58-75, 234-15-48 факс (812) 234-01-50
Начальник Управления
профилактической медицины
Минздравмедпрома России
Р.И.ХАЛИТОВ
Начальник Управления Государственного
санитарно-эпидемиологического надзора
и экспертизы Госкомсанэпиднадзора
России
В.И.ЧИБУРАЕВ
Приложение 5
к приказу Минздравмедпрома
и Госкомсанэпиднадзора РФ
от 19 апреля 1995 г. N 101/46
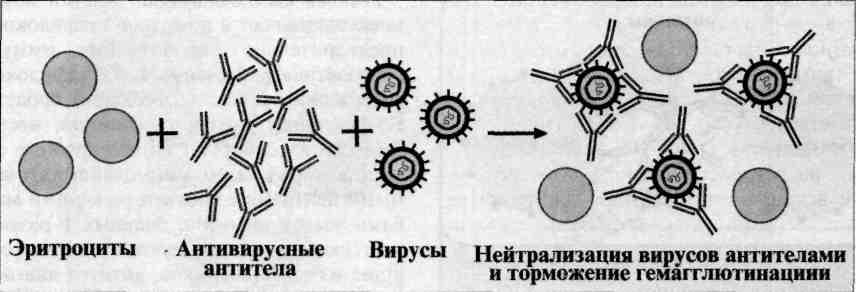
Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови.
Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты.
РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных.
Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток.
52. Реакция преципитации. Механизм. Компоненты. Способы постановки. Применение.
Реакция преципитации (РП) - это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах; избыток одного из них снижает уровень образования иммунного комплекса.
РП ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др. Широкое распространение получили разновидности РП в полужидком геле агара или агарозы: двойная иммунодиффузия по Оухтерлони, радиальная иммунодиффузия, иммуноэлектрофорез и др.
Механизм. Проводится с прозрачными коллоидными растворимыми антигенами, экстрагированными из патологического материала, объектов внешней среды или чистых культур бактерий. В реакции используют прозрачные диагностические преципитирующие сыворотки с высокими титрами антител. За титр преципитирующей сыворотки принимают то наибольшее разведение антигена, которое при взаимодействии с иммунной сывороткой вызывает образование видимого преципитата — помутнение.
Реакция кольцепреципитации ставится в узких пробирках (диаметр 0,5 см), в которые вносят по 0,2—0,3 мл преципити-рующей сыворотки. Затем пастеровской пипеткой медленно наслаивают 0,1—0,2 мл раствора антигена. Пробирки осторожно переводят в'вертикальное положение. Учет реакции производят через 1—2 мин. В случае положительной реакции на границе между сывороткой и исследуемым антигеном появляется преципитат в виде белого кольца. В контрольных пробирках преципитат не образуется.

53. Реакция связывания комплемента. Механизм. Компоненты. Применение.
Реакция связывания комплемента (РСК) заключается в том, что при соответствии друг другу антигены и антитела образуют иммунный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), т. е. происходит связывание комплемента комплексом антиген—антитело. Если же комплекс антиген—антитело не образуется, то комплемент остается свободным.
Специфическое взаимодействие АГ и AT сопровождается адсорбцией (связыванием) комплемента. Поскольку процесс связывания комплемента не проявляется визуально, Ж. Борде и О.Жангу предложили использовать в качестве индикатора гемолитическую систему (эритроциты барана + гемолитическая сыворотка), которая показывает, фиксирован ли комплемент комплексом АГ-АТ. Если АГ и AT соответствуют друг другу, т. е. образовался иммунный комплекс, то комплемент связывается этим комплексом и гемолиза не происходит. Если AT не соответствует АГ, то комплекс не образуется и комплемент, оставаясь свободным, соединяется со второй системой и вызывает гемолиз.
Компоненты. Реакция связывания комплемента (РСК) относится к сложным серологическим реакциям. Для ее проведения необходимы 5 ингредиентов, а именно: АГ, AT и комплемент (первая система), эритроциты барана и гемолитическая сыворотка (вторая система).
Антигеном для РСК могут быть культуры различных убитых микроорганизмов, их лизаты, компоненты бактерий, патологически измененных и нормальных органов, тканевых липидов, вирусы и вирусосодержащие материалы.
В качестве комплемента используют свежую или сухую сыворотку морской свинки.
Механизм. РСК проводят в две фазы: 1-я фаза — инкубация смеси, содержащей три компонента антиген + антитело + комплемент; 2-я фаза (индикаторная) — выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген—антитело происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных антителами эритроцитов не произойдет; реакция положительная. Если антиген и антитело не соответствуют друг другу (в исследуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит — ан-тиэритроцитарное антитело, вызывая гемолиз; реакция отрицательная.
Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана).

Основными видами диагностики вирусных инфекционных заболеваний, несмотря на разнообразие современных методов лабораторных исследований, остаются серологические тесты и классический метод выделения вирусов на культуре клеток. Успех своевременной этиологической диагностики хантавирусных инфекций в значительной степени зависит от разработки новых и совершенствования рутинных иммунологических методов исследования. Трудности, связанные с выделением на культуре клеток хантавирусов от больных геморрагической лихорадкой с почечным синдромом (ГЛПС) и грызунов-носителей, выдвигают на первое место серологические тесты. Для выявления специфических антител к определенному вирусу чаще всего используют метод непрямой иммунофлюоресценции (НМФА). К вирусам, обладающим гемагглютинирующими свойствами, применяют также и иммунологическую реакцию торможения гемагглютинации (РТГА), которая основана на способности сывороточных антител, вырабатываемых к гемагглютининам (специфическим белкам, содержащимся во внешней оболочке некоторых вирусов), подавлять вызываемую вирусом агглютинацию эритроцитов. После успешной изоляции прототипного штамма 76-118 вируса Hantaan [8] рН-зависимые гемагглютинины были выявлены в антигенах, полученных из мозга новорожденных мышей, клеток VERO E-6, вируссодержащих культуральных жидкостей [6, 10, 11]. Чувствительность и специфичность тестов гемагглютинации в значительной степени зависит от источника и способа получения антигенов, при этом условия репродукции вирусов оказывают заметное влияние на формирование гемагглютининов, а воздействие физических и химических факторов влияет на функциональные свойства антигенов и их стабильность [1, 10]. Было отмечено [9], что тест РТГА по своей специфичности не уступает реакции нейтрализации с использованием тканевых культур, а его применение предпочтительнее в тех регионах, где одновременно циркулируют несколько антигенных вариантов хантавирусов. На территории Приморского края с помощью молекулярно-генетических методов исследования выявлена циркуляция трех патогенных хантавирусов – Hantaan (геновариант FE), Amur и Seoul (геновариант VDV), природными хозяевами для которых установлены восточный подвид полевой мыши (Apodemus agrarius), восточно-азиатская мышь (Apodemus peninsulae) и серая крыса (Rattus norvegicus) соответственно [3–5].
Цель работы – показать эффективность модифицированных тестов торможения гемагглютинации при идентификации штаммов близкородственных вирусов Amur и Hantaan (геновариант FE), изолированных от экологически разных видов мышей рода Apodemus – A. peninsulae и A. agrarius соответственно, а также случаев заболевания ГЛПС, обусловленных этими патогенами, на территории Приморского края.
Материал и методы исследования
Гемагглютинирующие антигены штаммов – прототипных и выделенных нами на клеточной культуре VERO E-6 от грызунов-носителей хантавирусов на территории края – готовили из вируссодержащих культуральных жидкостей по разработанному способу [2]. Исследовали сыворотки крови от инфицированных хантавирусом грызунов (n = 86) и больных ГЛПС (n = 246) из трех очаговых регионов края (I – Восточно-Маньчжурский холмисто-равнинный, II – Амуро-Уссурийский предгорно-лесной, III – Сихотэ-Алиньский горно-таежный [7]) и г. Владивостока. Все больные были с серологически подтвержденным в НМФА диагнозом ГЛПС без четкого различия в титрах антител к вирусам Hantaan, Amur и Seoul. Гемагглютинирующую активность антигенов определяли в реакции гемагглютинации (РГА). Этиологическую диагностику ГЛПС у больных из разных регионов края и в разные сроки заболевания проводили в условиях модифицированной постановки РТГА – 2 активные единицы антигена (АЕ), время контакта 15 минут и 2 часа при +4 °С. Антигенные связи штаммов хантавирусов изучали в предложенной кинетической постановке РТГА (КРТГА) – 4 АЕ антигена, время контакта 15 и 30 минут, 1, 2, 4 и 18 часов при + 4 °С (табл. 1).
Характеристика тестов гемагглютинации, используемых в работе
Реакция гемагглютинации (РГА)
Определение гемагглютинирующей активности антигенов и их рабочей дозы – 4-8 АЕ
Реакция торможения гемагглютинации (РТГА)
Оценка специфической гемагглютининингибирующей активности антител (антигемагглютининов) в сыворотках крови больных ГЛПС по ? 4-кратной разнице в титре антител к антигенам гомо- и гетерологичных хантавирусов
Кинетическая реакция торможения гемагглютинации (КРТГА)
Проведение серологической идентификации штаммов хантавирусов с учетом кинетики взаимодействия антигемагглютининов иммунных сывороток крови, полученных к серотипам Hantaan (HTNV), Amur (AMRV), Seoul (SEOV) и Puumala (PUUV), с гомо- и гетерологичными гемагглютинирующими антигенами хантавирусов
Внутри- и межтиповые антигенные отношения исследуемых штаммов хантавирусов оценивали в перекрестных КРТГА, при этом степень антигенного сходства или различия штаммов количественно определяли по рассчитанному в каждой реакции значению предложенного ранее показателя А [1].
Результаты исследования и их обсуждение
На первом этапе изучали эффективность теста РТГА для дифференциальной диагностики хантавирусных инфекций среди разных видов – носителей хантавирусов. Часть результатов параллельного титрования сывороток крови от инфицированных животных с гемагглютинирующими антигенами разных хантавирусов представлена в табл. 2. Специфические антитела чаще выявляли к тому хантавирусу, для которого данный вид животного является основным хозяином. В ряде случаев отмечали перекрестные реакции с гетерологичными вирусами, но титр антител к гомологичному вирусу был выше.
Идентификация хантавирусной инфекции у грызунов-носителей в РТГА
Номер исследуемой сыворотки
Гемагглютинирующий антиген хантавируса / грызун-носитель
Читайте также:


