Ретроспективная диагностика при гриппе


ОРВИ и грипп имеют респираторные симптомы и общие. Их можно распознать по катаральным признакам со стороны дыхательных путей и общей симптоматике, характерной для большинства заболеваний.
Современные методы диагностики данной группы заболеваний
Различают несколько видов диагностики, которые различаются по особенностям проведения и методу выявления возбудителя. Это:
- экспресс-методы;
- серологическая диагностика;
- вирусологическая диагностика.
Первая группа - экспресс-методики. Это быстрый способ подтвердить или исключить наличие болезни. Используется метод флюоресценции и ПЦР. Рассмотрим их подробнее.
Изучение флюоресцирующих антител - МФА. Способ основан на определении антигенов к вирусу в эпителиальных клетках носовой слизистой, на конъюнктиве (если есть глазные поражения). Антитела при действии антигена реагируют специфическим свечением, которое легко заметить при микроскопическом исследовании. Этот параметр считается маркером диагностики и является основой для подтверждения результата. Способ имеет диагностическую ценность начиная с 3 и заканчивая 5 днем заболевания. Чувствителен к таким антигенам: вирус гриппа типа А, В, вирус парагриппа, аденовирусы и возбудитель РС-инфекции. Это удобный и быстрый метод, не требующий особых ресурсов, который часто применяется в ходе диагностики.

Метод полимеразно-цепной реакции базируется на основе обнаружения участков нуклеиновых кислот генетического материала вируса и определении их групповой принадлежности по этому критерию. Методика имеет высокую диагностическую ценность, является современным и качественным способом подтверждения заболевания. Считается “золотым стандартом” диагностики, так как не дает ложных результатов и является специфическим для определения конкретных патогенов, широко применяется в стационарных и амбулаторных условиях.
Вирусологические методики основаны на чистом выделении вирусных микроорганизмов и их конкретных штаммов, за чем следует их прикрепление к клеточным культурам в лабораторных условиях. Далее следует определение вида вируса с помощью ПЦР или других реакций. Метод требует значительных ресурсов, довольно длительный и трудоемкий. Его ценность заключается в получении эпидемиологических данных и основе для научных работ. То есть, детальное изучение вируса, частоты его распространения позволяет прогнозировать эпидемическую картину, создавать вакцины. Для исследования берется мазок из носа и носоглотки. Материал пригоден в течении 3-5 дня заболевания. С помощью вирусологических методов можно определить такие возбудители:
Серологические методы диагностики - это ретроспективное исследование, которое дает точные данные относительно стадии процесса, степени активности и типа возбудителя. Используется для эпидемиологических целей.
Для анализа используется сыворотка крови, в которой необходимо определить количество и виды антител. Используется известный антиген вируса. При возникновении реакции с материалом пациента формируются иммунные комплексы антиген-антитело, что подтверждает диагноз. Для диагностики также важен прирост титра антител, для чего используются парные сыворотки.
Результат имеет высокую точность и может определиться даже если все другие методы не дали результата, так как имеет высокую чувствительность. особенно важно использование метода для стертых форм с минимальными клиническими проявлениями. Сыворотки для анализа берутся в начале болезни, а также через 10-14 дней после её завершения. Используется метод для подтверждения наличия в организме таких возбудителей: вирусы гриппа А, В, возбудители парагриппа, аденовирусы и РС-вирусы.

Наличие вируса гриппа можно подтвердить с помощью РТГА - реакции торможения геммааглютинации. Метод основан на свойстве снижения гемагглютинирующих способностях вируса, если в крови есть антитела к нему. Для этого используется кровь с эритроцитами, антиген. Препараты крови берутся парными, в начале болезни, и в период выздоровления. Метод имеет высокую диагностическую ценность, точный и чувствительный.
Виды исследуемого материала и особенности сдачи
Для диагностики используются смывы из носа, мазки из носовых ходов, носоглотки, а также препараты крови.
Забор мазка и смыва проводит медицинский персонал. Он следит за тем, чтобы препараты строго соответствовали должной локализации. Забор проходит в чистых условиях, стерильными инструментами и в стерильную тару. До того, как взять мазки пациента просят высморкаться, чтобы очистить носовые ходы от слизи. Зонд вводится легко, на глубину 2-3 см. Проводится стандартное движение по нижней части носового хода и под раковиной носа. Необходимо, чтобы забор происходит в современной клинике, где есть возможность правильно хранить и транспортировать собранный материал в короткий срок до лаборатории.
Мазок из глотки берется по похожей методике, чтобы затронуть те участки слизистой, на которой скапливается возбудитель. Перед забором необходимо легко прополоскать рот, чтобы взятый материал был чистым. Желательно забирать материал на 3-й день после начал болезни.
Нормы и отклонения от них, расшифровка результатов
Экспресс-тест дает результаты сразу после диагностики, его расшифровка не вызывает трудностей, так как определяет наличие вируса или его отсутствие в организме.
Серологические реакции более сложные и могут расшифровываться по разному: наличие антител класса М говорит об острой стадии процесса, антитела G формируются при хроническом течении.
Сроки готовности результатов
Результаты исследования готовы на 1-2 день после сдачи. Экспресс-тест дает результат сразу. Серологические методы требуют больше затрат времени для сравнения титров антител. Более быстрые методы важны для диагностического процесса, а те, что более затратны - для эпидемиологического и научного исследования.

Скорость диагностики зависит от правильности сдачи препаратов, условий лаборатории, качества реактивов.
Вовремя сданный анализ позволяет точно и быстро определить диагноз. Это - залог правильного и эффективного лечения. Если болезнь запустить, она грозит осложнениями, которые особенно опасны, если у человека грипп. Это актуально для детей, пожилых людей, беременных женщин и лиц с дефицитом иммунной системы, ведь осложнения чаще всего проявляются у них.
Лаборатория АО "СЗЦДМ" предлагает услуги, обеспечивающие комплексное и преемственное лабораторное обследование пациента
Диагностика В медицинских центрах АО "СЗЦДМ" проводят качественные диагностические исследования всего организма
Лечение Наши медицинские центры ориентированы на обслуживание пациентов в амбулаторном режиме и объединены единым подходом к обследованию и лечению пациентов.
Реабилитация Реабилитация - это действия, направленные на всестороннюю помощь больному человеку или инвалиду для достижения им максимально возможной полноценности, в том числе и социальной или экономической.
Выезд на дом Внимание! Действует акция "Выезд на дом - 0 рублей"
Профосмотры АО "СЗЦДМ" проводит профилактические осмотры работников, которые включают в себя - комплексы лечебных и профилактических мероприятий, проводимых для выявления отклонений в состоянии здоровья, профилактики развития и распространения заболеваний.
Клиническая диагностика. Грипп диагностируют на основании внезапного начала с повышения температуры тела до высоких цифр, значительной интоксикации в виде лихорадки, адинамии, головной боли, миалгий, сухого кашля с болью за грудиной при слабо выраженных катаральных явлениях со стороны ротоглотки. Во время эпидемии гриппа в типичных случаях диагноз устанавливается без затруднения на основании клинико-эпидемиологических данных (возникновение массовых однотипных заболеваний в окружении больного).
Лабораторная диагностика состоит из клинических и специфических методов. Следует отметить, что в межэпидемический период диагноз гриппа должен быть подтвержден лабораторно (специфическими диагностическими тестами).
Специфические лабораторные диагностические методы предназначены для ранней (экстренной) или ретроспективной диагностики гриппа. По скорости получения результатов первоочередными методами являются следующие:
- иммунофлюоресцентный метод (РИФ), с помощью которого в поле зрения люминесцентного микроскопа в клетках верхних дыхательных путей выявляют вирусные антигены после их взаимодействия со специфическими антителами, меченными флюорохромом; образование специфического комплекса антиген— антитело проявляется ярким красным свечением в поле зрения микроскопа;
- выявление адсорбции груженных антителами эритроцитов поверхности клеток, пораженных вирусом (РНГ);
- выявление агглютинации обработанных противовирусными антителами эритроцитов под действием вируса гриппа, который содержится в опытном материале в лунках панели микротитратора Такачи (РСНГА);
- гемадсорбции (PIT), реакции связывания комплемента (РСК) и др.
Результат анализа описанных методик может быть получен уже через 3-5 часов с момента доставки материала в лабораторию.
К наиболее точным методам диагностики относится вирусологический метод — выделение вируса гриппа из секретов верхних дыхательных путей или из крови. Для этого метода материал от больного необходимо брать в ранние сроки болезни и доставлять в вирусологическую лабораторию в охлажденном состоянии (в термосе, заполненном льдом, или портативном холодильнике). Для выделения вируса гриппа чаще всего используют куриные эмбрионы, реже — культуру клеток и лабораторных животных. Индикацию выделенного вируса проводят с помощью РГА и реакции торможения
Но вирусологический метод является наиболее тяжелым и дорогостоящим и поэтому на практике применяется редко.
Из методов ретроспективной диагностики наибольшее распространение получили серологические методы. При этом диагностическим является нарастание титра антител в 4 и больше раз при исследовании парных сывороток крови, взятых в разгар заболевания и еще через 7-14 дней. В практическом здравоохранении чаще всего пользуются реакцией торможения гемагглютинации (РТГА), иногда РСК, редко — реакциями нейтрализации и радиального гемолиза.
Среди других рекомендованных для ретроспективной диагностики методов можно отметить реакцию непрямой гемагглютинации (РИГА), метод дифференцированного определения антител с помощью редуцирующих веществ, реакцию определения антител к нейраминидазе и другие (иммунодиффузные, иммуноэнзимные и радиоиммунные методы). Методы иммуноферментного анализа (ИФА) и молекулярной гибридизации (ММГ) пока еще не получили широкого распространения в практике. Серологическая диагностика гриппа обеспечивает точное определение этиологии вируса путем выявления в крови увеличения количества специфических антител в динамике заболевания; она особенно незаменима при атипичном или бессимптомном течении гриппозной инфекции.
Дифференциальная диагностика
Диагноз гриппа во время эпидемии не вызывает особенных трудностей. Намного тяжелее установить диагноз во внеэпидемический период, у больных с легкими формами заболевания, при поздней госпитализации в стационар, при микст-инфекциях с поражением респираторного тракта. Количество диагностических ошибок увеличивается после периода относительного эпидемиологического благополучия в связи с уменьшением настороженности относительно гриппа. Особенно опасны случаи гиподиагностики в связи с быстрым распространением заболевания и тяжелыми исходами. Распознавание гриппа представляет бесспорную сложность, потому что его симптомы подобны симптомам многих заболеваний. Дифференциальную диагностику необходимо проводить с целым рядом инфекционных болезней вирусной и бактериальной этиологии. Осуществить это возможно при использовании экспресс-методов лабораторных исследований, а также зная типичную клиническую симптоматику, свойственную каждой этиологической форме заболевания.
Острые респираторные вирусные инфекции (табл. 1).
Таблица 1. Дифференциально-диагностические признаки гриппа и других острых респираторных инфекций
Герпетическая инфекция. Она является наиболее сложной для дифференциальной диагностики с гриппом. Для так называемой герпетической лихорадки свойственные острое начало, выраженная температурная реакция с высокими цифрами, озноб, головная боль, тошнота, возможная рвота, снижение аппетита. Обращает на себя внимание сухость и гиперемия слизистых оболочек ротоглотки. Высыпания, типичные для герпетической инфекции, не всегда наблюдаются в первые дни заболевания. Появление их возможно на 3-7-й день от начала лихорадочного периода. Катаральные явления мизерные, возможны конъюнктивиты, но чаще кератоконъюнктивиты. Течение заболевания, как правило, длительное. С целью диагностики используют ИФА, ПЦР.
Тяжелый острый респираторный синдром (ТОРС). Новое заболевание, которое имеет много общих симптомов и ряд общих свойств с гриппом не только во время возникновения, но и в месте появления вирусов с повышенной вирулентностью.
Вирус ТОРС попал в человеческую популяцию от диких кошек (виверр). Передается не только при близком контакте с больным через зараженную мокроту, но и воздушно-капельным и даже водным путем. Инкубационный период колеблется от 2 до 10 дней.
Основные симптомы ТОРС: высокая температура (выше 38°С), озноб, головная и мышечно-суставная боль, першение в горле, частый сухой непродуктивный кашель, общая слабость, снижение аппетита, тошнота, иногда неинтенсивная рвота, редко — высыпания на коже. Через 3-7 дней наступает поражение нижних отделов респираторного тракта, которое усиливает сухой кашель, вызывает затруднение дыхания, одышку. Аускультативно в легких наблюдаются ослабленное дыхание, крепитация или мелкопузырчатые хрипы. Новая болезнь приводит к тяжелому отеку легких, часто с летальным исходом. При рентгенологическом обследовании в начале заболевания выявляется диффузное затемнение легочной ткани или локальные, ограниченные участки затемнения в сегментах, а также очаговые инфильтраты. На ранних стадиях болезни в периферической крови наблюдается лимфопения, нормо- или лейкоцитопения. Дальше наблюдаются повышения уровней креатинфосфокиназы, лактат-дегидрогеназы, активности аланинаминотрансферазы и аспартатаминотрансферазы. В настоящее время разработан ИФА-тест, с помощью которого можно очень быстро уточнить диагноз.
Коронавирусная инфекция. Основным отличием этой инфекции является наличие у подавляющего большинства больных симптомов поражения желудочно-кишечного тракта, которые наблюдаются с первых часов заболевания и нередко предшествуют катаральным проявлениям. Наряду со слизисто-серозным ринитом достаточно часто наблюдается воспаление слизистой гортани и увеличение шейных лимфатических узлов. Коронавирусы, как и аденовирусы, являются частыми возбудителями внутрибольничных инфекций. Наиболее распространенным методом выявления возбудителя является метод флюоресцирующих антител. Материалом является слизь ротоглотки и носа. Серологическая диагностика используется для ретроспективной расшифровки этиологии и проводится на основании повышения титров антител в РСК, РНГА.
Микоплазменная инфекция. Респираторный микоплазмоз чаще протекает по типу ОРЗ и пневмонии. Для первого характерно постепенное начало с умеренной и более длительной температурной реакцией, маловыраженнои интоксикацией, ринитом, сухим навязчивым кашлем длительностью до 10-15 дней. При осмотре обращает на себя внимание легкая гиперемия лица, конъюнктивит. Для микоплазменной пневмонии характерны более длительный инкубационный период (15-40 дней), потом острое начало с симптомами выраженной интоксикации (головная боль, анорексия, вялость, повторная рвота, мышечная боль). После высокой температуры тела, до 39-40°С в течение 7-12 дней (то есть более длительной, чем при гриппе) устанавливается длительный субфебрилитет (иногда до месяца). В отличие от гриппа — выраженная гиперемия дужек, язычка и задней стенки глотки, которая напоминает гиперемию ротоглотки при катаральной ангине. Кашель сухой, надсадный, коклюшеподобный, длительностью до 2-4 недель. Физикальные данные в большинстве случаев малоинформативные, лишь рентгенография легких позволяет распознать пневмонию. Используется специфическая идентификация микоплазм методом ИФА и ПЦР.
Легионеллез. Острая респираторная болезнь (лихорадка Понтиак) — клиническая форма болезни легионеров, по своим проявлениям подобна гриппу. Начинается остро с озноба, лихорадки, головной боли и боли в мышцах, нарастающей слабости. Больные жалуются на сухой кашель, насморк, сухость и боль в горле, ощущение сдавливания и умеренную боль за грудиной. Возникают неврологические изменения, иногда возможна боль в животе, рвота и понос. При исследовании крови выявляется нейтрофильный лейкоцитоз, сдвиг лейкоцитарной формулы влево, лимфопения, тромбоцитопения, резкое увеличение СОЭ. Характерны эпидемиологические особенности: возникает в летне-осенний период, основным фактором передачи является водный аэрозоль, который образуется при функционировании различных систем бытового, промышленного, лабораторного и медицинского назначения. Решающее значение имеют данные серологического (РНИФ) и микробиологического исследования.
Сибирская язва. Заболевание начинается остро с озноба, повышения температуры тела до 40°С, общей слабости, конъюнктивита (слезотечение, светобоязнь, гиперемия конъюнктивы), катаральных явлений со стороны верхних дыхательных путей (чихание, насморк, хриплый голос, кашель). Состояние больных с первых часов тяжелое, отмечаются сильные боли в груди, одышка, цианоз, тахикардия, артериальное давление снижено, профузный пот. Мокрота имеет примесь крови вязкой консистенции. Физикально и рентгенологически определяются признаки пневмонии, плеврита. Диагноз подтверждается эпидемиологическими и клиническими данными, лабораторной идентификацией палочки сибирской язвы.
Бруцеллез. Многообразие клинических проявлений заболевания создает трудности при определении диагноза и обусловливает необходимость дифференциальной диагностики инфекции с большим количеством заболеваний, в том числе и с гриппом. Острая форма бруцеллеза характеризуется высокой лихорадкой (39-40°С и выше), температурная кривая имеет тенденцию к волнообразному течению, нередко неправильного (септического) типа с большими суточными колебаниями, повторными ознобами, которые сменяются повышенной потливостью. Несмотря на высокую температуру тела, самочувствие больного остается удовлетворительным. Отсутствуют и другие признаки общей интоксикации. Из других клинических проявлений острой формы бруцеллеза стоит отметить генерализованную лимфаденопатию. При исследовании периферической крови отмечается лейкопения, СОЭ не повышена, учитываются данные эпидемиологического анамнеза.
В отдельных случаях возникает необходимость проводить дифференциальную диагностику гриппа с заболеваниями тифо-паратифозной группы и малярией в разгар заболевания, гепатитом А в преджелтушном периоде, бактериальными и вирусными менингитами и другими инфекционными заболеваниями, которые сопровождаются повышением температуры тела, симптомами интоксикации и катаральным синдромом.
Поставить диагноз на грипп птиц можно путём выделения вируса и идентификации его в РСК, РН и РТГА, а также выявления специфических AT в процессе эпизоотии или по прошествии её (ретроспективная диагностика). В нашей стране биопромышленность выпускает 2 диагностических набора:
а) набор специфических АГ и сывороток к ним для диагностики гриппа птиц 13-и серотипов;
б) диагностический набор для идентификации вируса НБ и Ш (актуального эпизоотического типа).
Выделение вируса. Взятие и подготовка материала. В качестве вируссодержащего материала используют селезёнку, головной мозг, синусы, трахею, лёгкие, воздухоносные мешки, кишечник от больной птицы или свежих трупов. Материал в лабораторию доставляют в замороженном виде в термосе со льдом. Инфекционные титры вируса в назальных смывах бывают максимальными через 2-4 дня после заражения птицы и достигают 10 5 -10 7 ЭИДзо/мл смыва. Изолировать вирусы из клоачных смывов удаётся чаще всего на 5-8-й день после экспериментального заражения птицы.
Заражение куриных эмбрионов. Испытуемую суспензию инокулируют 9-10-дн КЭ (не менее 5 на одну пробу) в аллантоисную или амниотическую (лучше) полости общепринятым методом и инкубируют в течение 72 ч. Экстраэмбриональную жидкость каждого эмбриона раздельно проверяют на ГА-активность капельной РГА с 1 %-ной взвесью эритроцитов кур. При отсутствии положительной РГА проводят еще 3-5 слепых пассажей, используя для заражения КЭ эмбриональную жидкость предыдущего пассажа. Если титры ГА низкие, проводят таким же образом еще 2-3 дополнительных пассажа. Проба испытуемого материала считается отрицательной, если в 3-5 слепых пассажах не будет обнаружено ГА и патогенного действия вируса (гибели КЭ). При положительной РГА проводят идентификацию выделенного вируса.
Заражение культуры клеток. Вирус после 2-5 пассажей хорошо развивается в культуре фибробластов КЭ. ЦПД обычно проявляется через 24-48 ч (в зависимости от дозы и адаптации). Присутствие его устанавливают при помощи РГА и РГАд. Предложен ускоренный метод титрования инфекционности вируса гриппа в культуре клеток путем подсчета гемадсорбирующих клеток. Метод позволяет получить результат через 8 ч после заражения.
Биопроба на цыплятах. Испытуемую суспензию инокулируют цыплятам 2-3-месячного возраста. Летальную инфекцию у цыплят можно вызвать при любом методе заражения (подкожно, внутримышечно, в мозг, конъюнктиву) подтипами А1, А7 и А5. Заражение per os с кормом и водой удается непостоянно, лишь в случае высокой патогенности эпизоотического изолята гриппа. Зараженные цыплята, как правило, гибнут через 36-72 ч в зависимости от дозы и вирулентности возбудителя.
Индикация и идентификация вируса. Для этой цели широко используют методы ИФ, цитоскопию, биопробу (на птице и КЭ) и серологическую идентификацию. С помощью монАТ можно идентифицировать не только разные группы вирусов (ВГП и ПМВ), но и определять подтипы ВГП и серотипы ПМВ птиц, и даже штаммы внутри одного подтипа, а также локализацию компонентов вириона в зараженных клетках (МРВГП - МА клонов 1С6, 5С10, N:2 - МА клоны 303 и т.д.). На основе монАТ можно готовить диагностические препараты для выявления АГ и AT в РТГА, НИФ, РСК, ИФА и др. реакциях.
РГА. Для индикации вируса в патологическом материале можно использовать РГА. Надосадочную жидкость после центрифугирования суспензии проб из органов и тканей больной птицы, а также смывов исследуют в капельной или пробирочной РГА с 1%-ной суспензией эритроцитов кур или 0,5%-ной взвесью эритроцитов морской свинки. Реакцию учитывают через 20 мин и 1 ч. Специфичность определяют в РТГА.
Цитоскопия. Метод заключается в исследовании тканевых элементов в отпечатках, полученных со слизистой оболочки верхних дыхательных путей (лучше) и органов. Препараты высушивают и окрашивают одним из методов: по Романовскому, Пигаревскому, Быковскому и т. п. При окраске по Быковскому и Пигаревскому в цитоплазме клеток при гриппе обычно обнаруживают тельца-включения ярко-красного цвета; при окраске по Романовскому - фиолетового цвета. Внутриклеточные включения находят не только в клетках цилиндрического эпителия, но и в цитоплазме макрофагов, лейкоцитов и плоского эпителия. В настоящее время этот принцип исследования используется с применением люминесцентной микроскопии.
Метод простого флюорохромирования. На мазки-отпечатки из органов и смывов наносят 1-2 капли рабочего раствора акридина оранжевого (1:10000), покрывают покровным стеклом и свежий препарат (в течение 10 мин после приготовления) рассматривают в люминесцентном микроскопе. Ядра клеток выявляются по изумрудно-зеленому свечению, РНК плазмы клеток - в виде не резко ограниченных гранул красного или оранжевого цвета. В препарате, имеющем вирус гриппа, выявляются включения в виде четко отграниченных ярко-красных гранул в цитоплазме клеток.
Для идентификации гриппа млекопитающих и птиц наиболее простым и высоко достоверным методом является РТГА. РН - штаммоспецифическая и также высоко достоверная, но используется в диагностике значительно реже. Ее обычно применяют при некоторых неясных и спорных случаях.
Реакция связывания комплемента. Используют для определения типоспецифичности выделенного вируса, когда в РТГА не удается установить родственных связей между выделенным и эталонными штаммами вируса гриппа по антисывороткам к ним. В этом случае в РСК с эталонными иммунными сыворотками против вирусов гриппа типов А, В и С устанавливают типовую принадлежность штамма.
В последнее время для типирования нейраминидазы вируса начали применять РТНА, но в диагностической ветеринарной практике она пока еще не применяется. Ее используют, в основном, для изучения АГ связей различных штаммов вируса гриппа.
Реакция торможения гемагглютинации. Идентификацию испытуемого вируса проводят с набором эталонных штаммоспецифических гриппозных сывороток к его АГ вариантам. Для дифференциации в реакцию вводят сыворотку против вируса НБ. РТГА ставят микро- или макрометодом по общепринятой методике.
Иммуноферментный метод. Может быть использована как экспресс-метод диагностики гриппа птиц. Препараты готовят непосредственно ex tempore от убитой больной или свежепавшей птицы. Прямой метод ИФ позволяет определять АГ ВГП в мазках-отпечатках тканей птиц, идентифицировать АГ данного вируса из различных тканей организма, инкубационных яиц, печени зараженных эмбрионов и культур клеток фибробластов; выявить вирусный АГ даже в тех случаях, когда вирус из пораженных тканей выделить не удается.
В ветеринарной диагностической практике для идентификации выделенного вируса РДП не используют, так как необходимы концентрированные и очищенные АГ. В основном применяют ее для изучения АГ структуры вирусов гриппа. Разработаны наборы для ИФА с монАТ, непосредственно обнаруживающие ГА, нуклеокапсидный или матриксный белки вируса гриппа. Идентификацию вирусспецифической нуклеиновой последовательности предлагается осуществлять ПЦР с 2-мя типами праймеров (на основе генов неструктурного белка и ГА). Тест стандартизован для определения AT к ВГП в сыворотке крови у индеек.
Минимальные АГ различия между вариантами и родительским вирусом выявлялись только монАТ, продуцируемыми клетками гибридомы PEG-1 или фрагментами селезенки гипериммунных животных. МонАТ дают возможность точно проследить филогенетические взаимоотношения между вирусными штаммами в составе субтипа, а в сочетании с методами пептидного картирования и определения последовательности а.к. - выяснить молекулярную структуру АГ участка ГА.
Серодиагностика и ретроспективная диагностика. Обнаружение анти-ГА, ВНА и КСА - надежный признак протекающей или уже прошедшей инфекции ГП в стаде.
РТГА. Исследование парных сывороток проводят с диагностической целью при атипичном, часто вялом течении болезни с поражением органов дыхания. Сыворотку от диких птиц на присутствие противогриппозных AT исследуют при изучении роли перелетных птиц в распространении гриппа. Обязательным условием для ретроспективной диагностики ГП является одновременное исследование парных сывороток, так как для диагностических целей имеет значение сравнительный титр AT против вирусов различных серологических подтипов в 1-й и 2-й пробах сыворотки. Первую пробу сыворотки хранят при 4°С или в замороженном виде. Обе пробы исследуют одновременно. Перед постановкой реакций сыворотки прогревают при 60°С 30 мин, а затем освобождают от термостабильных ингибиторов, используя СО2, КО4 и др. методы. Если титр AT во 2-й пробе сыворотки (через 10-14 дн после заболевания) превышает не менее чем в 4 раза титр AT к тому же типу вируса в 1-й пробе, то РТГА считается положительной, подтверждающей диагноз гриппа птиц. При постановке РТГА с парными сыворотками больных птиц необходимо использовать не только набор эталонных штаммов (например, к вирусам A/Fowl plague, A/Chick/Scotland, A/Turkey, A/Duck), но и местные штаммы того птицехозяйства, где зарегистрирована болезнь. При анализе результатов РТГА необходимо указывать, сколько сывороток было с низким, средним и высоким титром к тому или иному штамму вируса гриппа. В ряде случаев вместо индивидуальных сывороток показатели иммунитета стада (после переболевания или прививки живой вакциной) можно изучить на сыворотках,.полученных от нескольких птиц. В этих случаях испытуемые сыворотки, взятые от отдельных птиц, нужно соединять в равных объемах. На протяжении опыта (120 дн после реконвалесценции) в сыворотках кур находили анти-ГА: до 75-го дня титры сохранялись примерно на одном уровне (5-5,8 log2), а в дальнейшем снижались (до 4,4-4,6 log2).
РСК применяют для обнаружения АГ и AT в целях ранней и ретроспективной диагностики гриппа. Ставят с аллантоисными жидкостями КЭ или с очищенными диагностикумами. РДП широкого применения не нашла, так как необходимы высокие концентрации чистых АГ. Среди исследователей нет единого мнения о чувствительности этой реакции. Некоторые авторы указывают, что чувствительность РДП сравнительно невысока, поскольку достоверные положительные результаты получали лишь при исследовании сывороток с титром AT в РТГА 1:80 и выше.
Реакция радиального гемолиза. В настоящее время используется для сероэпидемиологических исследований и при оценке эффективности противогриппозных вакцин. РРГ с ВГ А обладает выраженной штаммовой специфичностью: диаметр зон гемолиза с гомологичными АГ при исследовании сывороток хорьков, зараженных 6-ю различными вирусами, были в 1,5-3 раза больше, чем с гетерологичными. При правильном подборе штамма РРГ может быть с успехом использована для определения анти-ГА.
Показано хорошее совпадение результатов титрования AT в ELISA, РСК и ИФ. Однако в ELISA значительно выше (титр 1:481-1:1520), чем в РСК и РИФ. Сенсибилизацию лунок панелей проводят РНК-АГ вируса гриппа А. Предложен новый метод приготовления AT эритроцитарных диагностикумов к вирусам гриппа, которые с успехом могут быть изготовлены на основе любых штаммов вируса гриппа. Они позволяют определять типовую принадлежность эпизоотических и межэпизоотических штаммов ВГП, свиней и лошадей. В практической работе врачу ветеринарной лаборатории, возможно, придется встретиться не только с гриппом кур и уток, но и с гриппом индеек.
Таблица 107 - Лабораторные методы дифференциации гриппа и ньюкаслской болези птиц
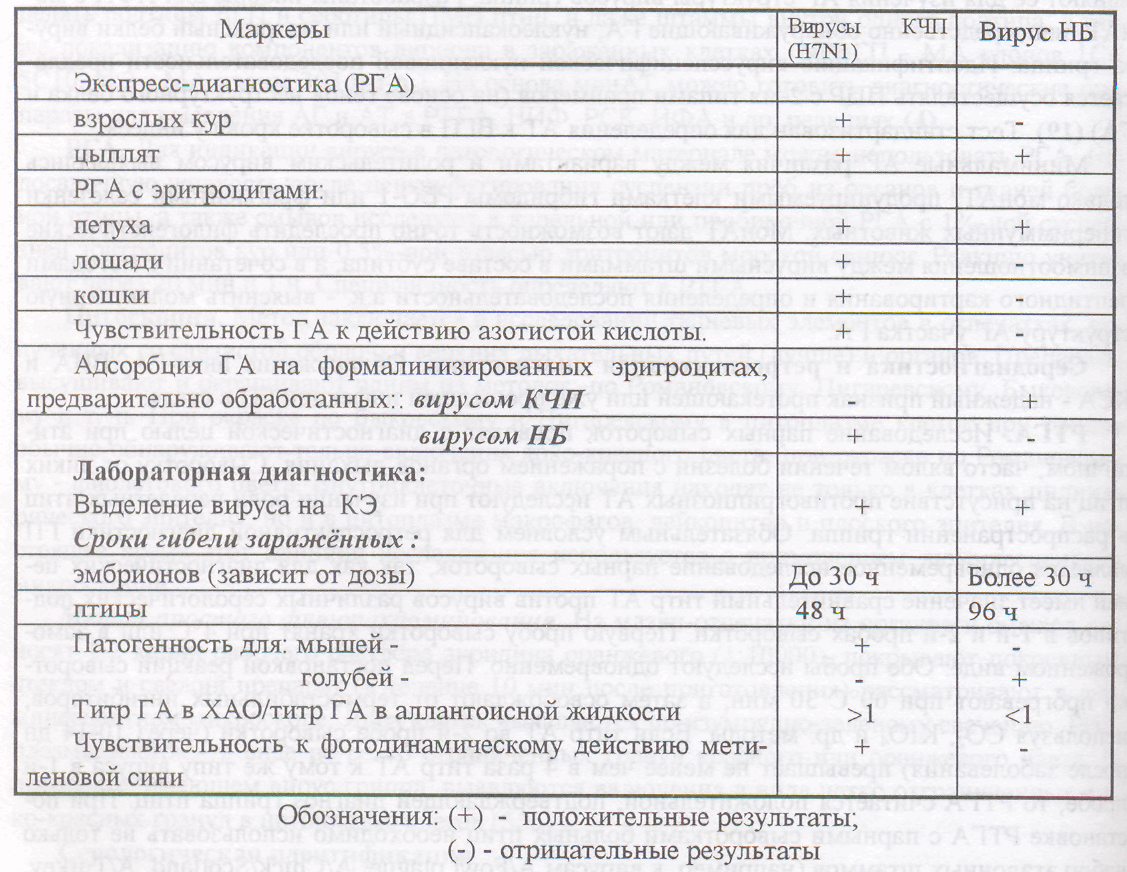
Умея диагностировать грипп кур и уток, имея набор диагностикумов, врач лаборатории при необходимости сможет поставить диагноз при гриппозной инфекции индеек.
При респираторных вирусных болезнях КРС, свиней и птиц (грипп, парагрипп, РС-инфекция) разработан направленный тест. Это новый иммуноферментный мембранный тест быстрого обнаружения вирусов гриппа в носоглоточных смывах. Чувствительность направленного метода Flu-А составляла 90%. С помощью этого теста более легко обнаруживается клеточно-ассоциированный АГ, присутствующий в клинических пробах, чем свободный вирус. С помощью Flu-А теста удалось обнаружить вирусы гриппа А птиц (субтипы ГА Н3 и Н6) и свиней (H1N1) в клоачных смывах и гомогенатах.
Дифференциальная диагностика. КЧП (H7N1) и другие формы гриппа птиц следует отличать от НБ, ИБ, ИЛТ, гемофилеза и респираторного микоплазмоза. Для идентификации вирусов НБ и КЧП используется диагностический набор.
В сомнительных случаях для дифференциального диагноза ставят РН на КЭ и заражают птиц, иммунных к вирусу НБ.
Лабораторная диагностика гриппа свиней
Грипп свиней (инфлюэнца свиней, энзоотическая бронхопневмония) - высоко контагиозная, остро протекающая болезнь, возникающая в холодное время года и характеризующаяся внезапным началом, резко выраженной лихорадкой, общей слабостью и поражением органов дыхания. Вирус гриппа свиней (ВГС) может вызвать заболевание людей и, наоборот, установлена возможность заражения свиней вирусом гриппа человека.
Болезнь впервые диагностирована в США в 1918 г. во время пандемии гриппа людей. Встречается во многих странах Европы и Америки, зарегистрирована и в бывшем СССР В отдельных хозяйствах причиняет большой экономический ущерб. Описана вспышка гриппа среди 115 свиноматок, вызванная "новым типом" вируса гриппа H3N2, который появился в Дании в 1990 г. Степень опоросов сократилась с 90 до 43% - через 14 дн после появления заболевания. Снизилось количество новорожденных поросят.
Выделение вируса. Выделение вируса на лабораторных животных. Используют хорьков, белых крыс, но чаще белых мышей. В качестве исходного материала для выделения вируса используют кусочки лёгкого, трахеи, бронхиальный экссудат, носовые смывы от больных свиней.
Мышей заражают интразально под эфирным наркозом и в течение 5- 7 дн наблюдают за ними, обращая внимание на общее состояние животных. Если животные не гибнут, их убивают. На вскрытии отмечают изменения в лёгких. Затем проводят ещё 3-4 пассажа. По мере адаптации вирулентность вируса для белых мышей значительно возрастает, они гибнут на 4-7-й, а иногда на 14-й день после заражения.
Выделение вируса на КЭ. Испытуемый материал инокулируют в аллантоисную или амниотическую полости 9-12-сут КЭ, которые после заражения инкубируют 48-72 ч, иногда до 96 ч при температуре 37°С. Для выделения вируса обычно проводят 2-3 слепых пассажа.
Выделение вируса в культуре клеток. Культура клеток почек поросёнка - универсальная биологическая система, применяя которую можно выделить вирус от больных свиней. Для быстрой индикации вируса гриппа в 1-слойных культурах почечного эпителия поросят используют РГАД с эритроцитами курицы, морской свинки или 0-группы человека. ГАд, положительная РГА, а также дегенеративные изменения клеток указывают на присутствие вируса в исследуемом материале. Вирус, вызвавший явление ГАд, должен адаптироваться к КЭ и вызывать накопление ГА.
Риноцитоскопия. Со слизистой оболочки носа делают мазки-отпечатки. Положительный диагноз ставят на основании обнаружения в отпечатке в первые 1-3 дн болезни большого количества клеток цилиндрического эпителия. Позднее содержание цилиндрических клеток в мазке уменьшается. Вопрос о диагностическом значении цитоплазматических включений при гриппе свиней неясен; в литературе нет достаточно обоснованных сообщений.
Обнаружение вируса в РГА. При постановке РГА обычно используют эритроциты кур или морской свинки. Берут 0,5 мл носового смыва, добавляют 0,5 мл 0,5%-ной взвеси эритроцитов, тщательно встряхивают и оставляют при комнатной температуре на 1-2 ч. Результаты реакции учитывают общепринятым методом. Чувствительность реакции можно повысить, увеличив объем испытуемых смывов. РГА со смывами используют только при массовом заболевании гриппом, так как процент специфических реакций не превышает 30.
Читайте также:


