Разнообразие вирусов и прокариот это
К прокариотам относятся архебактерии, бактерии и синезеленые водоросли. Прокариоты — одноклеточные организмы, у которых отсутствуют структурно оформленное ядро, мембранные органоиды и митоз.
Строение бактериальной клетки
Размеры — от 1 до 15 мкм. Основные формы: 1) кокки (шаровидные), 2) бациллы (палочковидные), 3) вибрионы (изогнутые в виде запятой), 4) спириллы и спирохеты (спирально закрученные).

Формы бактерий:
1 — кокки; 2 — бациллы; 3 — вибрионы; 4—7 — спириллы и спирохеты.

Строение бактериальной клетки:
1 — цитоплазматическая мембрана; 2 — клеточная стенка; 3 — слизистая капсула; 4 — цитоплазма; 5 — хромосомная ДНК; 6 — рибосомы; 7 — мезосома; 8 — фотосинтетические мембраны; 9 — включения; 10 — жгутики; 11 — пили.
Бактериальная клетка ограничена оболочкой. Внутренний слой оболочки представлен цитоплазматической мембраной (1), над которой находится клеточная стенка (2); над клеточной стенкой у многих бактерий — слизистая капсула (3). Строение и функции цитоплазматической мембраны эукариотической и прокариотической клеток не отличаются. Мембрана может образовывать складки, называемые мезосомами (7). Они могут иметь разную форму (мешковидные, трубчатые, пластинчатые и др.).
На поверхности мезосом располагаются ферменты. Клеточная стенка толстая, плотная, жесткая, состоит из муреина (главный компонент) и других органических веществ. Муреин представляет собой правильную сеть из параллельных полисахаридных цепей, сшитых друг с другом короткими белковыми цепочками. В зависимости от особенностей строения клеточной стенки бактерии подразделяются на грамположительные (окрашиваются по Граму) и грамотрицательные (не окрашиваются). У грамотрицательных бактерий стенка тоньше, устроена сложнее и над муреиновым слоем снаружи имеется слой липидов. Внутреннее пространство заполнено цитоплазмой (4).
В бактериальной клетке отсутствуют все мембранные органоиды, характерные для эукариотической клетки (митохондрии, пластиды, ЭПС, аппарат Гольджи, лизосомы).
В цитоплазме бактерий находятся рибосомы 70S-типа (6) и включения (9). Как правило, рибосомы собраны в полисомы. Каждая рибосома состоит из малой (30S) и большой субъединиц (50S). Функция рибосом: сборка полипептидной цепочки. Включения могут быть представлены глыбками крахмала, гликогена, волютина, липидными каплями.
У многих бактерий имеются жгутики (10) и пили (фимбрии) (11). Жгутики не ограничены мембраной, имеют волнистую форму и состоят из сферических субъединиц белка флагеллина. Эти субъединицы расположены по спирали и образуют полый цилиндр диаметром 10–20 нм. Жгутик прокариот по своей структуре напоминает одну из микротрубочек эукариотического жгутика. Количество и расположение жгутиков может быть различным. Пили — прямые нитевидные структуры на поверхности бактерий. Они тоньше и короче жгутиков. Представляют собой короткие полые цилиндры из белка пилина. Пили служат для прикрепления бактерий к субстрату и друг к другу. Во время конъюгации образуются особые F-пили, по которым осуществляется передача генетического материала от одной бактериальной клетки к другой.
Редко у бактерий наблюдается половой процесс, при котором происходит рекомбинация генетического материала. Следует подчеркнуть, что у бактерий никогда не образуются гаметы, не происходит слияние содержимого клеток, а имеет место передача ДНК от клетки-донора к клетке-реципиенту. Различают три способа передачи ДНК: конъюгация, трансформация, трансдукция.

Конъюгация — однонаправленный перенос F-плазмиды от клетки-донора в клетку-реципиента, контактирующих друг с другом. При этом бактерии соединяются друг с другом особыми F-пилями (F-фимбриями), по каналам которых фрагменты ДНК и переносятся. Конъюгацию можно разбить на следующие этапы: 1) раскручивание F-плазмиды, 2) проникновение одной из цепей F-плазмиды в клетку-реципиента через F-пилю, 3) синтез комплементарной цепи на матрице одноцепочечной ДНК (происходит как в клетке-доноре (F + ), так и в клетке-реципиенте (F - )).
Трансдукция — перенос фрагмента ДНК от клетки-донора к клетке-реципиенту с помощью бактериофагов.
Вирусы
Вирусы состоят из нуклеиновой кислоты (ДНК или РНК) и белков, образующих оболочку вокруг этой нуклеиновой кислоты, т.е. представляют собой нуклеопротеидный комплекс. В состав некоторых вирусов входят липиды и углеводы. Вирусы содержат всегда один тип нуклеиновой кислоты — либо ДНК, либо РНК. Причем каждая из нуклеиновых кислот может быть как одноцепочечной, так и двухцепочечной, как линейной, так и кольцевой.
Размеры вирусов — 10–300 нм. Форма вирусов: шаровидная, палочковидная, нитевидная, цилиндрическая и др.
Капсид — оболочка вируса, образована белковыми субъединицами, уложенными определенным образом. Капсид защищает нуклеиновую кислоту вируса от различных воздействий, обеспечивает осаждение вируса на поверхности клетки-хозяина. Суперкапсид характерен для сложноорганизованных вирусов (ВИЧ, вирусы гриппа, герпеса). Возникает во время выхода вируса из клетки-хозяина и представляет собой модифицированный участок ядерной или наружной цитоплазматической мембраны клетки-хозяина.
Если вирус находится внутри клетки-хозяина, то он существует в форме нуклеиновой кислоты. Если вирус находится вне клетки-хозяина, то он представляет собой нуклеопротеидный комплекс, и эта свободная форма существования называется вирионом. Вирусы обладают высокой специфичностью, т.е. они могут использовать для своей жизнедеятельности строго определенный круг хозяев.

Только паразитируя в клетке-хозяине, вирус может репродуцироваться, воспроизводить себе подобных.
В цикле репродукции вируса можно выделить следующие стадии.

Вирус иммунодефицита человека поражает главным образом CD4-лимфоциты (хелперы), на поверхности которых есть рецепторы, способные связываться с поверхностным белком ВИЧ. Кроме того, ВИЧ проникает в клетки ЦНС, нейроглии, кишечника. Иммунная система организма человека утрачивает свои защитные свойства и оказывается не в состоянии противостоять возбудителям различных инфекций. Средняя продолжительность жизни инфицированного человека составляет 7–10 лет.
Источником заражения служит только человек — носитель вируса иммунодефицита. СПИД передается половым путем, через кровь и ткани, содержащие вирус иммунодефицита, от матери к плоду.
Смотреть оглавление (лекции №1-25)

Защита, точнее, вакцины от вирусов появились еще до того, как люди поняли, что такое вирус. Они понимали, что существуют инфекционные заболевания, но не видели никакой разницы между бактериями, вирусами и даже какими-нибудь амебами. По-видимому, первой появилась вакцина против натуральной оспы, которую английский врач Эдвард Дженнер создал в конце XVIII века. Во всяком случае, это первый документированный случай исследования и использования вакцины. Потом, уже в 1870-е годы, случилось другое знаменитое событие — создание Луи Пастером вакцины против бешенства. Это прекрасно работало и выглядело как настоящее чудо: совершенно неизлечимая болезнь, которую можно предотвратить и даже вылечить, если вовремя начать лечение при помощи этих вакцин.
Но при этом вакцины создавались вслепую. Никаких идей о том, что есть некий особый тип агента, который вызывает эти болезни, не было. Такие идеи стали появляться в самом конце XIX века. В 1890-е годы был такой русский ученый, Дмитрий Иосифович Ивановский, молодой тогда еще человек, который готовился защищать диссертацию, ничем особенно не примечательный. Он исследовал болезни табака и был первым, кто уделил внимание тому обстоятельству, что эта болезнь передавалась с соком больных растений. То есть возбудитель этой болезни как-то проходил через фильтры, которые не пропускают бактерии. Ивановский на самом деле не понимал, живой это организм или нет, он скорее думал, что это токсин, хотя и подозревал, что это начало каким-то образом репродуцирует себя. Но, как бы то ни было, первым описал такой объект, привлек внимание научного сообщества и стал, по сути, основателем вирусологии. А дальше довольно за короткое время был сделан еще ряд важных открытий: было показано, что многие болезни вызываются вирусами — ящур, желтая лихорадка, полиомиелит, саркома птиц.

Английский бактериолог Фредерик Туэрт в 1915 году описал в своей статье группу вирусов, инфицирующих бактерии, а французско-канадский микробиолог Феликс Д’Эрелль в 1917 году описал эти вирусы подробно и дал им название бактериофаги, то есть ‘пожиратели бактерий’, поскольку при добавлении к бактериям в питательной среде эти вирусы создают зону с мертвыми бактериями. Таким образом, к концу Первой мировой войны стало понятно, что существуют некие мельчайшие агенты, которые составляют совершенно особый класс паразитов.
Такой иммунитет исключительно эффективен. Однако включается пресловутая гонка: как только вирус меняется в соответствующей части генома, он становится устойчивым против вакцины. И чтобы восстановить иммунитет, хозяин должен заимствовать новые фрагменты измененного вирусного генома. Так что это такая фундаментальная (поскольку основана на центральном принципе в биологии — комплементарности нуклеиновых кислот) форма этой гонки вооружений.
Есть и другие способы борьбы. Многие вирусы разрабатывают специальные, так сказать, противозащитные средства. В частности, у вирусов очень часто есть некие белки, которые адаптируются к системе иммунитета и мешают ей. Очень часто происходит так, что вирус захватывает компонент хозяйской защитной системы и его же использует против нее. Этот компонент меняется и перестает работать, но воспринимается как работающий. И таким образом вирус как бы ставит хозяину палки в колеса. Это очень распространенное явление. Такая гонка вооружений ведет к разнообразию как вирусов, так и хозяйской системы защиты. Это важнейший фактор генерации разнообразия в процессе эволюции.
Очевидно, что какие-то вирусы подстраиваются под иммунную систему и продолжают борьбу, а какие-то оказываются побежденными. Но мы ничего не знаем об этих видах, которые существовали миллионы лет назад, но так и не прошли по пути эволюции. Правда, мы можем реконструировать какие-то предковые формы, которые оставили потомство, дошедшее до наших дней.
В ходе эволюции у вирусов появились и другие способы выживания. Они могут встроить свой геном в клетку хозяина и таким образом жить. Однако когда что-то плохое угрожает его существованию, вирус активируется, выходит из своего полусонного состояния, убивает хозяина и переходит к другому. Вообще говоря, в ходе эволюции победили именно те паразиты, которые умеют сочетать названные две стратегии. Это как умение правильно распределять свои ставки в казино. И очень важно понимать, что гибель хозяина или его тяжелое состояние ни в коем случае не является чем-то выгодным для паразита. Это побочный эффект его деятельности.
Размножение вирусов, как правило, не сулит ничего хорошего индивидуальным организмам. Хотя, с другой стороны, вирусы могут стимулировать иммунитет. Были даже попытки вылечить рак при помощи заражения вирусами. Но в целом в ходе эволюции паразиты и вирусы играют огромную роль, без них не было, нет и не будет никакой жизни. И вся история жизни — это история совместной эволюции взаимодействия паразитов с хозяином. И увеличение сложности защиты хозяев, совершенствование иммунной системы было бы невозможно без постоянного взаимодействия с паразитами. В частности, можно математически показать, что возникновение многоклеточных организмов стимулируется во многом именно защитой от вирусов. Многоклеточность становится выгодной тогда, когда клетки атакуются вирусом: выгодно, когда одна клетка принимает на себя удар и при помощи механизмов программируемой клеточной смерти может себя убить и избавить других от вируса. И многие другие приспособления, которые существуют у клеточных организмов, связаны либо с защитой от вирусов, либо с генетическим материалом, который хозяин получает от вируса.
Можно привести следующий пример. Есть довольно знаменитый фермент под названием теломераза — это тот фермент, который обеспечивает стабилизацию наших хромосом, как бы следит за тем, чтобы они не становились короче. Это совершенно необходимо для выживания организма, и активность этого фермента связана как со старением, так и с раком. И изначально, на заре становления эукариот, эта самая теломераза была не чем иным, как обратной транскриптазой, которая у ранних эукариот входила в состав одного из мобильных генетических элементов. И нужно всегда помнить, что наш собственный геном где-то на две трети или чуть меньше состоит из остатков мобильных генетических элементов. Большинство людей полагают, что это бесполезный мусор, но их так много, что многие из них используются для всяких нужд. Таким образом, эволюция хозяев никогда не свободна от паразитов и очень многое от них берет.
В 1971 году великий американский ученый Дэвид Балтимор предложил классифицировать вирусы в зависимости от типа геномной нуклеиновой кислоты — ДНК или РНК. Тип вируса, согласно этой классификации, определяет цикл его размножения. Но в природе эти классы распределены очень неравномерно. Если мы посмотрим, какие виды вирусов заражают разные организмы, получится интересная картина. У бактерий и архей подавляющее большинство — это вирусы, содержащие двуцепочечную ДНК. А у эукариот существенно преобладают РНК-вирусы, которых существует просто фантастическое разнообразие. Причины этих различий очень интересны, но хорошо понятны только в немногих случаях. Например, большие ДНК-содержащие вирусы не могут распространяться в растениях, они там не выживают и присутствуют только в водорослях. У высших растений их место занимают РНК-содержащие вирусы. Вот это понятие ниши как раз и определяет, по-видимому, различия в распространении вирусов. Но это не всегда можно точно понять.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
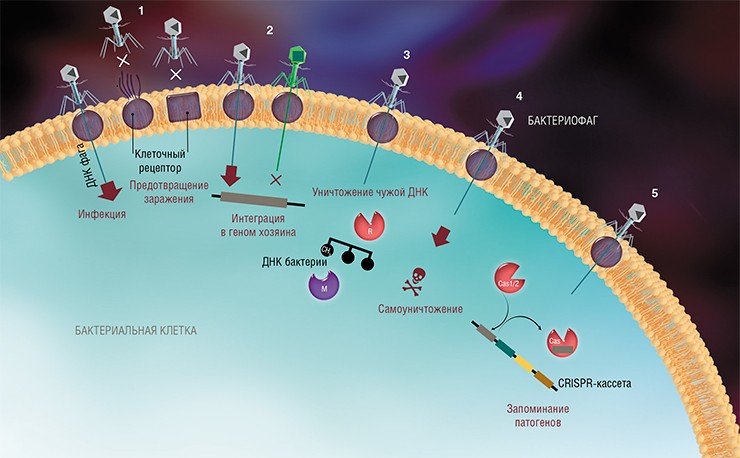
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)

Реконструкция мимивируса по электронной микрофотографии.
Xiao C, Kuznetsov YG, Sun S, Hafenstein SL, Kostyuchenko VA, et al. (2009)
Американские ученые описали новую группу гигантских вирусов, которые кодируют множество необычных генов, в том числе целый ряд компонентов аппарата трансляции, которых раньше у вирусов описано не было. Филогенетический анализ показал, что такое разнообразие свидетельствует не в пользу теории о клеточном или независимом происхождении домена вирусов, а является следствием увеличения генома более мелких предков. Исследование опубликовано в Science.
Происхождение вирусов до сих пор остается загадкой. Существует, как минимум, три гипотезы, описывающие этот процесс. Согласно первой, вирусы когда-то были мелкими клетками, паразитирующими внутри более крупных, и утратили за ненадобностью большую часть собственных генов и, как следствие, и другие органеллы. Согласно второй гипотезе, вирусы в прошлом были фрагментами ДНК или РНК нормальных клеток, которые отделились от своих хозяев в виде плазмид (небольших кольцевых ДНК, способных передаваться от клетки к клетке) или транспозонов (самостоятельных элементов ДНК, способных перемещаться внутри генома с места на место и реплицироваться отдельно от остальных). Согласно третьей гипотезе, вирусы возникли независимо во время зарождения жизни на планете и с самого начала ведут паразитический образ жизни.
Большинство известных вирусов имеет диаметр до 300 нм, однако существуют и так называемые гигантские вирусы, достигающие 300 нм и больше (рекордсменом является найденный в 2014 году в многолетней мерзлоте Сибири Pithovirus, достигающий 1,5 мкм в длину и 0,5 мкм в диаметре). Гигантские вирусы зачастую являются носителями генов, нетипичных для своих собратьев, в том числе генов аппарата трансляции, необходимого для синтеза белков. Согласно разным гипотезам, они опять-таки могли возникнуть за счет упрощения древней клеточный формы, или за счет собирания генов у других организмов изначально небольшими вирусами.
Исследуя метагеномы образцов из австрийских очистных сооружений города Клостернойбург, ученые обнаружили новый гигантский вирус, который назвали Klosneuvirus. Собранный геном этого вида оказался большим (1,57 Мб). Метатранскриптомные данные показали, что по крайней мере 15% генов этого вируса являются рабочими. Снимки, полученные с помощью электронной микроскопии, позволили предположить наличие у него типичной икосаэдрической структуры размерами около 300 нм.
По результатам поиска родственников Klosneuvirus, среди 7000 метагеномов таких обнаружилось трое, размерами 0,86 Мб (Indivirus), 1,33 Мб (Hokovirus) и 1,53 Мб (Catovirus). В их геномах ученые выявили около 2500 новых семейств генов, которые никогда раньше не были описаны для вирусов. 355 из них были семействами, известными среди эукариот, но лишь 14 таких эукариотических семейств нашлось у всех четырех новых вирусов одновременно. Это подчеркивает разнообразие группы Klosneuviruses, и указывает на то, что хозяева у них, скорее всего, разные. Таксономическая классификация метагенома, сделанная с помощью анализа 18s РНК, показала, что их хозяева относятся, по-видимому, к типу Cercozoa. Это отличает Klosneuviruses от других гигантских вирусов, которые паразитируют на амебах из рода Acanthamoeba, и лишний раз подчеркивает важность методики изучения вирусов по отдельности, без изначальной привязки к хозяину.

Эволюция геномов и филогенетическое положение Klosneuviruses, сделанное на основе сравнения ортологических генов гигантских вирусов. Правая панель отражает число картированных ортологов.
- 767
- 0,6
- 0
- 2
У вирусов архей семейства Bicaudaviridae вирионы имеют крайне необычную морфологию: к одному или двум концам заостренного капсида прикрепляются белковые хвосты, длина которых может варьировать.
Вирусы заражают все клеточные формы жизни, и археи — не исключение. Хотя сейчас известно гораздо меньше вирусов архей, чем вирусов бактерий и эукариот, разнообразие устройства их вирионов и используемых молекулярных механизмов поражает воображение: некоторые из них имеют вирионы в форме бутылки, у других генетический материал в вирионе хранится в форме А-ДНК, третьи обзавелись уникальным типом биологических мембран или используют для выхода из зараженной археи ранее неизвестные клеточные структуры. Наша статья посвящена этим пока еще малоизученным, но удивительно самобытным генетическим элементам.
Давно прошли те времена, когда археи считались обитателями исключительно тех мест, где никакая другая клеточная жизнь существовать не может, например, горячих источников. В действительности, архей можно найти везде, даже в желудочно-кишечном тракте человека, однако наиболее многочисленны они на глубоководьях морей и океанов. Так, показано, что археи, окисляющие ионы аммония до нитрата (они относятся к типу Thaumarchaeota) являются одной из самых многочисленных клеточных форм жизни в океанах. Неудивительно, что и вирусы архей также очень многочисленны: метагеномный анализ показал, что в некоторых зонах на долю вирусов архей приходится около 10% самых распространенных там вирусов. Объемы клеток архей, которые погибают из-за вирусов, тоже впечатляют: установлено, что в верхних 50 см океанического донного грунта клетки архей, лизированные вирусами, составляют до трети всей ежегодной биомассы погибших микробов, что соответствует 0,3–0,5 гигатоннам углерода ежегодно [1].
Все известные на данный момент вирусы архей имеют геномы, представленные ДНК: одноцепочечной или двухцепочечной, кольцевой или линейной. Недавно, однако, в горячих источниках Йеллоустонского национального парка, которые населены почти исключительно археей Sulfolobus solfataricus, с помощью метагеномики обнаружили вирусный РНК-геном, отдаленно напоминающий эукариотические РНК-вирусы, поэтому, возможно, существуют и РНК-содержащие вирусы архей.
Пока вирусы архей представлены 17 семействами. Стоит отметить, что вирусы архей, вообще-то, составляют две сильно различающиеся группы. К первой относят вирусы, которые структурно и генетически близки к вирусам бактерий и эукариот, а ко второй — вирусы, уникальные для архей и мало похожие на вирусы других клеточных форм. Практически все специфические для архей вирусы поражают представителей типа Crenarchaeota, а вирусы, близкие к бактериофагам и вирусам эукариот, чаще всего паразитируют на археях типа Euryarchaeota [1].
Строение вирусных частиц
Вирусы, специфичные для архей, нередко имеют вирионы необычной формы (рис. 1а).
Так, представители семейства Ampullaviridae имеют вирионы в виде бутылок из-под шампанского, причем поверх белков капсида они обтянуты липидной оболочкой. А у членов семейства Spiraviridae вирионы в виде спиралей. Столь необычная форма вирионов у вирусов этих двух семейств связана с особым способом упаковки генома при помощи белков капсида [1].

Рисунок 1а. Морфология вирионов вирусов, специфичных для архей. Просвечивающая электронная микроскопия.
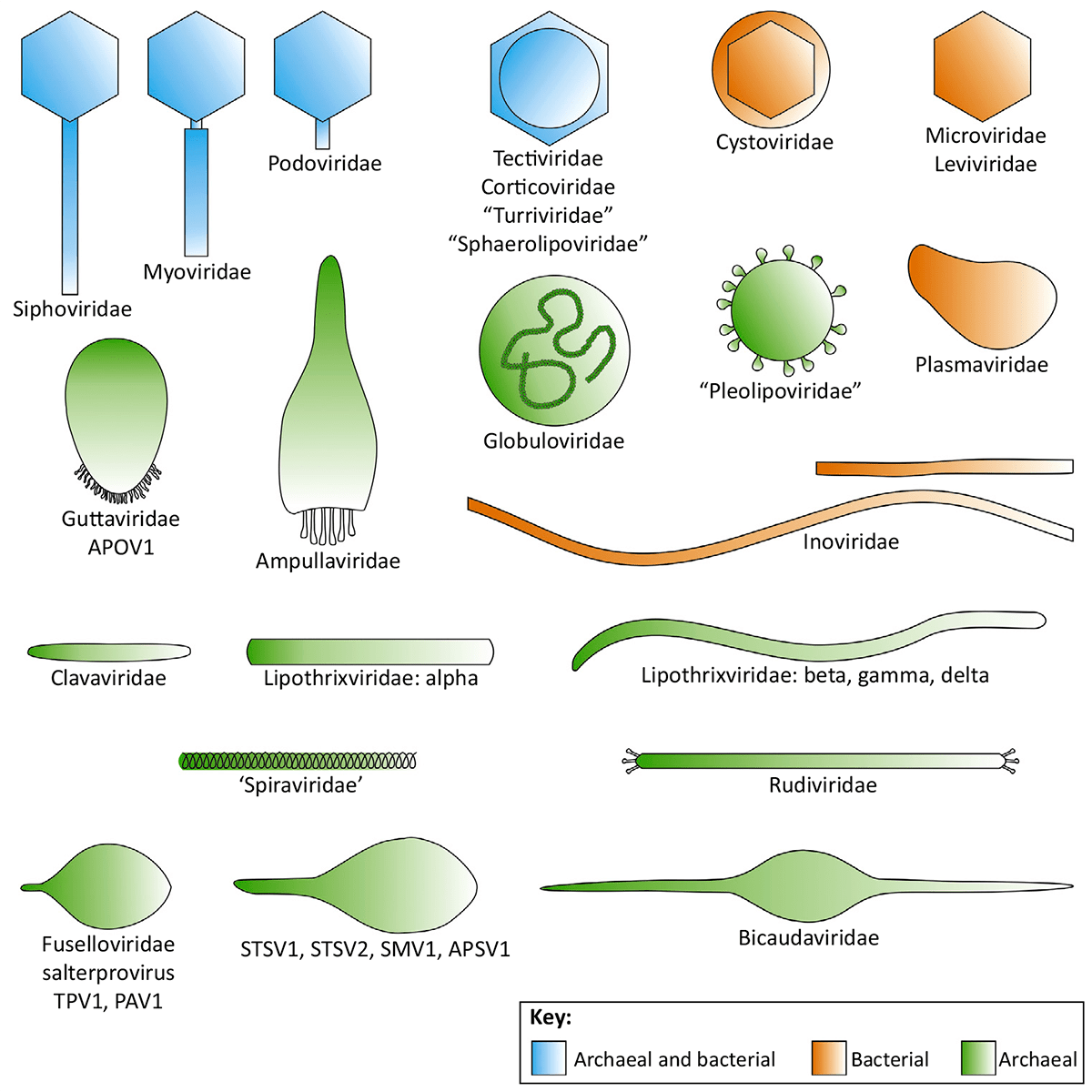
Рисунок 1б. Морфология вирионов некоторых вирусов архей и бактерий
Некоторые специфичные для архей вирусы имеют веретеновидные капсиды. Среди них у вирусов семейства Fuselloviridae на одном из заостренных концов капсида находится пучок белковых филаментов, а у членов семейства Bicaudaviridae на одном или двух концах капсида — одиночные придатки в виде хвостов. Не менее удивительна морфология вирионов Guttaviridae: у этих вирусов вирионы тоже похожи на веретено, однако один их конец закруглен и имеет каплевидную форму [1].
У многих специфичных для архей вирусов нитчатые вирионы, которые могут нести специальные придатки, предназначенные для распознавания клеток архей. Иногда, как у вирусов семейства Tristromaviridae, капсид сформирован не одним, а тремя типами белков [1].
Некоторые вирусы, специфичные для архей, имеют сферические вирионы, причем иногда поверх капсида находятся липидная мембрана и еще один слой белков, из-за чего частицы принимают икосаэдрическую форму [1].
Вирионы Pleolipoviridae по строению похожи на везикулы, которые образуют многие археи: голая геномная ДНК находится внутри мембранного пузырька, который пронизан белками двух типов. Такие пузырьки могут содержать как одноцепочечную, так и двухцепочечную ДНК линейной или кольцевой формы [1].

Рисунок 2. Морфология вирионов вирусов архей, родственных бактериофагам и вирусам эукариот. Просвечивающая электронная микроскопия.
Чем можно объяснить столь необычную морфологию вирусов архей? Вирионы некоторых из них удалось не только рассмотреть под электронным микроскопом, но и детально изучить с помощью криоэлектронной микроскопии. Так ученые выяснили, что геномы некоторых вирусов архей в капсидах находятся в А-форме! Это первый известный случай, когда А-форма ДНК присутствует в живых организмах в нормальных условиях. Один из вирусов с геномом в виде А-ДНК, AFV1, имеет очень тонкую липидную оболочку с необычным химическим составом — главным ее компонентом является липид глицеролдибифитанилглицеролтетраэфир (GDGT-0), имеющий необычную U-образную конфигурацию (рис. 3). В мембране, состоящей их таких липидов, их гидрофильные головки обращены наружу, а гидрофобные дуги — внутрь. Наряду с фосфолипидным бислоем и монослоем архей такое строение можно считать третьим из известных типов биологических мембран [1].
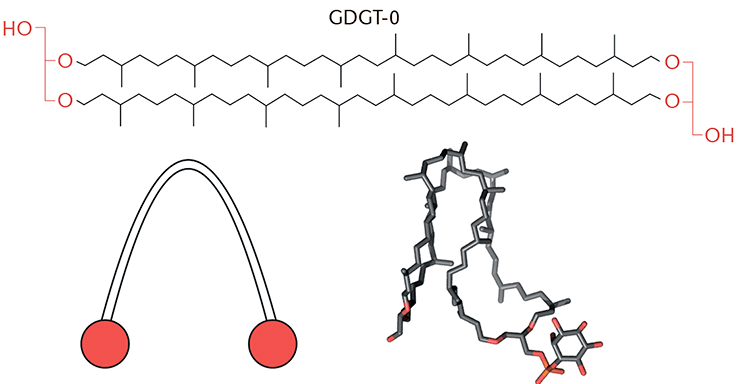
Рисунок 3. Химическая структура GDGT-0 (вверху), его схематическое представление (внизу слева; красным цветом показаны гидрофильные головки) и модель (внизу справа) в U-образной конформации подпись
Геномы
Все выделенные на данный момент вирусы архей имеют ДНК-геномы (хотя, как отмечалось выше, в горячих источниках Йеллоустона с помощью метагеномики удалось найти РНК-геном возможного вируса архей). В большинстве случаев геном представлен двухцепочечной молекулой ДНК, и лишь у членов семейств Spiraviridae и Pleolipoviridae геномы состоят из одноцепочечной ДНК. Размеры геномов архейных вирусов варьируют от 5300 пар нуклеотидов (п.н.) у клававируса APBV1 (это один из мельчайших известных геномов ДНК-содержащих вирусов) до 143 800 п.н. у миовируса HGTV-1. Как правило, вирусы, специфичные для архей, имеют меньшие геномы, чем вирусы архей, родственные бактериофагам и вирусам эукариот [2].
Механизмы репликации геномов вирусов архей экспериментально изучены лишь для небольшого числа вирусов. Известно, что ДНК представителей порядка Caudovirales (которые, кстати, имеют самые большие геномы среди архейных вирусов) кодирует часть или даже все компоненты аппарата репликации ДНК: ДНК-полимеразы, белки скользящего зажима (PCNA), праймазы и хеликазы. Имеющие более скромные размеры геномов вирусы архей, как правило, кодируют белки, которые необходимы для привлечения аппарата репликации клетки-хозяина. Стоит, однако, отметить, что в геномах многих вирусов, специфичных для архей, не удалось найти белки, связанные с репликацией ДНК, так что они либо полностью зависимы от аппарата репликации клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы репликации ДНК. Например, удалось показать, что и инициация, и терминация репликации генома липотриксвируса AFV1 связаны с рекомбинационными процессами [1].
Механизмы упаковки генома в капсид у вирусов архей детально не изучены. Тем не менее известно, что члены порядка Caudovirales имеют гомологи терминазы, которая упаковывает геномную ДНК в пустой капсид. Механизм формирования вирионов с использованием терминазы используют также вирусы бактерий и эукариот. Можно предположить, что упаковка генома в капсид у вирусов архей протекает так же, как и у бактериофагов и вирусов эукариот, а вот в плане репликации ДНК вирусы архей или целиком зависят от клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы [1].
Взаимодействие с клеткой-хозяином
Выход зрелых вирионов из клетки архей во многих случаях напоминает отпочковывание от эукариотической клетки-хозяина у вируса гриппа, ВИЧ и вируса Эбола. Когда вирион покидает клетку археи, он забирает с собой фрагмент ее мембраны, который становится дополнительной оболочкой поверх капсида. У некоторых вирусов архей финальные стадии созревания вирионов происходят уже после выхода из клетки, когда капсид претерпевает морфологические перестройки [1].
У некоторых вирусов архей (а именно, представителей семейств Rudiviridae и Turriviridae) все стадии созревания вириона проходят в цитоплазме клетки. Новые вирусные частицы покидают клетку через специальные структуры с семиосевой симметрией на их поверхности, которые получили название вирусассоциированных пирамид (virus-associated pyramids, VAP). VAP образуются на внутренней поверхности мембраны зараженной клетки, проходят сквозь ее поверхностный S-слой и открываются на финальных этапах инфекции, давая возможность вирионам выйти из клетки (рис. 4) [1].

Рисунок 4. Вирусассоциированная пирамида. а и б — Пирамида на поверхности клетки археи Pyrobaculum oguniense в закрытой (а) и открытой (б) конформациях. в и г — Открытая пирамида вируса SIRV2 на поверхности Sulfolobus islandicus. а–в — Визуализация с помощью трансмиссионной электронной микроскопии. г — С помощью электронной криотомографии (CryoET).
Выход некоторых вирусов архей из клетки сопровождается ее лизисом. К их числу относятся вирусы семейства Tristromaviridae, которые, хотя и развиваются целиком в цитоплазме, каким-то образом ухитряются приобрести липидную оболочку. Примечательно, что сифовирус ψM2 кодирует фермент псевдомуреинэндоизопептидазу, который разрушает псевдомуреиновую клеточную стенку археи [1].
Эволюция и родственные связи
Вирусы, специфичные для архей, как правило, заражают только представителей типа Crenarchaeota. Они отличаются от всех других вирусов не только нестандартной морфологией вирионов, но и генетически: около 90% их генов не имеет гомологов в существующих базах данных. В геномах некоторых архейных вирусов не удалось найти ни одного белка, для которого существовал бы функционально охарактеризованный белок-гомолог.
Иногда, если гомологию не удается установить по нуклеотидным или аминокислотным последовательностям, на помощь приходят пространственные структуры. Действительно, для различных белков вирусов архей получили пространственные структуры, но ситуация от этого не стала яснее: оказалось, что во многих из них содержатся совершенно уникальные структурные мотивы. Более того, функции многих генов вирусов архей совершенно непонятны: так, оказалось, что фузелловирус SSV1 может спокойно обойтись без половины своих генов. Можно предположить, что такие неохарактеризованные гены-сироты кодируют белки, участвующие во взаимодействии вируса с клеткой архей, например, противодействующие системам CRISPR-Cas [1].
Впрочем, многие вирусы архей родственны некоторым бактериофагам и вирусам эукариот. Однако вирусы, специфичные для архей, стоят особняком среди всех ДНК-содержащих вирусов. Более того, различные группы вирусов, специфичных для архей, неродственны друг другу и эволюционируют независимо друг от друга. Высказывается предположение, что некоторые группы специфичных для архей вирусов появились на заре эволюции клеточной жизни и были впоследствии утрачены бактериями и эукариотами. Другие группы специфичных архейных вирусов могли появиться в момент обособления домена архей или даже позже, в отдельных группах архей [1].
Любопытно, что некоторые вирусы архей родственны лишенным капсидов мобильным генетическим элементам (например, плазмидам) . Эти вирусы, так же как и мобильные генетические элементы, имеют родственные гены основных белков репликативного аппарата [1], [2].
Несмотря на то, что мы только-только начинаем приподнимать завесу тайны над вирусами архей, многие уже известные особенности их морфологии или генетического аппарата поражают воображение. Несомненно, дальнейшее изучение вирусов архей при помощи метагеномики и других подходов подарит нам множество сюрпризов.
Читайте также:


