Проявления эпидемического процесса бешенства

Автореферат диссертации по медицине на тему Эпидемиологические и эпизоотологические особенности бешенства в Липецкой области, пути совершенствования эпидемиологического надзора
На правах рукописи
ОЧКАСОВА Юлия Витальевна
ЭПИДЕМИОЛОГИЧЕСКИЕ И ЭПИЗООТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ БЕШЕНСТВА В ЛИПЕЦКОЙ ОБЛАСТИ, ПУТИ СОВЕРШЕНСТВОВАНИЯ ЭПИДЕМИОЛОГИЧЕСКОГО НАДЗОРА
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук
Заслуженный деятель науки РФ, доктор медицинских наук, профессор Зуева Людмила Павловна
Ученый секретарь диссертационного совета,
доктор медицинских Ширинский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. В мире на современном этапе происходит глобальный рост рабической инфекции. В Российской Федерации (РФ) также обострилась проблема бешенства вследствие формирования новых очагов инфекции, а также на фоне обострения социальных проблем, сокращения централизованного финансирования профилактических мероприятий. Бешенство приносит серьезный экономический ущерб, ежегодные затраты на иммунизацию населения составляют десятки миллионов рублей, на вакцинацию диких и сельскохозяйственных животных - 15 и более млн. рублей, ликвидацию очагов бешенства - около 8-9 млн. рублей (Черкасский Б.Л. с соавт., 2005).
В 2007 - 2011 гг. бешенство животных регистрировалось в 69 субъектах; самыми неблагополучными являлись Центральный (плотность инфекции - 2,5 случаев бешенства на 1000 кв. км) и Приволжский (1,3) ФО.
Негативными факторами, способствующими активизации эпизоотического и эпидемического процессов, являются неполный охват домашних животных учетом, профилактической иммунизацией, рост численности бездомных животных, нарушение правил содержания домашних животных, неудовлетворительное проведение мероприятий по регулированию численности диких плотоядных (Черкасский Б.Л. с соавт., 2005).
Для Липецкой области изучение данных вопросов крайне актуально, т.к. она входит в пятерку наиболее неблагополучных субъектов РФ по бешенству животных. По плотности инфекции область заняла 2 место после Белгородской (5,7 и 7,3 соответственно). С 2002 г. зарегистрирована самая интенсивная эпизоотия за последние 40 лет. Проблема профилактики гидрофобии относится к группе инфекций, имеющих наиболее высокую эпидемиологическую и экономическую значимость на территории области. Показатель обращаемости за антирабической помощью населения области (315,5°/оооо) превышает средний в РФ (Бешенство в Российской Федерации: инф.-аналит. бюллетень, 2013 г.).
Перечисленное указывает на высокий риск инфицирования населения области лиссавирусами. Поэтому исключительную важность на региональном уровне приобретают углубленный ретроспективный анализ эпидемиологических и эпизоотологических особенностей бешенства, выявление групп, территорий риска, времени и факторов риска, которые позволят совершенствовать систему эпидемиологического надзора, снизить риск развития гидрофобии.
Степень разработанности темы исследования. Изучены особенности эпизоотического процесса бешенства в период 1954 - 2005 гг., проведено ранжирование районов по степени опасности возникновения вспышек бешенства по количеству случаев бешенства животных на административных территориях Липецкой области (1993 - 2005 гг.). Изучена профилактика бешенства в части, касающейся эффективности оральной вакцинации (Жуков И.В., 1985; Гурьев М.С., 2009). Однако важен вопрос изучения особенностей эпизоотического процесса бешенства в современный период, углубленный анализ профилактических мероприятий (иммунизация домашних плотоядных животных, отлов бездомных животных, отстрел лисиц), ранжирование административных территорий области по степени эпидемиологической опасности заражения бешенством по интегральному показателю для дифференцированного проведения профилактических мероприятий.
Изучена вирулентность циркулирующих в Липецкой области изолятов лиссавирусов (Гурьев М.С., 2009). Однако актуальное значение приобретает изучение биологических и генетических свойств возбудителя и их роли в распространении инфекции.
Частично изучены эпидемиологические особенности бешенства в Липецкой области в 1996 - 2002 гг. (Мищук В.И. с соавт., 2003). Однако не выявлены эпидемиологические особенности бешенства, не установлены факторы риска развития гидрофобии, отсутствуют предложения по совершенствованию системы эпидемиологического надзора.
Цель_исследования - совершенствование системы
эпидемиологического надзора, мер профилактики бешенства на основе выявленных эпидемиологических и эпизоотологических особенностей бешенства в Липецкой области.
1. Выявить региональные особенности эпизоотического процесса за период с 1954 по 2010 гг. для ранжирования территорий области по степени риска заражения бешенством, современные особенности за период с 2001 по 2010 гг.
2. Выявить биологические особенности циркулирующих лиссавирусов.
3. Выявить особенности эпидемического процесса на территории области за период с 1954 по 1995 гг.
4. Провести оценку существующей системы эпидемиологического надзора за бешенством в Липецкой области за период с 2001 по 2010 гг.
5. Разработать и внедрить дополнительные меры эпидемиологического надзора за бешенством на территории области.
Научная новизна работы. Выявлены эпизоотологические особенности бешенства в современный период (2001 - 2010 гг.), характеризующиеся высокой интенсивностью эпизоотического процесса, природным типом, выраженной зимне-весенней и осенне-зимней сезонностью, поддерживаемым лисицей. Изучены эпизоотические особенности для каждой группы животных, вовлеченных в эпизоотический процесс. Установлены факторы, определяющие интенсивность эпизоотического процесса: плотность популяции лисиц и бездомных животных на территориях.
Впервые проведено интегральное ранжирование с учетом индекса эпизоотичности, плотности инфекции, плотности популяции лисиц на 1000 кв. км. территорий, по степени эпидемиологической опасности заражения бешенством, определены территории риска.
Впервые выявлены эпидемиологические особенности бешенства в области, характеризующиеся низкой интенсивностью, весенне-летней сезонностью, преобладанием в структуре взрослых мужчин. Изучены факторы риска развития гидрофобии: опасная локализация покусов, не обращение или несвоевременное обращение за антирабической помощью, прерывание или неполный курс иммунизации. Установлены негативные факторы увеличивающие риск развития гидрофобии в современный период: интенсивное вовлечение детей 7-14 лет, рост обращаемости по поводу покусов, нанесенных бездомными животными.
Впервые установлено, что в области циркулируют средне - и высоковирулентные лиссавирусы, относящиеся к кластеру степных вирусов бешенства с высоким уровнем гомологии с вирусами Белгородской и Воронежской областей, являющихся частью Среднерусского природно-очагового региона.
Разработаны и внедрены дополнительные мероприятия в систему эпидемиологического надзора за бешенством.
Обоснована тактика иммунизации домашних и сельскохозяйственных животных против бешенства в зависимости от сезонности эпизоотического процесса и степени риска эпидемической опасности территории.
Теоретическая и практическая значимость работы. Изучены вирусологические, молекулярно-генетические особенности циркулирующих
вирусов бешенства, группы риска, территории риска, время, факторы риска, влияющие на активность эпидемического и эпизоотического процессов бешенства на территории области.
Усовершенствована система эпидемиологического надзора за бешенством в области.
Обоснована тактика иммунизации животных против бешенства в зависимости от сезонности эпизоотического процесса и степени риска эпидемической опасности территории.
Для достижения цели и решения поставленных задач использовались эпидемиологические, статистические, зоологические, вирусологические, молекулярно-генетические, филогенетические методы исследований.
Положения, выносимые на защиту:
1. Липецкая область с 2007 г. находится на втором месте в РФ по активности эпизоотического процесса (плотность инфекции - 5,7 на 1000 кв. км), с 2002 г. зарегистрирована самая интенсивная эпизоотия за последние 40 лет. Основной резервуар инфекции - лисица красная, неблагоприятным фактором является превышение ее численности относительно эпизоотически безопасного уровня (1 особь на 1000 га охотничьих угодий) на территориях области в 2,0 - 3,7 раза.
2. Молекулярно-генетическими исследованиями лиссавирусов установлено, что они относятся к кластеру степных вирусов, циркулирующих на сопредельных территориях Воронежской, Белгородской, Тульской областей, являющихся частью Среднерусского природно-очагового региона.
3. Выявленные особенности эпизоотического и эпидемического процесса бешенства на территории области позволили разработать предложения по совершенствованию эпидемиологического надзора и основные направления проведения профилактических мероприятий.
Степень достоверности и апробация работы. Достоверность полученных результатов и выводов обеспечена представительностью анализируемых выборок, использованием адекватных и современных методов исследования и статистической обработкой полученных результатов, методик проведения расчетов, выполнением исследований на базе аккредитованных лабораторий, апробацией результатов и положений в рецензируемых журналах.
Публикации. По теме диссертации опубликованы 13 научных работ, в том числе 5 - в изданиях, рекомендованных Высшей аттестационной
комиссией Минобрнауки РФ для публикаций основных положений диссертаций на соискание ученой степени.
Структура и объем диссертации. Диссертация изложена на 166 страницах компьютерного текста, иллюстрирована 26 таблицами, 1 фотографией и 80 рисунками. Диссертация состоит из введения, обзора литературы, главы, описывающей материалы и методы исследований, 3 глав собственных исследований, заключения, выводов, указателя литературы, приложения. Библиографический указатель включает 170 источников, в том числе 41 - зарубежных.
Материалы и методы исследований. Для анализа эпидемиологических и эпизоотологических особенностей бешенства использовались материалы официальной статистики: формы государственного статистического наблюдения (ф. 2 -10) с обработкой данных о 37589 лиц, учтенных по поводу повреждений, нанесенных животными; (ф. 5, 6) с обработкой данных о профилактической иммунизации (6922 лиц); карты эпизоотолого-эпидемиологического обследования очага заболевания (ф. 391/у - 1117, в т.ч. 22 - на случаи гидрофобии), карты обратившихся за антирабической помощью (ф. 045/У - 7278), внеочередные донесения на очаги бешенства (подозрения) животных (1870), информационно-статистические бюллетени ветеринарной и санитарно-эпидемиологической служб области за 40 лет (80), обработка данных о вакцинации (719445 животных), отлове (148309), отстреле лисиц (23984).
Проведены зоомикробиологические исследования биоматериала от 1969 домашних, сельскохозяйственных, диких животных с подозрением на бешенство и 20 рукокрылых методами флюоресцирующих антител (1661), биологической пробы (860); иммуноферментного анализа, молекулярно-генетическими, включая секвенирование, вирусологическими (14 штаммов лиссавирусов). Филогенетический анализ проводили методом ближайшего соседа (пе!§ЬЬог]о1пт§, N1) с изолятами из Белгородской, Воронежской (п=7), данными Генбанка об изолятах с территорий Евразии, Северной Америки и Японии (п=61).
1. Проявления эпизоотического процесса бешенства на территории Липецкой области. Липецкая область - индустриально-аграрный субъект Центрального ФО. Из диких хищников наиболее многочисленный вид -лисица красная, её плотность в изучаемый период колебалась от 2,03 до 3,7 на 1000 га охотничьих угодий (показатель эпизоотологического благополучия - 1 особь на 1000 га). Численность популяции лисиц определяется условиями обитания: на большей части территории (70% площади области) выявлена сильная отрицательная связь (г= -0,75) между плотностью лисиц и распаханностью земельных угодий.
Численность домашних животных оценивалась по данным вакцинации, численность безнадзорных животных - по данным отлова, однако действительная численность популяций значительно больше, т.к. полный учет и отлов не организованы.
Наблюдается позитивная тенденция учета и вакцинации владельческих собак, показатель на 1000 жителей вырос в 1,9 раза (с 27,9 в 2001 г. до 51,9 в 2010г.). До 2005 г. учет и вакцинация домашних кошек практически не проводились, в результате актуализации данных мероприятий показатель вакцинации из расчета на 1000 жителей вырос в 21,1 раза (с 1,7 в 2001 г. до 35,8 в 2010 г.).
Тенденция к снижению плотности популяции безнадзорных животных (число особей на 1 км2 населенных пунктов) отсутствовала, что согласуется со стабильно высокой обращаемостью пострадавших от укусов бездомных животных и свидетельствует о недостаточности мероприятий по регулированию их численности.
Эпизоотический процесс на территории области характеризуется высокой интенсивностью. За последние 40 лет был зарегистрирован 2081 случай бешенства, в среднем - 49,2 случая в год. В течение 3-х десятилетий показатель был ниже среднего многолетнего и последовательно снижался (1971-1980 гг. - 46,0; 1981 - 1990 гг. - 33,2; 1991 - 2000 гг. - 8,1), в период
(2001 - 2010 гг.) был максимальным - 109,5, превысив в 2,2 раза среднемноголетний показатель. Последнее связано со значительным сокращением с 2000г.и не проведением (отдельные годы) иммунизации диких животных (Гурьев MC., 2009). Многолетняя динамика заболеваний животных бешенством характеризуется умеренной тенденцией к росту (среднегодовой темп прироста - 3,1%).

Дата публикации: 21.05.2017 2017-05-21
Статья просмотрена: 79 раз
В статье представлена модель эпидемического процесса с последующим исследованием соотношения времени и интенсивности вакцинации для предотвращения вспышки заболеваемости.
С помощью математической модели исследуется проблема поддержания коллективного иммунитета, обеспечивающего сдерживание вспышки заболеваемости.
Задачи практической эпидемиологии связаны с отысканием необходимых уровней коллективного иммунитета, обеспечивающих сдерживание эпидемического процесса в пределах, определяемых эпидемическим порогом. Это осуществляется путём вакцинации, обеспечивающей получение нужного уровня коллективного иммунитета.
Для расчёта граничных параметров вакцинации можно использовать математическое моделирование динамики групп населения с помощью систем дифференциальных уравнений. Используя и модифицируя уже существующие модели, описывающие естественное развитие эпидемий, можно сделать выводы о характеристиках необходимого управления. Цель статьи — описать метод получения границы области с допустимыми параметрами вакцинации при реализации модели эпидемии в прикладном пакете Simulink
Для описания динамики развития эпидемического процесса в группе воспользуемся классической моделью Кермака-Кендрика [1], дополнив её управляющим воздействием в виде активной вакцинации. Она вызывает у восприимчивых иммунный ответ организма – формирование антител, занимающее некоторое время TV. В результате вакцинированные становятся иммунными.
Пусть S – число восприимчивых в группе детей, I — число инфицированных, Iv — число вакцинированных, R — число иммунных; u — интенсивность вакцинации в группе детей, λ — заболеваемость (человек в сутки).
Тогда развитие управляемого эпидемического процесса описывается следующей системой дифференциальных уравнений:
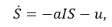
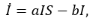
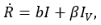
(1)
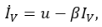
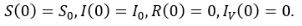
Будем полагать, что вакцинация начинается в момент T0 = 0 и длится не более Tm дней. Развитие эпидемического процесса будем прослеживать на протяжении TE дней. Требуется построить кривую 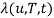
— границу области допустимых управлений, то есть области, в которой
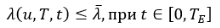
(2)
Для решения построим модель нашей системы (1) в пакете Simulink (рис. 2). Каждому конкретному значению u = uk ищем такую длительность вакцинации TP ≤ Tm, что заболеваемость λ не превосходит пороговой 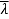
. Или, наоборот, для интересующих нас значений продолжительности T = TP ≤ Tm периода вакцинации находим интенсивность, обеспечивающую выполнение неравенства (2). По полученным точкам строим кривую.
Так как вакцинация длится на протяжении не более трёх осенних месяцев, то в качестве Tm берем 100 дней. Будем полагать, что эпидемия заканчивается в конце марта: TE = 200 дней.
Пусть в некотором крупном городе имеется 1 миллион восприимчивых человек: S0 = 1000. А 900 человек (I0 = 0.9) инфицированы некоторым вирусом с характерным временем болезни Ti = 10 дней. Предположим также, что против данного вируса существует вакцина, которая дает иммунитет примерно через две недели (TV = 15). Определим коэффициенты нашей системы:
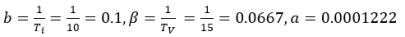
(3)
Возьмем 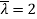
. Применяя описанную методику к данному примеру получим решение поставленной задачи в следующем виде.
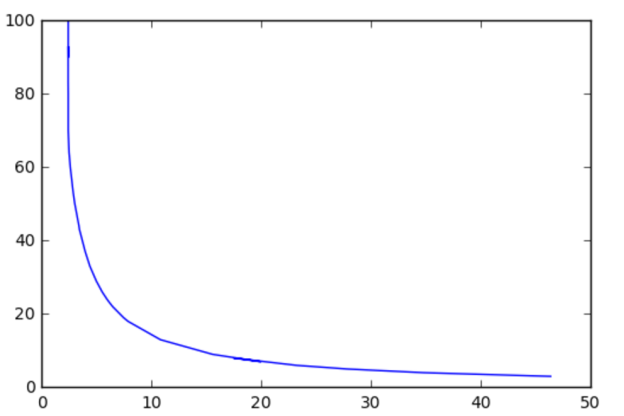
Рис. 1. По оси абсцисс — u, по оси ординат — Т
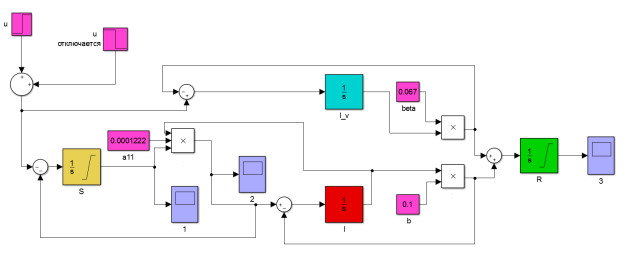
Визуальное представление модели в системе Simulink облегчает восприятие механики взаимодействия групп населения. Кроме того, модель крайне проста и легко модифицируема. Константы a, b и β, начальные условия, продолжительность и интенсивность вакцинации — все это можно изменить, открыв соответствующие блоки.
В ходе исследования было обнаружено, что в условиях рассматриваемого примера при вакцинации с параметрами u = 138.7, Т = 1 (то есть за один день) заболеваемость не превзойдет пороговой.
Построенная модель позволила исследовать соотношение двух параметров вакцинации — её интенсивности и длительности, — обеспечивающее сдерживание эпидемической вспышки, то есть поддержание заболеваемости на уровне, не превышающем эпидемический порог.
- Колесин И. Д., Житкова Е. М. Математические модели эпидемий. — СПб.: СОЛО, 2017.
- Смирнов Н. В., Смирнов М. Н., Смирнова М. А. Решение прикладных задач теории управления в MATLAB. — СПб.: СОЛО, 2013.
Сибирская язва - особо опасная инфекционная болезнь животных и человека. Болезнь у животных протекает сверхостро, остро и подостро, а у свиней бессимптомно, в основном в локальной ангинозной форме. Болезнь у человека чаще всего проявляется как инфекция наружных покровов и лишь изредка осложняется сибиреязвенным сепсисом: вместе с тем может развиться и первичная генерализованная инфекция, проявляющаяся в легочной или кишечной форме.
Возбудитель болезни Вас. anthracis, аэроб, существует в двух основных формах - бациллярной и споровой.
Источник возбудителя инфекции - больное животное. Экскреты заболевших животных (кал, моча, кровянистые истечения из естественных отверстий) содержат бациллы, которые на воздухе превращаются в споры. Контаминированные сибиреязвенными спорами участки почвы и другие объекты внешней среды длительное время являются резервуара-ми и факторами передачи возбудителя инфекции. Основной путь заражения животных - алиментарный - через корма и воду. Возможны также трансмиссивный и аспирационный пути заражения. Заражение человека происходит при уходе за больными животными, в процессе их убоя, снятия шкур, разделки туш, кулинарной обработки мяса, уборки и уничтожения трупов, при хранении, транспортировке, первичной переработке и реализации контаминированного животного сырья. Возможно заражение человека при контакте с контаминированной почвой, а также аспирационным и трансмиссивным путями. При организации противосибиреязвенных мероприятий следует различать эпизоотический очаг, стационарно неблагополучный пункт, почвенный очаг и угрожаемую по этой болезни территорию.
Эпизоотический очаг сибирской язвы - место нахождения источника или факторов пере-дачи возбудителя инфекции в тех пределах, в которых возможна передача возбудителя восприимчивым животным или людям (участок пастбища, водопой, животноводческое помещение, предприятие по переработке продукции животноводства и т.д.).
Стационарно неблагополучный пункт - населенный пункт, животноводческая ферма, пастбище, урочище, на территории которых обнаружен эпизоотический очаг независимо от срока давности его возникновения. Почвенными очагами считаются скотомогильники, биотермические ямы и другие места захоронения трупов животных, павших от сибирской язвы. Эпидемическим очагом сибирской язвы является эпизоотический очаг, в котором возникло заболевание людей этой инфекцией. Угрожаемой территорией считаются хозяйства, населенные пункты, административные районы, где имеется угроза возникновения случаев заболевания животных или людей. Границы угрожаемой территории определяют ветеринарные органы, учитывая эпизоотическую ситуацию, почвенно - географические, природно - климатические условия и хозяйственно - экономические связи хозяйств, населенных пунктов, заготовительных и перерабатывающих организаций и предприятий (перегоны животных на сезонные пастбища, наличие рынков, кожевенно - сырьевых предприятий, заготовительных баз и др.).
Бешенство - острая вирусная болезнь животных и человека, характеризующаяся признаками полиоэнцефаломиелита и абсолютной летальностью. Возбудитель болезни относится к семейству рабдовирусов. Резервуаром и главными источниками возбудителя бешенства являются дикие хищники, собаки и кошки. С учетом характера резервуара возбудителя различают эпизоотии городского и природного типов. При эпизоотиях городского типа основными распространителями болезни являются бродячие и безнадзорные собаки, а при эпизоотиях природного типа - дикие хищники (лисица, енотовидная собака, песец, волк, корсак, шакал). На территориях с повышенной плотностью их популяций формируются стойкие природные очаги болезни. Заражение человека и животных происходит при непосредственном контакте с источниками возбудителя бешенства в результате укуса или ослюнения поврежденных кожных покровов или наружных слизистых оболочек. При организации мероприятий по профилактике и борьбе с бешенством следует различать эпизоотический очаг, неблагополучный пункт и угрожаемую зону. Эпизоотические очаги бешенства - квартиры, жилые дома, личные подворья граждан, животноводческие помещения, скотобазы, летние лагеря, участки пастбищ, лесных массивов и другие объекты, где обнаружены больные бешенством животные. Неблагополучный пункт - населенный пункт или часть крупного населенного пункта, отдельная животноводческая ферма, фермерское хозяйство, пастбище, лесной массив, на территории которых выявлен эпизоотический очаг бешенства. В угрожаемую зону входят населенные пункты, животноводческие хозяйства, пастбища, охотничьи угодья и другие территории, где существует угроза заноса бешенства или активизации природных очагов болезни. Эпидемическим очагом называют эпизоотический очаг, в котором возникли заболевания людей.
Бруцеллез - хронически протекающая болезнь животных и человека, вызываемая бактериями, объединенными под общим названием Brucella. По современной классификации Объединенного Комитета экспертов ФАО/ВОЗ по бруцеллезу род Brucella состоит из шести видов, которые подразделяются на ряд биоваров. Так, B.melitensis состоит из 3 биоваров, носителями которых являются козы и овцы. B.abortus представлен 7 биоварами, основной хранитель возбудителя - крупный рогатый скот. B.suis состоит из 5 биоваров, основной хозяин возбудителя - свиньи, однако носителем 2-ого биовара являются также зайцы, 4-ого биовара - олени, а 5-ого - мышевидные грызуны. B.neotomae была обнаружена у пустынной кустарниковой крысы /США/. B.ovis - выделяется от овец, a B.canis - от некоторых видов собак. На территории России циркулируют B.melitensis, B.abortus, B.suis и B.ovis. Определение видов и биоваров бруцелл на конкретных территориях и в очагах инфекции имеет важное эпидемиологическое и эпизоотологическое значение с точки зрения классификации очагов, оценки степени напряженности эпидемиологического и эпизоотического процессов, установления фактов миграции бруцелл с одного вида животных на другой (особенно опасна миграция B.melitensis на крупный рогатый скот), выявление путей распространения возбудителя, выбора тактики лечения и др.
Бруцеллы относятся к патогенным микроорганизмам. Разные виды обладают различной вирулентностью. Наиболее вирулентны для человека B.melitensis, которые нередко вызывают эпидемические вспышки заболеваний, протекающих в тяжелой форме. B.abortus и B.suis вызывают, как правило, спорадические случаи клинически выраженных заболеваний. Что касается B.ovis, B.neotomae и B.canis, то известны лишь единичные случаи заболевания людей, вызванные B.canis. Бруцеллы обладают высокой инвазивностью, могут проникать через неповрежденные слизистые покровы, относятся к внутриклеточным паразитам, но могут также находиться вне клетки. Бруцеллы малоустойчивы к высокой температуре. В жидкой среде при +60 град. С они погибают через 30 минут, при +80-85 град. С - через 5 минут, при кипячении моментально. Под действием прямых солнечных лучей бруцеллы гибнут через 4-5 часов, в почве сохраняют жизнеспособность до 100 дней, в воде - до 114 дней. Длительно сохраняются в пищевых продуктах. Обладают большой устойчивостью к воздействиям низких темпера-тур. Возбудитель бруцеллеза весьма чувствителен к различным дезинфицирующим веществам: 2% раствор карболовой кислоты, 3% раствор креолина и лизола, 0,2-1% раствор хлорной извести и хлорамина убивают их в течение нескольких минут.
Основными источниками инфекции для людей при бруцеллезе являются овцы, козы, крупный рогатый скот и свиньи. Отмечаются случаи заражения людей бруцеллезом от северных оленей. В редких случаях источником заражения могут быть лошади, верблюды, яки и некоторые другие животные. Роль человека в передаче бруцеллезной инфекции эпидемиологического значения не имеет. Пути заражения человека бруцеллезом разнообразны. Заражение происходит преимущественно контактным (с больными животными или сырьем и продуктами животного происхождения) или алиментарным путем. Эпидемическое значение пищевых продуктов и сырья животного происхождения определяется массивностью обсеменения, видом бруцелл, их вирулентностью, длительностью их сохранения. Так, в молоке бруцеллы сохраняются до 10 и более дней, брынзе - до 45 дней, во внутренних органах, костях, мышцах и лимфатических узлах инфицированных туш - более одного месяца, в шерсти - до 3 месяцев. Возможны случаи заражения людей контактным и аэрогенным путем при работе с вирулентными культурами бруцелл. Здесь имеют место как контактный, так и аэрогенный путь заражения. Для заболевания людей бруцеллезом, вызванным козье - овечьим видом, характерна весенне - летняя сезонность. При заражении бруцеллезом от крупного рогатого скота сезонность выражена слабее, что объясняется длительным периодом лактации и заражением в основном через молоко и молочные продукты.
Бруцеллез человека - тяжелое заболевание. Инкубационный период равен 1-2 неделям, а иногда затягивается до 2-х месяцев. Это зависит от количества попавших микробов, их вирулентности и сопротивляемости организма. После инкубационного периода клиника бруцеллеза у человека проявляется в форме острого заболевания с выраженной лихорадочной реакцией (до 39-40 град. С) в течение 3-7 дней и более. Повышение температуры сопровождается ознобом и обильным потоотделением. При раннем применении антибактериальной терапии может наступить полное выздоровление. Однако чаще происходит дальнейшее прогрессирование клинических проявлений в виде рецидивирующего бруцеллеза или активного хронического процесса с поражением опорно - двигательного аппарата, нервной, мочеполовой и сердечно - сосудистой систем. Клиническое течение бруцеллеза у животных характеризуется полиморфизмом. Основным признаком является аборт, который сопровождается массовым и длительным выделением бруцелл с абортированным плодом, околоплодными водами, плацентой, выделениями из половых и родовых органов. Бруцеллы выделяются больными животными также с мочой и молоком. Инфицируются кожные покровы животных, стойла, подстилка, остатки корма, предметы ухода, помещения, а также пастбища и места водопоя. Помимо абортов бруцеллез у животных может сопровождаться орхитами, бурситами, эндометритами, маститами. Он может протекать также в скрытой форме и обнаруживаться лишь при специальном обследовании.
Туберкулез животных. Возбудитель: Mycobacterium tuberculosis был открыт Робертом Кохом в 1882 г . Возбудитель туберкулеза человека — М. Tuberculosis ; крупного рогатого скота — М. Bovis ; птиц — М. Avium , это тонкие, прямые, чаще слегка изогнутые палочки, располагающиеся одиночно или группами, аэроб, неподвижен, спор и капсул не образует. Для выращивания возбудителя туберкулеза применяют глицериновые МПА, МПБ, картофель, яичные и синтетические среды. Микобактерии сохраняют жизнеспособность в навозе 7 мес, в фекалиях — 1 год, в воде — 2 мес, в масле — 45 дней, в сыре — 45—100, в молоке — до 10 дней. Нагревание до 70°С убивает за 10 минут, а кипячение инактивирует через 3—5 минут. Восприимчивы: все виды животных.
Источник возбудителя: больные животные и вирусоносители. Пути передачи: аэрогенный; через поврежденную слизистую ротовой полости, реже через соски вымени и влагалище, факторы передачи — корма, навоз, вода, подстилка, предметы ухода. Инкубационный период: от 2—6 недель до появления аллергических реакций. Туберкулез протекает в основном хронически и бессимптомно. У крупного рогатого скота чаще поражаются легкие или кишечник. Туберкулез легких сопровождается кашлем и др. признаками поражения легких и плевры. При туберкулезе кишечника наблюдаются диарея, сменяющаяся запорами, выделение с фекалиями слизи с примесью крови. При поражении вымени у крупного рогатого скота увеличены лимфоузлы, вымя становится бугристым. Туберкулез половых органов у коров проявляется усилением охоты, у быков — орхитами. При генерализованном туберкулезе наблюдается увеличение поверхностных лимфоузлов, животные сильно худеют, быстро утомляются. У них пропадает аппетит, слизистые оболочки анемичны. У овец и коз туберкулез протекает, как и у крупного рогатого скота. У свиней — увеличение подчелюстных, заглоточных и шейных лимфоузлов. У лошадей туберкулез встречается редко, и в основном протекает латентно. Туберкулез птиц протекает с неясными клиническими признаками. Наблюдают исхудание, малоподвижность, побледнение и сморщенность гребня, атрофия грудных мышц. Генерализация процесса сопровождается поражением кишечника. Характерным для туберкулеза является наличие в разных органах и тканях животного специфических узелков (туберкул) величиной от просяного зерна до куриного яйца и более. Туберкулезные очаги окружены соединительнотканной капсулой, содержимое их напоминает сухую, крошковатую массу (казеозный некроз). При длительном переболевании туберкулезные узелки могут обызвествляться. Патологический материал направляют как при жизни животного (истечения из носа, бронхиальную слизь, молоко, особенно при увеличении надвыменных лимфоузлов, фекалии, мочу), так и посмертно (пораженные части органов и лимфоузлы бронхиальные, заглоточные, средостенные, предлопаточные, надвыменные. Труп птицы (или тушку) направляют целиком — исследуют пораженные печень, селезенку, легкие, яичники. Проводят туберкулинизацию, гистологические, бактериологические исследования, биопробу, серологические исследования (РСК). Пастереллез, паратуберкулез, актиномикоз, диктиокаулез, у свиней — лимфадениты, вызываемые атипичными микобактериями, у птиц — лейкоз.
Листериоз - инфекционная болезнь человека и животных. Возбудитель листериоза - Listeria monocytogenes - подвижная, полиморфная, грамположительная мелкая палочка (длиной 0,5-2,0 нм; шириной 0,3-0,5 нм) с закругленными конца-ми. Листерии обладают сравнительно высокой устойчивостью, широко распространены во внешней среде, при низких температурах (+4 - +6 град. С) длительное время (до нескольких лет) сохраняются в почве, воде, соломе, зерне. Размножаются в почве, воде, молоке, мясе, силосе. а также в органах трупов. Основным резервуаром возбудителя в природе являются многие виды диких и синантропных грызунов. Листерии обнаружены у лисиц, норок, енотов, песцов, диких копытных, птиц. Листериоз поражает домашних и сельскохозяйственных животных (свиней, мелкий и крупный рогатый скот, лошадей, кроликов, реже кошек и собак), а также домашнюю и декоративную птицу (гусей, кур, уток, индюшек, голубей, попугаев и канареек). Листерии обнаружены также в рыбе и продуктах моря (креветки). При листериозе имеет место многообразие механизмов передачи возбудителя инфекции (фекально-оральный, контактный, аспирационный, трансплацентарный). Основным из которых является фекально-оральный.
Лептоспироз - зоонозная природноочаговая инфекционная болезнь диких, домашних животных и человека, широко распространенная в различных ландшафтно - географических зонах мира. Источники возбудителей лептоспирозной инфекции подразделяются на две группы. К первой относятся грызуны и насекомоядные, являющиеся основными хозяевами (резервуаром) возбудителей в природе; ко второй - домашние животные (свиньи, крупный рогатый скот, овцы, козы, лошади, собаки), а также пушные звери клеточного содержания (лисицы, песцы, нутрии), формирующие антропургические (сельскохозяйственные) очаги. Возбудители лептоспироза - микроорганизмы рода Leptospira. Патогенные лептоспиры представлены 202 сероварами, которые по степени антигенного родства объединены в 23 серологические группы. На территории Российской Федерации возбудителями лептоспироза сельскохозяйственных животных и собак являются лептоспиры серогрупп Pomona, Tarassovi, Grippotyphosa, Sejroe, Hebdomadis, Icterohaemorrhagiae, Canicola; в природных очагах установлена цирку-ляция лептоспир серогрупп Grippotyphosa, Pomona, Sejroe, Javanica, Icterohaemorrhagiae, Bataviae, Australis, Autumnalis. В этиологической структуре лептоспирозных заболеваний человека преобладают лептоспиры серогрупп Grippotyphosa, Pomona, Icterohaemorrhagiae, Canicola, Sejroe. Основной путь передачи инфекции - водный, меньшее значение имеют контактный и пищевой (кормовой). В организм человека и животных лептоспиры проникают через незначительные повреждения кожи и неповрежденные слизистые оболочки полости рта, носа, глаз, желудочно - кишечного и мочеполового трактов.
Орнитоз - инфекционная болезнь человека и птиц, вызываемая внутриклеточным микро-бом Chlamydia psittaci, рода Chlamydia.
Орнитоз - зоонозная инфекция, характеризующаяся наличием природных очагов и вторичных антропургических очагов.
Основными хранителями возбудителя орнитоза в природе являются дикие и домашние птицы, у которых он вызывает острые, хронические или латентные формы заболевания.
Заражение людей орнитозом происходит при общении с больными птицами, носителями орнитозной инфекции или объектами внешней среды, инфицированными возбудителями орнитоза. Заражение человека в основном происходит воздушно - капельным или воз-душно - пылевым путем. Заражение может произойти контактным путем через поврежденные кожные покровы и слизистые (ранение, поклевывание), а также алиментарным путем (попадание возбудителя в организм с загрязненными продуктами питания).
Сальмонеллез - инфекционная болезнь животных и человека. Среди сельскохозяйственных животных сальмонеллезом болеет преимущественно молодняк (телята, поросята, ягнята, жеребята, щенки пушных зверей, цыплята, утята, гусята, индюшата и т.д.).
Болезнь проявляется поражением желудочно - кишечного тракта и септицемией, а при подостром и хроническом течении - пневмонией и артритами. У овец, кобыл, реже коров, сальмонеллез вызывает аборты.
Люди заражаются сальмонеллезом при употреблении продуктов питания, обсемененных сальмонеллами в процессе их получения, переработки, транспортировки и реализации прошедших недостаточную кулинарную обработку или хранившихся с нарушением установленных режимов. Возможно заражение через предметы бытовой и производственной обстановки, а также через воду.
Сальмонеллы, кроме того, вызывают у человека брюшной тиф (Salmonella typhi) и паратиф (Salmonella paratyphi А, В, С), к которым животные не восприимчивы. Сальмонеллы относятся к семейству энтеробактерий (Enterobacteriaceae), роду сальмонелл (Salmonella), подразделяющемуся на два вида, энтерика (enterica) и бонгори (bongori), и объединяют 2324 серовара, разделенных по набору соматических ("О") антигенов на 46 серогрупп. Основные возбудители сальмонеллеза животных относятся к серогруппам В, С и D.
| Виды животных |


