Повышение лдг при вирусной инфекции
Оценка характера и интенсивности метаболических процессов в лимфоцитах больных острыми респираторными вирусными инфекциями с различной степенью тяжести определялась по изменениям активности внутриклеточных ферментов и показала, что в разгар заболевания отмечена разнонаправленность интенсификации реакций пентозофосфатного цикла и гликолиза, а также при значительном повышении функциональной нагрузки на клетки происходит значительное снижение интенсивности реакций начального этапа цикла трикарбоновых кислот, что должно уменьшать энергетическую эффективность цикла, а интенсивное поступление метаболитов для снабжения цикла трикарбоновых кислот субстратами с аминокислотного обмена будет обеспечивать повышенный транспорт аминокислот в лимфоциты.
Ключевые слова: острые респираторные вирусные инфекции, лимфоциты, метаболические процессы, активность внутриклеточных ферментов.
Острые респираторные вирусные инфекции (ОРВИ) являются самыми распространенными вирусными инфекциями человека и представляют собой серьезную медико-социальную проблему. По оценкам ВОЗ, гриппоподобными заболеваниями ежегодно в мире болеют до 100 млн человек [5, 6, 8]. Удельный вес гриппа и ОРВИ среди всех инфекционных болезней в России составляет 90 %. Не исключение это и для Красноярского края, где доля ОРВИ в общей структуре инфекционной заболеваемости составила в 2010 году 92 %. Так в 2010 году было зарегистрировано 572 618 случаев заболеваний гриппом и ОРВИ, а показатель заболеваемости составил 19 786,9 случаев на 100 тыс. населения, что на 18,3 % ниже показателя заболеваемости 2009 года — 23 954,9 случаев на 100 тыс. населения.
Известно, что развитие, тяжесть любого инфекционного заболевания и его исход зависят от состояния иммунной системы, её ответа на внедрившийся микроорганизм, в результате развития этого ответа происходит распознавание возбудителя, его инактивация и элиминация из организма. В патогенезе и клиническом течении ОРВИ также существенную роль играют нарушения иммунологического механизма защиты организма человека. По мнению ряда авторов, изменения, происходящие в иммунной системе при ОРВИ, расцениваются как адаптационная реакция организма на воздействие вирусов В первую очередь с патогеном контактируют иммунокомпетентные клетки, функциональное состояние которых и обусловливает адекватность иммунного ответа; наиболее важная роль среди них принадлежит лимфоцитам. Проявление в полном объеме функциональных возможностей лимфоцитов в процессах формирования адекватного иммунного ответа, в том числе и противовирусного, определяется внутриклеточным метаболизмом, который обеспечивается соответствующим уровнем активности ферментов в клетках [4, 7].
Целью исследований явилась оценка характера и интенсивности метаболических процессов в лимфоцитах больных ОРВИ по изменениям активности внутриклеточных ферментов в зависимости от тяжести течения болезни.
Материалы и методы. Для достижения поставленной цели определялись энзиматические показатели лимфоцитов больных в возрасте от 18 до 42 лет, с диагнозом ОРВИ, который устанавливался в условиях специализированного стационара. Определение активности ферментов производилось в лимфоцитах, выделенных из периферической крови больных ОРВИ в течение первых суток после поступления на стационарное лечение. Обследованные больные были распределены на 2 группы: перенесшие ОРВИ легким и среднетяжелым течением и с тяжелым течением заболевания. В качестве контрольных показателей использовались значения активности внутриклеточных ферментов лимфоцитов практически здоровых лиц сопоставимого возраста, полученные нами ранее.
У всех больных в лимфоцитах, выделенных из венозной крови на градиенте плотности фиколл-верографина, биолюминесцентным методом с использованием бактериальной люциферазы, проводилось определение активности внутриклеточных ферментов. Определялись следующие энзиматические показатели: активность глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ), глицерол-3-фосфатдегидрогеназы (Г-3-ФДГ), лактатдегидрогеназы (ЛДГ), НАД- и НАДФ-зависимой изоцитратдегидрогеназы (НАДИЦДГ и НАДФИЦДГ), НАД- и НАДФ-зависимой глутаматдегидрогеназы (НАДГДГ и НАДФГДГ), НАД- и НАДФ-зависимой малатдегидрогеназы (НАДМДГ и НАДФМДГ), а также глутатионредуктазы (ГР). Активность ферментов выражалась в мкЕ на 10 000 лимфоцитов.
Полученные в результате исследований данные были обработаны методами статистического анализа, используемыми в биологии и медицине с применением пакета прикладных программ Statistica 6.0. В таблицах представлены среднегрупповые показатели (М) и ошибка средней (m). В связи с тем, что распределение показателей активности внутриклеточных ферментов отличалось от нормального, оценка достоверности различий проводилась с помощью U-критерия Манна-Уитни.
Результаты и обсуждение. Определявшиеся в исследовании энзиматические показатели свидетельствовали о значительных отличиях внутриклеточных метаболических реакций лимфоцитов больных в разгаре заболевания от соответствующих параметров практически здоровых лиц контрольной группы (см. табл.).
Активность ферментов в лимфоцитах (мкЕ/10 000 кл.) больных с разными вариантами течения ОРВИ (М ± m)
Примечание: Р1, Р2, Р3 — достоверность различий с показателем соответствующего столбца
Так при легком и среднетяжелом течении ОРВИ в лимфоцитах больных определялись достоверные при сравнении с уровнем контроля отличия активности всех изученных ферментов, однако изменения энзиматических показателей были разнонаправленными. Два фермента, ассоциированных с гликолизом (Г-6-ФДГ и Г-3-ФДГ) у больных ОРВИ, были достоверно более активными, чем в контроле: активность Г-6-ФДГ была равна соответственно 3,23 ± 0,62 и 2,74 ± 0,31 (р
Государственная лицензия ФГБОУ ВО НГМУ Минздрава России
на образовательную деятельность:
серия ААА № 001052 (регистрационный № 1029) от 29 марта 2011 года,
выдана Федеральной службой по надзору в сфере образования и науки бессрочно
Свидетельство о государственной аккредитации ФГБОУ ВО НГМУ Минздрава России:
серия 90А01 № 0000997 (регистрационный № 935) от 31 марта 2014 года
выдано Федеральной службой по надзору в сфере образования и науки
на срок по 31 марта 2020 года
Адрес редакции: 630091, г. Новосибирск, Красный проспект, д. 52
тел./факс: (383) 229-10-82, адрес электронной почты: mos@ngmu.ru
Средство массовой информации зарегистрировано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) —
Свидетельство о регистрации СМИ: ПИ № ФС77-72398 от 28.02.2018.
 |
|
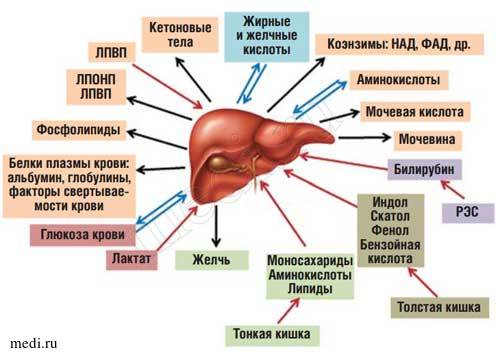
08.02.2016 11.01.2016 28.12.2015 М. Г. Ипатова 1, 2 к.м.н., Ю. Г. Мухина 1 д.м.н. профессор, П. В. Шумилов 1 д.м.н., профессор 1 Российский национальный исследовательский медицинский университет им. Н. И. Пирогова 2 Детская Городская Клиническая Больница № 13 им. Н. Ф. Филатова, Москва Ключевые слова: печень, синдром цитолиза, аланинаминотрансфераза, аспартатамино-трансфераза, гепатопротективные препараты В статье изложены биохимические лабораторные показатели и их клиническое значение при заболеваниях печени, протекающих с синдромом цитолиза. Отдельное внимание уделено механизмам действия гепатопротективных препаратов, применяемых при цитолитическом синдроме. Рис. 1. Роль печени в обмене веществ. Сокращения: ЛПВП - липопротеиды высокой плотности; ЛПОНП - липопротеиды очень низкой плотности; РЭС ретикуло-эндотелиальная система; НАД - никотинамидадениндинуклеотид; ФАД - флавинадениндинуклеотид. Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма почти всех классов веществ [1]. К основным функциям печени относятся: метаболическая, депонирующая, барьерная, экскреторная, гомеостатическая и детоксицирующая [2]. Печень может обезвреживать как чужеродные экзогенные вещества, обладающие токсическими свойствами, так и синтезированные эндогенно. Таблица 2. Причины повышения уровня аминотрансфераз Печеночные причины Внепеченочные причины •Вирусные гепатиты (В, С, ЦМВ и др.) •Хронические инфекции и паразитарные •Неалкогольный стеатогепатит •Аутоиммунные заболевания печени •Злоупотребление алкоголем •Прием лекарственных препаратов •Метаболические заболевания печени •врожденные и приобретенные дефекты •Цирроз печени •Опухоли печени •Патология сердца (острый инфаркт •Повышенная физическая нагрузка •Наследственные нарушения мышечного •Приобретенные мышечные заболевания •Травма и некроз мышц •Целиакия •Гипертиреоз •Тяжелые ожоги •Гемолиз эритроцитов •Нарушение кислотно-щелочного равновесия •Сепсис Находясь между портальным и большим кругами кровообращения, печень выполняет функцию большого биофильтра. Через воротную вену в нее поступает более 70% крови, остальная кровь попадает через печеночную артерию. Большая часть веществ, всасывающихся в пищеварительном тракте (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему), поступает по воротной вене в печень [2]. Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей (рис 1). Большое разнообразие функций гепатоцитов приводит к тому, что при патологических состояниях печени нарушаются биохимические константы, отражающие изменения многих видов обмена. Поэтому стандартный биохимический анализ крови включает определение различных параметров, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов. Концентрация ферментов в клетках значительно выше, чем в плазме крови; в норме только очень незначительная часть определяется в крови. Наиболее частыми причинами повышения уровня ферментов в сыворотке крови являются: прямое поражение клеточных мембран, в частности вирусами и химическими соединениями, гипоксия и ишемия тканей. Иногда активность ферментов увеличивается в результате их повышенного синтеза в тканях. Определение активности тех или других ферментов в сыворотке крови позволяет судить о характере и глубине поражения различных компонентов гепатоцитов [3, 4]. Ферменты в зависимости от их локализации можно разделить на несколько групп: 1) универсально распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – амино-трансферазы, фруктозо-1-6-дифосфатальдолаза; 2) печеночноспецифические (органоспе-цифические) ферменты; их активность исключительно или наиболее высоко выявляется в печени. К ним относятся холинэстераза, орнитин-карбамилтрансфераза, сорбитдегидрогеназа и др.; 3) клеточноспецифические ферменты печени относят преимущественно к гепатоцитам, 4) органеллоспецифические ферменты, являются маркерами определенных органелл Специфичность ферментов и их диагностическое значение представлено в таблице 1 [5]. Отдельное место занимает макроэнзиме-мия – редкое и крайне сложное для дифференциальной диагностики состояние, при котором происходит комплексирование молекул того или иного энзима с иммуноглобулинами или небелковыми веществами. Описаны клинические наблюдения макро-КФК-емии, макро-ЛДГ-емии, макро-АСТ-емии, макро-ГГТ-емии, макроамилаземии. Макро-энзимемии сложны для диагностики и дифференциальной диагностики и ведут к проведению инвазивных методов обследования и необоснованному лечению. В основе выявления макроэнзимемии лежит выявление отличий молекулы макрофермента от молекулы обычного энзима. Некоторые из этих методов являются прямыми, т. е. такими, которые позволяют непосредственно определить присутствие в крови ферментного комплекса, имеющего гораздо более высокий молекулярный вес, чем молекула нормального фермента. В основу прямого метода положено разделение белков сыворотки по молекулярному весу. Другие же методы являются непрямыми, так как выявление макроэнзима в крови проводится не путем выявления самого ферментного комплекса, а основываются на выявлении какого-либо из свойств макроэнзима. Прямые тесты имеют большее диагностическое значение и влекут за собой меньше технических и диагностических ошибок. В некоторых ситуациях повышение ферментов является физиологическим: уровень щелочной фосфатазы повышен у подростков в период вытяжения (период ускорения роста), у здоровых женщин во время третьего триместра беременности (за счет плаценты). Однако очень высокую активность щелочной фосфатазы наблюдают у женщин с преэк-лампсией, что связно с нарушением кровообращения плаценты [7]. Большое значение в диагностике заболеваний печени имеют анамнестические данные и клиническая картина заболевания. Из анамнеза следует попытаться узнать о факторах риска заболеваний печени, обращая особое внимание на семейный анамнез, прием лекарств, витаминов, растительных добавок, наркотиков, алкоголя, трансфузии препаратов крови, патологические результаты печеночных проб в прошлом и симптоматику заболеваний печени. Клиническое обследование позволяет диагностировать до 50–60% патологических состояний. Более детальная дифференциальная диагностика основана на иммунохимических методах. Они позволяют детализировать характер вирусной, а также паразитарной инфекции, определить локализацию неопластического процесса, определить этиологию аутоиммунного заболевания, уточнить вид нарушения наследственных заболеваний обмена веществ. При патологии печени в биохимическом анализе крови выделяют 4 синдрома: • Синдром печеночно-клеточной недостаточности • Мезенхиально-воспалительный синдром. Синдром цитолиза – это синдром, обусловленный нарушением проницаемости клеточных мембран, распадом мембранных структур или некрозом гепатоцитов с выходом в плазму ферментов (АЛТ, АСТ, ЛДГ, альдолазы и др.). АМИНОТРАНСФЕРАЗЫ: аспартатаминотрансфераза и аланинаминотрансфераза Референтные значения: у новорожденных детей до 1 мес. – менее 80 Ед/л; от 2 мес. до 12 мес. – менее 70 Ед/л., с 1 года до 14 лет – менее 45 Ед/л, у женщин – менее 35 Ед/л, у мужчин – менее 50 Ед/л. В клинической практике широко применяется одновременное определение уровня двух трансаминаз – аспартатаминотрансферазы (AСT) и аланинаминотрансферазы (АЛТ) в сыворотке крови. Ферменты АЛТ и АСТ содержатся практически во всех клетках человеческого организма. Однако самый высокий уровень фермента АЛТ содержится в печени, поэтому уровень данного энзима служит специфическим маркером поражения печени. В свою очередь, АСТ помимо печени (в порядке снижения концентрации) содержится в сердечной и скелетных мышцах, почках, поджелудочной железе, легких, лейкоцитах и эритроцитах [6, 7, 8]. В печени АЛТ присутствует только в цитоплазме гепатоцитов, а АСТ – в цитоплазме и в митохондриях. Более 80% печеночной АСТ представлено именно митохондриальной фракцией [6, 7, 8]. В норме постоянство концентрации транс-аминаз в плазме крови отражает равновесие между их высвобождением вследствие физиологического апоптоза состарившихся гепатоци-тов и элиминацией. Соотношение синтеза АСТ/ АЛТ в печени равно 2,5/1. Однако при нормальном обновлении гепатоцитов уровни АСТ и АЛТ в плазме крови практически одинаковы (30–40 Ед/л) из-за более короткого периода полувыведения АСТ (18 ч против 36 ч у АЛТ). При заболеваниях печени в первую очередь и наиболее значительно повышается активность АЛТ по сравнению с АСТ. Например, при остром гепатите, независимо от его этиологии, активность аминотрансфераз повышается у всех больных, однако преобладает уровень АЛТ, содержащейся в цитоплазме, вследствие ее быстрого выхода из клетки и поступления в кровяное русло. Таким образом, по уровню АЛТ судят о биохимической активности заболевания печени. Повышение показателя в 1,5–5 раз от верхней границы нормы свидетельствует о низкой активности процесса, в 6–10 раз – об умеренной и более 10 раз – о высокой биохимической активности. Повышение активности трансаминаз более 6 месяцев является биохимическим признаком хронического гепатита [6, 7]. Некоторые лекарственные препараты (например, вальпроевая кислота) метаболизируются в митохондриях гепатоцитов [9], поэтому ранним лабораторным маркером гепатотоксичности может быть лишь изолированное повышение АСТ. Помимо патологии печени АСТ служит одним из ранних маркеров повреждения сердечной мышцы (повышается у 93–98% больных инфарктом миокарда до 2–20 норм); специфичность его не высока. Уровень ACT в сыворотке крови возрастает через 6–8 часов после начала болевого приступа, пик приходится на 18–24 часа, активность снижается до нормальных значений на 4–5 день. Нарастание активности фермента в динамике может свидетельствовать о расширении очага некроза, вовлечении в патологический процесс других органов и тканей, например, печени [7]. Интенсивные мышечные упражнения с чрезмерной нагрузкой также могут вызвать преходящее увеличение уровня ACT в сыворотке крови. Миопатии, дерматомиозиты и другие заболевания мышечной ткани вызывают повышение трансаминаз, преимущественно за счет АСТ. Умеренное увеличение активности АСТ (в 2–5 раз от верхней границы нормы) отмечается при острых панкреатитах и гемолитических анемиях. При латентных формах цирроза печени повышения активности ферментов, как правило, не наблюдают. При активных формах цирроза стойкий незначительный подъем аминотрансфераз выявляют в 74–77% случаев, и, как правило, преобладает активность АСТ над АЛТ в два и более раз. Снижение активности АЛТ и АСТ имеет место при недостаточности пиридоксина (витамина В6), при почечной недостаточности, беременности. Ниже приведены печеночные и внепеченочные причины повышения активности аминотрансфераз в сыворотке крови (табл. 2). Помимо оценки уровня трансаминаз в клинической практике широко применяется коэффициент де Ритиса – отношение АСТ к АЛТ (АСТ/АЛТ). В норме значение этого кэффициента составляет 0,8–1,33. Следует отметить, что расчет коэффициента де Ритиса целесообразен только при выходе АСТ и/или АЛТ за пределы референтных значений. У новорожденных детей соотношение АСТ/АЛТ обычно превышает 3,0, однако к пятому дню жизни снижается до 2,0 и ниже. При поражениях печени с разрушением гепатоцитов преимущественно повышается АЛТ, коэффициент де Ритиса снижается до 0,2–0,5. При патологии сердца преобладает уровень АСТ, и коэффициент де Ритиса повышается. Однако для точной дифференциальной диагностики этот коэффициент непригоден, так как нередко при алкогольном поражении печени, неалкогольном стеатогепатите, циррозе печени также преобладает повышение АСТ и коэффициент де Ритиса составляет 2,0–4,0 и более. Значение данного коэффициента выше нормы часто наблюдается при обтурационных желтухах, холециститах, когда абсолютные значения АЛТ и АСТ невелики. 1. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛТ выше, чем АСТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение паренхимы печени может изменить это соотношение. 2. При алкогольном гепатите и циррозе нередко активность АСТ оказывается выше, чем АЛТ (коэффициент де Ритиса больше 1,0). 3. При остром ИМ активность АСТ выше, чем АЛТ (коэффициент де Ритиса больше 1,5). ЛАКТАТДЕГИДРОГЕНАЗА Референтные значения ЛДГ для новорожденных – до 600 Ед/л, у детей с 1 года до 12 лет активность ЛДГ – 115 – 300 Ед/л, для детей старше 12 лет и у взрослых норма ЛДГ – до 230 Ед/л. Лактатдегидрогеназа (ЛДГ) – гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пируват, широко распространен в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза [7]. При электрофорезе или хроматографии удается обнаружить 5 изоферментов ЛДГ, отличающихся по своим физико-химическим свойствам. Наибольшее значение имеют два изофермента – ЛДГ1 и ЛДГ5. Фракция ЛДГ1 более активно катализирует обратную реакцию превращения лактата в пируват. Она в большей степени локализуется в сердечной мышце и некоторых других тканях, в норме функционирующих в аэробных условиях. В связи с этим миокардиальные клетки, обладающие богатой митохондриальной системой, окисляют в цикле трикарбоновых кислот не только пируват, образующийся в результате протекающего в них самих процесса гликолиза, но и лактат, образующийся в других тканях. Фракция ЛДГ5 более эффективно катализирует прямую реакцию восстановления пирувата в лактат. Она локализуется преимущественно в печени, в скелетных мышцах. Последние нередко вынуждены функционировать в анаэробных условиях (при значительной физической нагрузке и быстро наступающем утомлении). Образующийся при этом лактат с кровотоком попадает в печень, в которой он используется для процесса глюконеогенеза (ресинтеза глюкозы), а также в сердце и другие ткани, где происходит его преобразование в пируват и вовлечение в цикл трикарбоновых кислот (цикл Кребса). Любое повреждение клеток тканей, содержащих большое количество ЛДГ (сердце, скелетные мышцы, печень, эритроциты), приводит к повышению активности ЛДГ и ее изо-ферментов в сыворотке крови. Наиболее частыми причинами повышения активности ЛДГ являются: 1. Поражение сердца (острый инфаркт миокарда, миокардит, застойная сердечная недостаточность); в этих случаях обычно преобладает повышение активности ЛДГ1 и/или ЛДГ2. 2. Поражение печени (острые и хронические гепатиты, цирроз печени, опухоли и метастазы печени), когда преимущественно увеличивается изофермент ЛДГ5, ЛДГ2, ЛДГ4. 3. Повреждение скелетных мышц, воспалительные и дегенеративные заболевания 4. Заболевания крови, сопровождающиеся распадом клеток крови: острый лейкоз, гемолитическая анемия, В12-дефицитная анемия, серповидноклеточная анемия, а также заболевания и патологические состояния, сопровождающиеся разрушением тромбоцитов (массивная гемотрансфузия, эмболия легочной артерии, шок и др.). В этих случаях может преобладать повышение активности ЛДГ2, ЛДГ3. 5. Острый панкреатит. 6. Заболевания легких (пневмония и др.) 7. Инфаркт почки. 8. Опухоли (повышенный уровень ЛДГ наблюдается в 27% случаев опухолей в I стадии и в 55% – метастатических семином). Следует помнить, что многие заболевания сердца, скелетных мышц, печени и крови могут сопровождаться повышением активности в сыворотке крови общей ЛДГ без отчетливого преобладания какого-либо из ее изоферментов. Таблица 3. Эффективность гепатопротекторов при синдроме цитолиза (по С. В. Морозову с соавт., 2011 г. и Н. Б. Губергриц, 2012 г.) [10] Лактатдегидрогеназа (ЛДГ) общая – внутриклеточный гликолитический фермент, который участвует в обратимом превращении лактата в пируват и содержится в большинстве тканей организма. Дегидрогеназа молочной кислоты. Синонимы английские Lactate dehydrogenase, Total, Lactic dehydrogenase, LDH, LD. УФ кинетический тест. Ед/л (единица на литр). Какой биоматериал можно использовать для исследования? Как правильно подготовиться к исследованию?
Общая информация об исследовании Лактатдегидрогеназа (ЛДГ) – цинксодержащий внутриклеточный фермент, который катализирует окисление молочной кислоты в пируват и содержится практически во всех клетках организма. ЛДГ наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах. Существует пять разных форм (изоферментов) ЛДГ, которые отличаются молекулярной структурой и расположением в организме. От того, какая из пяти преобладает, зависит основной способ окисления глюкозы – аэробный (до CO2 и H2O) или анаэробный (до молочной кислоты). Подобное различие обусловлено разной степенью родства того или иного изофермента и пировиноградной кислоты. Для миокарда и мозговой ткани основной является ЛДГ-1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ-1 и ЛДГ-2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ-3. ЛДГ-4 находится во всех тканях с ЛДГ-3, а также в гранулоцитах, плаценте и мужских половых клетках, в которых содержится и ЛДГ-5. Изоферментная активность в скелетных мышцах (в порядке убывания): ЛДГ-5, ЛДГ-4, ЛДГ-3. Для печени наиболее характерен изофермент ЛДГ-5, меньшая активность у ЛДГ-4. В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя – общей ЛДГ. Их активность в крови распределяется следующим образом: ЛДГ-2 > ЛДГ-1 > ЛДГ-3 > ЛДГ-4 > ЛДГ-5. При заболеваниях, сопровождающихся повреждением тканей и разрушением клеток, активность ЛДГ в крови повышается. В связи с этим она является важным маркером тканевой деструкции. Несмотря на то что увеличение активности фермента не указывает на какую-то определенную болезнь, его определение в комплексе с другими лабораторными анализами помогает в диагностике инфаркта легкого, мышечной дистрофии и гемолитической анемии. Повышенная активность ЛДГ может выявляться у новорождённых, беременных и после интенсивных физических нагрузок. Ранее совместные анализы на ЛДГ, аспартатаминотрансферазу и креатинкиназу широко использовались в диагностике инфаркта миокарда. Сейчас для этой цели определяют уровень тропонина как более специфического маркера повреждения сердечной мышцы. Но исследование активности ЛДГ остается вспомогательным анализом при дифференциальной диагностике болевого синдрома в грудной клетке. У больных стенокардией активность фермента не изменяется, но при инфаркте миокарда начинает возрастать через 8-10 часов с максимумом в первые 24-48 часов после сердечного приступа и возвращается к норме через 10-12 дней. Повышение ЛДГ при нормальной активности АСТ через 1-2 дня после боли в грудной клетке указывает на инфаркт легкого. При дифференциальной диагностике миопатий данный анализ помогает уточнить патофизиологические механизмы заболевания. Так, при нарушении мышечной функции, связанной с нейрогенными заболеваниями, ЛДГ не повышается, но при повреждении мышц из-за эндокринных и метаболических патологий активность ЛДГ увеличивается. Активность ЛДГ в крови может возрастать вследствие многих злокачественных новообразований, при эффективном лечении она снижается, что иногда применяют для динамического наблюдения за онкологическими больными. Для чего используется исследование?
Когда назначается исследование?
⠀ В указанное Вами время Вам позвонит наш администратор с номера +7 (343) 283-08-08 для подтверждения приёма. Our administrator will call you from the number +7 (343) 283-08-08 for confirmation of reception. V uvedenýčaszavolámeVám z t. č. +7 (343) 283-08-08 pro potvrzení prohlídky. Notre administrateur vous contactera au moment fixé à partir du numéro de +7 343 283 08 08 pour confirmer le rendez-vous. Our administrator will call you from the number +7 (343) 283-08-08 for confirmation of reception. Our administrator will call you from the number +7 (343) 283-08-08 for confirmation of reception. Our administrator will call you from the number +7 (343) 283-08-08 for confirmation of reception. Zur verabredeten Zeit ruft Sie unser Administrator von Nummern +7 (343) 283-08-08 an, um den Termin zu bestätigen. 명확하게 서술된 시간에 우리의 행정관은 확인하기 위해 +73432830808 번호로 전화해 드리겠습니다. Yöneticimiz, resepsiyon onayı için sizi +7 (343) 283-08-08 numaralı telefondan arayacaktır. Если Вы опоздали на приём менее, чем на 15 минут, то время приёма будет сокращено на время Вашего опоздания. If you are late for an appointment less than 15 minutes, the reception time will be reduced by the time you are late. V případězpoždění méně než 15 minut, doba prohlídky bude zkrácena o čas zpoždění. Si vous êtes en retard de moins de 15 minutes par rapport au rendez-vous fixé, votre temps de réception sera réduit tenant compte de votre retard. If you are late for an appointment less than 15 minutes, the reception time will be reduced by the time you are late. If you are late for an appointment less than 15 minutes, the reception time will be reduced by the time you are late. If you are late for an appointment less than 15 minutes, the reception time will be reduced by the time you are late. Wenn Sie zu einem Termin weniger als 15 Minuten zu spät kommen, wird die Empfangszeit für die Dauer Ihres Aufenthaltes verkürzt. 만약 15분 미만 늦으신다면 잔찰 시간은 지연 시간으로 줄일 겁니다. Randevunuza 15 dakika geçtiyseniz, geç kalma saatinizle resepsiyonun süresi kısalır. Если Вы опоздали более, чем на 15 минут, Ваш приём будет отменён и перенесён на удобное для Вас время. If you are late more than 15 minutes, your appointment will be moved to a convenient time for you. V případě zpoždění vícenež 15 minut, prohlídka bude zrušena a přesunuta na zvolený termín. Si vous êtes en retard de plus de 15 minutes, votre rendez-vous sera annulé et rapporté à une date qui vous conviendrait. If you are late more than 15 minutes, your appointment will be moved to a convenient time for you. If you are late more than 15 minutes, your appointment will be moved to a convenient time for you. If you are late more than 15 minutes, your appointment will be moved to a convenient time for you. Wenn Sie zu einem Termin mehr als 15 Minuten zu spät kommen, wird ihr Termin storniert und zu einem für Sie günstigen Zeitpunkt übertragen. 만약 15분 이상 늦으신다면 진찰은 취소하고 편리한 시간으로 연기해 드리겠습니다. 15 dakikadan fazla gecikti iseniz, randevunuz sizin için uygun bir zamana taşınacaktır. Событие появится в вашем личном кабинете в течение 15 минут. Не удалось сделать запись. Пожалуйста, попробуйте позже. Please try again later. Se nepodařiloobjednat. Zkuste to prosímpozději. Échec de l'enregestrement de votre inscription. Veuillez essayer ultérieurement. Please try again later. Please try again later. Please try again later. Bitte versuchen Sie es später erneut. 진철의 시간을 정할 수 없습니다. 나중에 다시 시도해 주시기 바랍니다. Lütfen daha sonra tekrar deneyin. В течение 2-х часов с номера +7 (343) 283-08-08 вам позвонит наш администратор и постарается вам помочь. В течение 2-х часов с номера +7 (343) 283-08-08 вам позвонит наш администратор и постарается вам помочь. Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|