Полевой штамм вируса что это
Данная диссертационная работа должна поступить в библиотеки в ближайшее время
Уведомить о поступлении
480 руб. | 150 грн. | 7,5 долл. ', MOUSEOFF, FGCOLOR, '#FFFFCC',BGCOLOR, '#393939');" onMouseOut="return nd();"> Диссертация, - 480 руб., доставка 1-3 часа, с 10-19 (Московское время), кроме воскресенья
Автореферат - бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Борисов, Александр Владимирович. Разработка средств и методов диагностики и специфической профилактики инфекционной бурсальной болезни : автореферат дис. . доктора ветеринарных наук : 16.00.03 / Всероссийский НИИ защиты животных.- Владимир, 2000.- 58 с.: ил. РГБ ОД, Др-00/126
Введение к работе
з 1.
1.1. Актуальность темы. Инфекционная бурсальная болезнь (ИББ) гистрируется во многих странах мира, включая Российскую Федерацию, и носит значительный экономический ущерб птицеводству, который падывается из прямых потерь (гибель, потеря продуктивности), затрат на оведение ветеринарно-санитарных и других мероприятий. Опасность спространения инфекционной бурсальной болезни резко возросла в связи с явлением высоковирулентных штаммов вируса, которые вызывают актически 100% заболеваемость цыплят, падеж молодняка яичных пород от до 80% и бройлеров - от 20 до 50%. В период с 1991 по 1993 г.г. в ссийской Федерации зарегистрировано несколько вспышек заболевания, званных высоковирулентными штаммами вируса ИББ.
Так, в 1993 г. отход птицы от ИББ в Российской Федерации составил 55,5 тыс. голов, что составляет 34,7% от общего падежа, вызванного рекционными болезнями.
Высокая устойчивость вируса ИББ в окружающей среде в большинстве чаев является одной из причин его длительного персистирования в цехозяйствах и эндемичности заболевания в регионах.
Во многих странах мира, включая Российскую Федерацию, наряду с рективными ветеринарно-санитарными мероприятиями проводится научно-снованная планируемая стратегия комплексной вакцинопрофилактики ИББ с эльзованием современных средств и методов диагностики. Для осуществления постоянного эпизоотологического монитгринга за
еЖйімвкАйюлят; іми вируса ИББ, вызывающими вспышки заболевания, ДАРСТВЕННАЯ Т
требуется совершенствование методов диагностики, предполагающ повышение их чувствительности и специфичности, а также возможность только выявлять, но и идентифицировать вирус.
В последние годы широкое распространение нашел метод полимеразн цепной реакции (ПЦР) для диагностики и идентификации различных вирусов их штаммов [Jackwood D.I. с соавт., 1996; Lin T.L. с соавт.; 1994,1995; Tham К. с соавт., 1995; Тиге О. с соавт., 1998].
Использование метода ПЦР позволяет выявлять не только инфекционні вирус, но и фрагменты вирусного генома, т.е. наиболее точно и достовер устанавливать штаммовую принадлежность вируса. Сравнительный анал соответствующих аминокислотных последовательностей полевых и вакцинн штаммов позволяет выявить вакцинные штаммы, имеющие наименьш отличия от полевых. Это имеет определяющее значение для выбора полевс изолята вируса, пригодного Для создания живой вакцины против ИББ.
При разработке оптимальных схем иммунизации птиц против ИББ усил исследователей направлены на достижение баланса между оптимальні уровнем материнского иммунитета и иммуногенной активностью вакцинн штаммов [Hitchner D.B., 1976; Rosales A.G. с соавт., 1989; Wyeth P.I., Cullen G. 1976, 1978, 1992].
Возраст птиц, при котором иммунизация наиболее эффективна, являет решающим фактором, обеспечивающим их защиту от заражения и заболевак ИББ.
Для определения наличия у птиц антител к вирусу ИББ в Российо Федерации до 1993 г. применяли реакцию диффузионной преципитаці которая обладает низкой чувствительностью, значительной трудоемкостьк дает результат только через 24-48 ч. после постановки [Алиев А.С. с coai 1989, 1990; Phillips W.E., 1981].
Более чувствительная и специфичная реакция нейтрализации применялась из-за отсутствия СПФ-эмбрионов, к тому же продолжительность постановки составляет 5-7 суток [Phillips W.E., 1981; Winterfield R.W.; Thac H.L., 1978].
Для экспресс-диагностики ИББ, массового эпизоотологичесю обследования птицепоголовья и определения оптимальных сроков иммунизаі цыплят живыми вакцинами потребовалась разработка набора для определеї наличия антител к вирусу ИББ иммуноферментным методом.
В регионах с развитым птицеводством, где отсутствуют острые вспышки
болевания, для специфической профилактики ИББ необходимо использовать
полевых штаммов, вызывающих субклиническую форму заболевания,
іиводящую в ряде случаев к иммунодепрессии.
Таким образом, разработка новых средств и методов диагностики и іецифической профилактики инфекционной бурсальной болезни является туальной проблемой и имеет важное народнохозяйственное значение.
1.2. Цель и задачи научных исследований. Главной целью следований являлась разработка и внедрение в ветеринарную практику рфективных средств и методов диагностики и специфической профилактики іфекционной бурсальной болезни.
Для достижения поставленной цели необходимо было решить следующие ідачи:
изучить эпизоотическую ситуацию по ИББ в России с 1990 по 1999 г.г.;
разработать стратегию и тактику борьбы с ИББ и на основе
экспериментальных исследований создать новые средства и методы
диагностики и специфической профилактики;
разработать метод индикации и штаммовой дифференциации вируса ИББ
и изучить с помощью методов молекулярной биологии генетические
взаимоотношения штаммов вируса ИББ с целью определения пригодности
полевых изолятов и музейных вакцинных штаммов для конструирования
живых вакцин против ИББ;
разработать экспресс-метод диагностики ИББ и создать набор для
определения наличия антител к вирусу ИББ методом иммуноферментного
изыскать в естественных условиях полевой изолят вируса ИББ, пригодн
для создания живой вакцины против ИББ и провести его аттенуацию;
изучить иммунобиологические свойства вакцинных штаммов из коллекц
ВГНКИ и ВНИИЗЖ и селекционировать наиболее перспективные из ні
отвечающие современным требованиям к продуцентам профилактическ
разработать технологические регламенты получения живых
инактивированной вакцин против ИББ, методы контроля качества вакцм
наставления по их применению;
изучить эффективность разработанных вакцин против ИББ
лабораторных и производственных условиях;
подготовить нормативно-техническую документацию на разработанні
биопрепараты и осуществить их промышленное производство;
внедрить в производство и широкую ветеринарную практк
диагностикумы и биопрепараты для специфической профилактики ИББ.
1.3. Научная новизна. С помощью разработанного метода штаммов дифференциации вируса ИББ на основе ПЦР и секвенирования исследоваї полевые изоляты и вакцинные штаммы вируса ИББ, выявлены генетическ группы штаммов, отличающиеся степенью антигенного родства, патогенності созданы новые профилактические препараты на основе близкородственн вакцинных штаммов.
Для создания однородного и напряженного материнского иммунитета у зіплят впервые в Российской Федерации разработана инактивированная идкая сорбированная вакцина против ИББ для иммунизации ремонтного олодняка родительских стад. При изготовлении вакцины определены ттимальные условия получения вирусного сырья, отработаны методы очистки инактивации, обоснованы ингредиентный состав и методы контроля.
На основании проведенных исследований пазработаны и утверждены в тановленном порядке НТД на следующие биопрепараты, которые широко іедреньї в ветеринарную практику:
1999 г.г. выпущено 2,2 млрд. доз вакцины;
вирусвакцина живая культуральная против ИББ из штамма «Винтерфилд
вакцина против ИББ жидкая сорбированная инактивированная, за период с
1994 по 1999 г.г. выпущено 33,5 млн. доз вакцины.
набор для определения антител к вирусу ИББ методе иммуноферментного анализа, за период с 1995 по 1999 г.г. выпущено 45J наборов ИФА;
набор для определения антител к вирусу ИББ иммуноферментны методом при тестировании сывороток в одном разведении, за 1999 выпущено 47 наборов ИФА.
1.5. Основные положения диссертационной работы, выносимые ь
защиту:
оценка иммуногенных и антигенных свойств живых вакцин против ИББ лабораторных и производственных условиях;
оценка иммуногенных и антигенных свойств инактивированной вакцик против ИББ и изучение иммунитета, передаваемого потомству; научное обоснование и экспериментальное подтверждение стратеп применения разработанных вакцин против ИББ и і противоэпизоотическая эффективность.
Публикации. По материалам диссертации опубликовано 52 научные боты, в т.ч. получены 3 патента РФ на изобретения, утверждено в тановленном порядке 34 нормативных документа (технические условия, ставлення по применению, инструкции, методики, указания, рекомендации).
Объем и структура диссертации. Диссертация изложена на 359 раницах и состоит из введения, обзора литературы, собственных следований, выводов и практических предложений, содержит 59 таблиц и 23 сунка. Список использованной литературы включает 623 наименования, из х 71 отечественных и 552 зарубежных. В приьожении представлены копии кументов, подтверждающие достоверность результатов работы, ее научную и актическую значимость.
В выполнении некоторых разделов диссертации принимали участие и азывали практическую и консультативную помощь А.А. Гусев, В.В. Дрыгин, А. Перевозчикова, Л.О. Щербакова, Н.С. Мудрак, Т.В. Оковытая, В.Н. знецов, Ю.В. Кузнецов, С.А. Гусев, З.Я. Михалишина, К.Ю. Федосеев, В.ІО. лаков, М.В. Гирин, В.В. Борисов, В.И. Смоленский, С.Н. Норкина, С.К. Старов, И. Ломакин, Г.В. Марков, О.А. Борисова, В.Н. Ирза, за что приносим им рдечную благодарность. Выражаем искреннюю признательность за помощь и м сотрудникам, которые перечислены в качестве соавторов в списке бликаций по теме.
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – тяжёлое заболевание, сопровождающееся поражением почек, а также кровоизлияниями в склеру и сосуды коньюктивов, под кожу, а в тяжёлых случаях внутренними почечными, желудочными и носовыми кровотечениями – стало известно менее 100 лет назад, однако сегодня оно занимает одно из первых мест среди всех природно-очаговых заболеваний человека в России. Динамика заболеваемости ГЛПС характеризуется периодическими подъёмами каждые 3-4 года, что обусловлено периодичностью массовых размножений грызунов – основных переносчиков и природного резервуара хантавирусов, возбудителей ГЛПС. Официальная регистрация ГЛПС в России началась в 1978 г. и с тех пор ежегодно в среднем регистрируется 6 000 случаев заболевания, с максимумом – более 20 000 случаев – в 1997 г.
Инфицированные грызуны выделяют вирус во внешнюю среду со слюной и экскрементами. Основной путь заражения – аэрогенный, при котором вирус с пылью, загрязнённой выделениями грызунов, попадает в лёгкие человека, где условия для его размножения наиболее благоприятны, а затем с кровью переносится в другие органы и ткани. Заражение возможно также через повреждённую кожу при контакте с экскрементами грызунов или со слюной в случае покуса зверьком.
Основной способ предотвращения инфекции – это ограничение контакта человека с грызунами и предметами, загрязнёнными их выделениями: защита домов от грызунов, хранение продуктов в недоступных для грызунов условиях, использование масок, влажной уборки и дезинфекции помещений, где обнаружены выделения грызунов, и дач после зимы. Создание санитарных зон на территориях вокруг садово-огородных массивов и оздоровительных учреждений является трудновыполнимой задачей, однако, как показала практика, способствуют значительному снижению заболеваемости. Очень интересны экологические методы регулирования численности грызунов-носителей инфекции: так, в скандинавских странах создаются благоприятные условия для хищных птиц, что позволяет сдерживать рост числа грызунов-носителей вируса.
Впервые случаи ГЛПС были обнаружены и описаны российскими учёными в 1935 году на Дальнем Востоке. В последующие годы вспышки заболевания регистрировались среди военнослужащих во время полевых учений и военных действий на Дальнем Востоке и в Манчжурии. Среди советских учёных и врачей долгое время считалось, что ГЛПС распространена только на Дальнем Востоке, поскольку все описанные случаи регистрировались в Хабаровском и Приморском краях и Амурской области. Позднее похожее заболевание с менее тяжёлыми клиническими проявлениями было зарегистрировано в Скандинавских странах и центральной России. Сравнительный анализ, проведённый профессором М.П.Чумаковым, показал идентичность этих заболеваний. Сегодня установлено, что число ежегодно регистрируемых случаев ГЛПС на Дальнем Востоке составляет всего 3% от числа случаев ГЛПС в европейской части России.
Исследования ГЛПС получили новый импульс в 1951 г., во время Корейской войны, когда за три года в Корее заболело более 3 000 американских военнослужащих, причём смертность составила 7%. Для изучения ГЛПС были организованы специальные лаборатории и выделены большие средства. Однако и в этот раз носитель инфекции не был установлен, а вирус не был выделен.
Исследования продолжались, приводя иногда к драматическим последствиям. Так, в 1961 г. в Институт эпидемиологии и микробиологии им. Н.Ф.Гамалеи в Москве были привезены для исследований и размещены в двух рабочих комнатах отловленные в Кировской области полёвки. Через три недели после этого начали заболевать люди, заболело 113 из 186 сотрудников и посетителей лаборатории, где содержались грызуны. К счастью, все они выздоровели. Этот эпизод выявил связь между заболеванием ГЛПС и контактами с грызунами. Был выявлен и стойкий иммунитет к повторной инфекции, так как пять сотрудников, ранее переболевших ГЛПС, не заболели во время этой вспышки.
Вирус-возбудитель ГЛПС был выделен в 1976 г. в лаборатории южнокорейского исследователя д-ра Ли. Это открытие позволило разработать диагностический метод выявления специфических антител у больных и грызунов-носителей вируса, ставший основой для дальнейших исследований и открытия новых хантавирусов. Первый штамм вируса был выделен от полевой мыши и назван вирусом Хантаан, по названию реки, протекающей в районе отлова. Под тем же названием – Хантаан – в международном каталоге был зарегистрирован и новый род вирусов в семействе Буньявирусов. В дальнейшем это стало традицией, называть новые хантавирусы по месту их обнаружения.
Второй хантавирус – вирус Сеул – был открыт д-ром Ли в 1982 г. Было установлено, что именно он вызывал инфекцию у городских жителей, не покидавших пределов города, а его носителем является серая крыса. Сегодня известно, что вирус Сеул – самый распространённый из хантавирусов, он выявлен на всех обитаемых континентах, в 42 странах мира, преимущественно в портовых городах. Исследования 1982 г. показали, что до 15% крыс, обитающих в Сеуле, и до 28% крыс в Токио инфицированы этим вирусом. То время было периодом интенсивного развития биомедицинских исследований, появлением многочисленных лабораторий с экспериментальными животными, в частности белыми лабораторными крысами. Оказалось, что до 29% белых лабораторных крыс были инфицированы вирусом Сеул и что их заражение происходило от диких серых крыс. При этом до 40% исследователей, работавших с лабораторными животными, имели специфические антитела к вирусу Сеул, т.е. перенесли инфекцию в скрытом виде.
Эти открытия заставили пересмотреть правила работы с животными. Были приняты новые требования к оборудованию лабораторий, полностью исключающие контакт и проникновение диких грызунов, новые требования проверки поступающих партий животных из питомников на наличие хантавирусной инфекции.
Ещё одним событием, привлекшим большой интерес общественности и учёных к проблеме хантавирусной инфекции, была вспышка в 1993 г. на территории США тяжёлого заболевания с летальностью до 40%, получившего название хантавирусный лёгочный синдром. Вспышка была зарегистрирована среди американских индейцев, живущих в резервациях и имеющих частые контакты с грызунами. Основные клинические симптомы нового заболевания значительно отличались от ГЛПС. Последующие исследования выявили многочисленные очаги хантавирусной инфекции в странах Северной и Южной Америки.
К настоящему времени в мире насчитывается более 30 различных серотипов и генотипов хантавирусов, а многочисленные очаги хантавирусной инфекции выявлены во всём мире.
На территории европейской части России выявлены три хантавируса – возбудителя ГЛПС. Отсутствие данных генетического анализа вирусов – возбудителей инфекции на Дальнем Востоке России определило цели и задачи нашего Центра, активно включившегося в исследования хантавирусов в 1997 г. Исследования выполнялись совместно с учёными из Хабаровской противочумной станции, Института эпидемиологии и микробиологии г. Владивостока и исследователями из США. В результате было выявлено и охарактеризовано три, а не два, как предполагалось ранее, генотипа вируса-возбудителя. В дополнение к вирусам Хантаан и Сеул был обнаружен ранее неизвестный хантавирус, названный по месту его выявления Амур. Нами было показано, что хозяином и носителем нового вируса является широко распространённая на Дальнем Востоке России, в Корее и Китае восточно-азиатская лесная мышь. Последующие исследования зарубежных учёных подтвердили распространённость вируса Амур в Китае и Корее. Основным прикладным результатом этих исследований явился правильный выбор штаммов для разработки профилактических вакцин, а также выбор оптимальных праймеров для тестирования при разработке диагностических ПЦР тест-систем.
В настоящее время наш Центр совместно с учёными из Института систематики и экологии животных начал изучение хантавирусов на территории Сибири. Обнаружены новые очаги хантавирусной инфекции в Республике Алтай, Новосибирской, Иркутской и Кемеровской областях. Наиболее интересной находкой явилось выявление двух новых хантавирусов, названных Алтай и Артыбаш, в средней и обыкновенной бурозубках, которые относятся не к грызунам, а к насекомоядным. Опубликованное ранее исследование иммунной прослойки среди населения показало, что в ряде районов Тюменской и Омской областей процент переболевших ГЛПС сравним с таковым в Удмуртии, где находятся одни из наиболее активных европейских очагов ГЛПС и где ежегодно регистрируются сотни больных. К сожалению, у большинства врачей отсутствует настороженность на возможность ГЛПС в нашем регионе, и это заболевание в Сибири проходит под другими диагнозами.
Не решён у нас вопрос и с вакцинопрофилактикой ГЛПС, так как основой имеющихся в Корее и Китае вакцин являются штаммы вируса, циркулирующие лишь в азиатских странах. Однако совместно с корейскими учёными уже разработана бивалентная вакцина, объединяющая европейский и азиатский штаммы хантавирусов. К сожалению, пока эта вакцина не прошла всех необходимых этапов испытаний и не доступна, как коммерческий препарат.
Людмила Николаевна Яшина,
к.б.н., ведущий научный сотрудник лаборатории буньявирусов
А.В. Олейник , кандидат биологических наук, технический консультант компании "Интервет"
Впервые на российском рынке появилась живая маркерная вакцина против ИРТ, производства компании Интервет. Вакцина Бовилис IBR marker изготовлена из аттенуироваиного генетически маркированного штамма GK/D вируса BHV-1, культивируемого на культуре клеток почек телят.
Это революция в профилактике крупного рогатого скота против ИРТ. Полная защита животных от клинических проявлений болезни, а также возможность контроля полевой инфекции делает данную вакцину самым эффективным средством, на сегодняшний день, в борьбе с инфекционным ринотрахеитом К PC.
Вакцина не вызывает выработку антител к гликопро-теину BHV-1 типа Е, содержащемуся в эпизоотических штаммах ИРТ. Это позволяет дифференцировать инфицированных полевым вирусом BHV-1 от вакцинированных животных.
Вакцина Бовилис IBR marker формирует 4 рубежа защиты.
1. Иммунитет местный неспецифический.
После интраназальной вакцинации на поверхности каждой клетки эпителия респираторного тракта образуется слой интерферона, препятствующий проникновению любого вируса внутрь клетки. Срок формирования такого иммунитета - несколько часов.
2. Иммунитет местный специфический.
Через 48-96 ч после местного применения вакцины, вслед за продукцией интерферона образуются секреторные иммуноглобулины (антитела) класса IgA. Данные антитела являются специфичными и связывают вирус ИРТ, попадающий в дыхательные пути, а также предотвращают повторную инфекцию.
3. Напряженный клеточный иммунитет - формируется в полном объеме как при интраназальном, так и при внутримышечном способе введения вакцины. Клеточный иммунитет - это важнейшее звено специфической противовирусной защиты, которая возникает при иммунизации живыми аттенуированными вакцинами.
4. Гуморальный иммунитет - образование иммуноглобулинов классов IgM и IgG выражается в нарастании титра антител, способных препятствовать репликации и проникновению в клетку вирусных тел, находящихся в кровяном русле.
Стратегия применения вакцины
Для снижения и предотвращения циркуляции полевого вируса вакцинируют одновременно всех животных в хозяйстве, начиная с 14 дневного возраста.
Телят до 3 месячного возраста прививают интрана-зально, с повторной вакцинацией через 3,5-4 мес. Повторную вакцинацию можно проводить как интраназально, так и внутримышечно. Животных старше 3-х месяцев, в том числе стельных и (или) лактирующих коров, быков-производителей вакцинируют однократно внутримышечно или интраназально. Ревакцинацию проводят каждые 6 месяцев. При любом способе вакцинации, независимо от возраста и веса животного доза составляет 2 мл (при интраназальном способе - по 1 мл в каждую ноздрю). Напряженный иммунитет у животных после вакцинации формируется на 4 день после интраназального и на 7 день после внутримышечного введения.
Таким образом, прививая все поголовье, животные не заболевают ринотрахеитом или пустулезным вульвовагини-том и, как следствие, прекращается выделение полевого вируса в окружающую среду.
Вторая схема предполагает одну интраназальную вакцинацию телятам в возрасте от 14 дней до 1 месяца. В данном случае не происходит оздоровления стада от ИРТ, но экономические потери резко снижаются за счет формирования активного иммунитета у телят в самом восприимчивом к инфекции возрасте (1,5-4 мес).
Наличие маркера в вакцине позволяет отличать вакцинные антитела от таковых на полевой вирус. Тест-системы для определения антител к маркерным вакцинам выпускает компания IDEXX- один из мировых лидеров в производстве диагностикумов. Исследуя сыворотки крови животных, ветеринарный врач получает информацию о соотношении животных-вирусоносителей и неинфицированных особей, а также о напряженности гуморального иммунитета после вакцинации. Такие данные позволяют судить о распространенности инфекции в хозяйстве, динамики оздоровления и эффективности вакцинации.
Скорость оздоровления стада при использовании маркерной вакцины зависит от множества факторов, таких как частота и качество дезинфекций, скорости обновления стада, ввоза животных из других хозяйств и т.д.
Получение отрицательных результатов исследований в. течении года по всему стаду на наличие полевой инфекции ИРТ, вызванной герпесвирусом BHV-1 позволяет считать данное хозяйство "теоретически" благополучным. В таком хозяйстве не могут произойти ни спорадические ни массовые случаи заболевания, также в данном стаде не выделяется полевой вирус в окружающую среду, но тем не менее возможно серологически скрытое латентное наличие вируса у единичных животных. На таком уровне ликвидации рекомендуется перейти на применение инактивированной маркерной вакцины Bovilis IBR marker inac.
Получение в течение 5 лет отрицательных серологических результатов на BHV-1 gE, свидетельствует о фактическом искоренении инфекции.
You are leaving the country website to access another site in the group.
Regulatory constraints and medical practices vary from country to country. Consequently, the information provided on the site in which you enter may not be suitable for use in your country.

You are leaving the country website to access another site in the group.
Regulatory constraints and medical practices vary from country to country. Consequently, the information provided on the site in which you enter may not be suitable for use in your country.

Винсент Турблин, Сева Санте Анималь, Франция Дмитрий Шешенин, Сева Санте Анималь, Россия
Вирус болезни Гамборо устойчив в окружающей среде и часто может присутствовать в птичнике еще до размещения в нем суточных цыплят. Раннему заражению цыплят полевым вирусом препятствует материнский иммунитет, который постепенно снижается в течение первых двух недель жизни.
Активный иммунитет формируется после вакцинации против болезни Гамборо (ИББ) и позволяет предотвратить заражение цыплят в последующий период выращивания. Основной проблемой в определении сроков вакцинации против этого заболевания является гетерогенность (разнородность) материнских антител у цыплят в ранний период выращивания. Ветеринарные специалисты в зависимости от давления полевого вируса и уровня материнских антител должны ответить на следующие вопросы:
– какой вакцинный штамм выбрать;
– какое количество доз вакцины необходимо для вакцинации;
– в каком возрасте лучше всего вакцинировать цыплят?
Благодаря новой технологии, которую специалисты компании Сева Санте Анималь разрабатывали много лет, была создана вакцина Севак® ТРАНСМУН, позволяющая решать проблему профилактики болезни Гамборо у цыплят с гетерогенным уровнем материнских антител.
Севак ТРАНСМУН: основная характеристика
Севак ТРАНСМУН - это комплексная вакцина, состоящая из вакцинного вируса ИББ штамма Винтерфилд 2512 G61 и специфических антител (рис. 1).
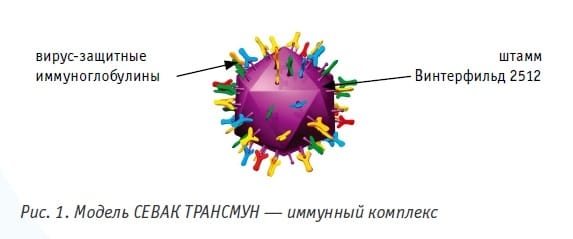
Особенностью этой комбинации является, с одной стороны, безопасность вакцинного вируса для цыплят в раннем возрасте, а с другой - устойчивость вируса к разрушению материнскими антителами. Вакцина производится в удобной лиофилизированной форме и вводится однократно куриным эмбрионам в возрасте 18,5 дней методом in ovo или суточным цыплятам-бройлерам
подкожно.
Применение вакцины Севак ТРАНСМУН позволяет:
– проводить индивидуальную вакцинацию цыплят против болезни Гамборо;
– осуществлять однократную вакцинацию (в отличие от необходимости проводить многократные вакцинации цыплят методом выпаивания);
– вакцинировать цыплят против болезни Гамборо в инкубатории (контроль санитарного состояния в инкубатории намного выше, чем в птичнике).
Каким же образом формируется иммунитет у цыплят при вакцинации Севак ТРАНСМУН?
Резорбция иммунного комплекса
В то время, как вакцинный вирус традиционных вакцин нейтрализуется материнскими антителами, циркулирующими в крови, вакцинный вирус Севак ТРАНСМУН защищен гомологичными антителами и не разрушается материнскими антителами.
Сохранение иммунного комплекса в фолликуло-дендритических клетках иммунных органов
После вакцинации цыплят одним из двух способов (in ovo или подкожно) иммунный комплекс с током крови разносится по организму и улавливается Fc-рецепторами фолликуло-дендритических клеток селезенки, тимуса и других органов. Нестабильный иммунный комплекс постепенно освобождается от гомологичных антител и выделяется в кровяное русло. Процесс освобождения вакцинного вируса из депо и выделение его в кровь может занимать достаточно длительное время (первые четыре недели жизни цыплят).
Массовая вакцинация с индивидуальным подходом
При высоком уровне материнских антител (рис. 2) освобожденный вакцинный вирус быстро распознается и на протяжении всего этого этапа нейтрализуется клетками иммунной системы цыпленка. Вакцинный вирус освобождается и выделяется в кровь постепенно, и как только уровень материнских антител снижается, достигает клеток Фабрициевой сумки и начинает реплицироваться в ней. Репликация вакцинного вируса происходит у каждого цыпленка в свой срок, в зависимости от первоначального уровня материнских антител в его организме (рис. 3).

Несмотря на практически повсеместное проведение вакцинации инфекционный бронхит кур (ИБК) остается серьезной проблемой для стран с промышленным птицеводством. На сегодняшний день ИБК - наиболее важное эндемичное вирусное заболевание, причиняющее огромный экономический ущерб, из-за снижения качества продукции, приводящей к большим потерям в производстве.
Вирус инфекционного бронхита (ВИБ) - птичий коронавирус, который имеет ярко выраженную генетическую изменчивость, обусловленную появлением мутаций и рекомбинаций. Она проявляется наличием многих серотипов и появлением новых антигенных вариантов вируса – на сегодня идентифицировано более 50 серотипов и вариантов ВИБ.
Постоянное возникновение новых серотипов и вариантов ВИБ затрудняет осуществление программ контроля заболевания с помощью вакцинации из-за антигенной изменчивости возбудителя и низкой степени перекрестной защиты между серотипами вируса (Dolz et al., 2008). Это обуславливает необходимость в быстрой и точной диагностике для своевременного выявления новых вариантов возбудителя и сравнения их с существующими вакцинными штаммами (De Wit, 2000).
Течение и характер заболевания зависит от многих факторов, к которым относятся: характеристика полевого вируса (вирулентность, тропизм, серотип), вид и возраст птицы, уровень иммунной защиты в момент инфицирования, наличие иммуносупрессивных факторов, наличие сопутствующих инфекций, уровень биобезопасности и менеджмента на предприятии.
Проявление ИБК у бройлеров и несушек различается по характеру течения, проявлению клинических и патологоанатомических признаков и, соответственно, экономическим убыткам.
У бройлеров отмечается снижение потребления корма и темпов роста, респираторная картина в виде чихания, одышки, хрипов, выделений из носовых раковин, явления внезапной смерти из-за удушья, аэросаккулит из-за вторичных бактериальных инфекций (E.coli, O.rthinotracheale и т.п.), поражения выделительной системы с повышенной смертностью, высокий процент выбраковки птицы.
На бройлерных предприятиях ИБК протекает в первую очередь в виде нефрозо-нефритного синдрома с наличием или отсутствием легких респираторных проявлений.

Фото 1:Фибринозный трахеит ( левая ) Фото 2: Нефрозо-нефрит ( правая )

Такое разнообразие в проявлении клинической, патологоанатомической картины при инфицировании птицы вирусом ИБК в первую очередь связано с широким распространением множества серотипов ИБК и зачастую влиянием на организм птицы одновременно нескольких вариантов ВИБ. На рисунке №1 представлены данные по выявлению спектра серовариантов ВИБ в некоторых хозяйствах Украины.

Рисунок №1. Спектр серовариантов ВИБ на некоторых птицефабриках Украины (по данным Центра современной диагностики за 2011-2015 гг.).
Из представленной гистограммы видно, что, несмотря на 100%-ю вакцинацию всего поголовья птицы на птицефабриках регистрируется инфицирование птицы различными серотипами ВИБ (4/91, D274, D3128, D8880, D1466, Italy-02, QX). Следует обратить внимание на одновременную циркуляцию нескольких разных серотипов ВИБ на каждом предприятии при превалировании таких серотипов как ВИБ Massachusetts и 793/В.
Существует несколько подходов к контролю ИБК:
- Проведение эпизоотологического серомониторинга распространения вируса ИБК на определенной территории (страна, район, птицефабрика) и обеспечение защиты птицы за счет использования вакцинных препаратов гомологичных циркулирующим полевым изолятам.
По такому пути сегодня идут многие страны (США, Китай, Российская Федерация).
- Применение двух живых ослабленных вакцинных штаммов из различных серотипов ИБК типа Маssachusetts и 793/В, значительно расширяет степень защиты от заражения целым рядом различных в антигенном отношении вирусов ИБК. Повышение степени перекрестной защиты от изолятов, принадлежащих к антигенно - различным серотипам, может быть достигнуто, если в возрасте около 2-х недель проводится ревакцинация с применением вакцины на основе серотипа, отличного от того, который был использован при первой вакцинации.
По данным Dr. Jackwood (The World Veterinary Poultry association (WVPA) для США актуальным вариантным штаммом ВИБ является штамм Аrkansas, для контроля ситуации по которому, по рекомендациям Sjaak De Wit (Animal Health Service), используют вакцинные препараты Nobilis IB Ма5 и 4/91, в суточном и 14-дневном возрасте соответственно. Такая комбинация обеспечивает 90% защиты птицы против ВИБ Аrkansas.
Результаты анализа эпизоотической ситуации по вирусу инфекционного бронхита кур в Украине в течение 2007-2011 годов коррелируют с данными W.J.H.Wijmenga по Европе и указывают на доминирующее распространение серовариантов из группы Маssachusetts (Mass) и Английской группы (793/В).

Рис.2 Распределение вируса ИБК на территории Европы и Украины (2007-2011 гг.)
Следовательно, превентивная программа вакцинации птицы против ИБК должна базироваться на использовании в первую очередь вакцин на основе двух ключевых серотипов - Маssachusetts и 793/В.
Именно такая комбинация и лежит в основе вакцины POLIMUN IB MULTI - препарат содержит актуальные для Украины штаммы вируса ИБК Н-120 и БК - 07, выделенные в Украине и антигенно родственные серотипу Маssachusetts и 793/В (антигенное родство штаммов БК-07 и 4/91 составляет 89% по формуле Архетти и Хорсфалла).
Комбинация штаммов Н-120 и БК – 07 позволяет обеспечить широкую перекрестную защиту птицы против антигенно различных ВИБ. На рисунке №3 представлены данные экспериментальной проверки эффективности защиты, обеспеченной вакциной POLIMUNIBMULTI, указывающие на высокую протективную активность препарата при заражении как гомологичными, так и гетерологичными (QX) вирулентными штаммами ВИБ.

Рисунок №3. Эффективность защиты птицы, привитой вакциной POLIMUN IB MULTI.
В заключение, не плохо бы освежить в памяти общие правила вакцинации птицы против ИБК, с учетом которых, можно улучшить ситуацию по данному заболеванию в хозяйстве:
Гомологичные вакцинные штаммы обеспечивают лучшую защиту против соответствующих полевых штаммов, то есть вакцинный и полевой штамм должны принадлежать к одному серотипу.
Для обеспечения перекрестной защиты против вариантных штаммов необходимо применять вакцины из разных серотипов. Например, для первой вакцинации используется вакцина на основе штамма Massachusetts, а для второй вакцинации на основе штамма из группы 793/В.
Праймирование проводят с использованием вакцинных препаратов на основе штамма типа Massachusetts.
Применение инактивированных вакцин для несушек и племенной птицы вызывает индукцию более сильного гуморального иммунитета, причем, чем выше уровень антител, тем лучше.
Лучшие результаты после применения инактивированной вакцины достигаются при правильной схеме праймирования птицы с помощью живых вакцин из гетерологичных штаммов.
Содержание нескольких гетерологичных штаммов в инактивированной вакцине вызывает образование высокого уровня антител к большему количеству штаммов вируса ИБК.
Уровень поствакцинальных антител к вирусу ИБК также зависит от используемых штаммов вируса в вакцине, количества и качества адъюванта в одной дозе, качественного применения вакцины.
Читайте также:


