Обратная транскрипция вируса гепатита с





Общие принципы вирусологии
Цель дисциплины – познакомить студентов с вирусами и субвирусными агентами.
Задача дисциплины - сформировать у студентов представление о:
· месте вирусов и субвирусных агентов в природе
· строении вирусных частиц,
· разнообразии вирусных геномов,
· особенностях взаимодействия вирусов с клеткой и механизмами их репликации,
· природе субвирусных агентов – вироидов, сателлитных РНК и прионах,
IV. Место дисциплины в структуре ООП
Информация об образовательном стандарте и учебном плане:
· тип образовательного стандарта и вид учебного плана – специалитет
· направление подготовки – фармация и лечебное дело
Информация о месте дисциплины в образовательном стандарте и учебном плане:
Для освоения дисциплины необходимо освоение следующих дисциплин: цитологии, органической химии, биохимии, молекулярной биологии, иммунологии
Общая трудоемкость курса – 36 ак. часа
Форма промежуточной аттестации – зачет
V. Форма проведения дисциплины –
Форма проведения дисциплины – лекции
Форма текущего контроля – коллоквиум.
VI. Распределение трудоемкости по разделам и темам, а также формам проведения занятий с указанием форм текущего контроля и промежуточной аттестации:
Трудоемкость (в ак. часах) по формам занятий (для дисциплин) и видам работ (для практик)
Аудиторная работа (с разбивкой по формам и видам)
Наименование разделов и тем дисциплины/наименование разделов (этапов практики)
Раздел I. Общие сведения о вирусах
Тема 1. Краткие сведения о вирусах.
Тема 2. Вирусная инфекция
Тема 3. Структура генетического материала вирусов.
Тема 4. Структура вирусных частиц.
Раздел II. Взаимодействие вируса и клетки.
Тема 1. Проникновение вируса в клетку
Тема 2. РНК-содержащие вирусы.
Тема 3. ДНК-содержащие вирусы.
Коллоквиум по разделам 1 и 2
Раздел III. Синтез компонентов вируса.
Тема 2. Обратная транскрипция.
Тема 3. Синтез вирусных белков
Тема 4. Формирование вирусных частиц
Раздел IV. Онкогенные вирусы и медленные инфекции
Тема 1. РНК-содержащие онкогенные вирусы.
Тема 2. ДНК-содержащие онкогенные вирусы.
Тема 3. Медленные вирусные инфекции.
Тема 4. Прионные болезни
Коллоквиум по разделам 3 и 4
VII. Содержание дисциплины
Раздел I. Общие сведения о вирусах
Тема 1. Краткие сведения о вирусах.
Тема 2. Вирусная инфекция.
Стадии инфекционного цикла. Терминология. История изучения инфекционного цикла. Культивирование клеточных линий. Цитопатический эффект. Синцитиеобразование. Оценка инфекционности вирусов. Методы определения инфекционности. Метод бляшек. Метод конечного разведения. Отношение количества вирусных частиц к количеству бляшкообразующих единиц.
Оценка количества вирусных частиц: гемагглютинация, электронная микроскопия, определение активности вирусных ферментов, иммуноблоттинг, ИФА. Современные методы: использование флуоресцентных белков, ПЦР, секвенирование. Работы Эллис и Дельбрюк. Одиночный цикл размножения фага. Множественность инфекции.
Тема 3. Структура генетического материала вирусов
Классификация вирусов по Балтимору (в зависимости от типа генетического материала). ДНК-содержащие вирусы. Различные типы ДНК-геномов: непрерывный дцДНК, сегментированный дцДНК, оцДНК.
РНК-содержащие вирусы. Различные типы РНК-геномов: дцРНК, оцРНК (+), оцРНК (-). Реассортация сегментированных геномов. Двусмыленная РНК.
Генетика вирусов. Трансформация, трансфекция, мутагенез. Эксперимент Херши-Чейз. Генная терапия.
Тема 4. Структура вирусных частиц.
Общие принципы структуры вирусов. Терминология. Функции вирусных белков. Молекулярная организация вирионов.
Методы изучения структуры вирусных частиц: электронная микроскопия, рентгеноструктурный анализ, криоэлектронная микроскопия, ЯМР-спектроскопия.
Общие принципы структуры вирусов, симметрия. Спиральные вирионы (принципы спиральной симметрии, вирус табачной мозаики). Принципы симметрии сферических вирусов. Икосаэдрические вирусы. Строение оболочечных вирусов. Функции гликопротеинов. Сложные вирусы (аденовирусы, реовирусы, герпесвирусы). Бактриофаги.
Раздел II. Взаимодействие вируса и клетки.
Тема 1. Проникновение вируса в клетку.
Этапы взаимодействия вирусной частицы и клетки. Клеточные рецепторы, необходимые для вирусных частиц. Механизмы проникновения вируса в клетку. Влияние рН на процесс проникновения на примере вируса гриппа. Механизмы регуляции. Молекулярные механизмы проникновения филовирусов в клетку. Взаимодействие простых вирусов с клеточной мембраной. Роль корецепторов в инициации вирусной инфекции. Механизмы проникновения в клеточное ядро.
Тема 2. РНК-содержащие вирусы.
История изучения РНК. Терминология. Типы РНК-геномов. Общие принципы синтеза РНК в клетке. Особенности транскрипции и трансляции (+) РНК-содержащих вирусов. Созревание и выход вирионов из клетки. Репликация и транскрипция (-) РНК-содержащих вирусов с непрерывным геномом. Репликация и транскрипция (-) РНК-содержащие вирусы с сегментированным геномом. РНК-содержащие вирусы с двуцепочечной РНК. Синтез и трансляция вирусных мРНК. Репликация двуцепочечных РНК и созревание вирионов. Синтез РНК как источник генетической изменчивости.
Тема 3. ДНК-содержащие вирусы.
Общие принципы синтеза ДНК в клетке. Особенности репликации вирусных ДНК-геномов. Роль клеточных и вирус-специфических белков в репликации ДНК. Два механизма репликации дцДНК. Обезьяний вирус-40 (SV-40): механизм репликации, роль клеточных и вирусных белков. Парвовирусы: самозатравочный механизм инициации синтеза ДНК. Репликативная форма, надрез (nick) вирусной эндонуклеазой. Инверсия концевых повторов.
Аденовирусы: роль белков в инициации синтеза ДНК. Точка начала репликации (ori) вирусов.
Крупные ДНК-содержание вирусы: механизм репликации вируса простого герпеса и вируса оспы.
Регуляция синтеза вирусных ДНК
Раздел III. Синтез компонентов вируса.
Тема 1. Вирусная транскрипция.
Типы клеточных РНК-полимераз. Понятие о транскрипции вирусных ДНК. Этапы транскрипции. Механизмы инициации транскрипции. Регуляция белкового синтеза на уровне транскрипции. Кэпирование и поладенилирование. Сплайсинг пре-мРНК. Контроль процессинга мРНК при ретровирусной инфекции. Полиаденилирование и сплайсинг при аденовирусной инфекции. Регуляция альтернативного сплайсинга вирусными белками.
Тема 2. Обратная транскрипция.
История открытия и изучения процесса обратной транскрипции. Ретровирусы. Функции вирусной обратной транскриптазы. Механизмы интеграции. Провирус. Ретроэлементы в геноме эукариот. Вирус гепатита В. Строение частиц вируса гепатита В. Структура генома, продукты генов и их функции. Транскрипция ДНК, синтез прегеномной РНК. Механизм репликации вирусного генома, транслокация белковой и РНК-затравок. Общая схема жизненного цикла вируса гепатита В. Эпидемиология гепатита В и его роль в возникновении гепатокарцином.
Тема 3. Синтез вирусных белков.
Тема 4. Формирование вирусных частиц.
Общие принципы сборки вирусных частиц. Механизмы формирования зрелых вирусных частиц. Локализация белков в месте отпочковывания. Механизмы почкования вирусных частиц. Процессы отпочковывания на примере вируса гриппа и ВИЧ. Упаковка вирусной нуклеиновой кислоты. Сигналы упаковки ДНК-содержащих и РНК-содержащих вирусов, вирусов с сегментированным геномом.
Раздел IV. Онкогенные вирусы и медленные инфекции.
Тема 1. РНК-содержащие онкогенные вирусы.
Онкоген, протонкоген, анти-онкоген (супрессор опухоли) – определение понятий.
Онкогенные РНК-содержащие вирусы. Типы структурной организации геномов ретровирусов. Онкогенез в результате вставки промотора, энхансера, трансактивации клеточного генома (вирус Т-клеточного лейкоза человека).
Тема 2. ДНК-содержащие онкогенные вирусы.
Онкогенные ДНК-содержащие вирусы. Истинные вирусные онкогены (механизм действия). ДНК-содержащие онкогенные вирусы как модельная система для исследования молекулярной биологии эукариотической клетки.
Паповавирусы. Общая характеристика. Папилломавирусы. Полиомавирусы. Обезьяний вирус-40 (SV-40): структура, продуктивная и непродуктивная формы инфекции, литическая инфекция. Ранняя транскрипция генов SV-40. Т-антиген - мультифункциональный белок. Репликация ДНК SV-40. Поздняя транскрипция генов. Сборка вириона.
Тема 3. Медленные вирусные инфекции.
Характеристика медленных вирусных инфекций. Факультативные возбудители: вирус кори (подострый склерозирующий панэнцефалит), вирус краснухи (прогрессирующая врожденная краснуха, прогрессирующий краснушный панэнцефалит), вирус клещевого энцефалита (прогредиентная форма клещевого энцефалита), вирус простого герпеса (подострый герептический энцефалит), вирус бешенства (медленная рабическая инфекция). Облигатные возбудители: вирусы JC, ВК, ВИЧ, HTLV 1,2.
Тема 4. Прионные болезни.
Губчатые (спонгиформные) энцефалопатии, свойства, отличающие прионные болезни от других инфекционных заболеваний; история открытия. Роль белка РrРC в организме; Структура и свойства клеточного белка PrPc. Изменение характера укладки полипептидной цепи при превращении белка PrPC в прион PrPSc; механизм копирования конформации. Прионные заболевания человека: наследственные, инфекционные, спорадические; межвидовой барьер, диагностика. Сателлиты. Классификация сателлитов. Сателлитные вирусы. Сателлитные нуклеиновые кислоты (вирусоиды). Вирус гепатита дельта.
VIII. Перечень компетенций, формируемых в результате освоения дисциплины
В результате освоения дисциплины студент должен
· представлять себе место вирусов и субвирусных агентов в системе живой природы
· знать принципы строения вирусов и субвирусных агентов, устройство вирусных геномов вирусов различных групп и способы их экспрессии, способы взаимодействия вирусов и субвирусных агентов с другими организмами.
· уметь использовать полученные знания для применения в области фармации, медицины, медицинской, молекулярной, ветеринарной вирусологии, молекулярной и клеточной биологии, а также смежных областях.
IX. Используемые образовательные, научно-исследовательские и научно-производственные технологии:
В преподавании дисциплины используются демонстрационные компьютерные технологии.
Х. Учебно-методическое обеспечение самостоятельной работы студентов, оценочные средства контроля успеваемости и промежуточной аттестации:
Примеры тем для семинаров:
1. История открытия вирусов
2. Гипотезы происхождения вирусов
3. Гигантские вирусы (мимивирус, мегавирус, пандоравирус)
5. Онколитическая виротерапия
6. Вирус Зика: эпидемиология, пути передачи, лечение
7. Вирус Эбола: эпидемиология, профилактика, лечение
8. Современные препараты для профилактики и лечения ВИЧ-инфекции/СПИДа. Микробициды
9. Вирусные препараты для лечения, профилактики и диагностики инфекционных заболеваний
10. Возбудители медленных вирусных инфекций. Прионы. Вироиды
XI. Учебно-методическое и информационное обеспечение дисциплины
Вирус гепатита В (частица Дейна) - ДНК-содержащий вирус из семейства Hepadnaviridae, диаметром 42 нм. Липопротеидная оболочка содержит поверхностный антиген HBsAg (австралийский антиген), открытый Бламбергом в 1965г. В частицах HBsAg определяются три белковых домена (Pre-S1, Pre-S2, S), липидный и углеводный компонент, а также рецептор полимеризованного альбумина рАR (рис. 1.).
Рис. 1. Структура вируса гепатита B
Гепатоциты (клетки печени) имеют рецептор для полиальбумина, предполагается, что с помощью рАR HBV проникает в клетку.
Существует один главный серотип и генетически устойчивые подтипы HBsAg, определяемые набором антигенных детерминант его поверхности: adw, adr, ayw, ayr.
В структуру нуклеокапсида (ядерного антигена - HBcAg) входят: субъединица HBeAg, ДНК-полимераза (обратная транскриптаза), протеинкиназа и ДНК.
Молекула ДНК (HBV DNA) частично однонитчатая, кольцевой конфигурации.
HBeAg образуется в процессе превращения белка Pre-core в структурный белок core и выделяется за пределы клетки (служит маркером репликации вируса).
Важные функции выполняют полипептидные Pre-S домены (регионы) HBsAg.
Pre-S1 регион HBsAg “распознается” рецепторами гепатоцита. Его содержание в крови служит отражением репликации вируса. К Pre-S1 вырабатываются вируснейтрализующие антитела, нарушение их синтеза способствует хронизации инфекции.
Предполагается, что антитела к Pre-S2 также имеют значение для элиминации вируса.
Вирус гепатита В во многом уникален. Его геном представлен двуцепочечной кольцевой молекулой ДНК — наименьшей из всех ныне идентифицированных ДНК у ДНК-содержащих вирусов. ДНК ВГВ состоит приблизительно из 3200 нуклеотидов, с колебаниями от 3182 до 3221 в различных изолятах вируса.
В ДНК ВГВ идентифицированы 4 гена (S, С, Р, X). Кроме того, в геноме вируса определены регуляторные последовательности ДНК, ответственные за синтез белков и репликацию вируса. Открытые рамки считывания определенных генов частично перекрывают друг друга, что обеспечивает высокую информационную емкость генома ВГВ.
Ген Р охватывает обширную зону протяженностью приблизительно в 840—850 нуклеотидов, кодируя белок с молекулярной массой 25000, обладающий ферментативной активностью (РНК-зависимая ДНК-полимераза).
Ген S содержит информацию о главном белке оболочки вируса — HBsAg. Этому гену предшествуют две зоны: pre-Sl и рге-S2. Ген S и указанные две зоны кодируют три белка: основной белок (ген S), состоящий их 226 аминокислот, обнаруживаемый в гликозилированной (gp 27) и негликозилированной форме (р 24); средний (ген S и pie-S2), существующий в единожды и дважды гликозилированных формах (gp 33); большой (ген S, pre-S2, pre-Sl) белок, находящийся в негликозилированной (р 39) и единожды гликозилированной (gp 42) форме.
Область pre-Sl кодирует белок, прикрепляющийся к рецептору IgA на поверхности гепатоцита, тем самым способствуя проникновению вируса в клетку.
Область гена pre-S2 несет информацию об участке связывания с полимеризованным альбуминовым рецептором, локализованным также на гепатоците.
Ген С, состоящий из 183-185 аминокислот, кодирует белок нуклеокапсида - HBcAg. Перед геном С расположена зона рге-Соге; синтезированный на ее основе белок является регуляторным или сигнальным в синтезе ядерного антигена.
Ген Х кодирует белок, состоящий из 154 аминокислот с молекулярной массой около 16000, который активирует экспрессию всех генов вируса гепатита В.
Репликация генома вируса гепатита В во многом отлична от таковой у других ДНК-содержащих вирусов. Она начинается с проникновения вириона в гепатоцит с разрушением внешней оболочки частицы Дейна.
При помощи ДНК-полимеразы происходит достройка одноцепочечных участков короткой цепи ДНК ВГВ с образованием РНК-репликативного посредника (прегенома) с одновременной транскрипцией и трансляцией, т. е. с синтезом вирусспецифических белков. Образовавшийся пренуклеоид включает в себя прегеномную РНК- и ДНК-полимеразу.
Следующим этапом репликации является обратная транскрипция, т. е. синтез полной цепи ДНК на РНК матрице при помощи вирусспецифической ДНК-полимеразы, обладающей свойствами обратной транскриптазы (ревертазы) с последующим разрушением прегеномной РНК.
Затем на минус цепи ДНК ВГВ происходит синтез неполной цепи ДНК ВГВ.
Образовавшаяся кольцевая структура ДНК ВГВ вместе с ДНК-полимеразой включается в нуклеокапсид вируса и мигрирует в цитоплазму гепатоцита, где формируется наружная оболочка вируса, состоящая из HBsAg и липидов клетки.
Как только новая вирусная частица выходит из гепатоцита, синтез плюс цепи ДНК ВГВ прекращается.
Различия во времени выхода из гепатоцита вирусных частиц определяют вариабельность длины плюс цепи ДНК ВГВ.
Кроме включения ДНК ВГВ в состав потомства вирусных частиц, она может интегрироваться в геном гепатоцита.
Синтез белков вируса гепатита В регулируется на уровне транскрипции и трансляции. Усилители транскрипции активируют экспрессию генов вируса, действуя преимущественно в клетках печени.
На протяжении длительного времени считалось, что гепатоциты являются единственными клетками организма, где может происходить синтез вируса гепатита В. Идентификация последовательностей ДНК и белков вируса в клетках почек, селезенки, поджелудочной железы, кожи, костного мозга и клетках крови опровергло это положение.
Вместе с тем доказано, что максимальная экспрессия генов вируса гепатита В, и прежде всего S-гена, происходит только в печени, возможно, под влиянием стероидных гормонов.
Одним из уникальных свойств вируса гепатита В является его взаимосвязь с развитием первичного рака печени. В настоящее время можно считать доказанной роль этого вируса в развитии опухоли.
ВГВ может быть обнаружен в сыворотках крови и цитоплазме гепатоцитов больных острым и хроническим гепатитом, а также у носителей вируса
При электронной микроскопии определяются две морфологические формы: частицы, имеющие оптически плотное ядро, содержащие ДНК ВГВ, и неполные частицы - без ДНК. Концентрация вирусных частиц в сыворотках крови с наличием HBsAg колеблется от 10 частиц в 1 мл до количеств, недоступных выявлению с помощью электронной микроскопии.
Некоторые сыворотки крови с наличием ВГВ инфекционны даже в разведениях 10 -7 — 10 -8 .
Инфекционность ВГВ в сыворотке крови сохраняется
- при 30-32° С в течение б месяцев;
- при -20°С - 15 лет;
- после прогревания до +60°С — 4 часа;
- при 98°С — в течение 1 минуты сохраняется частично, а через 20 мин исчезает полностью;
- при обработке сухим жаром (-Н60°С) разрушается в течение 1 часа;
- обработка бета-пропиолактоном в сочетании с ультрафиолетовым облучением снижает инфекционность ВГВ-содержащей плазмы примерно в 10 миллионов раз.
Частицы ВГВ чувствительны к эфиру и неионным детергентам, которые разрушают внешнюю оболочку вириона, освобождая при этом нуклеокапсид.
Многочисленные попытки культивирования ВГВ в различных клеточных культурах были неудачны.
Для обнаружения и количественного определения ВГВ применяют иммуноэлектронную микроскопию и определение ДНК-полимеразной активности. Косвенным доказательством наличия ВГВ в исследуемом материале может быть выявление ДНК ВГВ в тесте гибридизации и амплификации , а также в иммуноферментном или радиоиммунном анализе по наличию HBcAg, выделенного из состава частицы Дейна после обработки детергентами.
В экспериментальных условиях ВГВ способен размножаться в организме человекообразных обезьян, полностью воспроизводя клинико-морфологические проявления, характерные для гепатита В, кроме желтухи.
| Артикул | Цена, вал. | Наличие на складе | Количество | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1971.0040 | 40 реакций | 6 525,= RUB 6 525 | Под заказ | |||||||||||||||||||||||
| 1971.0200 | 200 реакций | 29 363,= RUB 29 363 | Под заказ |
Экстра-микс RT-PCR Color предназначен для проведения обратной транскрипции и ПЦР одношаговым методом. Кроме собственно экстра-микса, в состав набора входят 2-кратный буфер RT-PCR Color, ДМСО и вода, обработанная диэтилпирокарбонатом (ДЭПК). Буфер оптимизирован для протекания как обратной транскрипции, так и ПЦР и содержит все необходимые компоненты (за исключением РНК-матрицы и праймеров). Хранение буфера при комнатной температуре в течение 2 дней не снижает эффективность реакции. Буфер содержит красители, не влияющие на работу ферментов, и компоненты, увеличивающие плотность пробы для удобства нанесения на гель. MMLV–RH – генетически модифицированная обратная транскриптаза (ревертаза) вируса лейкемии мышей (M-MuLV). Она отличается от обратной транскриптазы MMLV дикого типа структурой, каталитическими свойствами и температурным оптимумом активности. Фермент проявляет РНК- и ДНК-зависимую полимеразную активность, но лишен активности РНКазы Н. MMLV–RH проявляет оптимальную активность при +42°С (активна до +50°С). Фермент способен синтезировать первую цепь кДНК длиной до 10 т.н. и включать модифицированные основания. HS-Taq ДНК-полимераза представляет собой рекомбинантную Taq ДНК-полимеразу, инактивированную специфическими моноклональными антителами. HS-Taq ДНК-полимераза неактивна при температуре ниже +70 о С. Для её активации необходим прогрев реакционной смеси при +95°С в течение 5 мин. Рекомбинантная HS-Taq ДНК-полимераза обладает 5´-3´ ДНК-зависимой полимеразной активностью и 5’-3’ экзонуклеазной активностью нативной Taq ДНК-полимеразы из Thermus aquaticus. Скорость продвижения Taq ДНК-полимеразы зависит от сложности ДНК-матрицы и составляет примерно 1 т.п.н./мин. Рекомбинантная HS-Taq ДНК-полимераза идеально подходит для стандартной ПЦР с матрицы до 5 т.п.н.; обладает способностью присоединять аденин к 3’-концу синтезируемой цепи, поэтому продукты ПЦР могут использоваться для ТА-клонирования. Состав набора
Состав Экстра-микса RT-qPCR:
Срок хранения и транспортировка: ДоставкаДоставка осуществляется по всей России и странам СНГ. Возможен самовывоз со склада по адресу Московская область, г. Мытищи, 7-й Ленинский переулок, д.13. Доставка по Москве и Московской области осуществляется бесплатно. Цена товара указана со склада в Москве и не включает расходы на доставку в другие города. Точная стоимость доставки рассчитывается менеджером при подтверждении заказа в зависимости от весообъемных характеристик и дальности. Товары, требующие особого температурного режима, доставляются с соблюдением требуемых условий. Если в заказе есть прекурсоры, необходимо оформить официальное письмо об отпуске прекурсоров. (образец письма об отпуске прекурсоров) ОплатаДля получения товара необходимо предоставление доверенности организации, а для получения товара при оплате физическим лицом необходим паспорт.
| ||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||
| Условное обозначение | RVT_1 | |||||||||||||||||||||||||
| Pfam | PF00078 | |||||||||||||||||||||||||
| Pfam клан | CL0027 | |||||||||||||||||||||||||
| InterPro | IPR000477 | |||||||||||||||||||||||||
| PROSITE | PS50878 | |||||||||||||||||||||||||
| СКОП | 1hmv | |||||||||||||||||||||||||
| СУПЕРСЕМЕЙСТВА | 1hmv | |||||||||||||||||||||||||
| CDD | cd00304 | |||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| РНК-ДНК-полимеразы направлены | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| номер ЕС | 2.7.7.49 | ||||||||
| Количество CAS | 9068-38-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | вид IntEnz | ||||||||
| BRENDA | запись BRENDA | ||||||||
| ExPASy | вид NiceZyme | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Джин Онтология | Amigo / QuickGO | ||||||||
| |||||||||
Обратной транскриптазы (RT) представляет собой фермент , используемый для создания комплементарной ДНК (кДНК) из РНК матрицы, процесс называется обратной транскрипции . Обратные транскриптазы используются ретровирусов , чтобы повторить их геномы, с помощью ретротранспозонов мобильных генетических элементов , которые пролиферируют в геном хозяина, с помощью эукариотических клеток , чтобы продлить теломеры на концах своих линейных хромосом , а некоторые не ретровирусов , таких как вирус гепатита В , член Hepadnaviridae , которые являются вирусами дц-RT .
Ретровирусное RT имеет три последовательные биохимическую деятельность: РНК-зависимая ДНК - полимераза активность, рибонуклеазы H и ДНК - полимеразную активность ДНК-зависимая. В совокупности эти мероприятия позволяют фермент конвертировать одноцепочечной РНК в кДНК двуспиральных. В ретровирусов и ретротранспозонов, эта кДНК может затем интегрировать в геном хозяина, из которого новые копии РНК может быть сделано с помощью хост-клеточной транскрипции . Же последовательность реакций , широко используется в лаборатории , чтобы преобразовать РНК в ДНК для использования в молекулярного клонирования , РНК - последовательности , полимеразной цепной реакции (ПЦР), или анализ генома .
содержание
история
Ревертазами обнаружены Темин в Университете Висконсин-Мэдисон в РСВ вирионов и независимо друг от друга изолированы от Дэвида Балтимора в 1970 году в MIT от двух вирусов опухолевых РНК: R-MLV и снова RSV . Для их достижения, как общие , так в 1975 году Нобелевскую премию по физиологии и медицине (с Дульбекко ).
Хорошо изучены обратные транскриптазы включают в себя:
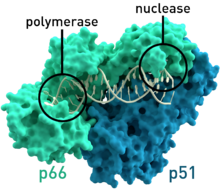
- ВИЧ-1 обратную транскриптазу из вируса иммунодефицита человека типа 1 ( PDB : 1HMV ) имеет две субъединицы, которые имеют соответствующие молекулярные массы 66 и 51 кД .
- М-MLV обратной транскриптазы из вируса мышиного лейкоза Молони является единственным 75 кДа мономера.
- AMV обратной транскриптазы от вируса птичьего миелобластоза также имеет две субъединицы, 63 кДа субъединицу и субъединицу 95 кДа.
- Теломеразы обратной транскриптазы , которая поддерживает теломеры из эукариотическиххромосом .
Функция в вирусах

Эти ферменты кодируются и используются вирусами , которые используют обратную транскрипцию в качестве шага в процессе репликации. Реверс-транскрибировать РНК вирусов , таких как ретровирусы , используют фермент обратной транскрипции РНК их геномов в ДНК, которая затем интегрирована в геном хозяина и реплицируется вместе с ним. Реверс-расшифровку ДНК - вирусы , такие как hepadnaviruses , может позволить РНК служить в качестве матрицы для сборки и изготовления нитей ДНК. ВИЧ заражает людей с использованием этого фермента. Без обратной транскриптазы, вирусный геном не был бы в состоянии включить в клетку - хозяина, что приводит к невозможности репликации.
Обратный транскриптазы создает двухцепочечной ДНК из матрицы РНК.
В вирусных видах с обратной транскриптазой отсутствует ДНК-зависимая ДНК - полимеразная активность, создание двухцепочечной ДНК , возможно , может быть сделано с помощью хост-кодируемого ДНК - полимеразы б , ошибочно вирусной ДНК-РНК для праймера и синтез двухцепочечной ДНК, аналогично механизм , как в грунтовочном удалении , где вновь синтезированная ДНК замещает исходную РНК - матрицу.
Процесс обратной транскрипции чрезвычайно подвержены ошибкам, и именно на этом этапе , который может произойти мутации. Такие мутации могут привести к лекарственной устойчивости .
Ретровирусы , называемые также класс В. И. оцРНК-RT вирусы, РНК обратного транскрибирование вирусов с помощью ДНК - промежуточного соединения. Их геномы состоят из двух молекул с положительной смысловой одноцепочечной РНК с микросхемой колпачок 5' и 3' полиаденилированой хвоста . Примеры ретровирусов включают вирус иммунодефицита человека ( ВИЧ ) и человеческий Т-лимфотропный вирус ( HTLV ). Создание двухцепочечной ДНК происходит в цитозоле в виде серии этих шагов:
Создание двухцепочечной ДНК также включает в себя перенос цепи , в которой происходит транслокация короткого продукта ДНК из исходного РНКА-зависимого синтеза ДНК в регионы шаблона акцептора на другом конце генома, которые затем достигли и обрабатывают с помощью обратной транскриптазы для его активности ДНК - ДНК-зависимой.
Ретровирусная РНК расположена в 5' - конца к 3' - концу. Сайт , где праймер отжигают с вирусной РНК называется сайт праймер-связывающий (PBS) , . РНК 5'на сайт PBS называется U5, а конец РНК 3' в PBS называется лидером. Праймера тРНК разматывается от 14 до 22 нуклеотидов и образует базовую спарены дуплекс с вирусной РНК в PBS. Тот факт , что PBS , расположен вблизи 5' - конца РНК вируса является необычным , поскольку обратной транскриптазы синтезируют ДНК от 3' - конца праймера в направлении 5' к 3' направлении (по отношению к вновь синтезированной цепи ДНК). Поэтому, праймер и обратной транскриптазы должны быть переведены в 3' конца вирусной РНК. Для того чтобы выполнить эту репозицию, несколько стадий и различные ферменты , включающие ДНК - полимеразы , рибонуклеазы H (РНКазы Н) и полинуклеотидной раскручивания нужны.
Обратной транскриптазы ВИЧ также имеет рибонуклеазы активностью , которая ухудшает вирусную РНК в ходе синтеза кДНК, а также ДНК - полимеразы ДНК-зависимую активность , которая копирует смысл цепь кДНК в антисмысловой ДНК с образованием двухцепочечной вирусной ДНК промежуточного (vDNA) ,
В эукариот
Самореплицирующихся участки эукариотических геномов , известные как ретротранспозоны используют обратную транскриптазу , чтобы перейти из одного положения в геноме к другому с помощью РНК - промежуточного соединения. Они найдены в изобилии в геномах растений и животных. Теломеразы является другой обратной транскриптазы во многих эукариот, включая человека, который несет свою собственную РНК шаблон; эта РНК используется в качестве шаблона для репликации ДНК .
В прокариот
Первоначальные доклады обратной транскриптазы в прокариот пришел еще в 1971 году (Beljanski и др., 1971а, 1972). Они с тех пор были широко описаны как часть бактериальных Retrons , различных последовательностей , которые кодируют обратной транскриптазы, и могут быть использованы в синтезе msDNA . Для того чтобы инициировать синтез ДНК, праймер необходим. У бактерий, праймер , синтезированный в процессе репликации.
Эволюционная роль
Валериан Dolja из штата Орегон утверждает, что вирусы, из-за их разнообразия, сыграли эволюционную роль в развитии клеточной жизни, с обратной транскриптазы играет центральную роль.
Состав
Обратной транскриптазы ферменты включают РНК-зависимой ДНК - полимеразы и ДНК-зависимой ДНК - полимеразы, которые работают вместе , чтобы выполнить обратную транскрипцию. В дополнении к функции транскрипции, ретровирусные обратные транскриптазы имеют домен , принадлежащие РНКазы Н семье, которая имеет жизненно важное значение для их репликации.
Репликация верность
Есть три различных системы репликации в течение жизненного цикла ретровирусов. Прежде всего, обратная транскриптаза синтезирует вирусную ДНК от вирусной РНК, а затем из новоиспеченного комплементарной цепи ДНК. Второй процесс репликации происходит, когда хост-клеточная ДНК-полимераза копирует интегрированную вирусную ДНК. Наконец, РНК-полимераза II переписывает провирусную ДНК в РНК, которые будут упакованы в вирион. Таким образом, мутация может произойти в течение одного или всех этих шагов репликации.
Обратные транскриптазы имеют высокую частоту ошибок при переписывании РНКА в ДНК , так как, в отличие от большинства других ДНК - полимераз , это не имеет никакого корректура способности. Эта высокая частота появления ошибок позволяет мутации накапливаются в ускоренном темпе относительно вычитать формы репликации. Коммерчески доступные обратные транскриптазы , производимые Promega цитирует их руководства как имеющая частоту ошибок в диапазоне от 1 в 17 000 оснований для AMV и 1 в 30000 оснований для M-MLV.
Другие , чем создание однонуклеотидных полиморфизмов , обратной транскриптазы также было показано, что участие в таких процессах, как транскриптов слитых , экзона перетасовки и создание искусственных антисмысловых транскриптов. Было высказано предположение , что этот шаблон переключение активность обратной транскриптазы, которая может быть продемонстрирована полностью в естественных условиях , может быть одной из причин для нахождения несколько тысяч Неаннотированных транскриптов в геномах модельных организмов.
Приложения
Поскольку ВИЧ использует обратную транскриптазу , чтобы скопировать свой генетический материал и создавать новые вирусы (часть окружности пролиферации ретровирусов), конкретные препараты были разработаны , чтобы нарушить процесс и тем самым подавить его рост. В совокупности эти препараты известны как ингибиторы обратной транскриптазы и включают нуклеозидные и нуклеотидные аналоги зидовудин (торговое название Ретровир), ламивудин (Эпивир) и тенофовир (Виреад), а также ненуклеозидные ингибиторы, такие как невирапин (Вирамун).
Обратный транскриптазы обычно используется в исследованиях для применения полимеразной цепной реакции технику РНК в технологии , называемой обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР). Классическая ПЦР метод может быть применен только к ДНК нитей, но, с помощью обратной транскриптазы, РНК может быть транскрибируется в ДНК, что делает ПЦР анализ молекул РНК возможных. Обратные транскриптазы используются также для создания библиотек кДНКа из мРНКа . Коммерческая доступность обратной транскриптазы значительно улучшилась знание в области молекулярной биологии, так как, наряду с другими ферментами , это позволило ученым клонировать, последовательность, и характеризуют РНК.
Обратные транскриптазы также использованы в инсулине производстве. Вставив эукариотической мРНК для производства инсулина вместе с обратной транскриптазы в бактерии, мРНК может быть вставлена в геном прокариот в. Большое количество инсулина , то могут быть созданы, обходя необходимость урожая поджелудочной железы свиней и других таких традиционных источников. Непосредственно вставив эукариотической ДНК в бактерии не будет работать , потому что она несет интронов , так что не будет переводить успешно с помощью бактериальных рибосом. Обработка в эукариотической клетке в процессе производства мРНК удаляет эти интроны , чтобы обеспечить подходящий шаблон. Обратные транскриптазы превращают этот отредактированный РНК обратно в ДНК , так что можно было бы включить в геноме.
Читайте также: