Низкий гемоглобин при лечении гепатита с

Инфицирование вирусом гепатита С (HCV) является основной причиной развития посттрансфузионного гепатита и цирроза печени и потому представляет актуальную проблему для больных с наследственными аномалиями крови [7, 10, 11]. Для этой патологии характерны повсеместное распространение, высокий уровень заболеваемости и смертности. Столь выраженная способность HCV вызывать персистирование инфекции связана с высокой частотой мутаций и образованием множественных квазивидов, незначительно отличающихся друг от друга геномами [6].
Инфицирование вирусом гепатита С пациентов с наследственной патологией крови возникает из-за регулярно проводимой гемотрансфузионной терапии, являющейся основным методом лечения больных. Поэтому пациентов с α и β талассемией причисляют к группе риска по заражению гемотрансмиссивными инфекциями. При гомозиготной форме β-талассемии (гомоз. β-th) HCV инфекция по частоте распространения является второй после гемохроматоза [12]. Возникший хронический гепатит С (ХГС) нередко протекает бессимптомно, под маской основной патологии. Поражается орган, который в норме поддерживает метаболитический гомеостаз и от функционального состояния которого во многом зависят течение и исход основного заболевания. При ХГС изменения в печени представляют собой постоянный, необратимый процесс и характеризуются длительным течением. Манифестация уже на поздней стадии болезни с высокой частотой внутри и внепеченочных проявлений, в том числе развитием анемического синдрома и портального цирроза печени, существенно усложняет лечебно-диагностический процесс [9].
Печень участвует в обмене железа, метаболизме порфиринов и образовании ферментов, необходимых для в синтеза молекул гема. При низких концентрациях сывороточного железа гепатоциты способны отдавать железо в кровь для нужд эритропоэза [6]. С развитием гемосидероза в печени возрастает тяжесть фиброзных изменений. Присоединение ХГС к наследственной патологии крови увеличивает функциональную недостаточность печени. По сравнению с HBV роль HCV инфекции в генезе поражения печени при гомоз. β-th, гемоглобинопатии Н (Hbpat.H) и поздней кожной порфирии (ПКП) представляется более значительной, в связи с частотой его выявления. У больных с ПКП обнаружена связь аккумуляции железа в печени с обострением ХГС [9]. HCV инфекция и железо увеличивают кислородный стресс на гепатоциты, способствуя окислению уропорфириногена в уропорфирин, который не метаболизируется ферментом уропорфириноген-декарбоксилазой, а накапливается в печени и оказывает токсическое влияние на жизненно важные органы и системы [1-5, 8].
В доступной литературе мы не встретили специальных работ, посвященных изучению обмена железа и порфиринов у больных с наследственными аномалиями крови, инфицированных вирусом гепати-
та С. Остаются малоизученными особенности течения ХГС у пациентов с талассемией и поздней кожной порфирией, не определены подходы к неинвазивной диагностике стадии патологического процесса, этиопатогенетической терапии и динамическому наблюдению за данной категорией больных.
Исходя из вышеизложенного целью исследования явилось изучение влияния хронического гепатита С на метаболизм железопорфиринового комплекса и результаты проводимой терапии у больных с гомозиготной формой β-талассемии, гемоглобинопатией Н и поздней кожной порфирией.
Материалы и методы исследования
Под наблюдением находилось 82 пациента с наследственной патологией крови, в возрасте 6-33 лет (медиана - 21 год, женщин - 38, мужчин - 44), проходивших обследование и лечение в АзНИИ гематологии и трансфузиологии. Все больные были разделены на 3 группы: 1-ю составили 32 пациента с гомоз. β-th без и с ХГС (по 16 больных), 2-ую - 30 пациентов с Hbpat.H без и в сочетании с ХГС (по 15 больных) и 3-ю - 20 больных с ПКП без ХГС - 4 случая и с ХГС - 16 пациентов. Во 2-й группе без ХГС 15 пациентов наблюдались после спленэктомии в анамнезе.
Диагноз гомоз. β-th основывался на анамнезе и клинико-лабораторных признаках заболевания. Семейно-генетические исследования подтверждали наследственный характер заболевания. У больных при проведении электрофореза гемоглобина (Нb) выявлены высокий уровень фетального гемоглобина (НbF) - 29-64 %, повышенное содержание HbА2 до 3,7 % и положительная осмотическая резистентность эритроцитов (ОРЭ). У 30 больных с α-талассемией из-за делеции 3-х из 4-х α-цепочечных глобиновых генов на электрофорезе (Hb) обнаружен аномальный HbH (8-17 %), при нормальном содержании HbF и HbA2. У больных определялась гепато- и спленомегалия, деформация костей скелета из-за расширения губчатого слоя при истончении коркового слоя костей черепа и длинных трубчатых костей, с развитием в них остеопороза. ПКП у 12 пациентов носила наследственный и у остальных приобретенный характер с хроническим течением. Диагноз подтверждался исследованием активности фермента УПГ-Д. Кожные проявления совпадали со сниженным уровнем фермента УПГ-Д до 69 %, при норме 97-100 %.
При поступлении больных в клинику и при выписке исследовались общий анализ крови с тромбоцитами, ретикулоцитами, эритроцитарные параметры (RBC, MCV, MCH, MCHC); основные биохимические показатели, характеризующие функцию печени: общий билирубин в сыворотке крови и его фракции, протеинограмма, белково-осадочные пробы печени (формоловая, сулемовая); активность внутриклеточных ферментов - аланин и аспартатаминотрансфераз (АЛТ и АСТ) с вычислением коэффициента Ритиса (АЛТ/АСТ, в норме 0,8-1). В сыворотке крови исследовался уровень щелочной фасфатазы (ЩФ) и гаммаглютаминтранспептидазы (ГГТ). О запасах железа свидетельствовали показатели сывороточного железа и общей железосвязывающей способности сыворотки крови (СЖ, ОЖСС, метод R. Henry et al., 1958); количество сидеробластов (СБ) и сидероцитов (СЦ) в костном мозге; десфераловый тест (метод R. Henry et al., 1958); данные биопсии печени с качественным и количественным определением железа; сывороточный ферритин (СФ). Учитывая взаимосвязь функционального состояния печени с метаболизмом порфиринов, в динамике определялись: предшественники порфиринового обмена - σ-аминолевулиновая кислота и порфобилиноген (σ-АЛК, ПБГ, метод D. Mauzerall, S. Granick, 1956); величина экскреции с мочой уропорфирина (УП) и копропорфирина (КП) (УП, метод W. Reinkingh и E. Van Kampen, 1964; КП, метод S. Schwarts et al., 1951). Всем больным проводилось ультразвуковое исследование (УЗИ) и 11 пациентам осуществлена магнитно-резонансная томография (МРТ).
Из анамнеза больных следовало, что инфицирование вирусом гепатита С произошло в различные периоды времени, а причиной тому в 89 % случаев была гемотрансфузионная терапия. Заражению в одинаковой степени были подвержены лица обоих полов и различных возрастных групп. Обладая высоким хроногенным потенциалом, HCV инфекция была основной причиной развития ХГС, с переходом в 36 случаях в портальный цирроз печени. Диагноз ХГС подтверждался с помощью клинико-эпидемиологических, лабораторно-инструментальных и морфологических данных, обнаружения в крови антител к вирусу гепатита С, а также путем качественного определения вирусной РНК, методом ПЦР, что имело существенное значение для оценки контагиозности и мониторинга результатов лечения. Маркер HCV исследовался имунноферментным анализом (ИФА). У инфицированных больных основными генотипами HCV были 1в (40 %) и 3а (20 %). С диагностической целью применялась пункционная биопсия печени. В биоптате печени больных обнаружены некрозо-воспалительные и фиброзные изменения, что служило показанием для начала этиотропной терапии. Лечение таких больных включало курсы специфической противовирусной терапии препаратами α-интерфероном и рибавирином.
Результаты исследования и их обсуждение
Нарушения в работе печени при талассемиях и поздней кожной порфирии (ПКП) регистрировались при первичной диагностике заболеваний в 85-97 % случаев. Общее состояние 46 пациентов после присоединения к основной патологии хронического персистирующего гепатита (ХГ) и ХГС оценивалось как средней тяжести, субкомпенсированное, а 36 больных с портальным циррозом печени - тяжелое, декомпенсированное (табл. 1). На течение заболевания оказывали влияние тяжесть анемии и нарушения в обмене железа и порфиринов. Жалобы больных сводились к нарастающей общей слабости, утомляемости, одышке, тяжести в эпигастральной области, выявлялись иктеричности склер и видимых слизистых оболочек. При портальном циррозе печени у 5 больных на коже передней брюшной стенки определялись характерные сосудистые звездочки, а у 19 отмечались диспептические явления с потерей массы тела и желтуха, как результат гемолиза и нарушенной функции гепатоцитов. Гепатомегалия выявлена у 77, а спленомегалия с синдромом гиперспленизма - у 47 больных 1-й и 2-й групп и у 8 пациентов с ПКП. В 26 случаях наблюдались отеки и асцит. У 6 пациентов определялись признаки печеночной энцефалопатии. У 30 больных рентгенологически обнаружено варикозное расширение вен пищевода с кровотечением у 10.
Таблица 1
Распределение ХГ, ХГС и цирроза печени среди больных
с наследственной патологией крови

Уровень гемоглобина – один из показателей общего анализа крови, характеризующий общее состояние организма, в том числе тяжесть печеночных дисфункций. Этот компонент эритроцитов состоит из железа и белка, занимается переносом кислорода ко всем клеткам. На гемоглобин при гепатите С ориентируются, когда назначают противовирусные и иммуностимулирующие препараты, так как некоторые из них способны истощать запасы железа в организме.
Почему изменяется уровень гемоглобина при гепатите С
Общий анализ крови – стандартное обследование, необходимое пациентам с острым и хроническим гепатитом. Нарушение функций печени сказывается на составе крови и функционировании системы кроветворения. Обязательно учитывается, какой гемоглобин при гепатите С – пониженный или повышенный, и от его уровня зависит тактика лечения.
Источник гемоглобина — железо, поступающее в организм вместе с пищей. Всасываясь в кишечнике, оно накапливается в клетках печени и высвобождается, поддерживая обновление эритроцитов. Если на гепатоциты воздействует вирус гепатита С, они разрушаются и теряют способность накапливать железо, приводя к его дефициту в организме.
При гепатите С часто развивается железодефицитная анемия, при которой гемоглобин длительное время держится в норме, пока не истощатся резервы железа. По мере прогрессирования гепатита и цирроза печени усиливается воспалительная реакция, приводящая к нарастанию симптомов железодефицита.
Отдельная причина низкого гемоглобина – портальная гипертензия. Она приводит к варикозному расширению вен желудка и пищевода. Для этих состояний характерны регулярные кровотечения, влияющие на состав крови.
Ряд фармакологических препаратов, предназначенных для подавления репликации вирусов, вызывает анемию. Чаще такой побочный эффект дают лекарства, уже десятилетиями использующиеся для лечения гепатита С, – Интерферон и Рибавирин. Например, в костном мозге на фоне длительного приема Интерферона нарушается выработка красных кровяных клеток, а негативное действие Рибавирина заключается в разрушении эритроцитов.
Когда красные клетки крови гибнут, гемоглобин преобразуется в билирубин, который перерабатывается печенью и выводится вместе с желчью в кишечник. Но при вирусном гепатите клетки печени не справляются со своими функциями, и уровень билирубина в крови повышается, усугубляя состояние больного.
Анемия, вызванная противовирусными препаратами, носит временный характер. Через некоторое время после их отмены показатели крови нормализуются.
Повышенный гемоглобин при гепатите – результат выраженных дисфункций печени. На фоне интоксикации и гипоксии развивается эритроцитоз – повышение количества эритроцитов, сгущение крови и нарушение ее циркуляции.
При гепатите С иногда требуется выяснить концентрацию гликированного гемоглобина. Его высокий уровень у здоровых людей свидетельствует о сахарном диабете, но при патологиях печени повышение указывает на истощение ресурсов железа, характерного для хронического течения гепатита.
Повышение гемоглобина опасно для здоровья, если его концентрация выше 190 г/л и он присутствует вне эритроцитов. Нарушается вязкость и циркуляция крови, что еще сильнее ухудшает самочувствие больного.
Как нормализовать показатели
Чтобы устранить анемию, наряду с лечением основного заболевания необходимо пересмотреть рацион. Пониженный гемоглобин при гепатите требует включения в ежедневное меню продуктов, содержащих железо: печени, говядины, гранатов, гречневой крупы, зелёных яблок, сухофруктов.
Если не удается поднять гемоглобин с помощью питания, нужно принимать препараты двухвалентного железа – Мальтофер, Сорбифер Дурулес, Актиферрин, Ферретаб, Фенюльс и Тардиферон. После терапевтического курса следует продолжать прием железосодержащих препаратов в поддерживающих дозировках, чтобы не допустить повторного развития анемии.
При высоком уровне гемоглобина требуется симптоматическое лечение, направленное на разжижение крови, улучшение микроциркуляции и устранение гипоксии. Для этой цели назначают антиагреганты и антиоксиданты – Курантил, Пентоксифиллин, Трентал, Актовегин.
Для снижения высокого гемоглобина нужно полностью отказаться от ряда продуктов:
- субпродукты, мясо говядины;
- свеклу, морковь;
- зелень;
- фрукты красного цвета;
- бобы, фасоль;
- орехи и сухофрукты;
- яичные желтки.
Гепатит С вызывает повышение холестерина, поэтому требуется ограничить потребление соли, острых специй, жирной и жареной пищи. Соблюдение диеты позволяет наладить работу печени, пораженной вирусом, и предотвратить колебания уровня гемоглобина.
Коррекция анемии у пациентов, находящихся на комбинированной противовирусной терапии по поводу хронического вирусного гепатита С
В связи с актуальностью проблемы вирусного гепатита С, являющегося широко распространенным заболеванием, сопровождающимся высокой частотой трансформации в хронический гепатит (ХГС), цирроз печени (ЦП) и гепатоцеллюлярную карциному, совершенствование противовирусной терапии является важной практической задачей [1–3, 5, 8].
Противовирусная терапия претерпела значительные эволюционные изменения. Впервые ИФН-альфа был рекомендован для лечения ХГС в 1991 году. Стандартная монотерапия интерфероном по 3 млн МЕ 3 раза в неделю демонстрировала низкую эффективность, вероятность достижения устойчивого вирусологического ответа (УВО) и составляла не более 10 %. Увеличение продолжительности лечения до 12–18 месяцев или использование высокодозовых схем терапии повышало вероятность достижения УВО еще у 5–9 % больных. С 1998 года началась эра комбинированной терапии с использованием ИФН-альфа и рибавирина, что значительно улучшило эффективность противовирусной терапии (ПВТ), результаты которой сопоставимы с результатами использования монотерапии пегилированными ИФН (ПегИФН) (с 2001 года) с частотой УВО около 40 %.
Использование комбинации ПегИФН с рибавирином привело к значительному увеличению частоты устойчивого вирусологического ответа у лиц с ХГС, и в настоящее время этот показатель в среднем составляет 60 %, а комбинированная терапия является золотым стандартом в лечении хронического ВГС. Современная комбинированная противовирусная терапия с использованием ПегИФН α-2а и рибавирина позволяет добиться полного выздоровления в среднем у 61–72 % больных (частота развития УВО варьирует от 48 % у больных с 1-м генотипом вируса до 88 % — со 2-м и 3-м генотипами).
Таким образом, одной из важных составляющих успеха в лечении хронического вирусного гепатита С являются в том числе оптимальные дозы рибавирина. Действительно, его значимость в эффективности ПВТ трудно переоценить, так как рибавирин не только влияет на частоту УВО, но и приводит к развитию анемии, являющейся одной из ведущих причин досрочного прекращения терапии.
Отмечается прямо пропорциональная корреляция между дозой рибавирина и частотой УВО [12]. Использование комбинации рибавирина с копегусом демонстрирует двукратное увеличение частоты УВО в сравнении с монотерапией ИФН и снижение частоты рецидивов в 2,5 раза.
Однако параллельно с ростом эффективности комбинированной терапии отмечается изменение структуры и частоты побочных явлений в связи с использованием рибавирина. Как известно, побочные эффекты, связанные с ПВТ, могут быть сгруппированы в пять основных групп: гриппоподобный синдром, нейропсихические и гастроинтестинальные проявления, воспалительные изменения в месте введения и гематологические отклонения [12, 16]. Побочные эффекты приводят к прекращению лечения у 15 % больных и требуют снижения дозы ИФН и/или рибавирина у 20–25 % пациентов. Анемия является одним из наиболее ограничивающих антивирусную терапию факторов, приводящих к преждевременному прекращению лечения в 1/3 случаев.
Принято считать, что анемия на фоне противовирусной комбинированной терапии у больных ХГС — состояние многофакторное. Хотя иногда эта болезнь может индуцироваться интерфероном, наиболее часто она вторична и основной причиной ее развития, безусловно, является прием рибавирина. У HCV/HIV ко-инфицированных пациентов дополнительным фактором развития анемии является параллельное использование антиретровирусной терапии, в частности зидовудина.
Рибавирин представляет собой синтетический нуклеозидный аналог, который трансформируется в его активную трифосфорилатную форму рибавирин трифосфат с помощью аденозинкиназы внутри эритроцитов. В эритроциты он проникает посредством нитробензилтиоинозинчувствительного нуклеозидного трансфера. Фосфорилированные формы рибавирина накапливаются в эритроцитах. Чтобы рибавирин был выведен из клетки, он должен быть дефосфорилирован. Но так как в эритроцитах отсутствуют дефосфорилирующие ферменты, рибавирин накапливается в эритроцитах. 87 % рибавирина внутри эритроцитов существует в форме фосфорилированного метаболита, а его период полувыведения из эритроцитов составляет более 40 дней в сравнении с 24 часами из плазмы [11, 16]. Такое накопление внутри эритроцитов приводит к истощению аденозинтрифосфата, оксидативному стрессу и оксидативному повреждению мембран эритроцитов с развитием внесосудистого гемолиза и анемии соответственно.
Возникающая в связи с развитием анемии необходимость в прекращении терапии объясняет значимость определения факторов, ассоциирующихся с рибавирин-индуцированной анемией [11, 16, 17]. Важно определить лиц с возможностью развития анемии на ранней стадии лечения, так как использование предикторов ее развития для каждого пациента позволило бы обеспечить безопасность и эффективность терапии. Попытки изучения этих факторов предпринимались в разных клинических испытаниях. В качестве таких предикторов рассматривались многие факторы, основные из которых перечислены ниже.
Предикторы развития рибавирин-индуцированной анемии:
— пол;
— возраст;
— масса тела;
— концентрация плазменного рибавирина;
— доза рибавирина, рассчитанная по массе тела;
— клиренс креатинина, скорректированный по площади поверхности тела;
— исходный уровень гемоглобина (Нb);
— снижение уровня Нb в течение 2 недель терапии более чем на 2 г/дл;
— исходно низкий уровень тромбоцитов (
Однако большинство из них не являются в должной степени информативными, их определение стоит дорого и не является стандартом в клинической практике.
Наиболее значимыми факторами риска развития анемии оказались пол, возраст и высокие дозы рибавирина. У женщин уровень гемоглобина менее 10 г/дл наблюдается в 4,4 раза чаще, чем у мужчин. В возрастной группе старше 60 лет анемия в среднем отмечалась в 30 % случаев, в то время как у лиц моложе 50 лет — только в 5 %. У пациентов, получающих рибавирин в дозе, превышающей 12 мг/кг, анемия регистрировалась в 3 раза чаще, чем при дозировке менее 12 мг/кг.
В ряде исследований продемонстрирована значимость предшествующей лечению концентрации гемоглобина в развитии рибавирин-индуцированной анемии. Если концентрация гемоглобина, предшествующая лечению, была более 16 г/дл, то анемия после назначения рибавирина не наблюдалась, тогда как при уровне гемоглобина менее 16 г/дл наблюдалась анемия различной степени выраженности.
Выраженная связь между массой тела и случаями анемии не была достоверной [11]. Однако такая связь была продемонстрирована в исследовании, проведенном в Японии, где рибавирин назначается в дозе 600 мг у лиц с массой тела менее 60 кг и 800 мг при массе тела более 60 кг. Однако даже при такой дозировке концентрация рибавирина может превышать 12 мг/кг у лиц с массой тела менее 50 кг и у лиц, чья масса тела находится между 60 и 66 кг. Средняя масса тела у женщин в Японии имеет тенденцию к снижению менее 50 кг в сравнении с мужчинами. Поэтому в данном исследовании отмечена значительная связь между массой тела и частотой развития рибавирин-индуцированной анемии, хотя основой такой взаимосвязи прежде всего является уровень рибавирина, превышающий 12 мг/кг.
Не наблюдалось связи между анемией и исходной вирусной нагрузкой или генотипом.
Существуют определенные группы пациентов с высоким риском развития анемии. К ним относятся HCV/HIV ко-инфицированные пациенты, получающие антиретровирусные препараты, в частности зидовудин, повышающий риск развития анемии вследствие повреждения костного мозга; пациенты после ортотопической трансплантации печени, а также лица с циррозом печени, у которых, как известно, имеются явления гиперспленизма с низким уровнем гемоглобина и тромбоцитов [4, 14]. При этом тромбоцитопения рассматривается как фактор риска развития тяжелой анемии.
Как правило, снижение концентрации гемоглобина начинается со 2-й недели терапии, достигая максимального снижения между 4-й и 8-й неделями с последующей стабилизацией уровня гемоглобина без продолжающегося его снижения. При снижении уровня гемоглобина на 4-й неделе лечения (в среднем на 2–3 г/дл) у большинства таких больных возникает умеренная анемия. У ряда пациентов такое снижение уровня гемоглобина наблюдалось уже на 2-й неделе лечения, и у этой категории пациентов отмечалась более тяжелая анемия. Рядом исследователей продемонстрирована достоверная связь между концентрацией гемоглобина на 2-й неделе терапии и степенью анемии в дальнейшем.
В литературных источниках приводятся различные данные о частоте развития рибавирин-индуцированной анемии — от 3,3–13 до 24 % и даже 67 % (Van Vlierbergh et al.). Во многом это является результатом разного подхода авторов к оценке понятия анемии и степени ее выраженности [13, 17]. В связи с вышеизложенным возникает вопрос о том, как оценивать степень анемии. Основываясь на результатах различных клинических испытаний, выделяют умеренную анемию со снижением уровня Нb менее 11 г/дл, которая отмечается в 30 % случаев; значительную анемию при концентрации Нb менее 10 г/дл (9–13 %). Если же уровень гемоглобина снижается менее 8,5 г/дл, то анемия трактуется как тяжелая. Но в любом случае, какой бы ни была анемия, она сопровождается слабостью, приводит к снижению качества жизни пациента, требует редукции дозы или отмены рибавирина, а значит — к значительному снижению частоты УВО.
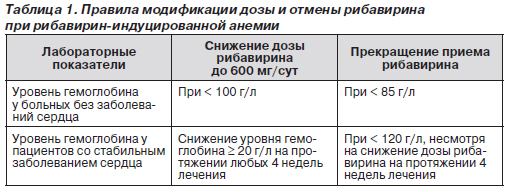
Общепринятые рекомендации по коррекции дозы рибавирина, представленные в табл. 1, включают снижение дозы рибавирина до 600 мг в случае понижения уровня Нb менее 10 г/дл или полную отмену препарата при уровне Нb менее 8,5 г/дл. Для лиц с заболеваниями сердечно-сосудистой системы эти требования еще жестче — редукция дозы рибавирина до 600 мг при снижении уровня Нb на ≥ 2 г/дл в течение любых 4 недель терапии и отмена при сохраняющемся снижении уровня Нb
К сожалению, не всегда удается предупредить прогрессирование анемии таким образом. На сегодня уже накоплен опыт применения рекомбинантного эритропоэтина у лиц с рибавирин-индуцированной анемией. Основным аргументом для раннего назначения эритропоэтина является тот факт, что раннее снижение дозы рибавирина может влиять на частоту достижения УВО. В настоящее время обсуждаются два альтернативных варианта ведения больных с рибавирин-индуцированной анемией с использованием эритропоэтина [7, 19]. Один из них предполагает первоначальную редукцию дозы рибавирина, а при отсутствии эффекта (снижении уровня Нb менее 8,5 г/дл) — назначение эритропоэтина. Другой вариант — назначение эритропоэтина у лиц с умеренной анемией (при уровне Нb менее 11,0 г/дл)
без предварительного снижения дозировки рибавирина. В таком случае раннее использование эритропоэтина позволяет избежать редукции дозы рибавирина у 80 % больных. Безусловно, последний вариант должен быть рекомендован пациентам с HCV/HIV ко-инфекцией и ЦП.
Рекомбинантные эпоэтины — это генно-инженерные препараты, которые по своему аминокислотному и углеводному составу идентичны эндогенному эритропоэтину. Механизм их действия состоит в воздействии на костный мозг и стимуляции образования эритроцитов из унипотентных клеток-предшественников. Известны эпоэтины альфа, бета и омега, основные представители которых приведены в табл. 2.

Препарат обладает хорошей переносимостью. Его побочные эффекты, как правило, связаны с предсуществующей патологией сердечно-сосудистой системы и проявляются усилением артериальной гипертензии, возникновением гипертензивных кризов с явлениями энцефалопатии, спутанности сознания, нарушения речи или тонико-клонических судорог.
Противопоказания к назначению эритропоэтина определяются тяжелыми сердечно-сосудистыми заболеваниями, такими как тяжелая артериальная гипертензия, нестабильная стенокардия, инфаркт или инсульт в анамнезе или повышенный риск развития тромбоэмболических осложнений, которые сами по себе ограничивают и возможность проведения комбинированной противовирусной терапии в том числе. В очень редких случаях могут образовываться нейтрализующие антитела к эпоэтину бета с развитием красноклеточной аплазии костного мозга [6].
Показания к назначению эритропоэтина постоянно расширяются и уже включают HIV-инфицированных пациентов, получающих зидовудин [4, 14, 15]. Препарат назначают при уровне эндогенного эритропоэтина ≤ 500 МЕ/мл. К сожалению, в наше время не существует схем лечения рибавирин-индуцированной анемии у больных ВГС, которые бы определялись консенсусом, однако в современной литературе схемы такой терапии обсуждаются. В качестве начальной дозы рекомендуют 100 МЕ/кг 3 раза в неделю подкожно. Лечение проводят в течение 4 недель, и при отсутствии эффекта, определяемого по уровню Нb и гематокрита (Ht), увеличивают разовую дозу на 50–100 МЕ/кг 3 раза в неделю. Увеличение дозы эритропоэтина проводят не чаще чем 1 раз в 4 недели. Максимальное увеличение дозы возможно до уровня 300 МЕ/кг 3 раза в неделю. При отсутствии эффекта на такой дозе лечение прекращают.
При развитии необходимого эффекта дальнейшее лечение проводят поддерживающей дозой, которая, как правило, составляет 30–50 % от исходной. Целью терапии является поддержание Нb на уровне менее 120 г/л и Ht в пределах 30–35 %. При повышении уровня Нb более 120 г/л, а Ht более 40 % введение эпоэтина прекращают до снижения концентрации Ht до 36 % с последующим возобновлением терапии в дозе, на 25 % меньшей, чем начальная. Препарат может быть введен п/к или в/в, при п/к введении доза должна быть на 20–30 % меньше.
Мониторинг лечения эритропоэтином включает контроль уровня гемоглобина, гематокрита, темпа прироста этих показателей и уровня АД. Первоначально контроль Hb и Ht осуществляется 1 раз в неделю до стабилизации их уровня, затем 1 раз в 10–14 дней. Темп повышения уровня Нb должен составлять 10 г/л за 2 недели или 20 г/л за месяц. Если прирост уровня Нb происходит быстрее, дозу эритропоэтина снижают на 25–50 %. При показателях Нb, превышающих 130 г/л, и/или Ht > 40 % эритропоэтин отменяют. Возобновление терапии эритропоэтином (в дозе на 25 % ниже начальной) возможно после снижения уровня Нb до 120 г/л.
С учетом высокой частоты развития индуцированной рибавирином анемии на фоне комбинированной противовирусной терапии ВГС в настоящее время разработаны и проходят клинические испытания различные препараты, альтернативные рибавирину. Это близкие к рибавирину по эффективности, но с улучшенным профилем безопасности левовирин и вирамидин, являющиеся предшественниками или пролекарствами рибавирина [10, 18]. Уже получены предварительные обнадеживающие результаты, однако окончательные данные будут опубликованы после завершения исследования.
1. Адекватно высокие дозы рибавирина увеличивают частоту УВО. Назначенная доза препарата должна поддерживаться на протяжении всего курса терапии.
2. Рибавирин-индуцированная анемия снижает качество жизни больных (QOL) и частоту УВО.
3. Пациенты с рибавирин-инду-циро-ванной анемией нуждаются в тщательном мониторировании. При необходимости доза рибавирина должна снижаться ступенчато (по 200 мг).
4. Использование эритропоэтина позволяет избежать отмены рибавирина и обеспечить высокую частоту УВО.
5. Разработка новых нуклеозидных аналогов, близких к рибавирину по эффективности, но с улучшенным профилем безопасности, позволит снизить частоту анемии в сочетании с сохраняющейся высокой частотой УВО.
1. Гураль А.Л., Мариевский Р.Ф., Сергеева Т.А. Повышение эффективности лабораторного контроля крови доноров на маркеры В, С, ВИЧ-инфекции // Лабораторная диагностика. — 1999. — № 3. — С. 26-31.
2. Ивашкин В.Т., Надинская М.Ю. Лечение хронического гепатита С в России // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2001. — Т. 11, № 4. — С. 51-53.
3. Марієвський В.Ф., Руденко А.О., Щербинська А.М. Інфекційні хвороби в Україні на рубежі двох століть // Сучасні інфекції. — 1999. — № 2. — С. 18-23.
4. Afdhal N., Dieterich D., Pockros P. et al. Epoetin alfa maintains ribavirin dose in HCV-infected patients: a prospective, double-blind, randomized controlled study // Gastroenterology. — 2004. — 126. — 1302-1311.
5. Alberti A. Hepatitis C. Epidemiolodgy Update // Pegintron Investigatior''s Update Meeting. — Barcelona , Spain , 2002.
6. Casadevall N., Nataf J., Viron B. et al. Pure red-cell aplasia and antierythropoietin antibodies in patients treated with recombinant erythropoietin // N. Engl. J. Med. — 2002. — 346(7). — 469-75.
7. Dev A., Patel K., Muir A., McHutchison J.G. Erythropoietin for ribavirin-induced anemia in hepatitis C: more answers but many more questions // Am. J. Gastroenterol. — 2003. — 98(11). — 2344-7.
8. Di Biscegli A.M. Natural Hystory of Hepatitis C: Its Impact on Clinical Management // Hepatology. — 2000 Apr. — 31(4). — 1014-18.
9. Gergely A.E., Lafarge P., Fouchard-Hubert I., Lunel-Fabiani F. Treatment of ribavirin/interferon-induced anemia with erythropoietin in patients with hepatitis C // Hepatology. — 2002. — 35(5). — 1281-2.
10. Lin C.C., Philips L., Xu C., Yeh L.T. Pharmacokinetics and safety of viramidine, a prodrug of ribavirin, in healthy volunteers // J. Clin. Pharmacol. — 2004. — 44(3). — 265-75.
11. Lindahl K., Schvarcz R., Bruchfeld A., Stahle L. Evidence that plasma concentration rather than dose per kilogram body weight predicts ribavirin-induced anemia // J. Viral. Hepat. — 2004. — 11. — 84-87.
12. Manns M.P. Analysis of the Impact of Individualized Dosing and Adherence with Peginterferon alfa plus ribavirin on Virologic Endpoints. Innovations in HCV Science, Clinical and Patient Management Initiatives. — Austria , Vienna , 8–10 September, 2002.
13. McHutchison J., Manns M., Lon-go D. Definition and management of anemia in patients infected with hepatitis C virus // Liver Int. — 2006. — 26. — 389-398.
14. Soriano V., Barreiro P., Martin-Carbonero L., Nunez M. HIV and hepatitis C virus coinfection // Hot. topics in viral. hepatitis. — 2005. — 7-26.
15. Torriani F.J., Rodriguez-Torres M., Rockstroh J.K. et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection in HIV-infected patients // N. Engl. J. Med. — 2004. — 351(5). — 438-50.
16. U.S. Food and Drug Administration. FDA Receives New Data on Risks of Anemia Drugs. Press release. January 3, 2008.
17. Van Vlierbergh H., Delan-ghe J.R., De Vos M., Leroux-Roel G. Factors influencing ribavirin-induced hemolysis // J. Hepatol. — 2001. — 34(6). — 911-16.
18. Watson J. Prospects for hepatitis C virus therapeutics: levovirin and viramidine as improved derivatives of ribavirin // Curr. Opin. Investig. Drugs. — 2002. — 3(5). — 680-3.
19. Yachimski P., Chung R. Erythropoietin for treatment-related anemia in persons with hepatitis C — questions remain // AIDS Read. — 2004. — 14. — 568-569.
20. Shiffman M., Price A., Hubbard S. et al. Treatment of chronic hepatitis C virus genotype 1 with peginterferon, ribavirin and epoetin alfa // Hepatology. — 2007. — 46. — 371-379.
Читайте также:


