Можно ли лечит гепатит с при ревматоидном артрите

Автореферат диссертации по медицине на тему Особенности поражения печени у больных ревматоидным артритом
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
БЕЛОРУССКИЙ ОРДЕНА ТРУДОЮГО КРАСНОГО ЗНАМЕНИ ГОСУДАРСТВЕННЫЙ ИНСТИТУТ УСОВЕРШЕНСТВОВАНИЯ ВРАЧЕЙ
ХШАТОВ Геннадий Иванович
ОСОБЕШЮСГИ ПОРАЖНИЯ ПЕЧЕНИ У БОЛЬНЫХ РЕВЫАТОНДЮИ АРТРИТОМ
14. 00. 05 - внутренние болезни
диссертации на соискание ученой степени кандидата медицинских наук
На правах рукописи
Работа выполнена в Витебском ордена Дружбы Народов медицинском институте.
Научный руководитель: Доктор медицинских наук, профессор Федоров Н. Е.
Научный консультант: Доктор медицинских наук, профессор Семенов В. К. Официальные оппоненты: Доктор медицинских наук, профессор Артивевская Н.И. Доктор медицинских наук, профессор Новиков Д. К.
Ведущее учреждение - Гродненский медицинский
К 074.24. 01 в Белорусском ордена Трудового Красного Знамени государственном институте усовершенствования врачей (220714, г. Минск, ул. П. Бровки, 3).
С диссертацией можно ознакомиться в библиотеке института, (г.Минск, ул. П. Бровки, 3).
Защита диссертации состоится " . 1993
года в /3 час. на заседании специализированного совета
Ученый секретарь специализированного совета, кандидат мед. наук, доцент
Актуальность проблемы. Ревматоидный артрит (РА) в настоя-щэе время является наиболее распространенным воспалительным >аболеванием суставов. Распространенность ревматоидного артрита составляет в среднем 0,42+0,07 на 1000 населения (Бенево-генская Л. И., Бриезовский ЕМ., 1988). В то же время рано наступающая инвалидность, затрудняющая самообслуживание больных гри относительно длительном течении данного заболевания, обус-ювливает его большое социальное значение.
Ревматоидный артрит относится к системным заболеваниям гаединительной ткани, при котором помимо суставов поражаются и шутренние органы: почки, сердце, печень и др. (Безбородько !. а и соавт., 1974; Нестерович К Т. и соавт., 1978; Грачева '. В. и соавт., 1982; Насонова Е А. и соавт. , 1989; ИисЛг1 А. I. ^ а1., 1981 и др.). Рядом исследователей (Еласенко А. И., 974; Дормидонтов Е. К и соавт. , 1982; Ковнацкий В. С., 1988 и [р.) изучены особенности поражения печени у больных ревматоид-[ым артритом, характеризующиеся нарушением её функционального остояния, в основе которого нередко лежат морфологические из-¡енения, укладывающиеся в рамки хронического персистирующэго епатита или амилоидоза.
В то же время остается мало изученной роль вирусов гепа-итов в поражении печени у данной группы больных и особенности ечения ревматоидного артрита при инфицировании вирусами гепа-итов В, С и дельта, а также характер развития и течение гепа-ита у таких больных.
Целью настоящего исследования явилось изучение особеннос-ей поражения печени у больных ревматоидным артритом, инфици-ованных вирусами гепатита В и дельта и роли иммунопатогенети-
ческих механизмов, способствующих персистенции этих вирусов с учетом влияния их как на течение основного заболевания, так и на состояние печени у таких больных.
Для достижения цели были поставлены следующие задачи:
1. На основании клинического обследования и оценки функциональных проб печени изучить частоту вовлечения этого органа в патологический процесс при РА.
2. Определить роль вирусов гепатита В, С, дельта и иммунных нарушений в развитии поражения печени у больных РА.
3. Определить особенности течения РА у больных с поражением печени, обусловленным вирусами гепатита В, С и дельта.
Положения выносимые на защиту.
1. Проведенные клинико-лабораторные исследования, указывают *на вовлечение в патологический процесс печени при РА.
2. При РА у 29,5% больных обнаруживаются маркеры вирусов гепатита В и дельта, что имеет существенное значение в вовлечении печени в патологический процесс.
3. Цри инфицировании больных РА вирусами гепатита В и дельта нередко создаются условия для их длительной персистенции, в некоторых случаях влияющей на течение основного заболевания.
Новизна и научная ценность работы.
Изучена частота обнаружения маркеров вирусов гепатита В, С и дельта у больных РА и первичным деформирующим остеоартро-зом (ЦЦОА). Проанализировано распределение маркеров данных вирусов в зависимости от серологического варианта, клинико-ана-томической формы заболевания, активности воспалительного процесса, степени прогрессирования, рентгенологической стадии, функциональной недостаточности опорно-двигательного аппарата,
Изучены особенности клеточного иммунного ответа на марке-эы вируса гепатита В у больных РА.
Впервые проведено определение антител к липопрогеину пе-юни человека у больных РА и ПДОА.
Изучены показатели функционального состояния печени у Зольных РА в зависимости от наличия в сыворотке крови маркеров шрусов гепатита В и дельта.
Проведено изучение некоторых параметров липидтранспортной ¡истемы у больных РА.
Практическая ценность работы.
Проведенные исследования показали довольно высокую часто-■у инфицирования больных РА вирусами гепатита В и дельта, не->едко влияющую на функциональное состояние печени. Анализ поденных результатов позволяет считать необходимым проведение 1бследования больных РА на наличие маркеров вирусов гепатита В [ дельта с целью коррекции лечения основного заболевания (ос-орояного назначения отрицательно влияющих на печень препара-ов и проведение гепатозащитной терапии).
Апробация работы. Материалы работы доложены и обсуждены а III съезде инфекционистов Белоруссии (1990); на XX научной ессии Центрального НИИ гастроэнтерологии (1993); на научных ессиях Витебского медицинского института (1988, 1990); на рачебных научно-практических конференциях.
Внедрение полученных результатов. Полученные данные ис-ольэуются в работе ревматологических отделений Витебской об-астной и 2-й городской больниц, а также в учебном процессе на афедрах терапии, инфекционных болезней Витебского медицинско-о института.
Объём и структура диссертации. Диссертация состоит из введения, обзора литературы (I глава), характеристики обследованных (II глава), описания методов обследования (III глава), собственных данных (IV и V главы), заключения, выводов, практических рекомендаций, указателя литературы.
Диссертация изложена на 146 страницах машинописи, содержит 23 таблицы и 3 рисунка. Список использованной литературы включает 181 источник, из которых 95 отечественных и 86 иностранных.
Материал и методы исследования. Обследовано 258 больных РА в возрасте от 16 до 75 лет, иг них 49 мужчин и 209 женщин. Контрольную группу составили 127 доноров и 31 больной первичным деформирующим полиостеоартрозом. Диагноз РА ставился на основании критериев Американской ревматологической Ассоциации (АРА) 1958 и 1987 гг. Развернутый диагноз формулировался согласно рабочей классификации РА , принятой на пленуме BHQP в г. Тбилиси в 1980 году.
Для обнаружения маркеров вирусов гепатита В, Си дельта применяли реакцию пассивной гемагглютинации (РИГА), иммунофер-ментный анализ (ИФА), радиоиммунный анализ (РИА) с помощью диагностических наборов Горьковского НИИЭМ, МНТК "Биоген" (Рига) , фирмы "ABBOTT" (США). Обнаружение антител к липопротеищ печени человека проводили, используя ИФА, разработанный в лаборатории 4.2 Витебского филиала НИИ радиационной медицинь (Жаворонок 6. В. , 1990; Доценко Ы. JL , 1992). Уровень иммуноглобулинов сыворотки крови определяли по Малчини, циркулирующга иммунных комплексов (ЦИК) с использованием белка А стафилакок-ка (Аааренок КС., 1987) и полиэтиленгликоля MB 6000 (Нови-
В сыворотке крови определяли триацидглицериды с помощью таборов фирмы "Лахема". Фракции липопротеинов разделяли методом преципитации гепарином в присутствии ионов марганца; определяли содержание холестерина по Абелю (Перова М. R, 1983). Зелково-липидный состав основных классов липопротеинов исследовали по Антонову М.П. и соавт. (1986), используя наборы фир-лы "Лахема" для определения общих липидов.*
Клеточный иммунный ответ на антигены вирусов гепатита В, сраснухи, кори, паротита и неспецифические митогены (фитоге-штлютинин, конканавалин А, митоген лаконоса) изучали в реак-(ии властной трансформации лимфоцитов (РБТЛ) при морфологичес-сом и радиометрическом учете реакции. Для оценки влияния ин-:ерлейкина-2 (ИЛ-2) на клеточный ответ на вирусные антигены и штогены, проводили постановку РБТЛ с добавлением в бластные сультуры клеток рекомбинантного ИЛ-2. **
Показатели клеточного и гуморального иммунного ответа шализировались с учетом наличия в сыворотке крови маркеров (ирусов гепатита В, Си дельта, а также возраста больных, се-юлогическаго варианта, клинико-анатомической формы, активнос-'и воспалительного процесса, скорости прогрессирсвания, рент-
* Выражаем искреннюю благодарность заведующему кафедрой био-:тяш ЗОДНМИ, д. б. н. .профессору А.А.Чйркину зз помочь, оказанную изучении некаторых параметров липидтранспортной системы.
**Быразкаем искреннюю благодарность директору Витебского финала НИИ радиационной медицины, д. м. н., профессору С. К Яаво-онку зз методическую помощь, оказанную в получении очищенных ре пар з тс в КЗз- и КВеАдг.
генологической стадии, функциональной недостаточности опорно-двигательного аппарата и длительности болезни.
Статистическую обработку проводили на ШВЫ IBM PC ХТ, используя пакет программ "STATGRAPHIKS".
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИИ у обследованных больных РА средний уровень альбуминов сыворотки крови составлял 53,0+0,54%, а у больных ПДОА -56,5+3,75%, причем у 23,9+3,277. больных РА этот показатель был ниже 50,0%. У больных РА, имеющих в сыворотке крови HBsAg он был (47,9+1,81%) достоверно ниже (р н их составе, I
группе больных РА, по сравнению с донорами в составе апо-В-ЛП увеличено содержание белков (6,4+0,49 г/л и 5,4+0,14 г/л соответственно) и уменьшено содержание липидов (7,1+0,30 г/л и 3,7+0,29 г/л соответственно). В результате белково-липидный юэффициент- апо-В-ЛП у больных повышен в 2 раза. Такие измене-лга можно связать с нарушением биосинтетической и экспортной, ю отношению к липопротеины очень низкой плотности (ЛПОНП), функции печени у больных РА, поскольку известно, что белковые сомпоненты апо-В-ЛП имеют преимущественно кишечное происхожде-[ие, а липидные - печеночное.
Аналогичные рассуждения можно привести и по отношению к шпопротеинам обратного транспорта холестерина - ЛПВП. Еелко-|ая часть этого класса липопротеинов не изменялась у больных 'А по сравнению с донорами (123,5+7,95 г'"л и 126,5+13,20 г/л оответственно), а доля липидного компонента увеличивалась 4,2+0,19 г/л и 3,5+0,17 г/л соответственно). В результате ве-ичина белково-липидного коэффициента ЛПЕП повысилась у части ольных. Это свидетельствует о том, что у больных РА имеется ризнаки компенсаторных изменений в Функционировании липидт-анспортной системы: в условиях относительной задержки холес-ерина в кровеносном русле липопротеины обратного транспорта ЯПБП) перегружаются липидами. Существенных изменений белко-липидного состава осноеных классов липопротеинов в зависи-эсти от клинико-лабораторной характеристики больных РА не об-арухено.
Следовательно, у больных РА по сравнению с донорами име-гся признаки умеренного нарушения белокеинтезирующей функции ?чени по отношению к экспортируемым белкам: уменьшение эффектной концентрации альбумина нэ 13,холестерина ЛПЕП на
обмена вообще, а выявлены изменения в липидтранспортной системе. Анализ распределения холестерина между основными классами липопротеинов показал, что у доноров ЛГОНП - 12%, ЛПВП - 28%, ЛПНП - 60%, а у больных РА ЛПОНП - 12%, ЛПВП - 25%, ЛПНП -63%. Этот анализ подтвердил ранее приведенные данные о том, что у больных РА страдает прежде всего прямой транспорт холестерина из печени в переферические ткани (увеличение доли холестерина в ЛПНП и изменение состава апо-В-ЛП).
Наибольшее значение в гепатологической клинике имеет определение активности в сыворотке крови АлАТ и АсАТ - индикаторных, универсально распространенных ферментов. Активность аминотрансфераз в сыворотке крови до настоящего времени остается одним из наиболее надежных показателей цитолитическогс ! процесса в печени. Её повышение характерно для диффузных поражений органа-с преимущественной заинтересованностью её паренхимы.
Средние показатели активности аминотрансфераз у всех обе-
ледованных больных РА составляли: АлАТ - 0,56+0,04 ммоль/ч-л, АсАТ - 0,45+0,03 ммоль/ч-л. У больных ГДОА уровень АлАТ составил 0, 42+0, ОЗммоль/ч- л, АсАТ - 0,39+0,02 ммоль/ч-л. Повышение АлАТ выявлено у 18,5+2,68%, повышение АсАТ - у 32,8+4,22% обследованных больных РА. -
В литературе есть данные о развитии ремиссии ревматоидно-лроцесса при возникновении у больных РА интеркуррентной тухи вирусного происхождения, в том числе и обусловленной усом гепатита В (Насонова Е А. , Астапенко М. Г., 1989; mâcher H. R., Sail E. P. , 1974). На это же указывает и ряд их клинических наблюдений за больными ревматоидным артритом ечении 5-6 лет.
Анализ частоты обнаружения маркеров вируса гепатита В у ьных РА при разной давности заболевания показывает, что говерно чаще HEsAg (р уса гепатита В, объясняет отсутствие выраженного цитолиза [атоцитов у этих лиц при относительно сохраненной функцио-шной активности лимфоцитов.
Отсутствие выраженной сенсибилизации лимфоцитов к HBsAg и *
Ag может быть обусловлено и недостаточностью продукции ерлейкина-2.
В группе больных РА (34 человека), у которых изучена осо-ность продукции Т-лимфоцитами ИЛ-2, маркеры вирусов гепати-В и дельта определялись у 14 человек ( HBsAg у 9 больных -5%; HBsAg+HEeAg у 5 больных - 14,7%; анти-HBcorAg класса у 7 больных - 20,6%; анти-HBsAg у 2-х больных - 5,9%; ан-дельта у 2-х больных - 5,9%).
Оценивая результаты РБТЛ до добавления ИЛ-2 установлено, положительный ответ на HBsAg определялся у 4-х больных, на Ag - у 2-х больных. После внесения в бластную культуру кле-
ИЛ-2 положительный ответ на HBsAg выявлен еще.у 2-х чело-
век, на HBeAg eEje у одного больного.
Кроме этого, после добавления ИЛ-2 у 11 больных был выя лен достоверный прирост (р левания. С другой стороны, установленная нами закономерно^ может указывать на то, что у серопозитивных больных РА с вьи ким уровнем РФ создаются условия для длительной персистен: вируса гепатита В. и продуктивной интеграционной фазы инфек онного процесса.
•Особенное патогенетическое значение, по-видимому, им выявляемые преимущественно при аутоиммунном ХАТ циркулирую гепатоспецифические аутоантитела (IgG) к липопротеину плаз; тической мембраны гепатоцита (Мэуег zum Buschenfelde et а 1980). Данный феномен бал выявлен у 38% больных ХАТ и у больных циррозом печени с отрицательным HBsAg, а также у е ничных больных ХПГ (Логинов A.C. , Блок D.E. 1987).
фи обследовании 90 больных РА и ЩОА антитела к липоп теину печени были выявлены только у одной больной (1,2+1,18%), имеющей в сыворотке крови HBsAg. Таким образ отсутствие антител к липопротеину печени человека у боль РА, инфицированных вирусами гепатита В и дельта, позвол предположить, что данный механизм развития хронического по жения печени у них отсутствует.
1. При ревматоидном артрите определяется умеренное нарушив белоксинтезирующэй функции печени, проявляющееся умень-зием содержания альбумина (у 23,9%), его эффективной кон-лрации (на 13,1%), холестерина ЛПШ (на 36,8%), а также ли-цов в апо-В-содержащих липопротеинах (на 17,9%), причем наи-иее выражении изменения у больных суставно-висцеральной фор-1 и быстро прогрессирующим течением заболевания.
2. Повышение АлАт выявлено у 18,5%, АсАт - у 32,8% боль-с РА, при этом уровень аминотрансфераз достоверно выше у
1, инфицированных вирусом гепатита В, а также у больных РА с ¡личенной печенью.
3. У 29,5% больных ревматоидным артритом обнаружены мар->ы вируса гепатита В, причем достоверно чаще у больных серо-1итивным вариантом основного заболевания и у страдающих арт-'ом более 12 лет.
4. У больных ревматоидным артритом, имеющих в сыворотке щи антитела' к вирусу гепатита дельта, как правило, отсутс-ют клинические признаки хронического агрессивного гепатита.
5. При инфицировании больных ревматоидным артритом виру-[ гепатита В поражение клеток печени в меньшей степени обус-лено клеточно-опосредованными реакциями иммунитета в связи сниженной сенсибилизацией лимфоцитов к антигенам данного уса и в ряде случаев с недостаточной продукцией интерлейки-
6. Длительное и частое обнаружение маркеров вируса гепа-а В у больных серопозитивным вариантом ревматоидного артри-укаэывает на недостаточность иммуно-патогенетических меха-мов, способствующих элиминации вируса у данной группы боль-
7. У больных ревматоидным артритом редко обнаруживают антитела к липопротеину печени человека (1,2%), что не позв ляет связать выявленные изменения функциональных проб печени данным механизмом её поражения.
1. С учетом частых парентеральных вмешательств и устано ленной сравнительно высокой частотой инфицирования больных вирусами гепатитов В, С и дельта, целесообразно проводить об ледование на маркеры этих вирусов всем больным данным забол ванием.
2. С учетом наличия маркеров вирусных гепатитов целесоо разно проводить коррекцию в терапии РА с целью избежания на начения гепатотоксичных препаратов и иммунодепресантов, кот рые могут способствовать персистенции вирусов гепатита.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫЙ ГО ТЕМЕ ДИССЕРТАЦИИ
1. Семёнов В. М., Азаренок К. С. , Наворонок С. В. , Сапе Л. Г. , Юпатов Г. II , Дмитраченко Т. И." Вирусный гепатит В и ре матоидный артрит // Здравоохр. Белоруссии. - 1986. - N 11. -28-30.
2. Шатов Г. И. , Семёнов В. М., Азаренок К. С. , Сапе Л. Г. , Дмитраченко Т. И. Влияние простагландина Е, цАМЕ и инте лейкина-2 на иммунный ответ при ревматоидном артрите и renal те В //III съезд инфекционистов Белоруссии. Тез. ' докл. Гродно, 1990. - С. 73-74.
3. Матвеев А. А. , Жаворонок С. Е , Матвеев В. А., Юла! Г. И., Доценко М. Л. Проблема хронических вирусных гепатито! Белоруссии.// III съезд инфекционистов Белоруссии. Тез. дою
Исследователи из Кокрейновского сотрудничества провели обзор эффектов метотрексата, применяемого в виде монотерапии или в комбинации с другими болезнь-модифицирующими антиревматическими препаратами (БМАРП) у людей с ревматоидным артритом. В результате поиска всех соответствующих исследований вплоть до 19 января 2016 года они обнаружили 158 исследований с участием более 37000 людей. Эти исследования были опубликованы в период между 1985 по 2016 годами, а продолжительность их составила от 12 недель до 2 лет. Объединенные результаты из этих исследований представлены ниже:
У людей с ревматоидным артритом, в сравнении с монотерапией метотрексатом:
- Комбинации метотрексат + сульфасалазин + гидроксихлорохин и метотрексат + большинство биологических БМАРП уменьшают активность заболевания. Другие комбинации для лечения (метотрексат + гидроксихлорохин, метотрексат + лефлуномид, метотрексат + инъекции препаратов золота) могут уменьшать активность заболевания у людей, не отвечающих на лечение только одним метотрексатом.
-Комбинации метотрексата и некоторых биологических БМАРП (адалимумаб, этанерцепт, цертолизумаб или инфликсимаб) уменьшают повреждение суставов (по данным рентгенограмм) в период немного более одного года у пациентов, ранее не принимавших метотрексат.
- Комбинации метотрексат + азатиоприн, метотрексат + циклоспорин и метотрексат + тоцилизумаб (8мг/кг), вероятно, увеличивают шансы прекращения приема лекарства из-за побочных эффектов.
Что такое ревматоидный артрит, метотрексат и другие болезнь-модифицирующие антиревматические препараты?
Если у вас ревматоидный артрит (РА), ваша иммунная система, которая обычно борется с инфекцией, атакует выстилку ваших суставов. Из-за этого ваши суставы становятся опухшими, тугоподвижными (скованными) и болезненными. В настоящее время РА считают неизлечимым заболеванием, поэтому лечение направлено на облегчение боли, уменьшение скованности и улучшение способности двигаться. К счастью, есть много лекарств, которые могут эффективно контролировать заболевание. Эти лекарства известны как болезнь-модифицирующие антиревматические препараты, или БМАРП. Метотрексат считают препаратом выбора среди БМАРП для большинства пациентов с РА, так как он хорошо работает у большинства пациентов и, как правило, хорошо переносится. Метотрексат может применяться самостоятельно (монотерапия) или в комбинации с другими БМАРП. Эти другие БМАРП включают в себя как препараты, доступные и используемые в течение многих лет (такие как сульфасалазин и гидроксихлорохин), так и более новые и дорогие (биологические БМАРП и тофацитиниб). Важно понимать, как все эти виды лечения соотносятся друг с другом в отношении пользы и побочных эффектов.
Что происходит у людей с ревматоидным артритом, которые принимают метотрексат в комбинации с другими болезнь-модифицирующими антиревматическими препаратами?
А) У пациентов, которые не принимали метотрексат ранее:
ACR 50 (число чувствительных или опухших суставов и другие исходы, такие как боль и нетрудоспособность)
- у 61 человека из 100, которые принимали метотрексат + сульфасалазин + гидроксихлорохин и у 56-67 человек из 100, которые принимали метотрексат + биологические БМАРП или тофацитиниб, было уменьшение выраженности симптомов ревматоидного артрита, по сравнению с 41 человеком из 100, которые принимали только метотрексат.
- У пациентов, которые принимали метотрексат в комбинации с адалимумабом, этанерцептом, цертолизумабом или инфликсимабом, было небольшое замедление прогрессирования повреждения суставов (по шкале Шарпа/ван дер Хейде) в течение одного года, по сравнению с пероральным метотрексатом, однако примерный объем повреждений даже при пероральном приеме метотрексата был очень небольшим (увеличение на 2.6 пункта).
Прекращение лечения из-за побочных эффектов
- 36 человек из 100, которые принимали метотрексат + азатиоприн, вынуждены были прекратить лечение из-за побочных эффектов, по сравнению с 8 людьми из 100, которые принимали только метотрексат.
Б) У пациентов, которые принимали метотрексат ранее:
ACR 50 (число чувствительных или опухших суставов и другие исходы, такие как боль и нетрудоспособность)
- у 61 человека из 100, которые принимали метотрексат + сульфасалазин + гидроксихлорохин и у 27-64 человек из 100, которые принимали метотрексат + биологические БМАРП или тофацитиниб, было уменьшение выраженности симптомов ревматоидного артрита, по сравнению с 13 людьми из 100, которые принимали только метотрексат.
- Ни одна из схем лечения не привела к значимому снижению объема повреждений суставов, оцениваемого по рентгенограммам, в течение одного года.
Прекращение лечения из-за побочных эффектов
- 21 человек из 100, которые принимали метотрексат + циклоспорин и 12 человек из 100, которые принимали метотрексат + тоцилизумаб (8 мг/кг), были вынуждены прекратить лечение из-за побочных эффектов, по сравнению с 7 людьми из 100, которые принимали только метотрексат.
Ревматоидный артрит (РА) – аутоиммунное заболевание неясной этиологии, характеризующееся симметричным эрозивным артритом (синовитом) и широким спектром внесуставных (системных) проявлений. РА – распространенное заболевание, им традает примерно 1 процент населения земного шара; характерная его черта – неуклонное прогрессирующее поражение суставов (постоянные боли, деформация, нарушение функции) и внутренних органов, приводящее к инвалидизации (около 1/3 больных за 20 лет болезни становятся полными инвалидами) и снижению продолжительности жизни. Последнему в немалой степени способствует высокий риск развития сопутствующих заболеваний (инфекции, атеросклеротическое поражение сосудов, артериальная гипертензия – АГЮ остеопороз и др.).
Развитие и прогрессирование РА определяется сложным, плохо изученным сочетанием генетически детерминированных и приобретенных дефектов (дисбалансом) нормальных (иммуно)регуляторных механизмов, ограничивающих патологическую активацию иммунной системы в ответ на потенциально патогенные, а нередко и физиологические стимулы (схема 1). Этот дисбаланс ведет быстрой трансформации физиологической (защитной) острой воспалительной реакции в хронический неконтролируемый прогрессирующий воспалительный процесс, потенциально затрагивающий все органы и системы человека, в первую очередь – суставы.
Неизученность этиологии РА делает невозможной эффективную этиотропную терапию и ставит его лечение в ряд наиболее сложных проблем медицины. Тем не менее в последние годы в этом направлении достигнуты определенные успехи. Благодаря расшифровке механизмов, лежащих в основе эффективности и токсичности нестероидных противовоспалительных препаратов (НПВП), симптоматическая терапия РА была усовершенствована, чему во многом способствовало создание нового класса этих препаратов – так называемых ингибиторов циклооксигеназы (ЦОК-2), а расширение знаний о механизмах ревматоидного воспаления позволило оптимизировать патогенетическую (базисную) терапию РА. Прогресс, достигнутый за последние годы, особенно хорошо виден при сравнении рекомендаций Американской коллегии ревматологов по фармакотерапии РА, опубликованных в 1996 и 2002 гг.
— глюкокортикоиды – ГК (внутрисуставно, перорально);
— базисные препараты: гидроксихлорохин, сульфасалазин, метотрексат, золи золота (внутримышечно, перорально), азатиоприн, D-пеницилламин.
— ГК (внутрисуставно, перорально);
— базисные препараты: гидроксихлорохин, сульфасалазин, метотрексат, соли золота (внутримышечно, перорально), азатиоприн, D-пеницилламин, циклоспорин А, лефлюномид, миноциклин;
— биологические агенты: моноклональные акнтитела – МАТ – к фактору некроза опухоли (ФНО)-ά (ремикейд); растворимый ФНО-75-Fc lgG (этанерцепт); растворимый антагонист ИЛ-1 (анакинра); иммуноадсорбция с использованием белка А стафилококка.
Однако особое значение имеет разработка концепции ранней, агрессивной терапии, в основе которой лежат данные о том, что наиболее высокая скорость деструкции суставов, в конечном счете, и определяющая неблагоприятный (непосредственный и отдаленный) прогноз болезни, наблюдается именно в дебюте РА. Полагают, что, поскольку применение базисных препаратов при раннем РА позволяет модифицировать течение болезни, активное лечение РА (как и других хронических заболеваний человека – сахарного диабета, АГ, ИБС и др.) должно начинаться как можно раньше. Ранняя диагностика и ранняя терапия любыми базисными противоревматическими препаратами имеют важное значение для улучшения качества жизни и отдаленного прогноза у пациентов с РА.
Современные подходы к диагностике РА подробно освещены в специальной литературе, их обсуждение выходит за рамки задач данной публикации. Следует лишь напомнить, что характерными признаками ревматоидного синовита являются утренняя скованность, длительность которой составляет не менее 1 ч. И симметричное поражение суставов кистей (и стоп); реже бывают поражены коленные, голеностопные, плечевые, локтевые, плюснефаланговые суставы, включая сустав большого пальца стопы, а также шейный отдел позвоночника и тазобедренные суставы. Поскольку РА и другие заболевания опорно-двигательного аппарата распространены весьма широко, очевидно, что заподозрить РА должны еще на поликлиническом этапе врачи-терапевты. Именно поэтому группа авторитетных европейских и американских ревматологов с позиций доказательной медицины разработала алгоритм ранней диагностики РА для поликлинических врачей: более трех воспаленных суставов, поражение пястнофаланговых/плюснефаланговых суставов, утренняя скованность более 30 мин – показания для немедленной консультации ревматолога. Применение алгоритма в широкой клинической практике должно способствовать улучшению прогноза РА, так как при правильной диагностике можно раньше назначить активную терапию базисными противоревматическими препаратами.
После постановки диагноза РА всем больным необходимо провести базовое клиническое, лабораторное и инструментальное обследование.
В клиническое обследование входят выявление субъективных симптомов (выраженность болей в суставах, длительность утренней скованности, длительность общего недомогания, ограничение подвижности в суставах) и физическое обследование:
— определение числа воспаленных и болезненных суставов; оценка механических нарушений (нарушение подвижности, крепитация, нестабильность и/или деформации);
— обнаружение внесуставных проявлений;
— оценка функционального статуса или качества жизни (по стандартным опросникам);
— общая оценка активности врачом;
— общая оценка активности пациентом.
При лабораторном обследовании:
— определяют СОЭ и концентрацию С-реактивного белка (С-РБ); ревматоидный фактор;
— проводят общий анализ крови;
— оценивают уровень электролитов;
— выполняют общий анализ мочи;
— проводят биохимическое исследование на печеночные ферменты, креатин, альбумин;
— исследуют синовиальную жидкость;
— проводят анализ кала на скрытую кровь.
Инструментальное обследование состоит в рентгенографии суставов кистей и стоп, при необходимости – других пораженных суставов.
При каждом визите пациента врач-ревматолог должен оценить активность патологического процесса, эффективность терапии и клинической ремиссии с использованием международных критериев.
Оценка активности РА:
Во время каждого визита определяют:
— выраженность болей в суставах (визуальная аналоговая шкала);
— длительность утренней скованности, в мин;
— наличие воспаленных суставов (болезненные и припухшие суставы);
— прогрессирование заболевания: нарастание ограничения подвижности, нестабильности и/или деформации суставов;
— прогрессирование по данным рентгенографии;
— динамику минеральной плотности костной ткани (МПКТ) по данным костной денситометрии.
Определяют и другие параметры, характеризующие ответ на лечение:
— активность, по мнению врача;
— активность, по мнению пациента;
— функциональный статус или качества жизни (по стандартизованным опросникам).
В задачи терапии РА входят:
— снижение выраженности симптомов, включая недомогание, боли, отек и скованность суставов;
— предотвращение деструкции, нарушения функции и деформации суставов;
— сохранение качества жизни;
— достижение клинической ремиссии;
— увеличение продолжительности жизни.
Нестероидные противовоспалительные препараты
Основной метод симптоматического лечения РА – назначение НПВП с целью уменьшения боли и воспаления в суставах. Однако эти препараты недостаточно хорошо контролируют не только прогрессирование, но и субъективные симптомы у пациентов с РА и вызывают побочные эффекты, особенно у лиц пожилого возраста. У пациентов с факторами риска осложнений со стороны желудочно-кишечного тракта – ЖКТ (пожилой возраст, язвенный анамнез, сочетанное применение глюкокортикоидов – ГК, антикоагулянтов) препаратами выбора являются так называемые ингибиторы ЦОГ-2 – мелоксикам (мовалис), целекоксиб (целебрекс) и нимесулид. Для профилактики и лечения НПВП-индуцированных поражений ЖКТ следует использовать ингибиторы протонной помпы и мизопростол, но не антагонисты Н2-гистаминовых рецепторов и антациды. Следует помнить, что, хотя ингибиторы ЦОГ-2 существенно реже вызывают поражение ЖКТ, чем стандартные НПВП, на фоне их приема также могут возникать нежелательные явления : симптомы диспепсии, замедление заживления язв желудка и двенадцатиперстной кишки, задержка жидкости, повышение АД. Применять как стандартные НПВП, так и ингибиторы ЦОГ-2 следует с особой осторожностью у пациентов со сниженным внутрисосудистым объемом или отеками, связанными с застойной сердечной недостаточностью, нефротическим синдромом, циррозом печени или при повышении концентрации креатина до уровня более 2,5 мг%.
Лечение низкими ( Поделиться: Tweet
4 комментариев(-ия)
скажите пожалуйста от чево РА
Спасибо затакой подробный ответ!
А где в Новосибирске можно сдать кровь на антиССР?
Отвечает главный специалист по клинической лабораторной диагностике
Главного управления здравоохранения мэрии г. Новосибирска,
кандидат медицинских наук Обухов Александр Васильевич:
Определение в крови антител к цитрулинсодержащему белку или цитруллиновые антитела – современный, эффективный, а главное ранний метод клинической лабораторной диагностики ревматоидного артрита.
Выявление антикератиновых антител (АКА) важно для ранней диагностики ревматоидного артрита. Их присутствие может предшествовать клиническим проявлениям заболевания – в ретроспективных исследованиях на замороженных пробах сыворотки показано, что в четверти случаев АКА можно выявить за 5 лет и менее до дебюта ревматоидного артрита, в 10% случаев – за 5 — 9 лет, в 8% случаев – за 10 и более лет. Этот вид антител может встречаться у пациентов с серонегативным ревматоидным артритом. По сравнению с ревматоидным фактором, для АКА характерна более высокая специфичность (88 — 99%), при более низкой чувствительности (40 — 60%).
Необходимо помнить, что НПВП, а тем более глюкокортикоиды (ГК), могут маскировать диагностически важные клинические признаки РА, поэтому от их назначения до установления точного диагноза лучше воздерживаться. Крайне нежелательно проведение внутрисуставных инъекций ГК, поскольку эта манипуляция на несколько недель, а иногда и месяцев затушевывает клиническую симптоматику и поэтому является одной из наиболее частых причин запоздалой постановки правильного диагноза.
Оценка лабораторных показателей воспаления – СОЭ, С-реактивный белок (СРБ), белковые фракции – имеет второстепенное значение в диагностическом процессе, и отсутствие их изменений не должно препятствовать постановке диагноза. В первые 2-3 месяца величины этих параметров не менее чем у 50% больных не выходят за пределы нормальных значений. Кроме того, изменения острофазовых показателей совершенно неспецифичны для РА.
Гораздо большее значение имеет обнаружение в крови РФ в диагностических титрах. Известно также, что больные, позитивные по РФ, имеют худший прогноз течения заболевания. Однако РФ-фенотип имеет два существенных ограничения. Во-первых, специфичность этого теста для РА является достаточно низкой: РФ обнаруживается примерно у 5% здоровых людей, у 5-25% лиц пожилого возраста, а также у значительного числа больных с хроническими заболеваниями. Так, классический IgM-РФ выявляется у 30-35% больных с системной красной волчанкой и системной склеродермией, 20% больных с дерматомиозитом, узелковым полиартериитом и болезнью Бехтерева, 10-15% больных с псориатическим артритом, болезнью Рейтера, сифилисом, туберкулезом, саркоидозом, хроническим активным гепатитом. При наличии суставного синдрома IgM-РФ-позитивными оказываются 25-50% больных с инфекционным эндокардитом, 45-70% — с первичным билиарным циррозом печени, 20-75% — с гепатитом В или С, 15-65% — с другими вирусными инфекциями, 5-25% — с опухолями. Во-вторых, наличие РФ не является стабильным. Частота выявления РФ существенно зависит от длительности заболевания: в первые 6 месяцев он выявляется лишь у 15-43% больных РА, в последующем часть РФ-негативных пациентов становятся РФ-позитивными. Под влиянием лечения возможна и обратная трансформация.
Указанных ограничений лишен недавно внедренный в клиническую практику новый тест иммуноферментного определения антител к цитруллинсодержащим белкам – производным филаггрина, в котором в качестве антигенной субстанции используется синтетический циклический цитруллинированный пептид (ЦЦП), что значительно повысило эффективность лабораторной диагностики РА на ранних стадиях.
Установлено, что анти-ЦЦП являются более специфичными для РА и, по меньшей мере, так же чувствительны, как традиционный РФ: чувствительность анти-ЦЦП при диагностике РА составляет 70-80%, специфичность – 98-99%. Чувствительность теста для больных с ранним РА колеблется между 40 и 70%. Согласно результатам одного из исследований специфичность анти-ЦЦП при диагностике РА на ранних стадиях составляет 86%, комбинации анти-ЦЦП + СОЭ – 95%, анти-ЦЦП + РФ – 91%, анти-ЦЦП + СРБ – 97%, анти-ЦЦП + полиартикулярная боль – 95%, анти-ЦЦП + утренняя скованность – 99%. При этом на момент обследования только 27% больных соответствовали диагностическим критериям ACR. Показано, что наличие этих антител предвещает развитие РА у здоровых на момент обследования людей и прогрессию недифференцированного артрита в РА.
В крупномасштабных клинических исследованиях установлено, что анти-ЦЦП-статус остается стабильным по меньшей мере в течение первых 3-5 лет РА. Наличие анти-ЦЦП на момент установления диагноза предвещает более агрессивное течение заболевания и более выраженное рентгенологическое прогрессирование, несмотря на проводимую терапию. Последующие колебания уровня этих АТ не отражают изменения активности заболевания. Ни НПВП, ни ГК, ни большинство базисных препаратов не влияют на уровень анти-ЦЦП. Следовательно, в клинической практике определение анти-ЦЦП имеет важное значение не только в ранней диагностике РА, но и в планировании терапевтической стратегии. Однако для контроля эффективности лечения данный тест не пригоден.
Таким образом, анти-ЦЦП и РФ являются наиболее важными лабораторными параметрами в диагностике РА на ранних стадиях. При решении вопроса о целесообразности одновременного или последовательного назначения больному этих тестов необходимо учитывать следующее. До 90% анти-ЦЦП(+) больных являются также позитивными по РФ, а одновременное присутствие обеих разновидностей антител не является более специфичным для РА, чем каждый из этих показателей в отдельности. Как уже упоминалось, РФ — достаточно чувствительный, но относительно неспецифичный маркер РА. Поэтому на ранних стадиях заболевания диагностическое значение имеют только высокие титры РФ. Например, если согласно методике РФ определяется как позитивный при значениях >20 Ед/мл, то высокими титрами считаются величины ≥50 Ед/мл. Кроме того, анти-ЦЦП и высокие титры РФ имеют примерно одинаковое прогностическое значение в плане агрессивного, с быстрым рентгенологическим прогрессированием течения заболевания.
Из вышеизложенного вытекает, что дополнительное определение анти-ЦЦП у больных с высокими титрами РФ с учетом экономических соображений нецелесообразно, поскольку не позволяет получить новую диагностическую и прогностическую информацию. В то же время при низких титрах РФ или у РФ-негативных пациентов такое исследование является исключительно полезным. Этот подход отражен в предлагаемом алгоритме диагностики РА на ранних стадиях (рис.).
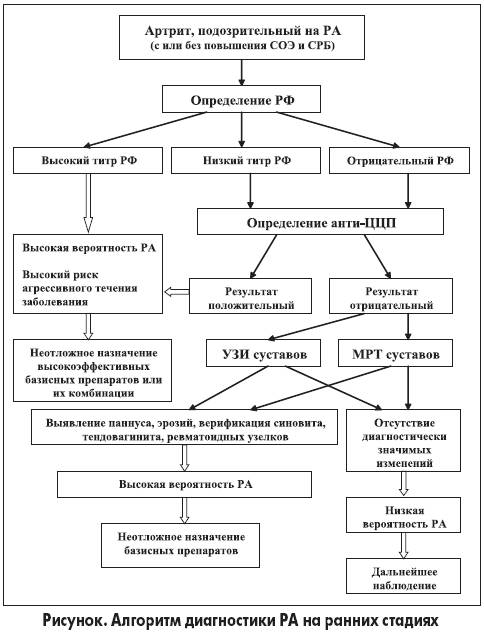
Расскажите пожалуйста о месте исследования в диагносике РА крови на Антитела к цитрулинсодержащему белку, или порекомендуйте источник, где можнооб этом почитать.
Читайте также:


