Можно ли лечить цитомегаловирус ацикловиром
ЦИКЛОФЕРОН В ТЕРАПИИ ЦИТОМЕГАЛОВИРУСНОЙ ИНФЕКЦИИ ОБЕЗЬЯН
Инфекция, вызываемая цитомегаловирусом (ЦМВ), широко распространена среди людей и обезьян и ассоциирована с большим спектром патологических состояний. Разновидность патологии, вызываемой ЦМВ, закономерности его распространения, филогенез, сходство циркуляции у человека и макаков резус позволяют считать ЦМВ-инфекцию обезьян адекватной моделью для человека, на которой можно разрабатывать вопросы профилактики и лечении этой инфекции у людей. В работе приведены результаты изучения эффективности действия иммуномодулирующего и антивирусного препарата циклоферон при цитомегаловирусной инфекции макаков резус. Показано, что циклоферон вызывал повышение у обезьян продукции ИФН-а и способствовал продлению сроков ремиссии у животных, носителей ЦМВ. В настоящее время проблема цитомегаловирусной (ЦМВ) инфекции имеет большое значение в медицине в связи с широким распространением этого заболевания в человеческой популяции и его актуальностью в акушерстве, неонатологии, педиатрии, клинической вирусологии, трансфузиологии, трансплантологии. Усугубляется эпидемиологическая значимость распространения ЦМВ из-за бессимптомного носительства, которое наблюдается у 80 % населения . Аналогичная ситуация наблюдается и среди обезьян, особенно макаков резус (RhCMV). В некоторых колониях носительство этого вируса отмечено у 100 % приматов. Медленная репликация представителей этого семейства, относительно низкая вирулентность и цито-патогенность служат причиной перехода вируса в латентное состояние, вызывая хронические инфекции с постоянными рецидивами, частота которых с годами возрастает . Согласно исследованиям, проведенным в Адлерском питомнике и литературным данным большинство взрослых обезьян и значительное количество обезьян до 1 года инфицировано этим вирусом. Наибольшую опасность ЦМВ-инфекция представляет для обезьян с иммунодефицитами, беременных самок и новорожденных . У обезьян наблюдается пожизненное носительство инфекции. Вывести вирус из организма невозможно. Показано, что такие препараты как ацикловир, ганцикловир, фоскарнет влияют на размножение вируса, однако не способны полностью его элиминировать. Исследования ЦМВ-инфекции обезьян (эпидемиологии, особенностей молекуляр-но-биологической структуры и филогенеза) позволяют рассматривать ее как адекватную модель для изучения этого заболевания людей с целью разработки специфической терапии и профилактики. Кроме того, на обезьянах Адлерского питомника отечественные ученые изучали препарат кипферон и показали его эффективность . Герпесвирусные инфекции, вызванные вирусами простого герпеса, цитомегаловирусом, вирусом Эп-штейна-Барр и др. характеризуются стимуляцией образования интерферонов (ИФН) -альфа, -бета, -гамма, а также продукцией ряда про- и противовоспалительных цитоки-нов (фактора некроза опухолей - ФНО-альфа, интерлейкинов - ИЛ-1бета, ИЛ-2, ИЛ-6, ИЛ-10, ИЛ-12, ИЛ-13, гранулоцито-макрофагального колониестимулирую-щего фактора) и хемокинов, действие которых направлено на стимуляцию клеточного и гуморального иммунитета, а также на формирование специфического противовирусного иммунитета. ЦМВ обладает множественными механизмами иммуносупрессии и ускользания от иммунного ответа хозяина, свойственными другим вирусам.Понимание механизмов иммуносупрессии, составляющих патогенетическую основу развития латентной ЦМВ инфекции, представляет особый интерес для определения средств лечения страдающих этим заболеванием. Отечественные индукторы ИФН (циклоферон, амиксин, кагоцел, ридостин и др.) стали успешно применять в последние 8-10 лет.Установлено, что антивирусное действие этих препаратов опосредовано в основном индукцией в ИФН-альфа,бета,гамма и других цитоки-нов, обладающих широким спектром эффекгорных и иммунорегулирующих функций, усиливающих иммунный ответ организма на внутреннюю инфекцию. Для исследования на ЦМВ-инфицированных обезьян нами был выбран препарат циклоферон. Терапия гер-песвирусных инфекций представляет значительные трудности. В связи с появлением в последнее время новых штаммов, резистентных к ацикловиру, стал актуален поиск новых средств терапии
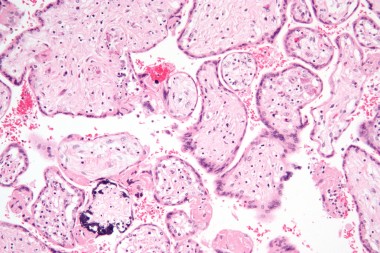
В статье проанализированы опубликованные данные по вопросам адекватной диагностики антенатальной и постнатальной цитомегаловирусной инфекции (ЦМВИ), а также лечению острых ЦМВИ у беременной, плода и новорожденного. Представлены отечественные клинические р
The article gives analysis of the data on the issues of relevance of diagnostics of antenatal and postnatal cytomegaloviral infection (CMVI), as well as treatment of acute CMVI in the pregnant, fetus and newborns. National clinical guidelines on diagnostics and treatment of congenital CMVI developed by the Russian Association of antenatal medicine in 2016, were presented; as well as the first unofficial international guidelines on the issues of diagnostics and treatment of congenital CMVI.
Цитомегаловирус (ЦМВ) — чрезвычайно распространенный вирус, поражающий людей всех возрастов и формирующий пожизненную персистенцию в организме инфицированного человека. Считается, что в большинстве случаев персистенция начинается в ранние годы жизни и протекает латентно, не оказывая выраженного патологического влияния на состояние здоровья инфицированного. С другой стороны, доказано, что персистенция вируса может сопровождаться хроническим воспалением, формировать разнообразные многочисленные иммунные дисфункции и определять развитие вторичных иммунных, аутоиммунных и дегенеративных нарушений. Различного рода иммунокомпрометации могут приводить к рецидивам размножения вируса и многообразным клиническим проявлениям с поражением любых органов и систем в любом возрасте.
Особое значение имеют врожденные инфекции детей, которые отличаются высоким риском развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией (ЦМВИ), что определяет потребность в своевременном пренатальном выявлении беременных и плодов с высоким риском развития врожденной ЦМВИ и ранней диагностике и лечении инфекций у новорожденных.
Теоретические дискуссии по вопросам адекватной диагностики антенатальной и постнатальной ЦМВИ, а также лечению острых ЦМВИ у беременной, плода и новорожденного продолжаются с 1990-х гг., но отсутствие единых руководящих принципов затрудняет практическую работу врачей. Российской ассоциацией специалистов перинатальной медицины в 2016 г. выработаны отечественные клинические рекомендации по диагностике и лечению врожденной ЦМВИ. Созданная в рамках 5-й Международной конференции по ЦМВИ (Брисбен, Австралия, 19 апреля 2015) международная группа экспертов на основе консенсусных дискуссий и обзора литературы выработала первые неофициальные международные рекомендации по вопросам диагностики и лечения врожденной ЦМВИ, которые опубликованы в Lancet Infect Dis в марте 2017. Все эти рекомендации будут нуждаться в постоянном обновлении по мере поступления дополнительных данных.
ЦМВ — двухцепочечный ДНК-вирус, член семейства герпес-вирусов (β-герпесвирус человека). Синтез вирусного генома ДНК происходит в ядре клетки-хозяина. Исследования последних лет подтверждают гипотезу о том, что штаммы ЦМВ могут варьировать в их вирулентности, тропизме и патогенном потенциале, который, в свою очередь, вероятно, связан с генетической изменчивостью ключевых для патогенеза генов. Внешняя оболочка вируса содержит множественные гликопротеины, кодируемые вирусом. Гликопротеин B и гликопротеин H, по-видимому, являются основными факторами для формирования гуморального иммунитета — антитела к ним способны нейтрализовать вирус. Эти гликопротеины используют сегодня при разработке анти-ЦМВ-вакцин [3].
Вирус распространяется различными способами: через продукты крови (переливание, трансплантация органов), грудное вскармливание, пролиферацию в местах контактов (кожа, любые слизистые оболочки), перинатально и половым путем. ЦМВИ может протекать в виде первичной инфекции ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни [4].
При острой ЦМВ-инфекции могут поражаться практически все типы клеток человеческого организма — эндотелиальные клетки, эпителиальные клетки, клетки гладкой мускулатуры, фибробласты, нейронные клетки, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и пр. Все типы клеток поражаются и в мозге: нейроны, астроциты, клетки эпендимы, выстилающие желудочки, макроглия, эндотелий капилляров, оболочек, микроглия, сплетения сосудистой оболочки, дендриты и аксоны — т. е. вирус в мозге не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения нервной системы у больных [5].
Считается, что ЦМВ реплицируется в эндотелиальных клетках с низкой скоростью, вызывая преимущественно подострые инфекции, однако истинная скорость репликации вируса в клетках определяется эффективностью цитотоксического Т-клеточного иммунитета и степенью иммуносупрессии хозяина. Так, например, на моделях ЦМВИ у животных продемонстрировано, что отсутствие CD4 Т-клеток сопровождалось более тяжелым и стремительным заболеванием ЦМВИ. Известно также, что ВИЧ-инфицированные новорожденные имеют очень высокую частоту врожденной ЦМВИ с высоким риском смерти, неврологических дефектов и прогрессии ВИЧ-инфекции [6–7].
Особое свойство ЦМВИ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [7].
Доказано, что и первичные и латентные ЦМВИ сами могут индуцировать хронические воспалительные системные реакции с устойчивой иммунной активацией, запускать и поддерживать аутоиммунные процессы, усиливать аллореактивность Т-клеток после трансплантации и, возможно, участвовать в комплексе причин повышения частоты нейродегенеративных состояний с возрастом человека (Jones R. P. The debility cascade in neurological degenerative disease). Установлено также, что ЦМВ-индуцированные иммунные изменения в пожилом возрасте могут отвечать, например, за замедленную элиминацию вируса гриппа из легких, сниженный поствакцинальный иммунитет на гриппозные вакцины, измененную реакцию организма на терапию интерферонами [8].
Многие годы риск развития врожденных инфекций плода ассоциировали преимущественно с первичной инфекцией матери, однако к настоящему моменту не вызывает сомнения, что большая доля врожденных ЦМВИ (до 75%) встречается в условиях рецидивирующей во время беременности материнской инфекции. Допускаются также и экзогенные реинфекции с новыми штаммами ЦМВ — доказательства основываются на молекулярных данных, подтверждающих получение нового штамма вируса.
Вместе с тем степень риска вертикального инфицирования плода в условиях первичной инфекции матери рассматривают по-прежнему как чрезвычайно высокую — в 30–50% случаев острой первичной инфекции беременной развивается врожденная инфекция ребенка. Показано, что ранее существовавший материнский иммунитет хоть и не гарантирует полной защиты, тем не менее обеспечивает снижение риска врожденной ЦМВИ при следующих беременностях на 69% [9].
Недавними исследованиями установлено, что ЦМВ может поражать амниотическую мембрану, ухудшая цитотрофобласт-индуцированный лимфангиогенез и ремоделирование сосудов в плаценте и задерживая правильное развитие клеток — предшественников трофобласта, одновременно вызывает врожденную провоспалительную иммунную реакцию. Это приводит к гипоксии плода, задержке внутриутробного развития и возможным последующим гипоксическим повреждениям головного мозга. Степень поражения плода определяется сроками антенатального инфицирования и вирусной нагрузкой в размножающихся клетках — чем меньше гестационный возраст, тем более выражена альтерация (разрушение) тканей с формированием пороков развития [10]. Особенно быстро ЦМВ достигает максимума в астроцитарных и глиальных клетках, при этом максимальная экспрессия вируса найдена в глиальных клетках развивающегося мозга мышат (что объясняет микрогирию, микроцефалию и другие пороки ЦМВ-инфицированного мозга детей). По мере увеличения срока гестации в клинической картине инфекционного заболевания плода преобладают симптомы системного воспаления с выраженной пролиферацией и экссудацией. У 1/3 умерших от ЦМВИ новорожденных (из них 60% — недоношенные) при морфологическом исследовании выявляют различные пороки развития. У 43% — признаки генерализованной внутриутробной инфекции с геморрагическими и ишемическими инфарктами (в том числе в головном и спинном мозге) [11].
Способность вируса реплицироваться в любых клетках человеческого организма определяет многообразие клинических форм болезни; ЦМВ может вызывать как генерализованные инфекции, так и поражения отдельных органов: печени, головного мозга, сердца, легких, мочеполовых органов, желудочно-кишечного тракта и др.
У беременных острая первичная ЦМВИ протекает чаще бессимптомно (25–50%) или малосимптомно — с неспецифическими проявлениями (обычно лихорадка, астения и головная боль).
Как первичная, так и рецидивирующая ЦМВИ матери может стать причиной антенатальных ультразвуковых признаков поражения плода в результате трансплацентарной инфекции. Самые частые УЗИ-признаки: задержка роста плода, вентрикуломегалия, микроцефалия, перивентрикулярная гиперэхогенность, кальцификаты в мозге, плевральный выпот или асцит, гепатоспленомегалия, гиперэхогенный кишечник и мекониальный илеус и др. Эти УЗИ-аномалии эмбриона прогнозируют тяжелую генерализованную манифестную врожденную ЦМВИ новорожденного с высоким риском формирования инвалидизирующих исходов болезни и смерти. Поэтому первичная острая ЦМВИ во время беременности может являться показанием к ее искусственному прерыванию. Установлено, что около 4% детей с антенатальной ЦМВИ умрут в утробе матери или вскоре после рождения, среди остальных около 60% будут иметь когнитивные дефекты, нейросенсорную потерю слуха и другие неврологические и прочие проблемы [11–12].
Сегодня установлено также, что нейросенсорная тугоухость является прогрессирующим заболеванием и может формироваться в течение 5–6 лет жизни даже у детей, родившихся с бессимптомной ЦМВИ (это связывают с многолетней репликацией ЦМВ в перилимфе), что требует соответствующей длительности наблюдения ребенка.
При инфицировании в поздние сроки гестации ЦМВИ у новорожденного может проявляться и как генерализованная инфекция, и как поражение отдельных органов с нетяжелыми транзиторными симптомами болезни, например, умеренной гепатомегалией, изолированным снижением количества тромбоцитов или повышенным уровнем аланинаминотрансферазы. Возможна и клинически бессимптомная ЦМВИ с изолированной нейросенсорной тугоухостью.
У 10% всех новорожденных в течение первого месяца жизни возникают инфекционные заболевания в результате в основном семейных контактов, в том числе грудного вскармливания. Экскреция ЦМВ с грудным молоком в течение первых недель после родов бывает низкой, достигает максимума к 4–8 неделям, завершается к 9–12 неделям. Считается, что риск трансмиссии вируса коррелирует с вирусной нагрузкой в молоке, передача максимальна при высокой экскреции. У доношенных детей в результате инфицирования ЦМВ через молоко матери формируется, как правило, субклиническое течение инфекции без остаточных явлений; в клинической картине более вероятно развитие энтероколита и транзиторного холестатического гепатита с минимальным цитолизом. Недоношенные дети (вес
И. Я. Извекова 1 , доктор медицинских наук, профессор
М. А. Михайленко
Е. И. Краснова, доктор медицинских наук, профессор
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения/ И. Я. Извекова, М. А. Михайленко, Е. И. Краснова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 90-95
Теги: новорожденные, беременность, инфекция, персистирование
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Герпесвирусы широко распространены в человеческой популяции. После первичного инфицирования вирусы герпесгруппы переходят в латентное состояние и пожизненно персистируют в организме. При неблагоприятных условиях и снижении местного или системного иммунитета может происходить реактивация инфекции, что обусловливает развитие воспаления чаще всего на местном уровне. Разнообразие клинических форм герпесвирусных инфекций постоянно поддерживает научный интерес как в области изучения их патофизиологии, так и в области поиска эффективной противовирусной терапии. Особенно актуально это для β- и γ-герпесвирусов, т. к. группа α-герпесвирусов изучена достаточно хорошо.
Цель исследования: определить эффективность валацикловира в отношении репликации вируса Эпштейна – Барр (ВЭБ), вируса герпеса человека 6 типа (ВГЧ-6), цитомегаловируса (ЦМВ) в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями верхних дыхательных путей (ВДП).
Материал и методы: нами амбулаторно обследованы 80 пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП. Всем пациентам проводились микробиологическое исследование мазков из ротоглотки и оценка вирусной нагрузки в смешанной слюне и цельной крови вне периода обострения. Пациенты получали терапию валацикловиром по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале проводился после окончания лечения.
Результаты и обсуждение: микробный пейзаж ротоглотки часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой. В смешанной слюне обнаруживалась ДНК ВЭБ, ВГЧ-6, но не ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлялась. Применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у часто болеющих взрослых.
Выводы: целесообразно провести дальнейшие исследования по определению режима дозирования и оценке клинической эффективности ациклических нуклеозидов в лечении ВЭБ-инфекции.
Ключевые слова: герпесвирусы, вирус Эпштейна – Барр, вирус герпеса человека, цитомегаловирус, часто болеющие взрослые, вирусная нагрузка, валацикловир.
Для цитирования: Щубелко Р.В., Зуйкова И.Н., Шульженко А.Е. Герпесвирусные инфекции человека: клинические особенности и возможности терапии. РМЖ. 2018;8(I):39-45.
Human herpesviruses infections: clinical features and opportunities of therapy
R.V. Shubelko 1 , I.N. Zuykova 2 , A.E. Shulzhenko 2
1 JSC "K+31", Moscow
2 “National Research Center — Institute of Immunology” Federal Medical-Biological Agency of Russia, Moscow
Herpesviruses are widely spread among the human population. After the primary infection, the herpesviruses become latent and persistent in the human body for life. Adverse conditions and a low local or systemic immunity may reactivate the infection, which causes the inflammation, usually at the local level. The variety of clinical forms of herpesviruses infections constantly supports scientific interest both in the field of studying their pathophysiology and in the search for effective antiviral therapy. This is especially important for β- and γ-herpesviruses, since the α-herpesvirus group has been studied rather well.
Aim: to determine the efficacy of valacyclovir for replication of the Epstein-Barr virus (EBV), human herpesvirus type 6 (HHV-6), cytomegalovirus (CMV) in the oropharynx in frequently ill adults with chronic inflammatory diseases of the upper respiratory tract.
Patients and Methods: 80 patients with frequent recurrences of chronic inflammatory diseases of the upper respiratory tract were examined outpatiently. All patients underwent microbiological examination of swabs from the oropharynx and the viral load in mixed saliva and whole blood not in exacerbation period was assessed. Patients received valacyclovir therapy according to the scheme 500 mg x 3 times a day for 14 days. Control of viral load in the biomaterial was carried out after the end of treatment.
Results and Discussion: out of the period of exacerbation the oropharynx microflora in frequently ill adults is represented mainly by a normal or conditionally pathogenic microflora. EBV DNA, HHV-6, but not CMV DNA, were detected in the mixed saliva. The DNA of the herpesvirus was not detected in the blood samples of these patients. The use of valacyclovir in a dose
of 500 mg 3 times a day significantly reduces the replication of EBV in the oropharynx in frequently ill adults.
Conclusions: it is advisable to conduct further studies to determine the dosage regimen and evaluate the clinical efficacy of acyclic nucleosides in the treatment of EBV infection.
Key words: herpes viruses, Epstein-Barr virus, human herpes virus, cytomegalovirus, frequently ill adults, viral load, valacyclovir.
For citation: Shubelko R.V., Zuykova I.N., Shulzhenko A.E. Human herpesviruses infections: clinical features and opportunities of therapy // RMJ. 2018. № 8(I). P. 39–45.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Только для зарегистрированных пользователей
Несколько представителей семейства герпесвирусов заразили до 95% населения Земли. Почему одни больные находятся из-за них на грани жизни и смерти, а другие не замечают, что инфицированы, какие методы лечения одобрены ВОЗ, как вирусы могут дремать годами и даже вызывать рак, рассказывает Indicator.Ru.
Чем больше геномов читают и сопоставляют биологи, тем сложнее и ветвистее становятся родословные древа живых организмов. Даже у вирусов, которые и живыми язык мало у кого из биологов повернется назвать, есть целый Международный комитет по таксономии вирусов (International Committee on Taxonomy of Viruses, ICTV).
Вирус сложный, герпес простой
Thomas Splettstoesser/Wikimedia Commons
Вообще у вирусов бывает два типа размножения. Они могут либо встраиваться в хозяйский геном и мирно дремать, позволяя размножающейся клетке-хозяину многократно копировать себя и передавать по наследству вместе с родными генами, либо сразу разрывать оболочку клетки, убивая ее, и отправляться на поиск новых жертв. Первый вариант называют лизогеническим циклом, второй — литическим.
Литический и лизогенический циклы
Семейство Herpesviridae подразделяется на три подсемейства, которые для простоты назвали альфа–, бета– и гаммагерпесвирусами. Мы выбрали четыре из них — по сочетанию распространенности и коварства. Зараженные этими вирусами часто не знают о своей болезни и о способах борьбы с ней. Поэтому, даже если у них самих симптомы не проявляются, носители могут быть опасны для окружающих, не должны становиться донорами и рискуют заразить людей с подавленным иммунитетом.
Всемогущество с точки зрения вируса
Вирус простого герпеса второго типа (Herpes simplex virus type 2, HSV-2) отстает от собрата, но все же и здесь масштабы впечатляют: им заражено 11% мировой популяции. Эти вирусы избрали своим объектом людей, которых, конечно, немало, но и не бесконечно много. А теперь представьте, как многочисленны могут быть вирусы, заразившие насекомых. А бактериофаги? Но мы отвлеклись.
Устройство белкового капсида вируса простого герпеса первого типа
Простой человеческий герпес второго типа чаще всего передается половым путем, но может распространяться и через контакты участков кожи. Он гораздо чаще вызывает язвочки на половых органах. Инфекция может сопровождаться набуханием лимфоузлов, лихорадкой и болями в теле, но часто вирус долгое время существует в организме бессимптомно.
Схема репликации (размножения) простого герпесвируса человека. Видно, что этот вирус не только заставляет клетку тиражировать себя, но и, уходя, прихватывает с собой кусок ее оболочки
Двое из ларца
Хотя по своим проявлениям герпесвирусы человека первого и второго типа различны, общего у них гораздо больше. Оба они сперва поражают клетки слизистых оболочек и лишь затем распространяются по организму. Оба хранят все знания о себе в менее чем сотне генов. Оба только и ждут, пока наш иммунитет утомится от борьбы с другими болезнями, а потом проявляются во всей красе. И оба могут, спрятавшись в телах нейронов от иммунитета, дремать годами, оставляя своего носителя заразным (правда, HSV-1 предпочитает гассеров узел тройничного нерва, а HSV-2 — крестцовые ганглии, но бывают и другие варианты), а потом резко переходить к литическому циклу и проникать по аксонам в клетки эпителия, чтобы продолжить свою работу.
Больше всего неприятностей HSV доставят новорожденным и людям с ослабленной иммунной системой: живущим с ВИЧ или тем, чей иммунитет временно подавлен, например, для трансплантации какого-либо органа. У них вирусы простого герпеса чаще переходят в литический цикл, уже не боясь иммунной обороны, что вызывает множество воспалительных осложнений. Если это произошло в нервных клетках, может начаться менингит (воспаление мозговых оболочек) или энцефалит (воспаление головного мозга).
Коварство обоих типов HSV в том, что заболевание протекает скрытно. Люди могут долгое время даже не догадываться, что они больны, и распространять инфекцию. Причем, что печально, лечения от обоих типов вируса простого герпеса в данный момент не существует. Вы можете прислушаться к рекомендациям Всемирной организации здравоохранения (ВОЗ) и использовать ацикловир, фамцикловир или валацикловир, которые останавливают цикл репликации (воспроизводства) вируса и не дают ему бесконтрольно плодиться. Их, согласно руководству той же ВОЗ, нужно принимать внутрь курсами по десять дней.
Авторы кохрейновского обзора 2016 года про первое проявление генитального герпеса и противовирусные препараты приходят к выводу, что прием ацикловира и валацикловира ослабляет симптомы заболевания. Этот вывод, однако, основывается на небольшом числе данных. А вот польза местных препаратов (различных мазей и антисептической обработки) пока не доказана.
В обзоре научных статей, выпущенном клиникой Мэйо в Рочестере, говорится, что в особенно тяжелых случаях и при частых рецидивах, возможно, понадобится вводить ацикловир внутривенно. Правда, тут нужно соблюдать осторожность во избежание нарушения работы почек.
Вирус Эпштейна — Барр: от поцелуя к спящему вулкану
Первой мишенью этого вируса обычно становятся эпителиальные клетки, чаще всего на тех же слизистых оболочках. Там вирус Эпштейна — Барр активно размножается по литическому циклу. Хотя в слизистых оболочках, на границе с жестоким внешним миром, не дремлет и иммунитет. B-лимфоциты только и ждут, чтобы отправить антитела на борьбу с врагом, но человеческий герпесвирус 4-го типа не боится встреч с ними. Он берет их на абордаж, присоединяясь к специфическим белкам на их поверхности. Связывается он и с белками MHC-II, которые в норме показывают другим иммунным клеткам, Т-лимфоцитам, кусочки внутриклеточных белков для проверки, нет ли в В-лимфоците чего-то чужеродного.
Схема репликационного цикла вируса Эпштейна — Барр у здоровых людей
Graham Beards/Wikimedia Commons
Белки играют в прятки
В ответ на такие наглые посягательства на уже порабощенную территорию вирус Эпштейна — Барр переходит в литический цикл. При этом он задействует много вирусных белков. Часть из них отвечают за конспирацию, мешая зараженным клеткам показывать куски вирусных белков Т-лимфоцитам, постоянно ищущим признаки поломок и инфекции. И вот, словно пробудившийся вулкан, B-лимфоциты извергают вирусные частицы, которые поражают лейкоциты и вызывают инфекционный мононуклеоз.
Симптомы инфекционного мононуклеоза
Чтобы улучшить состояние пациента, ему нужно больше отдыхать (хотя лежать в постели вовсе необязательно), снизить физическую активность, при болях и лихорадке принимать обезболивающие: ибупрофен, парацетамол или напроксен. Аспирина же советуют избегать, поскольку он повышает у зараженных герпесвирусом 4-го типа риск заполучить синдром Рейе — острую печеночную недостаточность вместе с поражением головного мозга. Антибиотики (как и против любых вирусов) будут бесполезны, если нет осложнения в виде бактериальной инфекции. Такие рекомендации по лечению дает сайт JAMA (Журнал Американской медицинской ассоциации, The Journal of the American Medical Association).
А как насчет противовирусных препаратов? Их в руководства по лечению инфекционного мононуклеоза не включают. Согласно уже упомянутому выше обзору клиники Мэйо в Рочестере, ни одно противовирусное лекарство не было одобрено для лечения инфекционного мононуклеоза, а к ацикловиру вирус Эпштейна — Барр чувствителен намного меньше, чем большинство герпесвирусов человека (кроме герпесвирусов 6-го, 7-го и 8-го типов, на которые он не влияет вовсе).
Эффективность ацикловира (а также валомацикловира и валацикловира), по данным кохрейновского обзора 2016 года, не доказана. То же самое о стероидных обезболивающих и жаропонижающих препаратах сообщают авторы еще одного обзора.
После первой вспышки, которая длится обычно пару недель или месяц, вирус остается в теле больного на всю жизнь, но перестает быть таким заразным для окружающих. Чувство слабости, тошноты и постоянной усталости может продлиться до трех месяцев. Однако потом, подавленный иммунитетом, вирус вынужден прятаться и дремать под его надзором, и во второй раз он уже может не активироваться никогда.
Как и в случае поражения герпесвирусами 1-го и 2-го типов, у больных изредка возможны серьезные осложнения. Их риск возрастает у людей с сильно ослабленным иммунитетом или зараженных ВИЧ. В таких случаях вирус может вызывать злокачественные перерождения клеток крови и эпителия. Оно и понятно: вирус Эпштейна — Барр любит воспроизводиться за счет хозяйской клетки, а не по литическому циклу, поэтому ему выгодно подарить клетке-носителю и ее потомкам бессмертие.
Но бессмертие отдельной клетки в сочетании с пренебрежением интересами организма на выходе чаще всего дает рак. Так происходит и с клеткой, зараженной вирусом Эпштейна — Барр, который даже открыт был при изучении лимфомы Беркитта. Назофарингеальная карцинома — еще одно онкологическое заболевание носоглотки, к которому приводят запущенные случаи, когда зараженный пациент долго не обращает внимание на боли и незаживающие язвы в носоглотке, а также затрудненное дыхание, вызванные усиленным распространением вируса.
Герпес номер пять с совиным глазом
Герпесвирус человека 5-го типа, который часто называют цитомегаловирусом, может вызвать заболевание, симптомы которого очень напоминают мононуклеоз. Но лимфоузлы и селезенка у таких пациентов обычно не увеличиваются, а следов вирусов гепатита или Эпштейна — Барр найти не удается.
Как и вирус Эпштейна — Барр, цитомегаловирус передается через жидкости тела, больше всего его в слюне и моче. Поэтому заражение очень часто происходит в детском саду, особенно когда дети не очень тщательно соблюдают правила личной гигиены.
Противовирусные препараты могут подавлять синтез новых частиц цитомегаловируса на разных стадиях. В списке важнейших лекарств по версии Всемирной организации здравоохранения можно увидеть валганцикловир, который, как и ганцикловир, обычно назначается в первую очередь. Ганцикловир рекомендуют вводить внутривенно в более тяжелых случаях, валганцикловир применяется в таблетках и лучше подойдет для борьбы с заболеванием средней и легкой тяжести. Также обзор противовирусных препаратов клиники Мэйо называет эффективными препараты фоскарнет и цидофовир, но они очень токсичны для почек, поэтому назначаются только в том случае, если препараты первого выбора не помогли.
Однако наука продвинулась в борьбе с цитомегаловирусом дальше, чем с его родственником под номером 4. Сейчас появились профилактические вакцины, которые даже получили одобрение Всемирной организацией здравоохранения. Поэтому людям с серьезным иммунодефицитом можно защитить себя при помощи пассивного иммунитета — готовых антител. Кстати, иногда можно услышать советы поддержать ослабленный каким-нибудь герпесвирусом иммунитет с помощью этих самых антител, иммуноглобулинов, интерферонов. Давайте вкратце обсудим, что это такое и может ли оно помочь от болезней, упомянутых в этой статье.
Интерфероны, иммуноглобулины, антитела
Тем более что тот же цитомегаловирус может грозить вам аутоиммунным заболеванием и без дополнительной стимуляции. Публикация в одном из самых цитируемых медицинских журналов, The Lancet, указывает на то, что цитомегаловирус связан с диабетом 1-го типа. Есть и сообщения о том, что герпесвирусы могут способствовать развитию синдрома Гийена — Барре, при котором из-за аутоиммунных воспалительных процессов у пациентов наступает мышечная слабость. И это еще не полный список.
К тому же, согласно обзору в журнале Annual Review of Microbiology, многие герпесвирусы человека благополучно подавляют работу наших интерферонов против самих себя, поэтому вы вряд ли сможете как-то на них повлиять.
Наши рекомендации нельзя приравнивать к назначению врача. Перед тем как начать принимать тот или иной препарат, обязательно посоветуйтесь со специалистом.
Читайте также:
- Постановление главного государственного санитарного врача рф о вирусном гепатите
- Какой вирус в китае был 2003
- Не поздно ли делать прививку от бешенства через 10 дней после укуса
- Клиническая диагностика острых вирусных гепатитов
- Ветрянка у взрослых период распространения вируса
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

