Микст инфекция вирусно бактериальная инфекция
- КЛЮЧЕВЫЕ СЛОВА: Кагоцел, ОРВИ у детей, ротавирусная инфекция
Подходы к терапии ОРВИ с поражением желудочно-кишечного тракта в условиях детской поликлиники
Как отметила доцент кафедры инфекционных болезней у детей Санкт-Петербургского государственного педиатрического университета, к.м.н. Татьяна Маратовна ЧЕРНОВА, в структуре инфекционной патологии у детей острые респираторные инфекции составляют более 90%. Ведущее место в структуре вирусных поражений желудочно-кишечного тракта (ЖКТ) занимает ротавирусная инфекция. Ее удельный вес среди всех острых кишечных инфекций (ОКИ) с установленной этиологией составляет 30–35%, а в период эпидемического подъема может превышать 50%. С гг. отмечается возрастание роли норовирусной инфекции, для которой характерны вспышки в организованных детских коллективах. В последние годы среди детей увеличилась доля заболеваний, сопровождающихся сочетанным вирусным поражением респираторного тракта и ЖКТ.
В этиологической структуре энтеритов/гастроэнтеритов у детей до 70% занимают вирусные поражения ЖКТ и только 30% – бактериальные 1 . При бактериальных инфекциях могут развиться тяжелые осложнения, такие как сепсис, инфекционно-токсический шок, гемолитико-уремический синдром. Вирусные процессы на фоне обычной симптоматической терапии могут быть купированы в течение двух – четырех дней. Тем не менее дети до трех лет требуют особого внимания врачей, поскольку не исключено развитие основного осложнения – эксикоза.
Как показывает анализ структуры первичных диагнозов у амбулаторных детей с энтеритом/гастроэнтеритом, у пациентов в возрасте до трех лет лидирующее положение занимает диагноз ОКИ, старше трех лет – диагноз острой респираторной вирусной инфекции (ОРВИ) с дисфункцией ЖКТ или энтеральными явлениями. Диагноз ОКИ в основном ставят детям, которым требуется госпитализация. Традиционно к вирусным поражениям ЖКТ педиатры относятся как к безобидному заболеванию. Однако, несмотря на видимую легкость течения, после перенесенной инфекции нарушается микробиоценоз кишечника, имеют место дисбаланс иммунной системы, формирование затяжных форм инфекции, длительное выделение вирусов с фекалиями (до месяца и более) 2 .
Татьяна Маратовна напомнила, какие основные функции для организма человека выполняет микрофлора кишечника, выделив из множества ее функций основную – иммуномодулирующую (формирование иммунологической резистентности). Более 25% слизистой оболочки кишечника представлено активной иммунологической тканью, которая содержит более 70% всех иммунокомпетентных клеток организма. Чем богаче флора, тем шире иммунный ответ. И наоборот: чем беднее флора, тем более скудный ответ. В европейских и российских стандартах терапии вирусных поражений ЖКТ у детей указано на применение только симптоматической терапии. В реальной клинической практике уже при первичном осмотре больного с любой диареей педиатры назначают антибактериальные или антисептические препараты, хотя при вирусных поражениях они не показаны.
Врожденным фактором противовирусной защиты является система интерферонов (ИФН), продукция которых начинается сразу после проникновения вируса в клетку. При полноценном иммунном ответе происходит быстрая и эффективная элиминация возбудителей из организма. Однако в остром периоде вирусной диареи у 80% детей отмечается недостаточность иммунного ответа со стороны альфа- и гамма-ИФН. Именно поэтому главная задача лечения – сместить пик активности ИФН-продукции в сторону более ранних сроков и уменьшить тем самым площадь распространения вирусного процесса.
Ректальные формы рекомбинантных ИФН обладают высокой биодоступностью и хорошей клинической эффективностью при лечении вирусной диареи. Экзогенные ИФН представляют собой чужеродный белок, поэтому при их применении возможны аллергические реакции. К тому же ректальный способ введения при вирусной диарее не всегда предпочтителен.
После приема внутрь одной дозы Кагоцела терапевтическая эффективность наступает уже через 8–12 часов, максимально нарастает на вторые сутки и сохраняется еще в течение 72 часов. Таким образом, общая продолжительность действия после однократного приема – пять суток, что позволяет применять препарат коротким курсом.
В то же время максимум продукции ИФН в кишечнике отмечается уже через четыре часа после приема дозы Кагоцела, что делает его привлекательным для лечения вирусных поражений ЖКТ.
Татьяна Маратовна представила результаты собственного клинического наблюдения по оценке эффективности препарата Кагоцел® при вирусных поражениях ЖКТ у детей в амбулаторно-поликлинических условиях 3 . В наблюдении участвовали 60 детей в возрасте от трех до 16 лет с клиническими признаками сочетанного вирусного поражения респираторного и желудочно-кишечного трактов.
При первичном осмотре у всех пациентов наблюдались синдром лихорадки, интоксикация, диарейный синдром. У 93% детей имел место фарингит, у 56% – ринит, абдоминальные боли отмечались у половины больных, у 68% наблюдалась рвота, у 63% – метеоризм. При лабораторном обследовании в этиологической структуре вирусных поражений ЖКТ превалировали норовирусы и ротавирусы. При этом у детей в возрасте от трех до шести лет чаще выявлялась ротавирусная инфекция (66,7%), а у детей от семи до 16 лет – норовирусная инфекция (45,3%) (рис. 1).
Пациенты были разделены на две группы – основную и контрольную. Пациенты основной группы (n = 30) дополнительно к симптоматической терапии получали Кагоцел® по схеме лечения ОРВИ соответственно возрасту ребенка в течение четырех дней. Эффективность препарата Кагоцел® оценивали по результатам динамики основных клинических симптомов заболевания и лабораторных показателей в исследуемых группах.
В группе Кагоцела длительность лихорадки и интоксикации оказалась достоверно меньше – на 1,1 и 1,2 суток соответственно – по сравнению с контрольной группой (р 4 .
Пациенты были распределены на две равные группы по 30 детей. В первой группе, получавшей Кагоцел® на фоне симптоматической терапии, у 19 больных диагностирован стеноз гортани 1-й степени, у семи – стеноз гортани 2-й степени, у четырех – ларинготрахеобронхит, у шестерых – рецидивирующий круп. Антибактериальная терапия проводилась 11 пациентам в связи с отитом и бронхитом вирусно-бактериальной этиологии.
Во второй группе, получавшей плацебо на фоне симптоматической терапии, клинические проявления стеноза гортани 1-й степени отмечались у 22 больных, 2-й степени – у шестерых, ларинготрахеобронхит – у шестерых, рецидивирующий круп – у четырех, ларингит без признаков стеноза – у двоих. Антибактериальная терапия проводилась девяти пациентам в связи с отитом и бронхитом вирусно-бактериальной этиологии.
Характерной особенностью клинических проявлений у больных метапневмовирусной инфекцией наряду с общими интоксикационными проявлениями были выраженные хрипы в легких (64%), респираторная одышка (45%) и признаки бронхообструкции. У больных с бокавирусной инфекцией в основном отмечалось поражение верхнего отдела респираторного тракта, хрипы в легких прослушивались у 10% детей. У одного пациента с бокавирусной инфекцией имел место гастроэнтерит, который сопровождался жидким стулом и рвотой.
В первой группе больные получали Кагоцел® в течение четырех дней по одной таблетке два раза в день в течение первых двух дней, а затем по одной таблетке один раз в день в течение последующих двух дней. Во второй группе пациенты принимали плацебо по аналогичной схеме.
У больных, получавших Кагоцел® на фоне симптоматической терапии при неосложненном течении заболевания, по всем показателям клинических проявлений (лихорадка, интоксикация, катаральные явления, сухой кашель, ларингит, стеноз гортани) отмечалось достоверное уменьшение продолжительности симптомов по сравнению с детьми, принимавшими плацебо (табл. 2).
Количество койко-дней, проведенных детьми в стационаре, на фоне терапии препаратом Кагоцел® достоверно сокращалось в сравнении с таковым при приеме плацебо и составило в среднем 4,7 ± 0,3 против 6,3 ± 0,3 дня (р
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Ежегодно в России регистрируется 27,3–41,2 млн случаев острых респираторных заболеваний (ОРЗ), при этом доля вируса гриппа как возбудителя ОРЗ составляла в первом XXI в. около 6,2–12,6%. Расходы на лечение гриппа и его осложнений в мире ежегодно составляют около 14,6 млрд долларов. В России экономические потери от гриппа в год оцениваются в 10 млрд руб. [1]. ОРЗ являются причиной смерти в 19% случаев у детей младше 5 лет, особенно в странах Африки, Латинской Америки. 20% медицинских консультаций у детей связаны с ОРЗ, в 30% случаев ОРЗ является причиной нетрудоспособности [10].
При респираторного тракта чаще высеваются Streptococcus (S.) pneumoniae, Staphylococcus (Staph.) aureus, Haemophilus (H.) influenzae, Moraxella (М.) catarrhalis или Neisseria catarrhalis [3, 4].
Природным резервуаром S. pneumoniae является носоглотка человека, возбудитель передается путем. Каждый ребенок инфицирован одним или несколькими штаммами S. pneumoniae и может быть переносчиком инфекции, особенно в первые годы жизни, в промышленно развитых странах — и в возрасте 6 мес. Чаще всего инфицирование не приводит к развитию клинических проявлений, а проходит бессимптомно. Клинические проявления начинаются при распространении инфекции из носоглотки в другие органы. Большинство инфекционных заболеваний возникает не после длительного носительства, а после инфицирования новыми серотипами, чувствительность организма зависит от состояния иммунной системы и вирулентности штамма возбудителя. Высокий уровень пневмококковых инфекций наблюдается у детей и пожилых людей, относящихся к группе риска по развитию иммунодефицита. Пневмококковая инфекция, по данным ВОЗ, приводит к смертельным исходам у 1,6 млн человек в год, при этом около 50% случаев составляют дети в возрасте от 0 до 5 лет. У 76% взрослых (0,5 млн случаев в год) и у 90% детей (70 тыс. случаев) пневмония вызывается пневмококковой инфекцией [2]. Особой тяжестью отличается пневмококковый менингит, частота которого составляет 8 на 100 тыс. детей до 5 лет. 30–40% острых средних отитов у детей вызывается пневмококком [2].
Большинство штаммов H. influenzae являются микроорганизмами. У новорожденных и маленьких детей H. influenzae типа В () вызывает бактериемию, пневмонию и острый бактериальный менингит. В ряде случаев развиваются воспаление подкожной клетчатки, остеомиелит, инфекционный артрит.
M. catarrhalis (или Neisseria catarrhalis) — грамотрицательная бактерия, вызывает инфекционные заболевания респираторного тракта, среднего уха, глаз, центральной нервной системы и суставов. M. catarrhalis относится к микроорганизмам, представляет угрозу для человека и персистирует в респираторном тракте. M. catarrhalis в 15–20% случаев вызывает острый средний отит у детей.
- до года — 4 и более эпизодов ОРЗ в год;
- до лет — 6 и более эпизодов ОРЗ в год;
- 4–5 лет — 5 и более эпизодов ОРЗ в год;
- старше 5 лет — 4 и более эпизодов ОРЗ в год.
Нами среди ЧБД выделена группа ЧБД с хроническими заболеваниями () [3].
- с заболеваниями рото- и носоглотки;
- с заболеваниями верхних дыхательных путей;
- с заболеваниями нижних дыхательных путей.
По данным , у ЧБД на слизистых происходит вытеснение сапрофитной флоры микроорганизмами, включая S. pneumoniae, Staph. аureus, H. influenzae. В контрольной группе в основном из носо- и ротоглотки высевались S. viridens — у 26%, S. mutans — у 23,3%, S. salivaricus — у 20% детей. У ЧБД эти возбудители высевались в 15,3; 16,6; 9,7% случаев. Доминирующими микроорганизмами являются Staph. aureus — 52,7%; S. pyogenes — 23,6%; Candida albicans — до 50% ЧБД. Повышается плотность заселения слизистых микроорганизмами: S. pneumoniaе — lg=3,5±0,97 КОЕ; H. influenzaе — lg=2,4±0,48 КОЕ; Staph. aureus — lg=3,5±0,87 КОЕ. Лишь 36,5% штаммов M. catarrhalis чувствительны к ампициллину. H. influenzaе была резистентна к ампициллину в 36,5% случаев. Разница представленных показателей была статистически достоверна. Смена сапрофитной флоры на , высевание Candida albicans, резистентность флоры к антибактериальной терапии затрудняют лечение и реабилитацию ЧБД [4, 5].
Микрофлора, высеваемая из зева ЧБД, представлена в таблице 1.
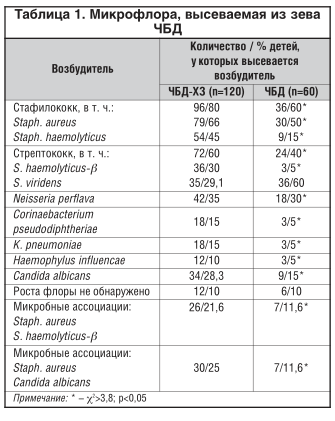
Обследовано и отобрано 60 ЧБД, согласно классификации , (1986) на основании частоты ОРЗ [13], и 120 с частотой ОРЗ 6 и более раз в год и хроническими заболеваниями носо- и ротоглотки. Было проведено сравнение персистенции флоры у ЧБД и . В мазках из зева монокультура выделена у 40% , 2 и более возбудителя — у 46,6%, Candida albicans — у 28,3%, сочетанная бактериальная и грибковая флора — у 25%. Количество возбудителей колебалось от 105хКОЕ до 108хКОЕ/мл. С уменьшением числа эпизодов ОРЗ уменьшаются частота и спектр высеваемых микроорганизмов. Сравнение частоты высеваемости Staph. haemolyticus и Staph. aureus, S. haemolyticus-β, Neisseria perflava в группах статистически достоверно (χ2>3,8; p 3,8; p Литература
- Зайцев А.А., Синопальников А.И. Грипп: диагностика и лечение // РМЖ. 2008. Т. 16. № 22. С. 1494–1502.
- Таточенко В.К., Озерецковский Н.А., Федоров А.М. Иммунопрофилактика – 2014. М.: ПедиатрЪ, 2014. 199 с.
- Маркова Т.П. Применение изопринозина для профилактики повторных респираторных инфекций у часто болеющих детей // Фарматека. 2009. № 6. С. 46–50.
- Хлынина Ю.О. Часто болеющие дети: микроэкологическое обоснование подходов к лечению и реабилитации: Автореф. дисс. … канд. мед. наук. Волгоград, 2012. 25 с.
- Хлынина Ю.О. Резидентное стафилококковое бактерионосительство в популяции человека, живущего в крупных промышленных городах // Вестник новых медицинских технологий. 2009. № 1. С. 43–45.
- Альбицкий В.Ю., Баранов А.А. Часто болеющие дети. Клинико-социальные аспекты, пути оздоровления. Саратов: Медицина, 1986.
- Mellioli J. Deciders in pulmonology (Принятие решений в пульмонологии) // Giorn. It. Mal. tor. 2002. Vol. 56 (4). Р. 245–268.
- Маркова Т. П., Чувиров Д. Г., Гаращенко Т.И. Механизм действия и эффективность бронхо-мунала в группе длительно и часто болеющих детей // Иммунология. 1999. № 6. С. 49–52.
- Maul J. Stimulation of immunoprotective mechanisms by OM-85 BV // Respiration. 1994. Vol. 61 (Suppl. 1). Р. 15.
- Del-Rio Navarro B.E., Espinosa-Rosales F.J., Flenady V., Sienra-Monge J.J.L. Immunostimulants for preventing respiratory tract infection in children (Review) // The Cochrane Collaboration. The Cochrane Library. 2011. Issue 6.
- Evans S.E., Tuvin M.J., Dickey B.F. Induciblе innate resistance of lung epithelium to infection // Ann. Rev. Physiol. 2010. Vol. 72. P. 413–435.
- Levy O. Innate immunity of the newborn: basic mechanisms and clinical correlates // Nat. Rev. Immunol. 2007. Vol. 7. P. 379–390.
- Заплатников А.Л., Гирина А.А., Бурцева Е.И. и соавт. Иммунопрофилактика гриппа и других острых респираторных вирусных инфекций в достижении контроля над течением бронхиальной астмы у детей // Педиатрия. 2013. Т. 92. № 1. С. 51–56.
- Olivieri D., Fiocchi A., Pregliasco F. et al. Safety and tolerability of ribosome-component immune modulator in adults and children // Allergy Asthma Proc. 2009. Vol. 30. Р. 33–36. doi: 10.2500/aap.2009.30.3247.
- Mora R., Dellepiane M., Crippa B. et al. Ribosomal therapy in the treatment acute adenoiditis // Eur.Arch.Otorhinolaryngol. 2010. Vol. 267. P. 1313–1318.
- Akikusa J.D., Kemps A.S. Clinical correlates of response to pneumococcal immunization // J.Paediatr. Child Health. 2001. Vol. 37 (4). Р. 382.
- Геппе Н.А. Рибосомальный комплекс в профилактике частых респираторных заболеваний у детей // Фарматека. 2013. № 1. С. 65–70.
- Fiocchi A., Omboni S., Mora R. et al. Efficacy and safety of ribosome-component immune modulator for preventing of recurrent respiratory infections in socialized children // Allergy Asthma Proc. 2012. Vol. 33 (2). P. 197–204.
- Сорока Н.Д. Особенности иммунотерапии затяжных и рецидивирующих болезней у детей // Педиатр. фармакология. 2008. Т. 5. № 5. С. 38–41.
- Алексеева А.А., Намазова-Баранова Л.С., Торшхоева Р.М. Рибосомальный комплекс в профилактике и лечении острых респираторных инфекций у детей // Вопр. совр. педиатрии. 2010. Т. 9. № 6. С. 127–130.
Только для зарегистрированных пользователей

Отечественная статистика свидетельствует о возрастающем увеличении потребления алкоголя. Алкоголизм в России является большой проблемой. Это касается всех сторон жизни: социальной, психологической, биологической. [3].
Среди наиболее частых причин заболеваемости и смертности у больных алкоголизмом являются тяжелые инфекции, как следствие сбоя иммунной защиты организма[3]. Некоторая часть этих нарушений поддается коррекции[4, 5]. При изучении взаимосвязей между алкоголизмом и урогенитальной микст-инфекцией у мужчин и женщин установлено отсутствие различий между ними по проценту встречаемости урогенитальной микст-инфекции [3].
При алкоголизме страдает не только урогенитальный тракт, но и слизистая ротовой полости. Ведущую роль в развитии хронического воспаления в ротовой полости играют бактерии, роль вирусов более значима в развитии острого воспаления. Наиболее часто встречаются вирусно-бактериальные ассоциации, которые усугубляют течение воспаления. Микрофлора не имеет определенной специфики [8].
Важное место в патогенезе алкоголизма занимают иммунные механизмы. Наиболее выражены изменения при тяжелом иммунодефиците, а бессимптомная инфекция обусловливает снижение местной защиты [8].
Известно, что у больных алкоголизмом в негативную сторону изменяются биохимические показатели крови. Но они могут ухудшаться не только вследствие алкоголизма, но и в результате влияния урогенитальной инфекции [7].
Существуют различные методы лечения и профилактики местных поражений [1].
Интересным, новым и перспективным представляется использование препаратов на основе лантаноидов, исследование свойств которых проводится сейчас в различных аспектах [2, 9].
Цель исследования
Исследовать влияние препарата на основе соли лантана на течение местных воспалительных процессов у мужчин и женщин с алкоголизмом в сочетании с урогенитальной инфекцией и предложить принципы патогенетически обоснованной терапии урогенитальной инфекции для улучшения качества жизни пациентов с алкоголизмом.
Материал и методы исследования
В исследовании принимали участие пациенты областного и городского наркологических диспансеров Н. Новгорода, а также частных клиник Н. Новгорода с диагнозом алкоголизм.
Обследовались мужчины и женщины, 35 - 60 лет, с урогенитальной инфекцией, подтвержденной методом полимеразной цепной реакции реального времени.
Сбор анамнеза и клиническое обследование проводились наркологами-психиатрами, диагностика алкогольной зависимости проводилась согласно МКБ-10.
Всего были отобраны 400 человек с алкоголизмом (200 мужчин и 200 женщин) с микст-инфекцией урогенитального тракта.
Пациенты, отдельно мужчины и женщины, были разделены на 4 группы по 50 человек каждая: вирусно-вирусные, вирусно-бактериальные, бактериально-бактериальные микст-инфекции и пациенты группы контроля с отсутствием урогенитальной инфекции.
В 1-ю группу вирусно-вирусных микст-инфекций вошли пациенты с двумя и более из следующих инфекций: папилломавирусная, вирус простого герпеса, цитомегаловирус.
Во 2-ю группу бактериально-бактериальных - с двумя и более из следующих инфекций: микоплазма хоминис, уреаплазма уреалитикум, кандида альбиканс, гарднерелла вагиналис.
В группу вирусно-бактериальных попали пациенты с наличием инфекций из 1-й и 2-й групп.
Определялись нормальность распределения показателей с применением критериев Колмогорова-Смирнова, Шапиро-Уилка и Лиллиефорса.
Вычислялись среднее арифметическое и среднеквадратичное отклонение по всем исследуемым показателям.
Выявлялись корреляционные связи, попарные и множественные различия между показателями.
Результаты исследования и их обсуждение
При урогенитальной инфекции местные воспалительные изменения встречаются статистически значимо чаще, чем в контрольной группе (p?0,01).
В процессе множественного сравнения таких показателей, как частота встречаемости местных воспалительных процессов в зависимости от видов микст-инфекции (вирусно-вирусной, бактериально-бактериальной и вирусно-бактериальной) с использованием поправки Бонферрони не выявлено достоверных различий по встречаемости местных проявлений воспаления в трех группах урогенитальной микст-инфекции.
Табличный коэффициент Стьюдента с поправкой Бонферрони для данной выборки составил 2,36.
Также не обнаружено достоверных различий при анализе групп по полу и возрасту (p?0,20).
У работающих пациентов местные проявления воспаления встречаются достоверно реже, чем у неработающих лиц (p?0,01).
По локализации местного воспаления достоверные различия есть.
На кожных покровах различные проявления встречаются достоверно чаще, чем в ротовой полости и в урогенитальном тракте (p?0,001).
Однако между локализацией в ротовой полости и в урогенитальном тракте достоверных различий в величинах данного показателя не обнаружено (p?0,16).
Нами выявлено, что на любом сроке начала применения препарата на основе лантаноидов при лечении местных воспалительных процессов, эффект наступает в течение 2 - 5 дней.
Это не имеет достоверной зависимости от сроков начала терапии по отношению к началу первых клинических проявлений местного воспаления (p?0,20).
У пациентов с сочетанием алкоголизма и урогенитальной инфекции не установлено существенной зависимости эффекта терапии от таких характеристик, как пол, возраст, социальный статус, длительность использования препарата в днях, локализация и частота встречаемости местных воспалительных проявлений.
Непараметрический анализ показал, что вышеперечисленные характеристики не коррелировали между собой. При этом ни у кого из пациентов не выявлено аллергических реакций на препарат, даже при более длительном его применении.
Напротив, при наличии у пациентов местных проявлений аллергических реакций, они бесследно проходили вследствие применения препарата на основе соли лантана.
Кроме того, независимо от того, насколько выражены были местные проявления воспаления и частоты их встречаемости - препарат на основе соли лантана был одинаково эффективен.
Также нами был оценен эффект от применения препарата на основе соли лантана по сравнению с эффектом от препаратов, содержащих антибиотики и гормоны (окситетрациклин, гидрокортизон), которые нередко используют в подобных ситуациях. При применении антибиотических и гормональных средств выявлялись аллергические реакции, дисбактериоз.
Эффект от препарата на основе соли лантана наступал на 2-5 сутки от начала лечения, а эффект от антибиотиков и гормонов - лишь к концу 7 - 14 суток.
Заключение
Алкоголизм, ассоциированный с урогенитальной инфекцией, усугубляет нарушения со стороны иммунной системы, что формирует порочный круг, снижая эффективность как общей, так и местной терапии.
Применение препарата на основе соли лантана при наличии местных воспалительных изменений различной локализации у женщин и мужчин с урогенитальной инфекцией на фоне алкоголизма достоверно более эффективно, чем применение антибиотических, гормональных и анальгезирующих средств. Такая терапия нетоксична, не имеет противопоказаний к многократному и длительному применению, что особенно важно для больных алкоголизмом, у которых достаточно выражены нарушения со стороны иммунной системы.
В ряде случаев местное применение препарата на основе соли лантана способствует элиминации ряда возбудителей урогенитальной инфекции у женщин и мужчин с алкоголизмом, что позволяет улучшить состояние больных без использования дополнительных препаратов (антибиотиков и иммунокорректоров).
Рецензенты:
Потемина Т.Е., д.м.н., профессор, заведующий кафедрой патологической физиологии, ГБОУ ВПО НижГМА Минздрава России, г. Нижний Новгород;
Артифексова А.А., д.м.н., профессор, заведующий кафедрой патологической анатомии, ГБОУ ВПО НижГМА Минздрава России, г. Нижний Новгород.
Е.А.Дондурей, Л.В.Осидак, Е.Г.Головачева, А.К.Голованова, И.В.Амосова, Л.Н.Гладченко
ГУ НИИ гриппа РАМН, Санкт-Петербург
Установлена доля острых респираторных вирусных инфекций с гастроинтестинальным синдромом в структуре заболеваемости у детей в возрасте от 6 мес. Доказана лечебная эффективность и безопасность включения анаферона детского в комплексную терапию острых респираторных вирусных инфекций с сопутствующим поражением желудочно-кишечного тракта и более быстрая ликвидация всех симптомов с улучшением показателей иммунного статуса.
Ключевые слова: сочетанное поражение, респираторный тракт, желудочно-кишечный тракт, индуктор интерферона, иммунный статус
Сочетанное поражение респираторного (РТ) и желудочно-кишечного трактов (ЖКТ) - не редкость в практике инфекциониста, однако, в связи с отсутствием до сих пор четких дифференциально-диагностических критериев, диагноз шифруется по-разному: либо как сопутствующие друг другу заболевания, либо как симптомы дисфункции ЖКТ при острых респираторных вирусных инфекциях (ОРВИ) расцениваются как проявления интоксикации или дисбиоза или не учитываются вообще. Этим, вероятно, объясняется отсутствие данных об удельном весе ОРВИ с гастроинтестинальным синдромом как в структуре инфекционной патологии вообще, так и среди ОРВИ в частности. Вместе с тем, еще в 60-e годы XX в. печати появились сообщения о выявлении различных расстройств ЖКТ у детей во время инфекций РТ и катаральных явлений в носоглотке [4,10]. При этом ведущая роль в этиологии принадлежала вирусной инфекции.
В дальнейшем появление современных методов лабораторной диагностики, а также вспышки новых, ранее неизвестных заболеваний (SARS, птичий грипп, Norwalk), расширили круг вирусных инфекций, в клиническом течении которых возможно острое сочетанное поражение РТ и ЖКТ [6,11,12]. Причиной симптомокомплекса может быть как моноинфекция, когда возбудитель репродуцируется в эпителиальных клетках и РТ, и ЖКТ, так и микст-инфекция с различной локализацией места репродукции возбудителей [2,8].
Значимость данной проблемы для детей объясняется также необходимостью совершенствования методов лечения. Учитывая полиэтиологичность изучаемой патологии и преимущественно ранний возраст пациентов, одним из наиболее перспективных путей является использование в терапии препаратов ИФН, которые, в отличие от химиопрепаратов, имеют значительно меньше противопоказаний и более широкий спектр показаний к применению [3]. К ним относится и анаферон детский (АД), созданный на основе сверхмалых доз антител к ИФН-γ в гомеопатических разведениях С12, С30 и С50, успешно применяемый при лечении гриппа и респираторно-синцитиально-вирусной инфекции [9].
Методика исследования
С целью установления удельного веса ОРВИ с гастроинтестинальным синдромом в структуре острых респираторных заболеваний (ОРЗ) проведен анализ 15 785 историй болезней детей, находившихся в инфекционно-боксовых отделениях Детской инфекционной больницы № 5 им. Н.Ф.Филатова (Санкт-Петербург) с симптомами ОРЗ в период с 2003 по 2006 г.
Лечебная эффективность АД изучена в двойном слепом плацебоконтролируемом, рандомизированном клиническом исследовании у 150 детей в возрасте от 6 мес, госпитализированных с симптомами острого сочетанного поражения РТ и ЖКТ. Из них 100 детей получили препарат, 50 - плацебо.
АД и плацебо назначали по лечебной схеме согласно инструкции в течение 7-14 сут в зависимости от клинической выраженности заболевания [7]. Кроме того, по показаниям дети получали патогенетически обусловленную базисную терапию.
В обеих группах преобладали дети первых 3 лет жизни (в 83 и 82% случаев). Мальчиков было больше, чем девочек (55 и 45% соответственно). У большинства пациентов заболевание протекало на неблагополучном преморбидном фоне, представленном, в основном, проявлениями дермато- или респираторного аллергоза, хроническими заболеваниями уха, горла, носа и других органов, частыми ОРЗ в анамнезе и т.п. В целом сравниваемые группы были репрезентативными по основным данным.
С целью установления этиологии заболевания, помимо рутинного бактериологического, мы проводили комплексное вирусологическое исследование в лабораториях ГУ НИИ гриппа РАМН. Вирусные антигены и их нуклеиновые кислоты в материалах из носоглотки определяли методами иммунофлюоресценции, ПЦР, ИФА и реакцией непрямой гемагглютинации; в фекалиях - методами ИФА и просвечивающей электронной микроскопии. Завершающим этапом диагностики было выявление нарастания титров специфических противовирусных антител в серологических реакциях парных сывороток методами реакций торможения и непрямой гемагглютинации, реакции связывания комплемента и ИФА.
У части пациентов в динамике наблюдения оценивали иммунологические показатели: содержание общего IgE в сыворотке крови, секреторного IgA в носовых смывах, сывороточного, спонтанного и индуцированного in vitro ИФН-α и ИФН-γ, а также маркеров иммунокомпетентных клеток CD3, CD4, CD8, CD20 и CD16 [1,5].
Результаты исследования
По данным стационара, за 4 года сочетанное поражение РТ и ЖКТ официально регистрировалось у каждого 4-5-го ребенка, находящегося на стационарном лечении с симптомами ОРЗ (в 2003 г. - в 22%, 2004 г. - в 16.6%, 2005 г. - в 19.3%, 2006 г. - в 26.2% случаев).
В отличие от данных стационара, где причина дисфункции ЖКТ осталась не расшифрованной в 69.1% случаев, включение в спектр исследования пациентов вирусологических методов резко изменило представления об этиологической структуре заболевания. У большинства наблюдаемых детей доминировала вирусная инфекция: по данным исследования материалов из носа - в 7488% случаев, фекалий - в 45.5-50.0%, по результатам серологических исследований - в 49-40%. В целом причина заболевания осталась неизвестной только в 9% случаев и в половине случаев она была представлена микст-вариантом с преобладанием вирусных ассоциаций.
Наиболее часто (у каждого 3-4-го пациента) регистрировались адено-, рота- и коронавирусная инфекции в виде моно- или микст-вариантов. Несколько реже регистрировалась респираторно-синцитиальная (в 21.5% случаев, в основном в виде микст), гриппозная (в 15.3% случаев), а также норо- и энтеровирусная инфекции.
Из бактериальных возбудителей в 12% случаев выявлена условно-патогенная флора, в том числе золотистый стафилококк, протей, клебсиелла и грибы рода Candida.
Таблица 1. Лечебная эффективность АД у детей с острым сочетанным поражением РТ и ЖКТ (M±m)
| Клинические симптомы | Продолжительность симптомов, дни | |
| АД (n=100) | плацебо (n=50) | |
| Лихорадочная реакция | 2.10±0.06* | 3.37±0.19 |
| Интоксикация | 2.68±0.08* | 4.63±0.19 |
| Катаральные явления в носоглотке | 4.33±0.10* | 6.79±0.23 |
| Дисфункция ЖКТ | 3.29±0.12* | 4.65±0.26 |
| Острый период заболевания | 4.68±0.08* | 6.78±0.22 |
Рис. Продолжительность обнаружения антигенов в носовых ходах (а) и частота внутрибольничных инфекций (б) на фоне АД (светлые столбики) или плацебо (темные столбики) при остром сочетанном поражении РТ и ЖКТ у детей.
Включение АД в комплексную терапию способствовало достоверному увеличению уровня секреторного IgA - фактора местной защиты в носовых смывах детей, в отличие от пациентов контрольной группы (в 72.6 и 32.9% случаев соответственно). Вероятно, активизация местного иммунитета способствовала сокращению периода выделения вирусных антигенов, обнаруживаемых методом иммунофлюоресценции в носовых ходах больных и, в конечном счете, уменьшению частоты развития внутрибольничных инфекций (рисунок).
Заболевания сопровождались изменением содержания большинства Т-лимфоцитов, в частности, снижением уже при первом обследовании числа CD3, CD4 и CD8. На 2-3-и сутки у пациентов, принимавших АД, достоверно увеличивалось относительное содержание CD3 (в основном за счет субпопуляции CD4 с 34.6+1.6 до 40.1+1.3%) и CD16 (с 14.3+0.9 до 17.0+1.1%), которые уменьшались или оставались на прежнем уровне в группе плацебо (CD4 - с 31.0+1.1 до 26.3+1.3%; CD16 - с 16.8+1.4 до 14.6+1.4%), что явилось показателем уменьшения числа клеток, принимающих непосредственное участие в формировании гуморального иммунитета.
На фоне приема АД наблюдалось достоверное увеличение индуцированной и спонтанной продукции ИФН-α и ИФН-γ, в отличие от детей контрольной группы, как и общего содержания данных цитокинов в сыворотке крови (табл. 2). Кроме того, несмотря на дальнейшее снижение уровня ИФН к моменту выздоровления, у детей, получавших препарат, он сохранялся на достоверно более высоком уровне.
Применение АД не вызывало каких-либо нежелательных явлений, в том числе аллергических реакций, что подтверждалось отсутствием повышения в сыворотке крови уровня общего IgE, а в ряде случаев - даже его снижением, в отличие от детей контрольной группы.
Таким образом, сочетанное поражение РТ и ЖКТ регистрируется у каждого 4-5-го пациента, госпитализированного по поводу ОРЗ, преимущественно у детей первых 3 лет жизни. В этиологии симптомокомплекса лидирует вирусная инфекция (адено-, рота- и коронавирусная в виде как моно-, так и микст-вариантов). Терапия должна быть комплексной, зависящей от ведущего синдрома и может включать индуктор ИФН - АД.
Читайте также:


