Метотрексат при гепатите с
Исследователи из Кокрейновского сотрудничества провели обзор эффектов метотрексата, применяемого в виде монотерапии или в комбинации с другими болезнь-модифицирующими антиревматическими препаратами (БМАРП) у людей с ревматоидным артритом. В результате поиска всех соответствующих исследований вплоть до 19 января 2016 года они обнаружили 158 исследований с участием более 37000 людей. Эти исследования были опубликованы в период между 1985 по 2016 годами, а продолжительность их составила от 12 недель до 2 лет. Объединенные результаты из этих исследований представлены ниже:
У людей с ревматоидным артритом, в сравнении с монотерапией метотрексатом:
- Комбинации метотрексат + сульфасалазин + гидроксихлорохин и метотрексат + большинство биологических БМАРП уменьшают активность заболевания. Другие комбинации для лечения (метотрексат + гидроксихлорохин, метотрексат + лефлуномид, метотрексат + инъекции препаратов золота) могут уменьшать активность заболевания у людей, не отвечающих на лечение только одним метотрексатом.
-Комбинации метотрексата и некоторых биологических БМАРП (адалимумаб, этанерцепт, цертолизумаб или инфликсимаб) уменьшают повреждение суставов (по данным рентгенограмм) в период немного более одного года у пациентов, ранее не принимавших метотрексат.
- Комбинации метотрексат + азатиоприн, метотрексат + циклоспорин и метотрексат + тоцилизумаб (8мг/кг), вероятно, увеличивают шансы прекращения приема лекарства из-за побочных эффектов.
Что такое ревматоидный артрит, метотрексат и другие болезнь-модифицирующие антиревматические препараты?
Если у вас ревматоидный артрит (РА), ваша иммунная система, которая обычно борется с инфекцией, атакует выстилку ваших суставов. Из-за этого ваши суставы становятся опухшими, тугоподвижными (скованными) и болезненными. В настоящее время РА считают неизлечимым заболеванием, поэтому лечение направлено на облегчение боли, уменьшение скованности и улучшение способности двигаться. К счастью, есть много лекарств, которые могут эффективно контролировать заболевание. Эти лекарства известны как болезнь-модифицирующие антиревматические препараты, или БМАРП. Метотрексат считают препаратом выбора среди БМАРП для большинства пациентов с РА, так как он хорошо работает у большинства пациентов и, как правило, хорошо переносится. Метотрексат может применяться самостоятельно (монотерапия) или в комбинации с другими БМАРП. Эти другие БМАРП включают в себя как препараты, доступные и используемые в течение многих лет (такие как сульфасалазин и гидроксихлорохин), так и более новые и дорогие (биологические БМАРП и тофацитиниб). Важно понимать, как все эти виды лечения соотносятся друг с другом в отношении пользы и побочных эффектов.
Что происходит у людей с ревматоидным артритом, которые принимают метотрексат в комбинации с другими болезнь-модифицирующими антиревматическими препаратами?
А) У пациентов, которые не принимали метотрексат ранее:
ACR 50 (число чувствительных или опухших суставов и другие исходы, такие как боль и нетрудоспособность)
- у 61 человека из 100, которые принимали метотрексат + сульфасалазин + гидроксихлорохин и у 56-67 человек из 100, которые принимали метотрексат + биологические БМАРП или тофацитиниб, было уменьшение выраженности симптомов ревматоидного артрита, по сравнению с 41 человеком из 100, которые принимали только метотрексат.
- У пациентов, которые принимали метотрексат в комбинации с адалимумабом, этанерцептом, цертолизумабом или инфликсимабом, было небольшое замедление прогрессирования повреждения суставов (по шкале Шарпа/ван дер Хейде) в течение одного года, по сравнению с пероральным метотрексатом, однако примерный объем повреждений даже при пероральном приеме метотрексата был очень небольшим (увеличение на 2.6 пункта).
Прекращение лечения из-за побочных эффектов
- 36 человек из 100, которые принимали метотрексат + азатиоприн, вынуждены были прекратить лечение из-за побочных эффектов, по сравнению с 8 людьми из 100, которые принимали только метотрексат.
Б) У пациентов, которые принимали метотрексат ранее:
ACR 50 (число чувствительных или опухших суставов и другие исходы, такие как боль и нетрудоспособность)
- у 61 человека из 100, которые принимали метотрексат + сульфасалазин + гидроксихлорохин и у 27-64 человек из 100, которые принимали метотрексат + биологические БМАРП или тофацитиниб, было уменьшение выраженности симптомов ревматоидного артрита, по сравнению с 13 людьми из 100, которые принимали только метотрексат.
- Ни одна из схем лечения не привела к значимому снижению объема повреждений суставов, оцениваемого по рентгенограммам, в течение одного года.
Прекращение лечения из-за побочных эффектов
- 21 человек из 100, которые принимали метотрексат + циклоспорин и 12 человек из 100, которые принимали метотрексат + тоцилизумаб (8 мг/кг), были вынуждены прекратить лечение из-за побочных эффектов, по сравнению с 7 людьми из 100, которые принимали только метотрексат.
Некоторые вопросы лечения ревматоидного артрита с сопутствующим хроническим гепатитом В или С
Лечение пациентов с ревматоидным артритом и сопутствующими заболеваниями — постоянная задача для ревматологов и врачей других специальностей, причем возможности специалистов с каждым годом непрерывно меняются. Последние тенденции в гепатологии позволяют предположить, что уже через мы будет иметь совершенно другие виды терапии и совершенно другие ее результаты.
Фактор некроза опухоли (ФНО) играет важную роль в элиминации вируса гепатита С и его репликации. Уровень ФНО в крови повышен при гепатите С и принимает участие в противовирусной резистентности. По некоторым данным, назначение препарата этанерцепта при ревматоидном артрите на фоне противовирусной терапии хронического гепатита С (интерфероном 2b и рибавирином) не только не снижает, но даже повышает эффективность последней: полная эрадикация вируса наблюдалась у 63% пациентов, а при назначении вместо этанерцепта плацебо — только у 32%. В то же время, терапия препаратами (ритуксимаб) снижала уровень IgG, усиливала репликацию вирусной РНК и вызывала диссеминацию вирусных частиц из разрушенных . Однако, ритуксимаб эффективен при криоглобулинемическом васкулите при гепатите С.
Интерлейкин 6 играет роль в регенерации и пролиферации печеночных клеток. Уровень интерлейкина 6 повышен в крови больных с хроническим гепатитом С, циррозом, и гепатоцеллюлярной карциномой. Пока очень мало информации о возможностях применения тоцилизумаба при ревматоидном артрите на фоне хронического гепатита С.
При гепатите С, если нет активного воспаления в печени и гепатоцеллюлярного некроза, большая часть врачей обычно из иммунобиологических препаратов применяет ингибиторы фактора некроза опухоли (). Накоплен достаточный опыт подобного лечения при гепатите С, и Рекомендации Американской Коллегии Ревматологов 2012 года ссылаются на эти данные. Если на момент начала терапии артрита у пациента сравнительно нормальные показатели ферментов печени, такая тактика лечения не должна вызывать опасений.
В соответствии с Рекомендациями Американской Коллегии Ревматологов (ACR), гепатологи должны наблюдать таких пациентов и мониторировать их состояние, включая проведение биопсии печени до начала лечения, динамику печеночных ферментов и уровень вирусной нагрузки. В Рекомендациях не указано, можно ли заменить биопсию печени методами неинвазивной оценки поражения печени по показателям крови (например, фибротест или фибромакс). ACR рекомендует назначать в этих случаях этанерцепт при хроническом гепатите С. При остром гепатите или обострениях хронического гепатита С назначения биологических препаратов следует избегать.
Применяемая фоновая терапия метотрексатом или лефлуномидом может усугубить тяжесть поражения печени, поэтому монотерапия иммунобиологическими препаратами предпочтительнее комбинации с базисными препаратами. Новые стратегии лечения гепатита С, основанные на безинтерфероновых препаратах, не имеют тяжелых побочных эффектов обладают очень высокой эффективностью, в связи с чем возможности лечения гепатита значительно расширяются.
Что касается гепатита В, то Рекомендации ACR 2012 не рекомендуют применение биологической терапии у больных с активным гепатитом В, но ничего не говорят о пациентах, которые перенесли его в прошлом и являются серопозитивными.
По данным Американской Ассоциации Гастроэнтерологов (2015), иммуносупрессивные препараты можно классифицировать на 3 группы по частоте реактивации гепатита В:
- препараты высокого риска (>10% случаев) — ритуксимаб;
- умеренного риска (1–10%) — все другие иммунобиологические препараты;
- низкого риска ( <1%) — традиционные базисные препараты (метотрексат, лефлуномид, сульфасалазин).
У пациентов с наличием HBsAg в крови следует выяснить вирусную нагрузку (количество вируса в единице объема крови) до начала лечения, а противовирусную терапию обязательно начать за неделю до начала применения биологических препаратов (высокого или умеренного риска реактивации). Противовирусное лечение следует продолжать не менее 3–6 месяцев после прекращения биологической терапии артрита. Европейская Ассоциация по изучению болезней печени (EASL) рекомендует предпочитать энтекавир и тенофовир ламивудину. Такая же тактика у и больных при обнаружении вируса гепатита В в крови.
Продолжаются дебаты о тактике лечения пациентов без поверхностного антигена гепатита В (HbSAg) при обнаружении антител к HBCor антигену без определяемого ДНК HBV методом полимеразной цепной реакции в крови. В основном это касается пациентов, у которых раньше некоторые тесты на гепатит В были положительны или сомнительны. При этом следует иметь в виду, что при применении некоторых биологических препаратов (особенно это касается ритуксимаба) у пациентов с положительными тестами на наличие антител к гепатиту В и отрицательными на наличие антигенов есть опасность реактивации болезни. По данным исследований, при использовании ритуксимаба частота реактивации возрастает от 3,4% до 80% среди и от 1,5% до 23,8% у пациентов, иногда с летальным исходом.
В то же время, недавние результаты длительных наблюдений за большим количеством пациентов с наличием антител к , которым в лечении артрита использовали множество биологических препаратов (включая ритуксимаб) без предшествующей противовирусной профилактики, не продемонстрировали сероконверсии у этих больных при наблюдении от 2 до 5 лет, риск реактивации инфекции у них был достаточно низким. И в большей части случаев больной с гепатитом В при наличии антител к может получать биологические препараты.
В настоящее время EASL и Американская Академия Гастроэнтерологов при лечении ритуксимабом (биологический препарат с высоким риском реактивации гепатита В) рекомендуют назначение профилактической противовирусной терапии. При лечении биологическими препаратами умеренного риска реактивации хорошей альтернативой может быть тщательный мониторинг возможной реактивации вирусной инфекции (уровень трансаминаз, HBsAg, вирусная нагрузка).
И хотя большинство пациентов с хронической формой гепатита В вынуждены принимать противовирусную терапию практически постоянно, эти препараты, в основном, не очень токсичны. Поэтому тактика лечения ревматоидного артрита для пациента с хроническим гепатитом В, даже в случае, если терапия с подавлением вируса вынуждена проводится длительно, обычно допускает применение биопрепаратов без особого опасения, что вирус выйдет контроля (при условии постоянного наблюдения и контроля инфекционистом и ревматологом).
2. Какие пациенты наиболее подходят для применения терапии ингибиторами (JAK), и на каком этапе лечения больных ревматоидным артритом, принимающих метотрексат, уместно добавление терапии ?
К сожалению, в настоящее время нет диагностических инструментов и предикторов ответа на биологические препараты разных групп (классов).
Поэтому клиническая оценка целесообразности применения того или иного препарата — единственно доступный инструмент (можно учитывать приемлемость внутривенных или подкожных введений, или же предпочтения пациентов принимать только таблетированные средства). Следует также учитывать опыт предшествующей терапии биологическими препаратами у данного конкретного пациента при принятии решения о продолжении терапии.
В то же время, данные об эффективности применения подтверждают, что они нисколько не уступают ингибиторам ФНО. Опубликованы несколько сравнительных исследований, включая опубликованные в New England Journal of Medicine, где тофацитиниб () сравнивался с адалимумабом, и продемонстрировал при этом достаточно неплохие результаты. Тофацитиниб и адалимумаб продемонстрировали схожие преимущества в сравнении с плацебо у пациентов, страдающих ревматоидным артритом и имеющих недостаточную реакцию на метотрексат, который они продолжали принимать в качестве фоновой терапии. Шестимесячное применение обоих агентов привело к клиническому и статистическому уменьшению проявлений и симптомов активного ревматоидного артрита; статистически разница по шкалам и была заметна уже через один месяц. Спустя полгода активного применения, улучшилась физическая функция, ремиссии удлинились. Повышения уровней аминотрансфераз наблюдались чаще, чем в плацебо; также было отмечено уменьшение уровня нейтрофилов и умеренная анемия. У части пациентов отмечено небольшое повышение уровней сывороточного креатинина, холестерина и холестерина липопротеидов высокой и низкой плотности. Серьезные инфекции возникли у 3,4% и 4% пациентов, принимавших тофацитиниб в дозах 5 мг и 10 мг соответственно, и у 1,5% пациентов, получавших адалимумаб.
С точки зрения безопасности, большинство пациентов, , предпочтут начать терапию с препаратов, которые имеют многолетний опыт применения, если только не вмешаются иные соображения или возобладает желание перорального приема препарата. В связи с этим, большинство пациентов, да и, наверное, ревматологов предпочитают начинать лечение с , просто того, что они знакомы с ними уже 15 с лишним лет.
3. Какую стратегию лечения можно рекомендовать пациентам с ревматоидным артритом, которым не помогает терапия метотрексатом, ритуксимабом или актемрой?
Для тех пациентов, которым не помогает биологическая терапия указанными выше препаратами, ингибиция может оказаться отличным выбором.
Тот факт, что этот препарат оказывает воздействие одновременно на многие цитокины, очень обнадеживает, поскольку это может приводить к воздействию сразу на несколько звеньев воспалительного процесса при ревматоидном артрите.
Обычно рекомендуют прием тофацитиниба дважды в день или барицитиниба один раз в день, в сочетании с другими препаратами. Следует отметить, что тофацитиниб очень хорошо показал себя у тех пациентов, которые не могут или не хотят принимать метотрексат в качестве фоновой терапии.
К сожалению, ингибиторы в Украине и в странах Европы пока не зарегистрированы, но, поскольку в ближайшие годы у ревматологов этих стран появится возможность использовать эти препараты в своей повседневной практике, нужно быть готовым к назначению этих средств и знать об их возможностях и ограничениях.
Материалы подготовлены на основе Рекомендаций Американской Коллегии Ревматологов 2012 года, а также статьи John S Richards и соавт. How to use biologic agents in patients with rheumatoid arthritis who have comorbid disease. BMJ 2015;351.
Ревматоидный артрит (РА) – аутоиммунное заболевание неясной этиологии, характеризующееся симметричным эрозивным артритом (синовитом) и широким спектром внесуставных (системных) проявлений. РА – распространенное заболевание, им традает примерно 1 процент населения земного шара; характерная его черта – неуклонное прогрессирующее поражение суставов (постоянные боли, деформация, нарушение функции) и внутренних органов, приводящее к инвалидизации (около 1/3 больных за 20 лет болезни становятся полными инвалидами) и снижению продолжительности жизни. Последнему в немалой степени способствует высокий риск развития сопутствующих заболеваний (инфекции, атеросклеротическое поражение сосудов, артериальная гипертензия – АГЮ остеопороз и др.).
Развитие и прогрессирование РА определяется сложным, плохо изученным сочетанием генетически детерминированных и приобретенных дефектов (дисбалансом) нормальных (иммуно)регуляторных механизмов, ограничивающих патологическую активацию иммунной системы в ответ на потенциально патогенные, а нередко и физиологические стимулы (схема 1). Этот дисбаланс ведет быстрой трансформации физиологической (защитной) острой воспалительной реакции в хронический неконтролируемый прогрессирующий воспалительный процесс, потенциально затрагивающий все органы и системы человека, в первую очередь – суставы.
Неизученность этиологии РА делает невозможной эффективную этиотропную терапию и ставит его лечение в ряд наиболее сложных проблем медицины. Тем не менее в последние годы в этом направлении достигнуты определенные успехи. Благодаря расшифровке механизмов, лежащих в основе эффективности и токсичности нестероидных противовоспалительных препаратов (НПВП), симптоматическая терапия РА была усовершенствована, чему во многом способствовало создание нового класса этих препаратов – так называемых ингибиторов циклооксигеназы (ЦОК-2), а расширение знаний о механизмах ревматоидного воспаления позволило оптимизировать патогенетическую (базисную) терапию РА. Прогресс, достигнутый за последние годы, особенно хорошо виден при сравнении рекомендаций Американской коллегии ревматологов по фармакотерапии РА, опубликованных в 1996 и 2002 гг.
— глюкокортикоиды – ГК (внутрисуставно, перорально);
— базисные препараты: гидроксихлорохин, сульфасалазин, метотрексат, золи золота (внутримышечно, перорально), азатиоприн, D-пеницилламин.
— ГК (внутрисуставно, перорально);
— базисные препараты: гидроксихлорохин, сульфасалазин, метотрексат, соли золота (внутримышечно, перорально), азатиоприн, D-пеницилламин, циклоспорин А, лефлюномид, миноциклин;
— биологические агенты: моноклональные акнтитела – МАТ – к фактору некроза опухоли (ФНО)-ά (ремикейд); растворимый ФНО-75-Fc lgG (этанерцепт); растворимый антагонист ИЛ-1 (анакинра); иммуноадсорбция с использованием белка А стафилококка.
Однако особое значение имеет разработка концепции ранней, агрессивной терапии, в основе которой лежат данные о том, что наиболее высокая скорость деструкции суставов, в конечном счете, и определяющая неблагоприятный (непосредственный и отдаленный) прогноз болезни, наблюдается именно в дебюте РА. Полагают, что, поскольку применение базисных препаратов при раннем РА позволяет модифицировать течение болезни, активное лечение РА (как и других хронических заболеваний человека – сахарного диабета, АГ, ИБС и др.) должно начинаться как можно раньше. Ранняя диагностика и ранняя терапия любыми базисными противоревматическими препаратами имеют важное значение для улучшения качества жизни и отдаленного прогноза у пациентов с РА.
Современные подходы к диагностике РА подробно освещены в специальной литературе, их обсуждение выходит за рамки задач данной публикации. Следует лишь напомнить, что характерными признаками ревматоидного синовита являются утренняя скованность, длительность которой составляет не менее 1 ч. И симметричное поражение суставов кистей (и стоп); реже бывают поражены коленные, голеностопные, плечевые, локтевые, плюснефаланговые суставы, включая сустав большого пальца стопы, а также шейный отдел позвоночника и тазобедренные суставы. Поскольку РА и другие заболевания опорно-двигательного аппарата распространены весьма широко, очевидно, что заподозрить РА должны еще на поликлиническом этапе врачи-терапевты. Именно поэтому группа авторитетных европейских и американских ревматологов с позиций доказательной медицины разработала алгоритм ранней диагностики РА для поликлинических врачей: более трех воспаленных суставов, поражение пястнофаланговых/плюснефаланговых суставов, утренняя скованность более 30 мин – показания для немедленной консультации ревматолога. Применение алгоритма в широкой клинической практике должно способствовать улучшению прогноза РА, так как при правильной диагностике можно раньше назначить активную терапию базисными противоревматическими препаратами.
После постановки диагноза РА всем больным необходимо провести базовое клиническое, лабораторное и инструментальное обследование.
В клиническое обследование входят выявление субъективных симптомов (выраженность болей в суставах, длительность утренней скованности, длительность общего недомогания, ограничение подвижности в суставах) и физическое обследование:
— определение числа воспаленных и болезненных суставов; оценка механических нарушений (нарушение подвижности, крепитация, нестабильность и/или деформации);
— обнаружение внесуставных проявлений;
— оценка функционального статуса или качества жизни (по стандартным опросникам);
— общая оценка активности врачом;
— общая оценка активности пациентом.
При лабораторном обследовании:
— определяют СОЭ и концентрацию С-реактивного белка (С-РБ); ревматоидный фактор;
— проводят общий анализ крови;
— оценивают уровень электролитов;
— выполняют общий анализ мочи;
— проводят биохимическое исследование на печеночные ферменты, креатин, альбумин;
— исследуют синовиальную жидкость;
— проводят анализ кала на скрытую кровь.
Инструментальное обследование состоит в рентгенографии суставов кистей и стоп, при необходимости – других пораженных суставов.
При каждом визите пациента врач-ревматолог должен оценить активность патологического процесса, эффективность терапии и клинической ремиссии с использованием международных критериев.
Оценка активности РА:
Во время каждого визита определяют:
— выраженность болей в суставах (визуальная аналоговая шкала);
— длительность утренней скованности, в мин;
— наличие воспаленных суставов (болезненные и припухшие суставы);
— прогрессирование заболевания: нарастание ограничения подвижности, нестабильности и/или деформации суставов;
— прогрессирование по данным рентгенографии;
— динамику минеральной плотности костной ткани (МПКТ) по данным костной денситометрии.
Определяют и другие параметры, характеризующие ответ на лечение:
— активность, по мнению врача;
— активность, по мнению пациента;
— функциональный статус или качества жизни (по стандартизованным опросникам).
В задачи терапии РА входят:
— снижение выраженности симптомов, включая недомогание, боли, отек и скованность суставов;
— предотвращение деструкции, нарушения функции и деформации суставов;
— сохранение качества жизни;
— достижение клинической ремиссии;
— увеличение продолжительности жизни.
Нестероидные противовоспалительные препараты
Основной метод симптоматического лечения РА – назначение НПВП с целью уменьшения боли и воспаления в суставах. Однако эти препараты недостаточно хорошо контролируют не только прогрессирование, но и субъективные симптомы у пациентов с РА и вызывают побочные эффекты, особенно у лиц пожилого возраста. У пациентов с факторами риска осложнений со стороны желудочно-кишечного тракта – ЖКТ (пожилой возраст, язвенный анамнез, сочетанное применение глюкокортикоидов – ГК, антикоагулянтов) препаратами выбора являются так называемые ингибиторы ЦОГ-2 – мелоксикам (мовалис), целекоксиб (целебрекс) и нимесулид. Для профилактики и лечения НПВП-индуцированных поражений ЖКТ следует использовать ингибиторы протонной помпы и мизопростол, но не антагонисты Н2-гистаминовых рецепторов и антациды. Следует помнить, что, хотя ингибиторы ЦОГ-2 существенно реже вызывают поражение ЖКТ, чем стандартные НПВП, на фоне их приема также могут возникать нежелательные явления : симптомы диспепсии, замедление заживления язв желудка и двенадцатиперстной кишки, задержка жидкости, повышение АД. Применять как стандартные НПВП, так и ингибиторы ЦОГ-2 следует с особой осторожностью у пациентов со сниженным внутрисосудистым объемом или отеками, связанными с застойной сердечной недостаточностью, нефротическим синдромом, циррозом печени или при повышении концентрации креатина до уровня более 2,5 мг%.
Лечение низкими ( Поделиться: Tweet
4 комментариев(-ия)
скажите пожалуйста от чево РА
Спасибо затакой подробный ответ!
А где в Новосибирске можно сдать кровь на антиССР?
Отвечает главный специалист по клинической лабораторной диагностике
Главного управления здравоохранения мэрии г. Новосибирска,
кандидат медицинских наук Обухов Александр Васильевич:
Определение в крови антител к цитрулинсодержащему белку или цитруллиновые антитела – современный, эффективный, а главное ранний метод клинической лабораторной диагностики ревматоидного артрита.
Выявление антикератиновых антител (АКА) важно для ранней диагностики ревматоидного артрита. Их присутствие может предшествовать клиническим проявлениям заболевания – в ретроспективных исследованиях на замороженных пробах сыворотки показано, что в четверти случаев АКА можно выявить за 5 лет и менее до дебюта ревматоидного артрита, в 10% случаев – за 5 — 9 лет, в 8% случаев – за 10 и более лет. Этот вид антител может встречаться у пациентов с серонегативным ревматоидным артритом. По сравнению с ревматоидным фактором, для АКА характерна более высокая специфичность (88 — 99%), при более низкой чувствительности (40 — 60%).
Необходимо помнить, что НПВП, а тем более глюкокортикоиды (ГК), могут маскировать диагностически важные клинические признаки РА, поэтому от их назначения до установления точного диагноза лучше воздерживаться. Крайне нежелательно проведение внутрисуставных инъекций ГК, поскольку эта манипуляция на несколько недель, а иногда и месяцев затушевывает клиническую симптоматику и поэтому является одной из наиболее частых причин запоздалой постановки правильного диагноза.
Оценка лабораторных показателей воспаления – СОЭ, С-реактивный белок (СРБ), белковые фракции – имеет второстепенное значение в диагностическом процессе, и отсутствие их изменений не должно препятствовать постановке диагноза. В первые 2-3 месяца величины этих параметров не менее чем у 50% больных не выходят за пределы нормальных значений. Кроме того, изменения острофазовых показателей совершенно неспецифичны для РА.
Гораздо большее значение имеет обнаружение в крови РФ в диагностических титрах. Известно также, что больные, позитивные по РФ, имеют худший прогноз течения заболевания. Однако РФ-фенотип имеет два существенных ограничения. Во-первых, специфичность этого теста для РА является достаточно низкой: РФ обнаруживается примерно у 5% здоровых людей, у 5-25% лиц пожилого возраста, а также у значительного числа больных с хроническими заболеваниями. Так, классический IgM-РФ выявляется у 30-35% больных с системной красной волчанкой и системной склеродермией, 20% больных с дерматомиозитом, узелковым полиартериитом и болезнью Бехтерева, 10-15% больных с псориатическим артритом, болезнью Рейтера, сифилисом, туберкулезом, саркоидозом, хроническим активным гепатитом. При наличии суставного синдрома IgM-РФ-позитивными оказываются 25-50% больных с инфекционным эндокардитом, 45-70% — с первичным билиарным циррозом печени, 20-75% — с гепатитом В или С, 15-65% — с другими вирусными инфекциями, 5-25% — с опухолями. Во-вторых, наличие РФ не является стабильным. Частота выявления РФ существенно зависит от длительности заболевания: в первые 6 месяцев он выявляется лишь у 15-43% больных РА, в последующем часть РФ-негативных пациентов становятся РФ-позитивными. Под влиянием лечения возможна и обратная трансформация.
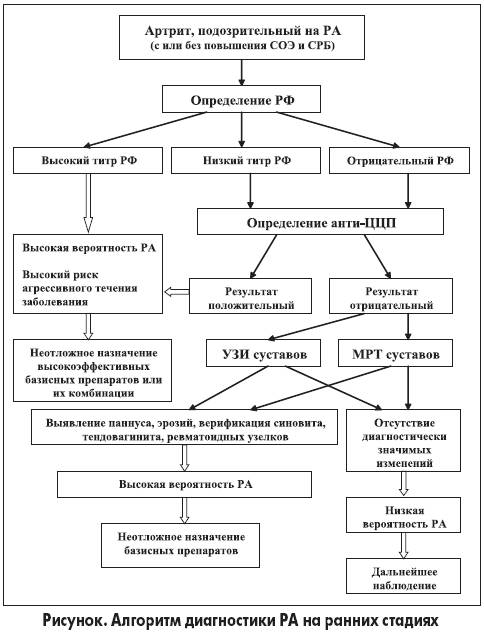
Указанных ограничений лишен недавно внедренный в клиническую практику новый тест иммуноферментного определения антител к цитруллинсодержащим белкам – производным филаггрина, в котором в качестве антигенной субстанции используется синтетический циклический цитруллинированный пептид (ЦЦП), что значительно повысило эффективность лабораторной диагностики РА на ранних стадиях.
Установлено, что анти-ЦЦП являются более специфичными для РА и, по меньшей мере, так же чувствительны, как традиционный РФ: чувствительность анти-ЦЦП при диагностике РА составляет 70-80%, специфичность – 98-99%. Чувствительность теста для больных с ранним РА колеблется между 40 и 70%. Согласно результатам одного из исследований специфичность анти-ЦЦП при диагностике РА на ранних стадиях составляет 86%, комбинации анти-ЦЦП + СОЭ – 95%, анти-ЦЦП + РФ – 91%, анти-ЦЦП + СРБ – 97%, анти-ЦЦП + полиартикулярная боль – 95%, анти-ЦЦП + утренняя скованность – 99%. При этом на момент обследования только 27% больных соответствовали диагностическим критериям ACR. Показано, что наличие этих антител предвещает развитие РА у здоровых на момент обследования людей и прогрессию недифференцированного артрита в РА.
В крупномасштабных клинических исследованиях установлено, что анти-ЦЦП-статус остается стабильным по меньшей мере в течение первых 3-5 лет РА. Наличие анти-ЦЦП на момент установления диагноза предвещает более агрессивное течение заболевания и более выраженное рентгенологическое прогрессирование, несмотря на проводимую терапию. Последующие колебания уровня этих АТ не отражают изменения активности заболевания. Ни НПВП, ни ГК, ни большинство базисных препаратов не влияют на уровень анти-ЦЦП. Следовательно, в клинической практике определение анти-ЦЦП имеет важное значение не только в ранней диагностике РА, но и в планировании терапевтической стратегии. Однако для контроля эффективности лечения данный тест не пригоден.
Таким образом, анти-ЦЦП и РФ являются наиболее важными лабораторными параметрами в диагностике РА на ранних стадиях. При решении вопроса о целесообразности одновременного или последовательного назначения больному этих тестов необходимо учитывать следующее. До 90% анти-ЦЦП(+) больных являются также позитивными по РФ, а одновременное присутствие обеих разновидностей антител не является более специфичным для РА, чем каждый из этих показателей в отдельности. Как уже упоминалось, РФ — достаточно чувствительный, но относительно неспецифичный маркер РА. Поэтому на ранних стадиях заболевания диагностическое значение имеют только высокие титры РФ. Например, если согласно методике РФ определяется как позитивный при значениях >20 Ед/мл, то высокими титрами считаются величины ≥50 Ед/мл. Кроме того, анти-ЦЦП и высокие титры РФ имеют примерно одинаковое прогностическое значение в плане агрессивного, с быстрым рентгенологическим прогрессированием течения заболевания.
Из вышеизложенного вытекает, что дополнительное определение анти-ЦЦП у больных с высокими титрами РФ с учетом экономических соображений нецелесообразно, поскольку не позволяет получить новую диагностическую и прогностическую информацию. В то же время при низких титрах РФ или у РФ-негативных пациентов такое исследование является исключительно полезным. Этот подход отражен в предлагаемом алгоритме диагностики РА на ранних стадиях (рис.).
Расскажите пожалуйста о месте исследования в диагносике РА крови на Антитела к цитрулинсодержащему белку, или порекомендуйте источник, где можнооб этом почитать.
Читайте также:


