Методы индикации вирусов в культуре клеток


тЙУ. 5. йОДЙЛБГЙС ТЕРТПДХЛГЙЙ ЧЙТХУБ Ч ЛХМШФХТЕ ФЛБОЙ РП ГЙФПРБФЙЮЕУЛПНХ ДЕКУФЧЙА (грд): 1.ЙОФБЛФОБС НПОПУМПКОБС ЛХМШФХТБ ЛМЕФПЛ; 2. ЪБТБЦЕООБС ЛХМШФХТБ (грд). (нЙЛТПВЙПМПЗЙС Й ЙННХОПМПЗЙС.-рПД ТЕД. б.б. чПТПВШЕЧБ.-н, нЕДЙГЙОБ, 1999.-464 У.)
л РПМХРЕТЕЧЙЧБЕНЩН ЛХМШФХТБН ПФОПУСФУС ДЙРМПЙДОЩЕ ЛМЕФЛЙ ЮЕМПЧЕЛБ. пОЙ РТЕДУФБЧМСАФ УПВПК ЛМЕФПЮОХА УЙУФЕНХ, УПИТБОСАЭХА Ч РТПГЕУУЕ 50 РБУУБЦЕК (ДП ЗПДБ) ДЙРМПЙДОЩК ОБВПТ ИТПНПУПН. дЙРМПЙДОЩЕ ЛМЕФЛЙ ЮЕМПЧЕЛБ ОЕ РТЕФЕТРЕЧБАФ ЪМПЛБЮЕУФЧЕООПЗП РЕТЕТПЦДЕОЙС Й ЬФЙН ЧЩЗПДОП ПФМЙЮБАФУС ПФ ПРХИПМЕЧЩИ.
дМС ЧЩТБЭЙЧБОЙС ЧЙТХУПЧ НПЦОП ЙУРПМШЪПЧБФШ ЛХМШФХТЩ ФЛБОЕК МАВПЗП ФЙРБ. дПЪБ ЪБТБЦЕОЙС ЪБЧЙУЙФ ПФ ГЕМЙ Й ОБЪОБЮЕОЙС ПРЩФБ. фЛБОЕЧЩЕ ЛХМШФХТЩ ЙУРПМШЪХАФ ДМС ЧЩДЕМЕОЙС ОПЧЩИ НБМПЙЪХЮЕООЩИ ЧЙТХУПЧ, ЛПЗДБ ПВЩЮОЩН НЕФПДПН (ЪБТБЦЕОЙЕ ЦЙЧПФОЩИ, ЛХТЙОЩИ ЬНВТЙПОПЧ) ОЕЧПЪНПЦОП ХУФБОПЧЙФШ ЧЙТХУОХА РТЙТПДХ ЧПЪВХДЙФЕМС. чЩВПТ ЛМЕФПЮОЩИ ЛХМШФХТ ПРТЕДЕМСЕФУС ЙИ ЮХЧУФЧЙФЕМШОПУФША Л ПФДЕМШОЩН ЗТХРРБН ЧЙТХУПЧ.
тБЪМЙЮБАФ ПУФТХА Й ИТПОЙЮЕУЛХА ЙОЖЕЛГЙЙ. пУФТПЕ ФЕЮЕОЙЕ ЙОЖЕЛГЙЙ ИБТБЛФЕТЙЪХЕФУС ГЙФПРБФЙЮЕУЛЙН ДЕКУФЧЙЕН (ДЕУФТХЛФЙЧОЩНЙ ЙЪНЕОЕОЙСНЙ ЪБТБЦЕООЩИ ЛМЕФПЛ, ЪБЧЕТЫБАЭЙИУС ЙИ ЗЙВЕМША). иТПОЙЮЕУЛБС ЖПТНБ ТЕРТПДХЛГЙЙ ЧЙТХУБ ОЕ ЧЩЪЩЧБЕФ ВЩУФТХА ЗЙВЕМШ ЛМЕФПЛ, ПОЙ ДПМЗПЕ ЧТЕНС ПУФБАФУС ЦЙЪОЕУРПУПВОЩНЙ Й ЧОЕЫОЕ НПЗХФ ОЕ ПФМЙЮБФШУС ПФ ЪБТБЦЕООЩИ.
йОДЙЛБГЙА ЧЙТХУПЧ Ч ЛХМШФХТЕ ЛМЕФПЛ РТПЧПДСФ ОБ ПУОПЧБОЙЙ УМЕДХАЭЙИ ЖЕОПНЕОПЧ:
- гЙФПРБФЙЮЕУЛПЕ ДЕКУФЧЙЕ (грд) - ЧЙДЙНЩЕ РПД НЙЛТПУЛПРПН НПТЖПМПЗЙЮЕУЛЙЕ ЙЪНЕОЕОЙС ЛМЕФПЛ, ЧРМПФШ ДП ЙИ ПФФПТЦЕОЙС ПФ УФЕЛМБ, ЛПФПТЩЕ ЧПЪОЙЛБАФ Ч ТЕЪХМШФБФЕ ЧОХФТЙЛМЕФПЮОПК ТЕРТПДХЛГЙЙ ЧЙТХУПЧ (ТЙУ. 5). иБТБЛФЕТ грд РТЙ ТБЪМЙЮОЩИ ЧЙТХУОЩИ ЙОЖЕЛГЙСИ ОЕПДЙОБЛПЧ. рТЙ ТЕРТПДХЛГЙЙ ПДОЙИ ЧЙТХУПЧ (РБТБНЙЛУПЧЙТХУЩ, ЗЕТРЕУЧЙТХУЩ) ОБВМАДБЕФУС УМЙСОЙЕ ЛМЕФПЛ У ПВТБЪПЧБОЙЕН УЙОГЙФЙС, ДТХЗЙИ (ЬОФЕТПЧЙТХУЩ, ТЕПЧЙТХУЩ) - УНПТЭЙЧБОЙЕ Й ДЕУФТХЛГЙС ЛМЕФПЛ, ФТЕФШЙИ (БДЕОПЧЙТХУЩ) - БЗТЕЗБГЙС ЛМЕФПЛ Й Ф.Д.
- чЙТХУОЩЕ ЧЛМАЮЕОЙС - УЛПРМЕОЙЕ ЧЙТХУОЩИ ЮБУФЙГ ЙМЙ ПФДЕМШОЩИ ЛПНРПОЕОФПЧ ЧЙТХУПЧ Ч ГЙФПРМБЪНЕ ЙМЙ СДТЕ ЛМЕФПЛ, ЧЩСЧМСЕНЩЕ РПД НЙЛТПУЛПРПН РТЙ УРЕГЙБМШОПН ПЛТБЫЙЧБОЙЙ. чЛМАЮЕОЙС ТБЪМЙЮБАФУС РП ЧЕМЙЮЙОЕ, ЖПТНЕ, ЮЙУМЕООПУФЙ. иБТБЛФЕТОЩЕ СДЕТОЩЕ ЧЛМАЮЕОЙС ЖПТНЙТХАФУС Ч ЛМЕФЛБИ, ЪБТБЦЕООЩИ ЧЙТХУБНЙ ЗЕТРЕУБ, БДЕОПЧЙТХУБНЙ, ЗТЙРРБ, ВЕЫЕОУФЧБ, ПУРЩ Й ДТ.
- вМСЫЛЙ, ЙМЙ ОЕЗБФЙЧОЩЕ ЛПМПОЙЙ - ПЗТБОЙЮЕООЩЕ ХЮБУФЛЙ, УПУФПСЭЙЕ ЙЪ ДЕЗЕОЕТБФЙЧОЩИ ЛМЕФПЛ, ЛПФПТЩЕ ЧЙТХУЩ УРПУПВОЩ ПВТБЪПЧЩЧБФШ Ч НПОПУМПЕ ЛМЕФПЛ РПД БЗБТПЧЩН РПЛТЩФЙЕН. пОЙ ЧЙДОЩ ОЕЧППТХЦЕООЩН ЗМБЪПН ЛБЛ УЧЕФМЩЕ РСФОБ ОБ ЖПОЕ РТЙЦЙЪОЕООП ПЛТБЫЕООЩИ ОЕКФТБМШОЩН ЛТБУОЩН ЛМЕФПЛ. пДОБ ВМСЫЛБ УППФЧЕФУФЧХЕФ РПФПНУФЧХ ПДОПЗП ЧЙТЙПОБ. оЕЗБФЙЧОЩЕ ЛПМПОЙЙ ТБЪОЩИ ЧЙТХУПЧ ПФМЙЮБАФУС РП ТБЪНЕТХ, ЖПТНЕ. вМСЫЛППВТБЪПЧБОЙЕ ЙУРПМШЪХАФ ДМС ДЙЖЖЕТЕОГЙБГЙЙ, УЕМЕЛГЙЙ ЧЙТХУПЧ, Б ФБЛЦЕ ДМС ПРТЕДЕМЕОЙС ЙИ ЛПОГЕОФТБГЙЙ Ч ЙУУМЕДХЕНПН НБФЕТЙБМЕ. фЙФТ ЧЙТХУБ, ХУФБОПЧМЕООЩК ЬФЙН НЕФПДПН, ЧЩТБЦБАФ ЮЙУМПН ВМСЫЛППВТБЪХАЭЙИ ЕДЙОЙГ (впе) Ч 1 НМ.
- `гЧЕФОБС' РТПВБ. еУМЙ ЧЙТХУЩ ОЕ ТБЪНОПЦБАФУС Ч ЛХМШФХТЕ ЛМЕФПЛ, ФП ЦЙЧЩЕ ЛМЕФЛЙ Ч РТПГЕУУЕ УЧПЕЗП НЕФБВПМЙЪНБ ЧЩДЕМСАФ ЛЙУМЩЕ РТПДХЛФЩ, ЮФП ЧЕДЕФ Л ЙЪНЕОЕОЙА То УТЕДЩ Й ГЧЕФБ ЙОДЙЛБФПТБ ЖЕОПМПЧПЗП ЛТБУОПЗП ОБ ЦЕМФЩК. рТЙ РТПДХЛГЙЙ ЧЙТХУПЧ ОПТНБМШОЩК НЕФБВПМЙЪН ЛМЕФПЛ ОБТХЫБЕФУС, ЛМЕФЛЙ ЗЙВОХФ, Й УТЕДБ УПИТБОСЕФ УЧПК РЕТЧПОБЮБМШОЩК (ЛТБУОЩК) ГЧЕФ. фБЛЙН ПВТБЪПН, ЛТБУОЩК ГЧЕФ УТЕДЩ ХЛБЪЩЧБЕФ ОБ ОБМЙЮЙЕ ЧЙТХУБ Й РТЕЛТБЭЕОЙЕ ЦЙЪОЕДЕСФЕМШОПУФЙ ЛМЕФПЛ.
- зЕНБДУПТВГЙС - УРПУПВОПУФШ ЛХМШФХТ ЛМЕФПЛ, ЙОЖЙГЙТПЧБООЩИ ЧЙТХУБНЙ, БДУПТВЙТПЧБФШ ОБ УЧПЕК РПЧЕТИОПУФЙ ЬТЙФТПГЙФЩ ПРТЕДЕМЕООЩИ ЧЙДПЧ ЦЙЧПФОЩИ Й РФЙГ. зЕНБДУПТВГЙС РТПСЧМСЕФУС УЛПРМЕОЙЕН Ч ЧЙДЕ ЗТПЪДЕК ЬТЙФТПГЙФПЧ, БДУПТВЙТПЧБООЩИ ОБ ЙОЖЙГЙТПЧБООЩИ ЧЙТХУПН ЛМЕФЛБИ.
- йОФЕТЖЕТЕОГЙС - ОЕЛПФПТЩЕ ЧЙТХУЩ НПЦОП ПВОБТХЦЙФШ Ч ЛХМШФХТЕ ФЛБОЙ ФПМШЛП РП ОБМЙЮЙА ЙОФЕТЖЕТЕОГЙЙ. йУРЩФХЕНЩК ЧЙТХУ ЧЧПДЙФУС Ч ЛХМШФХТХ ЛМЕФПЛ РЕТЧЩН, ЮЕТЕЪ ОЕУЛПМШЛП ДОЕК ФХДБ ЦЕ ЧОПУСФ УФБОДБТФОХА ДПЪХ ЧЙТХУБ, ПВМБДБАЭЕЗП ЧЩТБЦЕООПК ГЙФПРБФЙЮЕУЛПК БЛФЙЧОПУФША ЙМЙ УРПУПВОПУФША ЧЩЪЩЧБФШ ЗЕНБДУПТВГЙА. рПУМЕ ПРТЕДЕМЕООПЗП ЙОЛХВЙТПЧБОЙС РТПЧЕТСАФ ОБМЙЮЙЕ ГЙФПРБФЙЮЕУЛЙИ ЙЪНЕОЕОЙК ЙМЙ ЗЕНБДУПТВГЙЙ, РПДФЧЕТЦДБАЭЙИ ТБЪНОПЦЕОЙЕ `ЧЩСЧМСАЭЕЗП' ЧЙТХУБ. пФУХФУФЧЙЕ Ч ЛХМШФХТЕ `ЧЩСЧМСАЭЕЗП' ЧЙТХУБ ЗПЧПТЙФ П ОБМЙЮЙЙ ЙУРЩФХЕНПЗП ЧЙТХУБ.
Существуют следующие основные методы индикации вируса в культуре клеток: по цитопатическому эффекту или цитопатическому действию (ЦПЭ, ЦПД); по положительной реакции гемадсорбции (РГАд); по образованию бляшек; по обнаружению внутриклеточных включений; по выявлению вирусов в реакции иммунофлуоресценции (РИФ); по обнаружению интерференции вирусов; по подавлению метаболизма клеток (цветная проба); электронной микроскопией и др.
ЦПД Наиболее широко и часто о размножении вируса в культуре клеток судят по цитопатическому эффекту или цитопатическому действию. ЦПД называются любые изменения клеток в культуре клеток под влиянием размножающегося в них вируса. Физиологические изменения клеток установить довольно сложно, а морфологические изменения обнаруживаются довольно легко. Для этого достаточно положить на предметный столик микроскопа пробирку или матрас слоем клеток вверх и, используя малое увеличение (объектив х8-10, окуляр х7-10), осмотреть слой. Полезно сравнить клетки, зараженные вирусом, с такими же клетками в пробирке, не подвергавшимися заражению. В этом случае практически любые наблюдаемые в микроскоп отличия зараженной культуры клеток от контрольной можно считать проявлением ЦПД. Эти отличия могут захватывать весь монослой или отмечаться только в виде небольших очажков измененных клеток в слое нормальных клеток. Интенсивность ЦПД выражается тем, какая часть клеточного монослоя изменена вирусом. Хотя общепринятой системы оценки интенсивности ЦПД нет, ее часто оценивают в крестах или баллах. Так, если изменению (по сравнению с контролем) подвергся весь монослой в пробирке или матрасе, ЦПД оценивают на четыре креста, если 3 /4 - на три, если V2 - на два креста, V4 - на один крест. Но эти оценки весьма условны.
Наиболее существенно различаются между собой три формы ЦПД: фрагментация клеток, округление клеток, симпластообразование.
Фрагментация - разрушение клеток на отдельные фрагменты, которые отделяются от стекла и переходят в культуральную жидкость в виде клеточного детрита (вирус везикулярного стоматита).
Округление - потеря клетками способности прикрепляться к стеклу, вследствие чего клетки, обычно распластанные по стеклу, принимают шаровидную форму, отделяются от стекла и свободно плавают в культуральной жидкости, где и погибают (энтеровирусы, аденовирусы и др.).
Симпластообразоеание - растворение клеточных оболочек, вследствие чего цитоплазмы соседних клеток сливаются, образуя одно целое, в котором располагаются (главным образом по периферии) ядра клеток. Такие образования из цитоплазматической массы с многими клеточными ядрами называются симпластами (гигантские многоядерные клетки).
РГАд. Гемадсорбция - соединение эритроцитов с поверхностью пораженных вирусом клеток - впервые была обнаружена Фогелем и Щелоковым (1957) на культуре ткани, инфицированной вирусом гриппа. В основе этого явления лежит родство рецепторов вируса, находящихся на поверхности пораженной клетки, с рецепторами эритроцита, что приводит к их взаимному сцеплению аналогично реакции гемагглютинации. Преимущество этой реакции состоит в том, что она становится положительной еще до появления отчетливых цитопатиче- ских изменений в инфицированных клетках.
Методика РГАд состоит в следующем. На 3-4-й день после инфицирования клеток берут две пробирки с одинаковой культурой клеток, из которых одна заражена вируссодержащим материалом, а вторая контрольная. Из обеих пробирок сливают культуральную жидкость и вносят в обе по 2-3 капли 0,5-процентной суспензии отмытых эритроцитов. Обе пробирки оставляют на 5-10 мин так, чтобы эритроциты были на поверхности клеток (кладут горизонтально на стол), а затем слегка споласкивают физраствором и исследуют под микроскопом (малое увеличение). В контрольной пробирке эритроциты полностью удаляются с физраствором, а некоторые из оставшихся плывут вместе с жидкостью. Если в зараженной пробирке эритроциты не удалились с физраствором и не плывут, а прикреплены к поверхности клеток, следует считать РГАд положительной.
В зависимости от вируса и вида клеток расположение эритроцитов может быть трояким:
Каждый вирус способен адсорбировать эритроциты крови животных определенных видов.
Самостоятельная работа студентов
- 1) Студенты проводят микроскопию клеточных культур (живая культура клеток, фиксированная).
- 2) Изучают методы обнаружения вирусов в зараженных клеточных культурах (по ЦПД, по гемадсорбции эритроцитов на монослое, по обнаружению бляшек, по обнаружению телец-включений).
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла.
Частичная дегенерация культур клеток может протекать по следующим типам:
- гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
- очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
- симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х 200
Индикация вирусов с помощью реакции гемадсорбции (РГад).
Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.
Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.
Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому - Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).
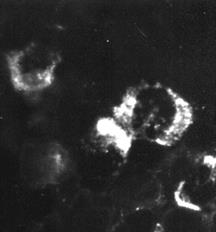
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х 900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри. При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов - поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов - одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
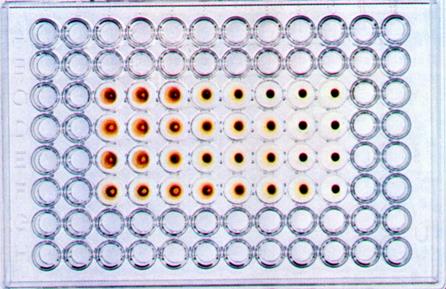
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов проводится с помощью следующих методов .
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте - подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 37 0 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку.
Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 37 0 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к двукратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (4 0 , 20 0 , 37 0 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
- выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
- электронно-микроскопическое изучение вирусов (см. выше).
гемадсорбция - адсорбция на клетках эритроцитов, добавленных к культуре ткани, инфицированной вирусом парагриппа (демонстрация);
подавление метаболизма клеток вирусом полиомиелита (цветная проба –демонстрация). Клетки культуры ткани в процессе их культивирования вырабатывают кислые продукты метаболизма, при этом цвет среды, в которую добавлен индикатор метиловый красный, изменяется с красного на желтый. Клетки, инфицированные вирусом, разрушаются и цвет среды не меняется, оставаясь красным;
интерференция вирусов - отсутствие репродукции вируса в культуре ткани, инфицированной другим вирусом, не обладающим цитопатическим эффектом (демонстрация).
3. Выделение и индикация вирусов на ркэ.
обнаружение вирусов на хорион-аллантоисной оболочке РКЭ, зараженного вирусом герпеса (микроскопия мазков-отпечатков, окрашенных по Романовскому-Гимза – демонстрация));
выявление вируса гриппа в аллантоисной жидкости зараженного РКЭ с помощью реакции гемагглютинации (РГА) с эритроцитами кур. Куриные эмбрионы вскрывают, аллантоисную жидкость отсасывают пастеровской пипеткой, титруя ее в лунках пластикового планшета в разведениях от 1:10 до 1:512 в объеме 0,5 мл. В каждую лунку добавляют 0,5 мл 1% взвеси эритроцитов кур, выдерживают при комнатной температуре в течение 40 минут, после чего производят учет. Контролями служат незараженная аллантоисная жидкость и физиологический раствор. Наличие гемагглютинации в опыте при отсутствии ее в контролях указывает на наличие вируса в исследуемой жидкости.
4. Идентификация вирусов:
выявление типа вируса гриппа в хорион-аллантоисной жидкости РКЭ с помощью РТГА. (нейтрализация гемагглютинирующей активности различных типов вируса гриппа А, В, С соответствующими противогриппозными диагностическими сыворотками). Отсутствие гемагглютинации с одной из противогриппозных сывороток указывает на тип вируса гриппа;
выявление вирусов с помощью реакции преципитации в геле (демонстрация). В одну из лунок в агаровом геле вносят исследуемый материал от больного, а в другую – диагностическую сыворотку, содержащую соответствующие антитела. В месте встречи вируса и антитела формируется преципитат в виде белых линий;
реакция нейтрализации (демонстрация). Производят заражение РКЭ, культур клеток или экспериментальных животных (в зависимости от свойств вируса) смесью вируссодержащего материала (материал от больного, хорион-аллантоисная жидкость РКЭ, надосадочная жидкость зараженной культуры ткани) и соответствующих диагностических противовирусных сывороток. В качестве контроля используется биологический объект (РКЭ, культура ткани, экспериментальное животное), зараженный только вируссодержащим материалом. Контрольное животное, в организме которого вирус не нейтрализуется антителами сыворотки, погибает. Опытное животное выживает, так как антитела сыворотки нейтрализуют вирус.
5. Серологический метод диагностики вирусных инфекций(выявление антител в сыворотке крови больных - ретроспективная диагностика)
РСКпри аденовирусной инфекции. Ставится с целью определения антител и их титра в сыворотке крови больных на 2 и 8 день болезни.
Цветная пробапри полиомиелите (демонстрация). Сущность реакции состоит в изменении цвета среды, на которой культивируется культура ткани, в результате выделения кислых продуктов метаболизма, что приводит к изменению исходного красного цвета индикатора среды (феноловый красный) на желтый. У зараженных вирусом клеток выделения метаболитов не происходит, поэтому изменения цвета среды не происходит. Схема опыта: к разным разведениям исследуемой сыворотки добавлено 0,1 мл вакцинного штамма вируса полиомиелита, смесь внесена в пробирки с культурой ткани. После 8-10-дневной инкубации в термостате проводят учет реакции по наибольшему разведению сыворотки, при котором наблюдается изменение цвета среды с красного на желтый.
РНГА (демонстрация) - определение антител к вирусу гепатита В.
PТГA (демонстрация)- определение антител в сыворотке крови больного клещевым энцефалитом. Реакция основана на способности некоторых вирусов склеивать эритроциты птиц, морских свинок, I (0) группы крови человека. К известному гемагглютинирующему вирусу добавляют исследуемую сыворотку крови. Если в исследуемой крови содержатся антитела, они нейтрализуют гемагглютинирующую активность вируса и агглютинации вирусов не наступает. Схема опыта: к разным разведениям сыворотки крови больного добавляют антиген вируса клещевого энцефалита и взвесь эритроцитов. После экспозиции в течение 40 мин проводят учет реакции по наибольшему разведению сыворотки крови больного, вызвавшему торможение агглютинации эритроцитов.
ИФА (демонстрация)– определение антител к ВИЧ.
После изучения темы студент должен знать: теоретические основы общей вирусологии (репродукция, генетика вирусов, особенности вирусных инфекций и противовирусного иммунитета), методы культивирования, индикации и идентификации вирусов, серологический метод диагностики вирусных инфекций.
Изучив тему, студент должен уметь: выполнять основные методы индикации и идентификации вирусов, трактовать результаты серологических исследований при вирусных инфекциях.
Тема 14. ВИРУСЫ - ВОЗБУДИТЕЛИ ГРИППА И ОРВИ. ПАРАМИКСОВИРУСЫ - ВОЗБУДИТЕЛИ КОРИ И ЭПИДЕМИЧЕСКОГО ПАРОТИТА. ВИРУСЫ, ПОРАЖАЮЩИЕ КОЖУ И СЛИЗИСТЫЕ ОБОЛОЧКИ (ПОКСВИРУСЫ, ГЕРПЕСВИРУСЫ). КОРОНАВИРУСЫ
Цель занятия:разбор биологических свойств возбудителей гриппа, ОРВИ, кори и эпидемического паротита, покс- и герпесвирусов, освоение методов лабораторной диагностики, профилактики и лечения указанных инфекций.
Для количественного накопления вирусов наиболее удобную систему представляют культуры клеток. Первые попытки культивирования клеток животных вне организма относятся к концу прошлого столетия. Эти отрывочные наблюдения указывали на возможность сохранения жизнеспособности тканей и клеток в искусственных условиях и положили начало глубоким научным исследованиям тканевых культур.
Тканевые культуры давно нашли применение для решения различных вопросов биологии и медицины. Однако лишь успехи в области вирусологии, достигнутые с помощью тканевых культур, явились мощным стимулом их развития до современного уровня.
Культивирование вирусов помогает решить ряд теоретически проблем, связанных с изучением особенностей взаимодействия "вирус-клетка". Кроме того решение целого ряда прикладных задач, связанных с диагностикой и производством препаратов для профилактики вирусных инфекций невозможно без накопления вируссодержащего сырья.

-
Более 80 курсов для обучения Всего 20 минут в день на занятия Персональный преподаватель
Индикация вирусов – лабораторный процесс установления присутствия неидентифицированных вирусов в исследуемом материале или в системе культивирования вирусов. Осуществляется путем электронной микроскопии, выявления цитопатического действия (ЦПД) и образования включений, реакциями гемагглютинации, гемадсорбции, гемолиза, присутствия бляшек на ХАО КЭ и кре клеток под агаровым покрытием, признаков экспериментальной инфекции.
Для культивирования вирусов используют культуры клеток, куриные эмбрионы и чувствительных лабораторных животных. Эти же методы используют и для культивирования риккетсий и хламидий — облигатных внутриклеточных бактерий, которые не растут на искусственных питательных средах.
Культуры клеток. Культуры клеток готовят из тканей животных или человека. Культуры подразделяют на первичные (неперевиваемые), полуперевиваемые и перевиваемые.
Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчения ткани, разъединения клеток путем трипсинизации, отмывания полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост, например в среде 199 с добавлением телячьей сыворотки крови.
Перевиваемые культуры в отличие от первичных адаптированы к условиям, обеспечивающим им постоянное существование in vitro, и сохраняются на протяжении нескольких десятков пассажей.
Перевиваемые однослойные культуры клеток приготовляют из злокачественных и нормальных линий клеток, обладающих способностью длительно размножаться in vitro в определенных условиях. К ним относятся злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Нер-3 (из лимфоидной карциномы), а также нормальные клетки амниона человека, почек обезьяны и др.
К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом, типичный для соматических клеток используемой ткани. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых.
О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически и характеризуется морфологическими изменениями клеток.
Характер ЦПД вирусов используют как для их обнаружения (индикации), так и для ориентировочной идентификации, т. е. определения их видовой принадлежности.
Один из методов индикации вирусов основан на способности поверхности клеток, в которых они репродуцируются, адсорбировать эритроциты — реакция гемадсорбции. Для ее постановки в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты.
Другой метод — реакция гемагглютинации (РГ). Применяется для обнаружения вирусов в культуральной жидкости культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона.
Количество вирусных частиц определяют методом титрования по ЦПД в культуре клеток. Для этого клетки культуры заражают десятикратным разведением вируса. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических доз.
Более точным количественным методом учета отдельных вирусных частиц является метод бляшек.
Метод ПЦР (полимеразная цепная реакция) – принцип контролируемого умножения копий ДНК искомого микроорганизма
Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток.
Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям.
Для получения чистых культур риккетсий, хламидий и ряда вирусов в диагностических целях, а также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. О размножении упомянутых микроорганизмов судят по морфологическим изменениям, выявляемым после вскрытия эмбриона на его оболочках.
О репродукции некоторых вирусов, например гриппа, оспы, можно судить по реакции гемагглютинации (РГА) с куриными или другими эритроцитами.
К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие в нем большого количества белков и других соединений, затрудняющих последующую очистку риккетсий или вирусов при изготовлении различных препаратов.
Лабораторные животные. Видовая чувствительность животных к определенному вирусу и их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки — к вирусам Коксаки).
Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования.
Лизис (от греч. λύσις) — растворение, разрушение клеток и их систем, в том числе микроорганизмов, под влиянием различных агентов, например ферментов, бактериолизинов, бактериофагов, антибиотиков. Также, в медицинской практике может обозначать период постепенного и медленного падения температуры при инфекционных заболеваниях; антоним термину кризис.
Нуклеи́новые кисло́ты (от лат. nucleus — ядро) — высокомолекулярные органические соединения, биополимеры (полинуклеотиды), образованные остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Але́ксис Карре́ль (фр. Alexis Carrel) (28 июня 1873, Сент-Фуа-ле-Лион — 5 ноября 1944, Париж) — французский хирург, биолог, патофизиолог и евгенист, лауреат Нобелевской премии по физиологии и медицине в 1912 году.
Читайте также:


