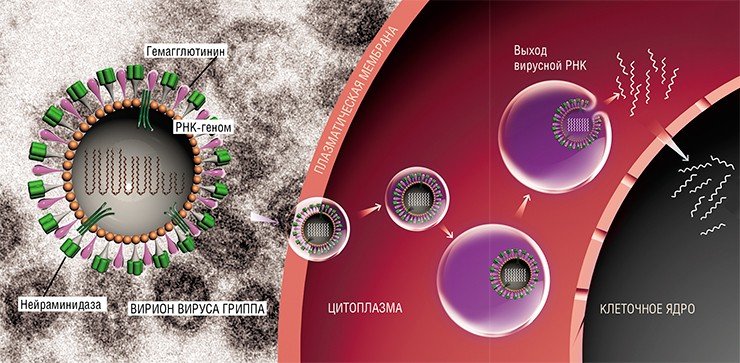
Липидная оболочка вируса гриппа
Природа создала множество биологических наноустройств и наномашин, элементы которых могут быть перепрограммированы для решения задач современной биологии и медицины. Одна из областей их применения – биофармацевтика. Молекулы белка, ДНК, РНК и их комплексы успешно применяются для конструирования терапевтических препаратов и вакцин. Это основа медицины будущего, которая будет базироваться на применении интеллектуальных лекарств, избирательно действующих на инфекционные агенты или на биополимеры, определяющие функционирование клеток человека
Широкое использование вирусов обусловлено их уникальным строением и образом жизни: они полностью инертны вне организма хозяина и не имеют клеточного строения. Структура их генома очень разнообразна: вирусы могут содержать одну или несколько молекул РНК или ДНК, которые могут принимать линейную, кольцевую или сегментированную форму.
Роль клеточного ядра, защищающего геном вируса, выполняет капсид, состоящий из структурных белков и ферментов. Более сложно организованные вирусные частицы могут иметь дополнительные оболочки – суперкапсиды. Эти липопротеидные структуры включают в себя гликопротеины – белки, взаимодействующие с поверхностными клеточными рецепторами, что обеспечивает проникновение вирусов внутрь заражаемой клетки. Вирус может содержать более одного типа гликопротеинов, например, у вируса гриппа их два: гемагглютинины и нейраминидаза.
Природные наноконтейнеры
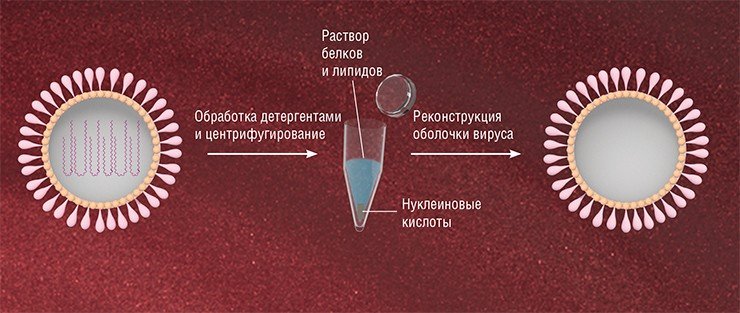
Так возникла идея решить эту проблему с помощью виросом – вирусных частиц, освобожденных от генетического материала, но содержащих поверхностные гликопротеины. Подобные частицы обладают важным свойством: сохраняют способность избирательно связываться с определенными клетками, доставляя в них свое содержимое.
Возможность доставки лекарственных средств с помощью виросом была показана на примере подавления синтеза белков вируса гепатита С в организме животных. В виросомы, сделанные на основе вируса Сендай, заключили короткие шпилечные РНК, способные ингибировать наработку белка вируса гепатита С в зараженных клетках. В результате внутривенного введения такого препарата удалось эффективно снизить количество исследуемого вирусного белка в клетках печени больных мышей (Subramanian et. al., 2009).
Безопасные вакцины
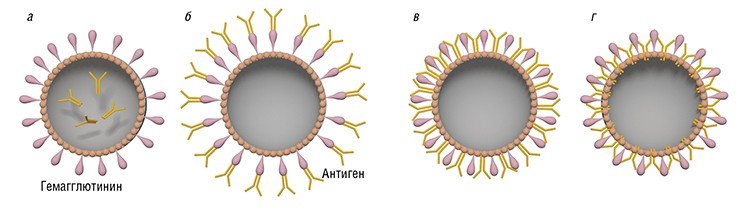
Виросомы могут применяться в качестве вакцин не только против вирусов, но и других патогенов. Так, у мышей происходит наработка антител против возбудителя малярии после введения им виросом на основе вируса гриппа, несущих на поверхности синтетические пептиды, соответствующие фрагментам белков плазмодия (Okitsu et al., 2008). Эффективные вакцинирующие препараты были разработаны на основе виросом, содержащих дифтерийный и столбнячный токсины. Сравнение действия таких препаратов и анатоксинов (токсинов, вызывающих иммунный ответ, но не проявляющих токсикологических свойств и служащих традиционными вакцинами против дифтерии и столбняка) показало, что в первом случае антитела нарабатываются более эффективно (Zubrrigen & Gluck, 1999).
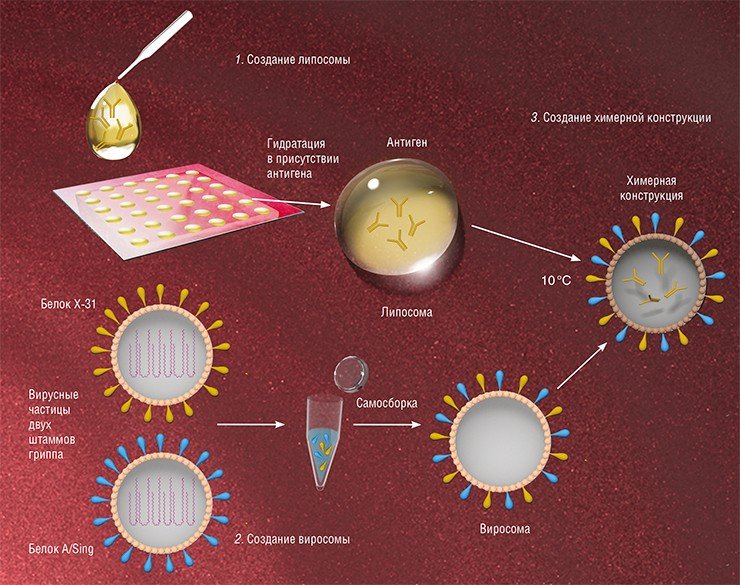
Виросомы можно использовать и для иммунотерапии онкологических заболеваний – доставки в опухоль ассоциированных с раком антигенов в виде плазмидной ДНК или коротких пептидов. Такие виросомы способны активировать клетки иммунной системы даже более эффективно, чем антиген в нативном виде. В экспериментах на животных было показано, что антиген, специфичный для клеток меланомы Melan-A, доставляемый в виросомах на основе вируса гриппа, успешно проникает в плазматические дендритные клетки иммунной системы (популяция антигенпрезентирующих клеток крови). В результате происходит более эффективная активация Т-клеток, способных уничтожить раковые клетки, чем при введении свободного пептида. Этот эффект, по-видимому, обусловлен хорошей защищенностью антигена, находящегося в виросомах (Angel et al., 2007).
Использование виросом в терапии болезней человека и животных имеет существенные достоинства, главные из которых – нетоксичность и совместимость с большинством лекарственных средств. Кроме того, липидная оболочка обеспечивает надежную защиту заключенного в виросомах материала от преждевременной деградации. С помощью виросом-опосредованной терапии уже удалось добиться весьма многообещающих результатов. Некоторые созданные на их основе препараты, в основном вакцины, находятся на разных стадиях доклинических и клинических испытаний. К их числу относятся интраназальные вакцины против вируса гриппа, вакцина против РСВ-вируса, ВИЧ-инфекции.
Примером коммерчески доступных виросомных вакцин является препарат Инфлексал производства Швейцарии, который представляет собой виросомы, содержащие антигены против вирусов гриппа типов А и В. В последнее десятилетие именно Швейцария занимает лидирующие позиции по числу средств, вкладываемых в исследование и разработку препаратов на основе виросом.
На сегодняшний день в мире можно выделить несколько групп, занимающихся доставкой терапевтических нуклеиновых кислот, в том числе и малых интерферирующих РНК (siRNA), в клетки млекопитающих с помощью вирососм (de Jonge et al., 2006). Основные затруднения, с которыми приходится сталкиваться при приготовлении таких виросомных препаратов, связаны с эффективностью включения препарата в состав виросом, а также адресной доставкой в определенные типы клеток. Сегодня в Институте химической биологии и фундаментальной медицины СО РАН (Новосибирск) ведутся работы по получению виросом стандартного качества со стабильными свойствами, в том числе обладающих способностью к адресной доставке терапевтических нуклеиновых кислот. Уже разработаны методы включения этих макромолекул в оболочки вируса (Власов и др., 1988, 1989). В дальнейшем планируется создать виросомные препараты, содержащие терапевтические нуклеиновые кислоты, и оценить их воздействие на различные типы раковых клеток человека.
Власов В. В., Иванова Е. М., Кренделев Ю. Д. и др. Оболочки вируса Сендай и тени эритроцитов – мембранные переносчики для введения реакционноспособных производных олигонуклеотидов в клетки // Биополимеры и клетка. 1989. Т. 5. № 4. Р. 52—58.
Власов В. В., Кренделев Ю. Д., Овандер М. Н. и др. Эффективный метод включения ДНК в реконструированные оболочки вируса Сендай // Биополимеры и клетка. 1988. Т. 4. № 5. Р. 250—254.
Шамшева О. В., Ртищев А. Ю.. Ультрикс – отечественная вакцина нового поколения // Педиатрия. 2014. Т. 93. № 6. P. 121—124.
Angel J., Chaperot L., Molens J. et al. Virosome-mediated delivery of tumor antigen to plasmacytoid dendritic cells // Vaccine. 2007. V. 25. P. 3913—3921.
de Jonge J., Holtrop M., Wilschut J. et al. Reconstituted influenza virus envelopes as an efficient carrier system for cellular delivery of small-interfering RNAs // Gene Therapy. 2006. V. 13. P. 400—411.
Okitsu S. L., Mueller M. S., Amacker M. et al. Preclinical profiling of the immunogenicity of a two-component subunit malaria vaccine candidate based on virosome technology // Human Vaccines. 2008. V. 4 N. 2. Р. 106—114.

Грипп и ОРВИ по-прежнему остаются одной из актуальнейших медицинских и социальных проблем нашего общества в силу высокого удельного веса в инфекционной патологии, риска развития тяжелых осложнений, обострений хронических болезней, составляя до 90% от числа всех инфекций.
На сегодняшний день известно более 200 видов респираторных вирусов, вызывающих гриппоподобные заболевания у человека. В эту этиологическую группу входят вирусы парагриппа, аденовирусы, вирусы гриппа А и В, респираторно-синцитиальный вирус, коронавирусы, риновирусы и др.
В мире ежегодно гриппом заболевают до 20% людей. Наибольшую опасность грипп представляет для детей младшего возраста, пожилых людей и людей, страдающих онкологическими и различными хроническими заболеваниями [5], которые чаще всего подвержены осложнениям гриппа, в т. ч. фатальным.
В начале 1930-х гг. были открыты и идентифицированы возбудители гриппа, позднее были выделены 3 типа этих вирусов: А, В и С.
Вирус гриппа А вызывает заболевание средней или тяжелой степени тяжести, поражает как человека, так и животных, ответственен за развитие тяжелых эпидемий и пандемий.
Вирус гриппа В циркулирует только в человеческой популяции и чаще вызывает заболевание у детей. Обычно является причиной локальных вспышек и эпидемий, иногда охватывающих одну или несколько стран, и не вызывает пандемии.
Вирус гриппа С изучен мало, поражает только человека. Симптомы болезни, вызванные вирусом гриппа С, обычно протекают очень легко либо не проявляются вообще, а также, как правило, не вызывают эпидемий и не приводят к серьезным последствиям.
Строение вирусов гриппа всех трех типов сходно. Липидная оболочка вируса содержит гликопротеиды -- Н и N, образующие шипы на ее поверхности. Гемагглютинин обеспечивает связь вируса с рецепторами клетки, способствуя его проникновению в клетку, а нейраминидаза, наоборот, рецепторы разрушает, обеспечивая освобождение вируса из клетки по окончании цикла его размножения и поражение других клеток.
По АГ-вариантам поверхностных гликопротеидов Н и N выделяют подтипы вируса гриппа. Наибольшее значение имеют три основных: Н1, Н2 и Н3 и из 10 подтипов N вируса А -- два основных: N1 и N2. Среди штаммов вируса гриппа В и С подтипы не выделяются.
Частичная антигенная изменчивость поверхностных гликопротеидов вируса (точечные мутационные процессы) -- антигенный дрейф приводит к развитию эпидемии.
Крупная или полная замена одного из подтипов Н -- реже N -- на другой называется шифтом и приводит к развитию пандемии гриппа. (Примером антигенного шифта может служить изменение подтипа вируса А с Н1N1 на Н2N2, вызвавшее тяжелую пандемию гриппа в США в 1957 г., средняя летальность при которой была превышена на 70 000 случаев. Антигенный шифт стал также причиной развития пандемии гриппа в 1968 и 1977 гг.)
В клиническом течении гриппа выделяют несколько стадий.
1. Заражение
Происходит попадание вируса в организм ребенка и его внедрение в клетки слизистой. В этот период ребенок ничего не ощущает и его ничего не беспокоит.
3. Период клинических проявлений
В это время происходит массовый выход вирусов из клеток. Ребенок выделяет в окружающую среду огромное количество вирусов, особенно с чиханьем. При чиханье вирусы могут разноситься на расстояние до 10 м от больного ребенка. Клинически этот период характеризуется слабостью, сонливостью, ребенок вялый, адинамичный, появляется мышечная слабость, болезненность мышц, ломота в суставах и костях, повышается температура тела, глаза слезятся, болят, из носа начинает выделяться слизь. Температура в этот период обычно не очень большая -- 37,6--38,0 °С, однако возможны и резкие подъемы температуры тела до 39 °С. Температура имеет волнообразный характер, поднимается больше к вечеру и связана с периодическим выходом вирусов из клетки. Длится этот период 3--5 дней.
4. Микробно-вирусный период
При гриппе, который длится более 3 дней с высокой температурой тела (38 ºС и выше), защитные свойства организма начинают истощаться. Это позволяет бактериям, которые постоянно находятся в нашем организме, начать активно размножаться. В этот период количество вируса в организме начинает снижаться, однако его место начинают занимать бактерии. Температура в этот период теряет свою волнообразность, становиться постоянной, поднимается до более высоких цифр (38,5--39,5 °С). Отделяемое из носа становится более густым, появляется кашель. Ломота в суставах и костях проходит, однако сохраняется общая слабость и мышечная вялость. Этот период может протекать длительно, его продолжительность и исход зависят от проводимого лечения.
5. Исход заболевания
После проведенного лечения ребенок может либо выздороветь, либо заболевание примет иную форму, например перейдет в пневмонию. Выздоровление ребенка возможно на любом из периодов заболевания, все зависит от иммунитета ребенка и проводимого лечения. Так, после попадания вируса в организм ребенка его иммунные клетки могут полностью уничтожить все вирусные частицы, и заболевание даже не разовьется, однако это может произойти только в том случае, если организм имеет иммунитет именно к тому штамму вируса гриппа, который проник в организм.
Огромное количество вирусов имеют те же сходные симптомы, что и вирус гриппа, однако это не грипп (табл. 1). Так, например, аденовирусная инфекция проявляется покраснением глаз, слезотечением, насморком со слизистым отделяемым, повышением температуры тела до 37--38 °С, слабостью, мышечной болью. Если сравнить эти симптомы с симптомами гриппа, можно заметить явное сходство между ними. Без анализов точный диагноз грипп поставить нельзя, поэтому констатируют ОРВИ.
| Таблица 1. Сравнительная характеристика гриппа с другими ОРВИ | ||
| Симптомы | ОРВИ | Грипп |
| Начало | Постепенное | Всегда острое. Больные, как правило, могут назвать час, когда почувствовали, что больны |
| Лихорадка | Температура повышается незначительно, редко выше 38,5 °С | Температура в течение нескольких часов достигает максимальных значений (39--40 °С и даже выше). Высокая температура держится 3--4 дня |
| Симптомы интоксикации | Интоксикация выражена слабо, общее состояние обычно не страдает | Быстро нарастают симптомы интоксикации: озноб, обильное потоотделение, сильная головная боль в лобно-височной области, боль при движении глазных яблок, светобоязнь, головокружение, ломота в мышцах и суставах |
| Насморк и заложенность носа | Частый симптом, преобладающий | Обычно присутствует лишь небольшая заложенность носа, которая появляется ко второму дню болезни |
| Катаральные явления (боль в горле, покраснение) | Обычный симптом, почти всегда сопровождает простуду | В первые дни болезни выявляется не всегда, обычно гиперемированы задняя стенка глотки и мягкое небо |
| Кашель, ощущение дискомфорта в груди | Слабо или умеренно выражены, часто отрывистый, сухой кашель, который проявляется с самого начала заболевания | На 2-е сут. болезни часто возникает мучительный кашель, боль за грудиной по ходу трахеи, появляющиеся в результате поражения слизистой оболочки |
| Чиханье | Частый симптом | Бывает редко |
| Гиперемия слизистой оболочки глаз | Бывает редко, чаще при наслоении бактериальной инфекции | Довольно частый симптом |
| Астенический синдром | После выздоровления выражен незначительно | Утомляемость, слабость, головная боль, раздражительность, бессонница могут сохраняться на притяжение 2--3 нед. |
Унифицированной классификации гриппа не существует. Тем не менее выделяют три основных формы гриппа:
- типичная форма, характеризуется типичными клиническими проявлениями гриппа, протекающими с умеренным токсикозом и катаральными симптомами;
- атипичная форма, характеризуется отсутствием лихорадки и катаральных явлений;
- молниеносный грипп, характеризуется катастрофическим развитием токсикоза, геморрагического синдрома и других осложнений.
Степень тяжести гриппа определяется выраженностью токсикоза и признаков поражения различных органов и систем, в связи, с чем выделяют легкую, среднетяжелую и тяжелую форму.
Можно выделить следующие осложнения гриппа (по С.Г. Чешик, 2005):
• Органы дыхания: бронхит, бронхиолит (редко), ларинготрахеит, острый ларинготрахеит с острым стенозом гортани, пневмония, обострение хронического бронхита, обострение бронхиальной астмы.
• ЛОР-органы: ангина, острый риносинусит, обострение хронического риносинусита.
• Нервная система: фебрильные судороги, нейротоксический синдром, синдром Рейе, вторичный бактериальный менингит, энцефалит (редко).
• Другие осложнения: синдром диссеминированного внутрисосудистого свертывания, инфекции мочевыводящих путей, миокардит (редко), абдоминальный синдром (боли в животе, рвота).
Среди методов терапии гриппа можно выделить три основных:
2. Симптоматическая неспецифическая терапия направлена на устранение симптомов гриппа и его осложнений. Выбор терапии определяется особенностью и тяжестью клинических проявлений гриппа и ОРВИ: жаропонижающие, отхаркивающие, противокашлевые средств, витамины, антибактериальная терапия и др., а также обильное питье.
3. Профилактическая терапия. Профилактика развития осложнений. К этому виду терапии можно отнести использование барьерных методов, санацию носоглотки, вакцинацию, применение иммуномодуляторов.
Как уберечь ребенка от заболевания? Самое важное правило: болезнь легче предупредить, чем лечить. По данным ВОЗ, на сегодняшний день единственным научно обоснованным методом борьбы с гриппом является специфическая вакцинопрофилактика. Эффективность вакцинации против гриппа имеет высокий уровень доказательности. Как уже было сказано выше, вирус гриппа очень изменчив, поэтому проводить вакцинацию необходимо ежегодно. Процедура иммунизации проводится в сентябре-октябре до начала эпидемии, поскольку для развития иммунного ответа необходимо несколько недель.
Основные усилия врача при лечении заболеваний должны быть направлены на:
• оптимизацию этиотропной терапии, в частности на борьбу с неоправданными назначениями антибактериальных и других средств,
• снижение тяжести клинических проявлений заболевания,
• нормализацию сниженных реакций иммунитета,
• профилактику осложнений.
При ОРВИ и гриппе организм ребенка страдает из-за вирусной атаки, чрезмерной нагрузки на иммунитет и неприятных симптомов.
При лечении ОРВИ, и в частности гриппа, серьезно встает проблема полипрагмазии. Для успешного излечения пациента врачу приходится назначать не менее трех препаратов одновременно, что приводит к серьезной медикаментозной нагрузке на ребенка. В связи с этим при выборе лекарственных средств и режимов терапии необходимо четко обосновать целесообразность их применения.
Нередко врачи переоценивают возможную роль бактериальной инфекции при вирусных заболеваниях и назначают антибиотики чаще, чем это необходимо. Микроорганизмы обладают столь мощной адаптационной способностью, что до сих пор не удалось создать ни одного антибиотика, к которому отдельные болезнетворные микроорганизмы не смогли бы выработать устойчивость. Во Франции, Италии, Греции, Португалии, Великобритании и других странах Европы уже не менее 30% всех возбудителей обладают резистентностью к антибиотикам, а в США достигают 60% всех патогенных микроорганизмов. До настоящего времени антибиотики назначаются у 70--80% пациентов с ОРВИ [4]. Необоснованное назначение антибактериальных препаратов при вирусных ОРЗ является причиной многих серьезных побочных эффектов:
- формирования лекарственной аллергии и псевдоаллергии к антибиотикам,
- развития устойчивых штаммов пневмотропных бактерий,
- нарушения микрофлоры кишечника,
- повышения затрат на лечение.
Итак, что делать, если же ребенок все-таки заболел?
1. Необходим строгий постельный режим. Во время заболевания на борьбу с инфекцией тратится большое количество энергии, поэтому дополнительный расход энергии на игры будет плохо сказываться на течении заболевания.
2. Обильное теплое питье. Во время разрушения клеток и выхода вирусов наружу образуется большое количество токсинов, которые попадают в кровоток. Они способствуют повышению температуры, развитию слабости. Чтобы снять эти симптомы, необходима жидкость, которая будет разбавлять токсины в крови и выводить их из организма.
3. Жаропонижающие препараты. Повышение температура тела -- это естественный процесс при заболевании: замедляется процесс размножения вирусов. Поэтому, если ребенок хорошо переносит температуру, нет головной боли, вялости, сонливости, не было ранее развития судорог на подъем температуры тела, жаропонижающие можно не применять до температуры 38,5 ºС. Следует соблюдать осторожность при назначении ацетилсалициловой кислоты при высокой температуре у детей до 12 лет во избежание развития такого осложнения, как синдром Рейе.
4. Для снятия интоксикации и улучшения самочувствия можно применять комбинированные препараты, такие как ТераФлю, Колдрекс, Фервекс. Принимать эти препараты лучше всего в первые три дня заболевания.
5. При насморке целесообразно применять солевые растворы для промывания носа: Аквалор, Аква Марис, Маример и пр.
6. При непродуктивном кашле обычно применяются противокашлевые средства центрального действия, при продуктивном влажном кашле -- отхаркивающие средства (Амброксол, Лазолван и др.).
7. Применение антибиотиков целесообразно только в том случае, если присоединяется бактериальная инфекция.
8. Противовирусные препараты: римантадин -- ингибитор активности ионных каналов М2-белка вируса гриппа, а также осельтамивир (Тамифлю) и занамивир (Реленза), ингибиторы нейраминидазы. Нейраминидаза вируса гриппа, модифицируя поверхностные гликопротеины клеток, способствует созданию новых мест для адгезии бактерий и развитию вторичной гнойной инфекции. Препараты этой группы избирательно подавляют активность нейраминидаз вирусов гриппа, что ограничивает проникновение вируса в клетку, выход вириона из клетки по окончании цикла размножения и поражение новых клеток.
Также при гриппе целесообразно применение препарата Изопринозин, т. к. он обладает иммуностимулирующим и противовирусным действием. Этот препарат восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, предупреждает снижение активности лимфоцитарных клеток под влиянием глюкокортикостероидов, нормализует включение в них тимидина. Изопринозин оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию IgG, гамма-интерферона, интерлейкинов ИЛ-1 и ИЛ-2, снижает образование провоспалительных цитокинов -- ИЛ-4 и ИЛ-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Препарат проявляет противовирусную активность in vivo в отношении вирусов гриппа А и В. Механизм противовирусного действия Изопринозина связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации некоторых вирусов, усиливает подавленный вирусами синтез мРНК лимфоцитов, что сопровождается подавлением биосинтеза вирусной РНК и трансляции вирусных белков, повышает продукцию лимфоцитами обладающих противовирусными свойствами альфа- и гамма-интерферонов. При комбинированном назначении усиливает действие альфа-интерферона, противовирусных средств ацикловир и зидовудин.
Изопринозин действует сразу в трех направлениях, что особенно актуально из-за проблемы полипрагмазии при лечении ОРВИ:
1. Обладает противовирусной активностью в отношении широкого спектра возбудителей ОРВИ.
2. Восстанавливает сниженную иммунную защиту, уменьшая риск вторичной инфекции.
3. Сокращает продолжительность заболевания и тяжесть симптомов, что позволяет поправиться пациенту быстро и без лишней медикаментозной нагрузки.
Лечение Изопринозином необходимо продолжать до момента исчезновения клинических симптомов и в течение еще 2 дней после этого. При необходимости длительность лечения может быть увеличена индивидуально под контролем врача.
Безусловно, обладая столь широким спектром терапевтических средств, следует также помнить о стандартных профилактических мероприятиях в период эпидемий гриппа и ОРВИ: избегать мест большого скопления людей, регулярно проветривать и обеззараживать воздух в помещениях, носить защитные маски.
Список литературы:
1. Беляков В.Д., Семененко Г.А., Шрага М.К. Введение в эпидемиологию инфекционных и неинфекционных заболеваний человека. М.: Медицина, 2001: 262.
2. Караулов А.В., Ликов В.Ф. Иммунотерапия респираторных заболеваний. Руководство для врачей. М., 2004.
3. Лусс Л.В. Современные подходы к комплексной терапии гриппа и ОРВИ. Эффективная фармакотерапия, 2014, 5-1: 36-42.
4. Лусс Л.В. Место иммуномодуляторов в педиатрической практике. Педиатрия, приложение Consilium Medicum, 2010, 3: 72-76.
5. Rothberg MB, Haessler SD. Complications of seasonal and pandemicinfluenza. Crit Care Med., 2010, 38 (4): 91-97.
Источник: Медицинский совет, № 14, 2014
Как вирус проникает в клетку
Юрий Александрович Чизмаджев, чл.-корр. РАН, д. х. н., проф. кафедры биофизики МГУ,
заведующий лабораторией биоэлектрохимии Института электрохимии им.А.Н.Фрумкина РАН.
Как известно, клетка содержит огромное количество мембранных образований — от изолированных везикул до непрерывной сети эндоплазматического ретикулума. И вся эта система находится в состоянии постоянной перестройки, которая включает множественные акты слияния и деления. Так, в аппарате Гольджи белок упаковывается в контейнеры-везикулы, которые сливаются с плазматической мембраной. Это завершает процесс экзоцитоза. Другой пример — слияние синаптической мембраны и секреторных пузырьков с нейромедиаторами, в результате чего и происходит передача нервного импульса, одного из основных переносчиков информации.
Доставка крупных частиц внутрь клетки осуществляется посредством эндоцитоза. Клетка заглатывает частицы из внешней среды, которые обволакиваются участком плазматической мембраны, образуется впадина, перемычка разрушается, и контейнер оказывается внутри клетки. Его разборка — это уже другая история, а нам остается подчеркнуть, что и эндоцитоз, и экзоцитоз опосредованы множеством белков, чьи природа и механизм действия не вполне установлены.
Кроме “полезного” слияния клетка сплошь и рядом переживает случаи слияния “вредного”. Например, когда ее атакует вирус, которому достаточно сказать: “Сезам, откройся!”, и липидная оболочка вируса сливается с плазматической мембраной. При этом формируется так называемая пора слияния, и вирусная ДНК или РНК начинают хозяйничать внутри клетки. Справедливости ради надо отметить, что уникальную способность вирусов “вскрывать сейфы” уже используют во благо организму. В генной терапии подбирают безвредные вирусы-взломщики, к которым пришивают полезный ген, способный помочь больной клетке.
Разобраться в физическом механизме слияния биологических объектов чрезвычайно трудно. Как всегда, в подобных случаях на помощь приходят модельные системы. Обращаясь в недавнее прошлое, следует подчеркнуть, что в середине 80-х были достигнуты впечатляющие успехи в изучении механизма слияния липидных бислоев [1]. Однако к середине 90-х выяснилось: интермедиаты этого процесса, принятые в теоретических моделях, имеют настолько высокую энергию, что его расчетная скорость, вопреки экспериментальным данным, ничтожно мала. Кроме того, хотя было доказано, что специальные белки играют ключевую роль в ходе слияния, оставалось неясным, что же они делают. Решению этих задач были посвящены экспериментальные и теоретические работы нашей лаборатории, которые проводились во второй половине 90-х.
Путь вируса в клетку
Мир вирусов весьма разнообразен. Общее для них то, что любой наследственный материал (в форме ДНК или РНК) бережно упакован в защитный скафандр из белков. Вирусные частицы (вирионы) отличаются по форме и размерам. Так, диаметр сферических вирионов — от 20 до 300 нм. Некоторые вирусы имеют дополнительную липидную оболочку, в которую включены специализированные белки, способствующие слиянию мембран. Такие вирусы называются оболочечными. Требования к липидно-белковой оболочке двойственны. С одной стороны, она должна уберечь наследственный материал от превратностей судьбы, а с другой — легко разрушаться, когда вирус начинает активную жизнь внутри клетки-жертвы.
Оболочечные вирусы проникают в клетку двумя путями. В первом случае вирус связывается с рецепторами клеточной поверхности, затем в результате эндоцитоза, везикулы, содержащие вирион, отпочковываются. В таком состоянии вирус упакован в дополнительную оболочку, образованную клеточной мембраной. От второй оболочки он освобождается при слиянии везикулы с эндосомой, в которой кислая среда активирует белки слияния и тем самым способствует объединению мембраны вириона с эндосомальной. В результате наследственный материал попадает в цитоплазму и может добраться до ядра. На первых стадиях этого процесса, включая проникновение в эндосому, вирус играет пассивную роль. Здесь используется обычный механизм эндоцитоза, причем доверчивая клетка даже не знает, какую опасность таит в себе этот “подарок судьбы”. И только оказавшись в эндосоме, вирус активируется и берет всю игру на себя, вызывая слияние своей оболочки с эндосомальной мембраной. Именно так действует всем известный вирус гриппа.
Два пути проникновения оболочечного вируса в клетку.
Слева — эндоцитоз и слияние в эндосоме: 1 — вирус, 2 — эндосома, 3 — ядро.
Справа — слияние с плазматической мембраной.
Другие вирусы, например вирус иммунодефицита человека (HIV), не нуждаются для активации в низких рН и проникают в клетку более простым путем, в ходе которого их оболочки сразу сливаются с плазматической мембраной, и наследственный материал оказывается к клетке. Теперь ему остается только добраться до ядра.
Таким образом, в любом случае ключевое событие в битве оболочечного вируса с клеткой — слияние его липидной оболочки с плазматической или лизосомальной мембраной. Именно этой важнейшей стадии инфицирования клетки и посвящен наш рассказ. Конкретно речь пойдет о вирусе гриппа А. Благодаря особенностям своего строения он оказался наиболее удобным объектом для экспериментального изучения механизма слияния.
Этот оболочечный вирус имеет примерно сферическую форму с диаметром около 0.13 мкм. В его центральной части находятся молекулы РНК и ряд белков, необходимых вирусу на первых стадиях жизни в клетке. Сердцевина вириона окружена оболочкой из белка М1, следом за ней располагается липидная мембрана. Белковая оболочка, утопленная в липидной мембране, напоминает рыболовную сеть, которая крепится на сваях. Размер ячеек в белковой сети примерно 4 ґ 4 нм 2 , так что такая крупная “рыба”, как комплекс РНК-белок, пройти сквозь них не может. Липидная оболочка формируется из плазматической мембраны инфицированной клетки при отпочковывании синтезируемого вируса. В этой мембране заякорены три белка: нейраминидаза (Н), ионный канал М2 и гемагглютинин (ГА). При закислении среды благодаря ионному каналу внутри вириона понижается рН, что приводит к разрушению белковой оболочки М1. Одновременно активируется гемагглютинин, главная составляющая “машины слияния”. В ходе ее работы мембраны вируса и клетки смыкаются, и в цитоплазму открывается путь для чужеродного генетического материала.
Схема вириона гриппа:
ГА — гемагглютинин, М2 — ионный канал, Н — нейраминидаза, М1 — белковая оболочка.
На поверхности вирусной оболочки гемагглютинин присутствует в виде тримеров. Каждая его молекула состоит из двух субъединиц: ГА1, обеспечивающей первичный контакт с клеткой-мишенью, и ГА2, отвечающей за слияние. В исходном, нейтральном, состоянии (при рН7) все тримеры ориентированы примерно перпендикулярно к поверхности мембраны, их протяженность
13 нм. Каждая молекула гемагглютинина прочно заякорена в своей мембране и, что очень важно, имеет в своем составе короткий (25 аминокислот) пептид, который при рН7 спрятан внутри тримера и локализован недалеко от основания белка. После уменьшения pH с 7 до 5 молекулы гемагглютинина глобально перестраиваются, и пептид слияния не просто выходит на свободу, а перемещается в самый верхний конец молекулы и проникает в мембрану жертвы.
Структура гемагглютинина в исходном (рН7) и в активном (рН5) состояниях.
Цветом отмечен пептид слияния, который в кислой среде меняет свою конформацию.
В нейтральной среде молекула гемагглютинина напоминает пружину, зажатую защелкой, роль которой играет пептид слияния, спрятанный в “гидрофобный карман” тримера. Но стоит снизить рН до 5, как пептид выходит из заточения и молекула ГА может перейти в новое конформационное состояние. Выделяющаяся при этом энергия, судя по измерениям, довольно велика, но еще не достаточна для сближения мембран клетки и вируса. Чтобы решить эту задачу, молекулы гемагглютинина действуют не поодиночке, а коллективно. Как показали эксперименты, в ходе взаимодействия вируса с клеткой-мишенью образуются розетки из шести—восьми тримеров, внутри каждой из которых находятся изогнутые липидные участки с радиусом
10 нм. С помощью электронно-микроскопических и электрофизиологических исследований удалось обнаружить такие локальные вспучивания, получившие название димплов [2].
Именно здесь, на верхушках димплов, начинается перестройка липидов, приводящая к образованию поры слияния. Теоретическая модель этого процесса [3] состоит в следующем: белки слияния, изгибая мембраны, не только сближают их, но и обеспечивают энергией, облегчая образование монослойной перемычки — сталка; липиды из удаленных монослоев деформируются без больших энергетических затрат. В результате образуются новые промежуточные структуры — низкоэнергетические интермедиаты, обеспечивающие слияние.
Образование димплов между мембранами эритроцитов и клеток, экспрессирующих гемагглютинин.
Вверху — граница мембран эритроцита и клетки, экспрессирующей ГА, рН 7.4;
внизу — то же, но рН 4.9 — видно большое количество контактных областей (цветная стрелка).
На врезке показана схема контакта.
Под слиянием клеток, вирусов или клеточных органелл понимается объединение ограниченных мембранами водных объемов и самих мембран. Для наблюдения за этим процессом используют растворимые в липиде флуоресцентные метки. Если такая метка изначально содержится в клетках А, то появление ее в клетках В говорит о слиянии. Правда, бывают случаи, когда происходит так называемое полуслияние, т.е. объединяются только внешние монослои клеток, сближенные в области локального контакта. Чтобы различить случаи полу- и полного слияния, в клетки А вводят водорастворимый краситель. Его перетекание из одних клеток в другие свидетельствует о полном слиянии с образованием поры, через которую осуществляется связь. Так в эксперименте изучают массовое слияние, например в суспензии вирусов и клеток. Однако возможности этой методики ограничены, с ее помощью трудно разобраться в деталях процесса, включая образование локального контакта, появление поры и ее развитие. Подобные задачи можно решать только с использованием более точного метода, позволяющего следить за одиночными объектами, т.е. с помощью методов флуоресцентной микроскопии и современной электрофизиологии. Впервые это было сделано при изучении экзоцитоза в тучных клетках с использованием микроэлектронной техники.
Однако вирусные частицы настолько малы, что непосредственно применить к ним микроэлектронную технику нельзя. И тут на помощь пришла генная инженерия. На основе фибробластов получены клетки (названные HAb2), которые содержат на своей плазматической мембране молекулы гемагглютинина. Они оказались прекрасной моделью вирусной частицы с диаметром порядка 10 мкм, на которой можно проводить электрические измерения.
Схема эксперимента по слиянию клетки HAb2 с эритроцитом,
мембрана которого окрашена флуоресцирующим липидным зондом.
В ходе развития поры слияния краска распространяется по мембране HAb2.
Электрический сигнал измеряется с помощью электродов и усилителя тока,
а перетекание зонда — с использованием флуоресцентного видеомикроскопа.
В типичном опыте по слиянию клетки HAb2 и эритроцита при закислении окружающего раствора до рН5 образуется пора. Через нее протекает емкостной ток, который заряжает эритроцит. Его изменение во времени отражает расширение поры слияния. Одновременно из мембраны эритроцита в мембрану HAb2 перетекает краситель. Сопоставляя две кривые (проводимости и интенсивности флуоресценции) в зависимости от времени, замечаем, что вторая значительно отстает от первой. Предполагается, что эта временная задержка вызвана белковой розеткой из тримеров гемагглютинина, которая образует своеобразный заслон потоку липидного зонда. Первичная пора слияния образуется в области липидных димплов. Следовательно, изменяя липидный состав мембран, можно воздействовать на весь процесс. При сближении липидных бислоев может образоваться перемычка между близлежащими монослоями (так называемый сталк), зародыш будущей поры. Вероятность его образования существенно зависит от липидного состава. Например, введение в монослои лизофосфатидилхолина (LPC), даже в небольших концентрациях, полностью ингибирует слияние. Эксперименты в системе HAb2—эритроцит показали, что лизофосфатидилхолин здесь столь же эффективен, как и в модельных липидных системах. Иными словами, пора слияния после введения LPC не возникает вообще, хотя, судя по появлению флуоресценции, монослои объединяются.
| Кривые проводимости поры (цветная) и интенсивности флуоресценции. Вверху — контроль, внизу — та же система, но с добавкой лизофосфатидилхолина. По оси ординат — проводимость, по оси абсцисс — время. |
Схема процесса слияния.
После понижения рН образуется розетка слияния (1),
которая способствует образованию локального мембранного контакта (2)
и перемычки, которая затем превращается в пору слияния (3, 4).
Однако любая модель всегда отличается от реального объекта. Мембрана клетки HAb2 имеет другой липидный состав, нежели мембрана вириона, различна и плотность гемагглютинина, а клетка HAb2 не содержит белков М1 и М2. Разработанная в нашей лаборатории методика позволяет изучать слияние одиночного вириона с бислойной липидной мембраной [5]. В нейтральную среду (буферный раствор с рН7) впрыскиваются вирионы, часть которых адсорбируется на бислое. После этого к плоской мембране прижимается микропипетка, заполненная раствором с рН5. Поскольку кончик пипетки имеет радиус
1 мкм, весьма вероятно, что внутри него, на липидном пятачке, окажется один или несколько вирионов, в мембрану которых включен флуоресцентный зонд в концентрации самогашения. Низкое рН внутри пипетки инициирует слияние, и зонд диффундирует в бислой. Возникающее при этом разбавление приводит к флуоресценции, которую можно регистрировать.
Схема экспериментальной установки. Подробности в тексте.
Электрические измерения показали, что наряду с латеральным потоком зонда возникает флуктуирующий электрический ток, который течет через пору слияния и какие-то проводящие структуры в мембране вируса. Специальными опытами доказано, что дело обстоит именно таким образом [6]. В этих экспериментах ионные каналы М2 блокировались амантадином, а закисление внутри вириона достигалось уменьшением рН (до 5) в нижнем отсеке ячейки. Очевидно, что при такой постановке опыта сразу после слияния протоны из нижнего отсека должны устремиться внутрь вириона через открывающуюся пору, что разрушит белковую оболочку из М1 даже при заблокированных каналах М2. Действительно, в этих условиях возникает электрическая активность, точно такая же, как при открытых М2 каналах. Значит, таким способом можно следить не только за эволюцией поры слияния в липидной мембране, но и за разрушением белкового каркаса. Это чрезвычайно существенно, так как выход генетического материала вируса в цитоплазму лимитируется обеими защитными оболочками — белковой и липидной.
Итак, сочетая методы электронной микроскопии и электрофизиологии, удалось обнаружить локальные мембранные контакты (димплы). Введение лизолипида ингибирует биологическое слияние, что доказывает: первым интермедиатом процесса, как и в модельных системах, служит перемычка (сталк).
Разработанная методика изучения слияния одиночных вирионов с липидными бислоями позволяет исследовать кинетику этого процесса, а модель слияния, использующая принципиально новые интермедиаты, решает проблему “энергетического кризиса”.
Выяснение роли липида и белка в таком процессе имеет не только познавательный интерес. В перспективе это важно для разработки новых методов антивирусной терапии.
Результаты были получены в ходе исследований, поддержанных грантами РФФИ:
№93-04-20590, №96-04-50779, №99-04-48427 и №02-04-48287.
1. Черномордик Л.В., Меликян Г.Б., Чизмаджев Ю.А. // Биол. мембраны. 1987. Т.4. С.117—164.
2. Frolov V.A., Cho M.-S., Bronk P. et al. // Traffic. 2000. ?1. P.6.
3. Kuzmin P.I., Zimmerberg J., Chizmadzhev Yu.A. et al. // PNAS. 2001. V.98. P.7235—7240.
4. Chernomordik L.V., Frolov V.A., Leikina E. et al. // The Journal of Cell Biology. 1998. V.140. P.1369—1382.
5. Максаев Г.И.,Самсонов А.В., Липатов А.С. и др. // Биол. мембраны. 2000. Т.17. С.312—323.
6. Максаев Г.И., Михалев И.И., Фролов В.А. // Биол. мембраны. 2001. Т.18. С.489—495.
Читайте также:


