Лечения рака вакцинами и вирусами
Ученые Калифорнийского университета в Сан-Франциско создали генетически модифицированный вирус, который убивает раковые клетки, а также стимулирует иммунную реакцию против опухоли. Об этом сообщается в пресс-релизе на MedicalXpess.
Онколитический вирус Pexa-Vec представляет собой модифицированную версию вируса коровьей оспы. В него добавлен ген, кодирующий небольшую пептидную молекулу, которая стимулирует рост иммунных клеток. Кроме того, из вируса убран ген тимидин киназы, в результате чего инфекционный агент способен размножаться только в раковых клетках, в которых уровень киназы высок из-за мутации в специфических генах — RAS и p53.
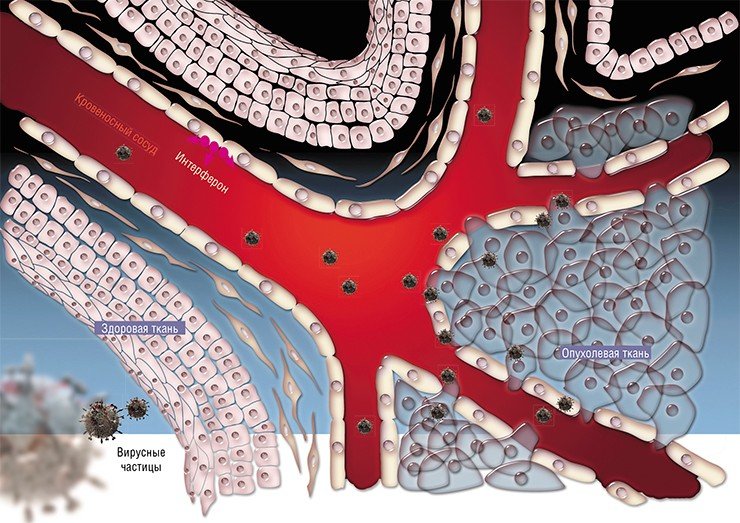
Показано, что Pexa-Vec ограничивает рост кровеносных сосудов, которые питают злокачественную опухоль, снижая ее рост. При этом вакцину можно вводить внутривенно, а не непосредственно в тело опухоли, как другие онколитические вирусы. Это позволяет модифицированному инфекционному агенту атаковать не только первичный рак, но и метастазы, находящиеся в других местах организма.
Pexa-Vec был испытан на мышах, которые страдали от нейроэндокринного рака поджелудочной железы. Оказалось, что вирус не мог заразить здоровые органы, но поражал кровеносные сосуды. Хотя инфекционный агент уничтожил лишь часть злокачественных клеток, вызванный им иммунный ответ привел к исчезновению новообразования.
Мы попросили прокомментировать это сообщение главного научного сотрудника отделения биологии и биотехнологии Института фундаментальной медицины и биологии Казанского федерального университета, доктора биологических наук Альберта Ризванова.
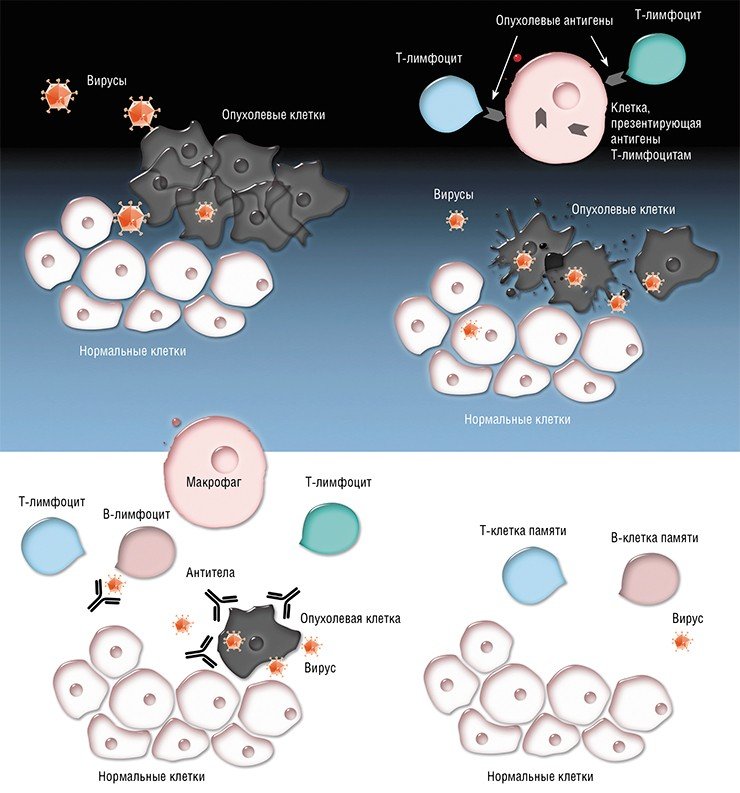
- Исследование коллег из Калифорнийского университета представляется весьма перспективным и, я бы сказал, оригинальным, - говорит Альберт Анатольевич. - Само по себе использование в качестве агента версий вируса коровьей оспы не ново. Метод хорошо изучен, ученые, в том числе и мы, в КФУ часто используют вирусы для доставки генетического материала и для инфекции клеток с различной целью. Нюанс в том, что коллеги из США – как сказано в сообщении MedicalXpess – модифицировали вирус таким образом, что он реплицируется только в опухолевых клетках, не затрагивая здоровые, а также сумели заставить вирус синтезировать особый белок, который стимулирует иммунные клетки. Поэтому когда раковые клетки умирают из-за жизнедеятельности этого вируса, то они ещё и высвобождают белок, который служит своего рода раздражителем иммунных клеток, что приводит к выработке иммунитета против раковых клеток.
Таким образом получается, что вирус и убивает клетки, и натравливает иммунную систему организма на борьбу с онкологическим заболеванием. И такие результаты, насколько можно судить по открытым источникам, уже подтверждены доклиническими испытаниями на грызунах. Проводятся и первые фазы клинических исследований.
Тем не менее, должен разочаровать тех, кто, возможно, решит, что мы имеем дело с некоей панацеей, спасающей от всех онкологических заболеваний. Пока что речь идет о препарате для лечения лишь орфанных, то есть редко встречающихся, видов онкологических заболеваний. Это нисколько не умаляет значимости проделанной коллегами работы, скорее, наоборот, ведь фармацевтический бизнес не очень заинтересован в производстве таких препаратов в силу малой емкости рынка, и прекрасно, что государство поощряет компании, устанавливая более легкие условия для доклинических и клинических испытаний подобных средств, и есть люди, которые готовы вести в данном направлении продуктивные исследования. Думаю, не покажусь нескромным, если сообщу, что мы в КФУ тоже проводим исследования в области новых методов лечения онкологических заболеваний. Это, например, разработка препаратов на основе собственных опухолевых клеток пациента, генетически модифицированных специальным образом и кодирующих белки иммунной системы так, что усиливается иммунный ответ против собственных раковых клеток пациента.
Другой подход связан с применением уже нормальных стволовых клеток человека. Такие клетки способны к миграции в очаги опухолевого образования, метастазы, и если в них загрузить химические препараты или генетические конструкции, обладающие противоопухолевой активностью, то мы достигнем эффекта направленной доставки. Это работа в области создания таргетной терапии онкологических заболеваний. Кроме того, ведутся работы в области онкодиагностики. Например, мы проводим исследования связанные с анализом циркулирующих опухолевых клеток, циркулирующих в крови нуклеиновых кислот, таких как ДНК и РНК, наследственной онкогенетикой.
Подводя итог, позволю себе выразить надежду, что, по меньшей мере, по орфанным видам онкологии решение близко. Может, через 5-7 лет вакцина и таргетные препараты на основе генно-клеточных технологий могут стать доступной клиникам.

11 Октября 2018
В Петербурге можно сделать прививку от рака. И это не фантастика. Еще в ХХ веке ученые разобрались, что рак шейки матки у женщин вызывает вирус папилломы человека (ВПЧ) и разработали профилактическую вакцину против него. Во многих странах мира прививку от ВПЧ включили в национальный календарь прививок, причем используют гендерно нейтральный подход, то есть прививают и девочек, и мальчиков. О том, как позаботиться о своем здоровье и здоровье своих детей, на деловом завтраке в петербургской редакции "РГ" рассказала президент Российского общества гинекологов-онкологов (RSGO), ведущий научный сотрудник отделения онкогинекологии НМИЦ онкологии имени Н. Н. Петрова, профессор Адель Урманчеева.
Коварен как грипп, опасен как рак
Адель Урманчеева: В свое время немецкий ученый Харальд цур Хаузен получил Нобелевскую премию, когда смог доказать, что до 99 процентов женщин, у которых развился рак шейки матки, являлись носителями ВПЧ. У других форм рака есть невирусное происхождение, но тут все довольно однозначно.
Штаммов вируса папилломы человека существует более ста, но внимания медиков в первую очередь требуют те, которые передаются половым путем, таких более 30. Особенность ВПЧ - часть штаммов вызывает доброкачественные новообразования, а часть - онкологические заболевания.
Клиническое проявление штаммов первого типа - кондиломы и папилломы, а попросту говоря, бородавки. Другими словами, в большинстве случаев, если человек обнаружил у себя такие новообразования, то можно слегка успокоиться - он инфицирован штаммом ВПЧ неонкологического типа. Хотя бывают и случаи малигнизации (перерождения в злокачественную опухоль - Прим. "РГ").
Мы мало знаем об этой инфекции, потому что она часто проходит бессимптомно. То есть можно получить вирус ВПЧ и даже не знать об этом. Если у человека сильный иммунитет, возможно самоизлечение. Однако возможно и реинфицирование.
Адель Урманчеева: Грипп себя проявляет - температурой, кашлем, ломотой в суставах, а ВПЧ - нет. И при снижении иммунитета - по разным причинам - заболевание может приобрести хронический характер, вирус останется в клетке и интегрируется в ее ядро. Если организм не справляется, то сначала появляется предрак - такое поражение слизистой, которое обязательно нужно убрать хирургическим путем. Но если сделать это вовремя, то пациент полностью излечивается.
У женщин риск значительно больше, чем у мужчин: ВПЧ чаще всего вызывает рак шейки матки, у мужчин с онкогенным вирусом связывают рак ротоглотки. Факторы риска - раннее начало половой жизни, частая смена партнеров, то есть в прин-ципе высокий риск инфицирования половыми инфекциями.
Вообще по распространенности онкологических заболеваний среди женщин на первом месте - рак молочной железы. Однако рак шейки матки нередко поражает очень молодых, до 30 лет.
И девочкам, и мальчикам
Адель Урманчеева: Первое и главное, что должна делать женщина, - тщательно следить за своим здоровьем, вовремя проходить обследования. Однако сразу хочу сказать, что лечение от ВПЧ - неспецифическое, то есть оно не гарантирует излечения. Терапия направлена на укрепление общего иммунитета, специального лекарства от ВПЧ пока не изобрели.
Наиболее надежный способ - вакцинирование. Лечебных вакцин не существует, а вот профилактические уже доказали свою эффективность во всем мире. Это как с детскими инфекциями типа кори или даже натуральной оспы: вакцина позволяет выработать иммунитет, в организме появляются антитела, и при попадании инфекции в организм она не развивается.
Разрабатывать вакцины против ВПЧ начали в конце ХХ века, однако прежде чем эти препараты были разрешены к применению, прошло довольное длительное время. Исследования шли по тому же пути, что и при разработке вакцины против полиомиелита, но тогда нам казалось фантастикой, что можно будет изобрести прививку от рака шейки матки. В начале XXI века ее начали внедрять в практику, сначала с использованием контрольных групп. Оказалось, что у вакцинированных женщин состояние предрака практически не проявлялось, иммунитет справляется.
Адель Урманчеева: Сразу хочу успокоить: вакцина от ВРЧ не содержит вирусов, то есть никто не заражает вас раком даже в ослабленной форме, как это происходит с тем же гриппом. В основе препарата - вирусоподобные частицы, которые не могут вызвать инфекцию. Но в ответ на их появление в организме вырабатываются нужные антитела.
Адель Урманчеева: В России прививка от ВПЧ пока не входит в национальный календарь прививок, в то время как в Европе, Америке, Австралии она включена в государственную программу вакцинации девочек школьного возраста. Потому что прививку важно сделать до начала половой жизни, до сексуального дебюта. В разных странах он происходит в разном возрасте, поэтому для вакцинации выбирается интервал от 9 до 13-16 лет. Прививка ставится троекратно (иногда двукратно).
Кстати, в Испании, Австралии и ряде других стран обязательно вакцинируют и мальчиков, хотя проблем с раком, вызванным ВПЧ, у них меньше. Но, как с любой прививкой, здесь важен охват - если привить 70 процентов населения, вирус не будет распространяться, риски заражения падают на несколько порядков.
Прививка от ВПЧ делается внутримышечно в три этапа: через месяц и затем через полгода после первой вакцинации
И здесь приходится говорить о цене вопроса. Сейчас в Петербурге прививка стоит около 10 тысяч рублей. Конечно, со временем появятся дженерики, стоимость будет снижаться, но пока проблемы бюджетного характера не позволяют нам широко распространить вакцинацию от ВПЧ.
Соответствующее решение могут принять родители. Но в нашей стране мамы или не знают о такой возможности, или сознательно от нее отказываются. В интернете можно найти массу зловещей информации, однако надо понимать, что нежелательные явления могут проявиться при любой вакцинации. Данных о том, что прививка от ВПЧ может сказаться в будущем на репродуктивном здоровье женщины, нет. А защита от рака есть, и это показывают исследования. Противопоказания стандартные - аллергические реакции, тяжелые заболевания, вроде муковисцидоза.
Кстати, мои прежние пациентки, которых я оперировала и спасла, часто приходят ко мне с вопросом, надо ли прививать ребенка. И я всем говорю: обязательно. Одна из них сделала вакцинацию дочке в качестве предсвадебного подарка.
Адель Урманчеева: Когда вакцина попала в широкую практику, мне уже было поздно по возрасту. Но моя внучка привита. А многие мои коллеги привили своих детей.
"Берегите себя, любите себя"
Адель Урманчеева: От всех одну прививку или даже от каждой формы рака - наверное, нет. Разные опухоли вызывают разные факторы, в том числе и гормональные, и наследственные. Но могу, кстати, сказать, что рак шейки матки не носит наследственный характер. Так что, если в семье были такие случаи, непосредственной угрозы они не несут. А вот если был рак яичника, рак молочной железы в родословной, то вероятность наследственных форм велика, и это требует соответствующего генетического обследования больной и членов ее семьи.
Адель Урманчеева: В поздних стадиях пациенток, к сожалению, не удается спасти, возможно только паллиативное лечение. А вот на ранних стадиях рака шейки матки можно радикально вылечить пациенток как хирургическим, так и лучевым методом. У некоторых молодых больных даже удается сохранить детородную функцию. Хотя это в большинстве своем уникальные ситуации, мы даже фотографии таких деток храним.
Чудес не бывает. Берегите себя, любите себя, следите за собой - и это не должен быть только макияж и физическая форма - обязательно своевременное обследование. Женщина должна приходить к гинекологу не реже чем раз в год. А родители должны задуматься о будущем здоровье своих детей, вступающих во взрослую жизнь. Одной из форм защиты может быть профилактическая вакцинация подростков против ВПЧ.
В рамках ОМС анализ на ВПЧ не предусмотрен, делается только цитологическое исследование, которое может выявить атипию - предрак или рак. Такое исследование проводится в рамках диспансеризации один раз в три года у женщин с 30 до 60 лет. Если вирус обнаружен, скрининг достаточно проходить раз в год. Если ВПЧ не выявлен, то прививку можно сделать в любом возрасте.
В России ежегодно рак шейки матки в тяжелых стадиях выявляется у 16 тысяч женщин. В целом при инвазивных формах рака шейки матки спасают чуть более 60 процентов пациенток.
Keshelava V.V.
Federal State Enterprise “Russian Scientific Center of Roentgenoradiology of Russian Health and Social Development Ministry”.
Abstract
The progress in oncological diseases treatment is due to significant achievements of molecular biology, immunology and development of immunotherapy methodology. One of the most perspective methods is known to be antitumor vaccination with vaccines containing intact tumor cells (autologic and allogenic), autologic hit shock proteins, Newcastle disease virus (NDV).
Antitumor vaccines generation methods and their role in cancer prophylaxis and treatment has been worked out and recognized. Wide experience of these vaccines usage has been collected by clinical oncologists and their effectiveness has been recognized by many clinics over the world.
Autologic vaccine consists of tumor cells exposed during the tumor extraction.
The interclinical prospective nonrandomized research of vaccines’ effectiveness and toxicity held in 2004–2006 included 46 patients with skin melanoma (9 patients), breast cancer (21 patient), large intestine cancer (7 patients), cervix cancer (5 patients), ovarian cancer (1 patient), uveal melanoma (2 patients), vagina cancer (1 patient). Medium age of the patients was 54,2.The majority of patients suffered disseminated tumor process with multiple metastasis affecting several organs and resistant to radial and chemotherapy. Almost all patients were treated on an outpatient basis. So they were leading their common life during the treatment. There were no complications noticed. At the end of the first course of treatment pain and metastasis were reduced, the patients rejected narcotics and anaesthetics, became active, their appetites and weight improved. Due to low toxicity it became possible to continue treatment up to one year and even longer to get stable results.
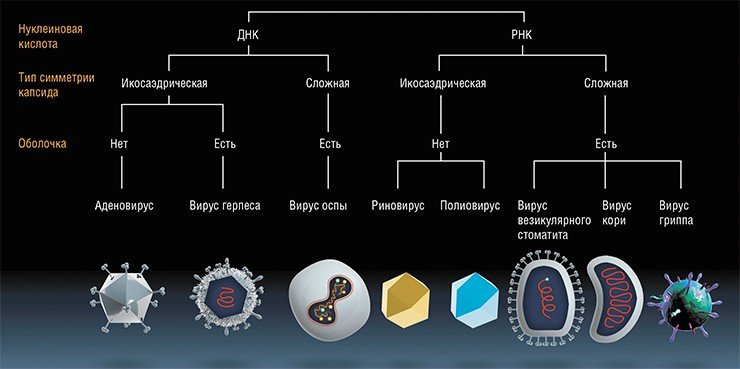
За последние годы в онкологии сделано много, но решающего прорыва не произошло. Все чаще в отечественной и зарубежной литературе появляются сообщения несколько сенсационного плана, свидетельствующие о переломном моменте в лечении больных раком. Прогресс в лечении онкологических заболеваний связан с существенным прорывом в молекулярной биологии, иммунологии, развитии методов иммунотерапии, из которых наиболее перспективным представляется создание противоопухолевых вакцин: на основе цельных опухолевых клеток (аутологичных и аллогенных); ДНК или РНК – вакцины; рекомбинантные вирусные или бактериальные вакцины; вакцины на основе аутологичных белков теплового шока и др. (1,2,7.8).
Клиническая онкология имеет большой опыт использования противоопухолевых вакцин эффективность применения которых доказана во многих клиниках мира. При этом разработаны и общепризнанны методы получения противоопухолевых вакцин и определено их место в профилактике и лечении рака (2.3.5.7.8.).
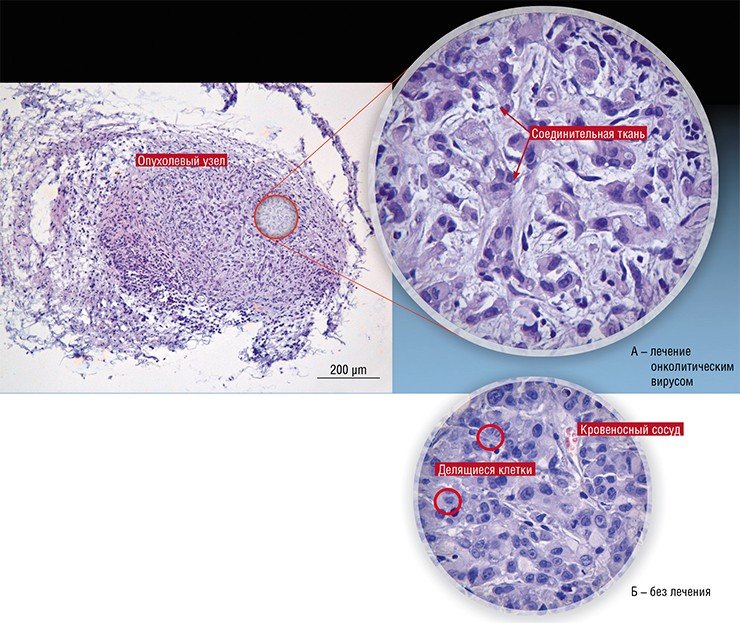
Клетки собственных опухолей, полученные при операции или биопсии, широко используются в мировой онкологической практике для получения иммунотерапевтических препаратов для того же самого пациента. Основной задачей при такой терапии является повышение иммуногенности собственных опухолевых клеток с помощью химической обработки - гаптенизации, генетической модификации - трансфекцией генов кодирующих стимулирующие иммунитет молекулы и вирусной модификации. Последний подход является наиболее технологичным при использовании вируса селективно заражающего опухолевые клетки. Таковым является вирус болезни Ньюкасла (ВБН) - псевдочумы птиц, точнее его вакцинные штаммы – генетически стабильные, апатогенные для млекопитающих, живые вирусные препараты, повсеместно используемые для профилактики заболевания у кур. Преимущественное размножение этого вируса в опухолевых клетках млекопитающих было продемонстрировано более 40 лет назад. С этого времени большим количеством экспериментов на опухолях животных доказана безвредность ВБН для млекопитающих и его достаточно высокая терапевтическая эффективность, особенно в случае сочетания онколитического действия с иммунизирующим воздействием зараженных вирусом опухолевых клеток
Существует множество различных штаммов ВБН, все они классифицированы как литические (лизирующие клетки: МТН-68,73-Т, Roakin, PV701) и нелитические (Ульстер) для человеческих клеток и изучались как противораковые агенты(4-8).
Исследователи при этом предполагают три клеточных механизма взаимодействия. Первый механизм – литические штаммы вируса напрямую уничтожают опухоли. Второй – с помощью нелитических штаммов белки вируса проникают в мембрану опухолевых клеток, вызывая иммунную реакцию. И, наконец, сам вирус может стимулировать организм носителя вырабатывать цитокины: интерфероны и фактор некроза опухоли (TNF), что ведет в свою очередь к активации естественных клеток-убийц, макрофагов и сенсибилизированных Т-клеток.
Вместе с тем есть много вопросов в клеточном механизме взаимодействия вируса с организмом. Не совсем ясно, какой из штаммов более эффективен, а также что эффективнее - собственные опухолевые клетки пациента или опухолевые клеточные линии.
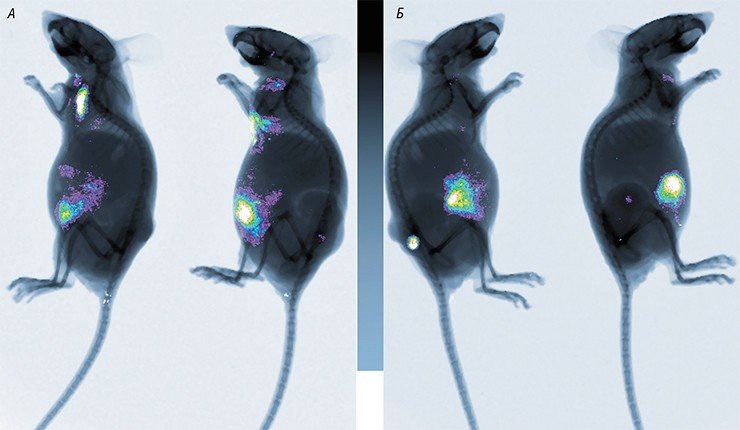
Экспериментальные исследования на животных показали, что ВБН и зараженные ВБН раковые клетки могут стимулировать большое разнообразие иммунных ответов, что способствует успешной терапии рака. Доказано - ВБН безопасен, лечение считается безвредным. Эффективность метода в той или иной мере подтверждена клиническими наблюдениями на пациентах с различными злокачественными новообразованиями (II – III фазы испытаний) проведенными в США, Европе и Китае. Представлены результаты исследований использования онколизатов (штамм ВБН 73-Т для лечения метастатической меланомы, а так же рака почки, молочной железы и яичников), цельноклеточных вакцин (штамм ВБН Ульстер для лечения колоректального рака, рака яичников почки, шейки матки) и заражение пациентов литическим штаммом ВБН МТН-68 для лечения рака толстой кишки, желудка, поджелудочной железы, легких и др. (6.7.8)
Во всех случаях отмечен положительный эффект применения, как чисто вирусной терапии, так и аутологичной вакцинации вирус модифицированными опухолевыми клетками. Некоторые противоопухолевые вакцины в настоящее время завершают III фазу клинических испытаний и по мнению большинства исследователей уже в недалеком будущем активная иммунотерапия станет стандартным методом и частью комплексного лечения рака (4-8).
Нами проанализированы результаты и возможности вакцинотерапии большинства клиник, обобщен опыт работы общепризнанных специалистов и с 2003 года начаты экспериментальные и клинические исследования по данной проблеме в рамках допустимых и принятых медицинских программ с учетом мирового опыта в процессе клинических испытаний, в том числе и России.
Была поставлена задача оптимизации и совершенствования имеющихся технологий получения аутологичных и модифицированных ВБН вакцин, а также онколитического ВБН для использования у пациентов с различными злокачественными заболеваниями.
Применяемый нами вирус Болезни Ньюкасла, живая вакцина для птицеводства, апатогеный штамм Ла-Сота выращивается в свободных от патогенной микрофлоры куриных эмбрионах. Для внесения в человеческие опухолевые клетки и для инъекций пациентам вирус очищали ультрацентрифугированием и проверяли на стерильность и безвредность. Оценка токсичности препарата (вакцины) проводилась в соответствии с критериями, рекомендованными ВОЗ. Препарат при необходимости может быть лиофилизован, сохраняя при этом свои свойства в течение одного года.
Для приготовления аутологичной вакцины используют опухолевые клетки, выделенные непосредственно в ходе удаления опухоли. Технология приготовления вакцины общеизвестна и предполагает дезагрегацию образцов опухоли, культивирование клеток, облучение клеток с целью блокады их пролиферативной активности и различные приемы модификации с целью повышения ее эффективности. Этап создания культуры опухолевых клеток представляет собой сложный и неоднозначный процесс. По мнению абсолютного большинства исследователей, существуют значительные трудности и особенности в создании условий, благоприятных для индивидуальных первичных культур опухолевых клеток. Выживание клеток и их пролиферация возможны только лишь при воссоздании всех внешних условий, которые клетки имели in vivo. Разработанные и применяемые нами оригинальные технологии выделения и культивирования клеток позволяют получить пролиферирующие первичные культуры более чем 70% случаев для таких опухолей как меланома кожи, рак почки, толстой кишки, яичников и молочной железы, а клеточные линии – не менее чем в 50% случаев.
Не менее специфичным в процессе приготовления клеточных вакцин является необходимость инактивировать их способность к размножению с одновременным сохранением их метаболической активности и повышения иммуногенности собственных опухолевых клеток с помощью вирусной модификации. На данном этапе клетки инактивировали гамма-излучением (дозы облучения подбирали индивидуально), замораживали в жидком азоте и использовали для вакцинации в дозах 10 – 50 млн. после обработки 10 - 100 ID50 вируса (ВБН) на клетку.
Более специфическую аутовакцину получали из размножающихся in vitro клетках – перевиваемых опухолевых линиях. Такие линии могут быть получены из операционного или биопсийного материала и могут размножаться бесконечно долго, обеспечивая необходимое для вакцинации количество гомогенных опухолевых клеток. Эти линии также замораживали, инактивировали гамма-излучением и обрабатывали вирусом перед введением пациентам.
Известно, принцип действия противоопухолевых вакцин основан на усилении противоопухолевой защиты, заложенной в природе иммунитета здорового человека. Недостаточность противоопухолевого иммунитета обусловлена растущей опухолью и/или прогрессированием с возникновением множества метастазов и иммунодепрессивным эффектом противоопухолевой химиотерапии и облучения.
Усиление эффективности противоопухолевых вакцин путем повышения иммуногенности опухолевых антигенов нами достигалась модификацией вакцины непатогенным вирусом (ВБН) и использованием человеческого рекомбинантного гранулоцитарного колониестимулирующего фактора (Г-КСФ). Основное биологическое действие Г-КСФ – гемопоэтическое, главным образом нейтрофилопоэтическое. Его введение в организм приводит к увеличению содержания в крови функционально активных нейтрофилов. Кроме этого препарат повышает биохимическую (синтез протеаз), фагоцитарную, хемотаксическую активности, усиливает в организме синтез других цитокинов (интерферонов, трансформирующего фактора роста β и др.). Тем самым активизируются различные неспецифические и специфические механизмы защиты организма.
Предварительная клиническая и иммунологическая оценка эффективности вакцинотерапии в сочетании с Г-КСФ, а так же наличие клеточных линий полученных на этапах создании позволили пересмотреть принципы и подходы химиотерапии в данном комплексе лечения. Правильный подбор препаратов избирательно действующих на опухолевые клетки, выбор оптимальной дозы, режима и способа применения позволяли проводить курсы химиотерапии длительно без каких-либо осложнений в течение всего курса вакцинотерапии.
Предполагая данную комплексную методику лечения рака, мы учитывали те слабые сторон аутовакцин, где результат зависит от индивидуальных особенностей противоопухолевого иммунитета, а опухоль характеризуется не только множественностью антигенов, но и повышенной мутационной активностью с дальнейшим усилением признаков злокачественности.
Проведенные медико-биологические исследования показали высокую эффективность предлагаемой модели патогенетической терапии и позволили с учетом в рамках допустимых и принятых медицинских программ провести клинические испытания на определенной группе больных с различными злокачественными новообразованиями.
Цель данного исследования: оценить объективный непосредственный эффект и его продолжительность, время до прогрессирования, выживаемость, качество жизни больных с различными злокачественными заболеваниями при использовании как аутологичных, облученных вакцин модифицированных ВБН (группа А), так и получивших онколитический вирус ВБН в чистом виде (группа В) в плане комплексного лечения.
Для отбора больных были использованы общепринятые в клинической практике критерии.
Критерии включения:
- Гистологически верифицированный диагноз опухолевого очага
- Возраст старше 18 лет
- Общее удовлетворительное состояние (индекс Карновского не менее 70%)
- Отсутствие противоопухолевого эффекта лечения на фоне ранее проводимого лечения или наличие признаков прогрессирования после их проведения.
- Возможность визуальной или инструментальной оценки динамики изменений
- Согласие больного на участие в данном исследовании.
- Поражение центральной нервной системы
- Активный аутоиммунный процесс
- Возраст старше 70 лет
- Больные с одной из перечисленных инфекций: HIV, HBV, HCV.
- Наличие инфекционных или тяжелых заболеваний сердечно-сосудистой, нервной, дыхательной или эндокринной систем; беременность или лактация
- Нарушение функции печени и/или почек (билирубин >1,5хN, креатинин >1,5хN), показатели крови: лейкоциты 9 /Л, Hb
Список использованной литературы
- Гриневич Ю.А. Фильчаков Ф.В. Адаптивная иммунотерапия и ее влияние на эффективность лечения онкологического профиля. Онкология 2003 т.5 №2 с. 90-95.
- Хансон К.П., Моисеенко В.М. Биотерапия злокачественных новообразований. Проблемы клинической медицины №3 2005г.с.10-15.
- Steiner, H. H., Bonsanto, M. M., Beckhove, P., Brysch, M., Geletneky, K., Ahmadi, R., Schuele-Freyer, R., Kremer, P., Ranaie, G., Matejic, D., Bauer, H., Kiessling, M., Kunze, S., Schirrmacher, V., Herold-Mende, C. (2004). Antitumor Vaccination of Patients With Glioblastoma Multiforme: A Pilot Study to Assess Feasibility, Safety, and Clinical Benefit. J Clin Oncol 22: 4272-4281
- Washburn, B., Weigand, M. A., Grosse-Wilde, A., Janke, M., Stahl, H., Rieser, E., Sprick, M. R., Schirrmacher, V., Walczak, H. (2003). TNF-Related Apoptosis-Inducing Ligand Mediates Tumoricidal Activity of Human Monocytes Stimulated by Newcastle Disease Virus. J Immunol 170: 1814-1821
- Pecora, A. L., Rizvi, N., Cohen, G. I., Meropol, N. J., Sterman, D., Marshall, J. L., Goldberg, S., Gross, P., O'Neil, J. D., Groene, W. S., Roberts, M. S., Rabin, H., Bamat, M. K., Lorence, R. M. (2002). Phase I Trial of Intravenous Administration of PV701, an Oncolytic Virus, in Patients With Advanced Solid Cancers. J Clin Oncol 20: 2251-2266
- Nakaya, T., Cros, J., Park, M.-S., Nakaya, Y., Zheng, H., Sagrera, A., Villar, E., Garcia-Sastre, A., Palese, P. (2001). Recombinant Newcastle Disease Virus as a Vaccine Vector. J. Virol. 75: 11868-11873
- Csatary, L. K., Csatary, E., Moss, R. W. (2000). Re: Scientific Interest in Newcastle Disease Virus Is Reviving. J Natl Cancer Inst 92: 493-493
- Nelson, N. J. (2000). RESPONSE: Re: Scientific Interest in Newcastle Disease Virus Is Reviving. J Natl Cancer Inst 92: 493a-494 .
В 2015 г. в арсенале онкологов официально появился принципиально не новый, но новаторский по сути метод разрушения опухолей с помощью вирусов. Назвать его новым нельзя потому, что первые официальные публикации по его использованию, в ряде случаев успешному, появились еще в 1904—1910 гг. (Dock, 1904; De Pace, 1912). Тогда ученые описали сначала случайное, а затем и намеренное использование для лечения онкологических больных ослабленного (вакцинного) препарата вируса бешенства. Правда, широкого применения этот метод не получил, так как вакцина имела побочные эффекты, а результаты лечения было трудно предсказать.
В течение следующей сотни лет к этому методу неоднократно пытались вернуться. В 1950—1970-е гг. для лечения рака применялись непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусов, вируса болезни Ньюкасла и др. Иногда больные полностью выздоравливали, нередко случались и временные ремиссии. Но плохая предсказуемость результатов, незнание научно обоснованных механизмов действия вирусов на опухоль и предубеждения скептиков из контролирующих органов вынуждали врачей отступать.
Новая история онколитических вирусов
![]()
Позднее выяснилось, что в отсутствие гена E 1B не реализуется и вторая функция белка E1B-55K (O’Shea et al., 2004), которая состоит в переносе из ядра в цитоплазму вирусных РНК, кодирующих белки вирусной оболочки. В опухолевых клетках эту функцию берет на себя не установленный до сих пор фактор. Таким образом, механизм действия ONYX‑015 еще нуждается в дальнейшем исследовании. Кроме того, за перерождение клеток в раковые могут отвечать не только дефекты белка р53. Есть и другие механизмы ракового перерождения клеток, и в этом случае аденовирусы будут неэффективны.
![]()
Все это привело к тому, что к концу 1990-х гг. разработки онколитических вирусов снова затихли. Однако аналог ONYX‑015 под названием онкорин был разрешен для лечения некоторых типов онкобольных с опухолями головы и шеи в Китае, так же, как и рекомбинантный аденовирус с удаленным геном Е1В и дополнительной вставкой гена р53 для усиления онколитических свойств (препарат гендицин) (Guo et al., 2006).В СССР исследования онколитических свойств вирусов были начаты в 1960—1970-х гг. в Институте полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). Кроме изучения вирусов полиомиелита и разработок вакцин против них, в институте проводились более широкие исследования, в результате которых вакцинные штаммы вируса полиомиелита были применены для лечения рака. Кроме того, были выделены и типированы несколько других непатогенных для людей энтеровирусов, у которых обнаружились онколитические свойства.
С онколитическими вирусами работала член-корр. АМН СССР доктор медицинских наук М. К. Ворошилова, и в ряде случаев ей удалось добиться серьезных успехов вплоть до полного исчезновения первичной опухоли и метастазов. Однако в 1970-х гг. ее эксперименты были запрещены. Поводом послужил недостаток данных о механизмах явления и молекулярной природе как вирусов, так и раковой опухоли. Уже после прекращения этих работ были опубликованы два ее обзора, оба – в малодоступных изданиях: русскоязычном и зарубежном (Ворошилова, 1987; Voroshilova, 1989).
Позднее профессор В. В. Кешелава, работая в разных российских онкологических клиниках, использовал в терапии некоторых видов опухолей непатогенный для человека вирус болезни Ньюкасла (Keshelava et al., 2009). Однако до широких клинических испытаний дело так и не дошло.
![]()
Новейшая история: клинические испытания
За рубежом работы с онколитическими вирусами за последние десять лет получили мощное развитие. Вначале они в основном развивались в Канаде, и канадское Агентство здравоохранения даже финансировало некоторые проекты в США.
В октябре 2015 г. Управление по контролю качества пищи и лекарств США (FDA USA) официально разрешило клинические испытания III фазы генно-инженерного штамма герпесвируса под названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой. Штамм герпесвируса, содержащий в геноме аттенуирующие (снижающие патогенные свойства) мутации и человеческий ген гранулоцит-макрофаг-колониестимулирующего фактора для усиления противоопухолевого эффекта, был разработан американской компанией BioVex, Inc. Эту разработку и саму компанию вместе с правами на препарат в 2011 г. поглотил фармацевтический гигант Amgen. В конце 2015 г. препарат был официально разрешен к применению и в Европе.
![]()
Сейчас онколитические препараты на основе вирусов разрабатываются и начинают применяться во многих странах. В Канаде это – аденовирусы и рекомбинантные вирусы осповакцины, в Финляндии – рекомбинантные аденовирусы, в Японии – рекомбинантные герпесвирусы, в Латвии – энтеровирусы. В США – целый ряд вирусов, включая рекомбинантный аттенуированный герпесвирус, вакцинный штамм вируса кори и вакцинные штаммы вирусов гриппа. В Великобритании начинаются клинические испытания вакцинного штамма вируса гриппа на больных раком печени.
![]()
В России подобные разработки также продолжаются. В 2010 г. Новосибирский государственный университет получил мегагрант, руководителем которого стал известный российский молекулярный биолог П. М. Чумаков (сын М. К. Ворошиловой), а ведущими исполнителями – авторы этой статьи (Нетесов и др., 2013). В результате в НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, опубликованы обзорные статьи по онколитическим вирусам (Kochneva et al., 2012; Жираковская и др., 2012; Чумаков и др., 2012; Святченко и др., 2012), получены и охарактеризованы первые кандидатные штаммы онколитических энтеровирусов, парамиксовирусов и ортопоксвирусов.
![]()
Но пока существует недоверие к потенциально полезным противораковым вирусам, боязнь их патогенных свойств превалирует. И это удивительно, потому что широко используемые в настоящее время для борьбы с онкозаболеваниями химиопрепараты вызывают массу вредных побочных эффектов. Механизм действия большинства из них таков, что эти лекарства поражают не только раковые, но и здоровые, активно делящиеся клетки. Хорошо известно, что химиотерапия иногда приводит к преждевременной гибели больных, но ее применяют, потому что зачастую другого способа лечения онкобольных нет.
Попутно возникает еще один интересный вопрос о роли вирусов в нашей жизни. Ведь некоторые из них, как и бактерии, обитают в нашем теле, не нанося ему вреда. Может быть, роль вирусов, по крайней мере некоторых из них, как раз и состоит в защите от раковых клеток? И они лишь иногда вызывают заболевания, выйдя из-под контроля? Ответы на эти вопросы должны стать предметом будущих исследований, если мы хотим добиться прорыва в борьбе с онкозаболеваниями.
* Вакцинация против полиомиелита производилась живой вакциной Сэбина.
Святченко В.А., Тарасова М.В., Нетесов С.В. и др. Онколитические аденовирусы в терапии злокачественных новообразований: современное состояние и перспективы // Молекулярная биология. 2012. Т. 46. С. 556—569.
Dock G. Rabies virus vaccination in a patient with cervical carcinoma// Am. J. Med. Sci. 1904. V. 127. P. 563—565.
Guo J.; Xin H. Chinese gene therapy. Splicing out the West? // Science. 2006. V. 314. N. 5803. P. 1232—1235.
Kochneva G., Zonov E., Grazhdantseva A. et al. Apoptin enhances the oncolytic properties of vaccinia virus and modifies mechanisms of tumor regression // Oncotarget. V. 5. N. 22. 2014. P. 11269—11280.
Читайте также: