Лечение вирусной пневмонии и пневмоцистной пневмонии
Пневмония пневмоцистная (ПЦП) — это заболевание дыхательной системы, проявляющееся как инфекционно-токсический синдром, поражающий легкие и мелкие бронхи. Возбудителями заболевания — являются пневмоцисты Pneumocystis carinii, описанные в 1909 г. и выделенные из организма животного в 1912 г. Из-за этого вначале считали, что данный возбудитель не опасен для человека. В 1942 г. была выделена пневмоциста Pneumocystis jiroveci, ставшая причиной вспышки пневмонии у грудных детей и детей с низким иммунитетом. Pneumocystis jiroveci названа в честь ученого Отто Йировица, который первым описал данный возбудитель, вызывающий легочную форму заболевания у людей.
Возбудитель пневмоцистоза широко распространен, как среди людей, так и среди различных животных. Выявляется повсеместно, но наиболее часто пневмоцистную инфекцию диагностировали в США, Канаде, странах Западной Европы. С 1938 по 1963 гг. отмечались вспышки, а к 1991г. в мире было зарегистрировано более 100 000 случаев пневмоцистоза. В России и странах СНГ эта инфекция до настоящего времени официальной статистикой не учитывается из-за трудности постановки этиологического диагноза на основании клинических проявлений и слабого уровня лабораторной диагностики [1].
Группами риска в отношении заражения пневмоцистозом являются [1]:
- дети недоношенные, ослабленные новорождённые и дети раннего возраста с гипогаммаглобулинемией, гипотрофией и рахитом;
- дети из домов ребенка;
- пожилые люди из домов престарелых;
- больные лейкозом, онкологические больные, реципиенты органов, получающие иммунодепрессанты;
- больные туберкулезом;
- больные цитомегалией и другими вирусными инфекциями;
- ВИЧ-инфицированные;
- больные, перенесшие массивную кровопотерю;
- больные, длительно получающие стероидную терапию;
- пациенты с лучевой болезнью.
Основными путями передачи являются воздушно - капельный, воздушно-пылевой, аэрогенный и ингаляционный. Входными воротами возбудителя служат дыхательные пути. Фактор передачи инфекции - мокрота, слизь верхних дыхательных путей.
Источником инвазии является больной или носитель данного возбудителя. Среди здорового населения до 10 % случаев выявляются носители пневмоцист [1].
После взаимодействия с больным инкубационный период ПЦП составляет 4-8 недель. У детей старшего возраста и взрослых заболевание, как правило, характеризуется острым началом напоминающим, воспаление легких. Проявляются все симптомы интоксикации: озноб, повышение температуры тела, боль в груди, кашель надсадного характера. Постепенно наступают признаки дыхательной недостаточности: учащенное дыхание, синюшность кожных покровов, одышка.
Течение пневмоцистной пневмонии у детей начинается скрыто, первые симптомы появляются только после поражения легких: кашель коклюшеобразный (лающий, не дающий облегчения), затрудненное дыхание, удушающего характера (обычно по ночам), мокрота серого цвета и пенистая.
У детей недоношенных и с ослабленным иммунитетом (особенно в возрасте до 6 месяцев) ПЦП протекает более тяжело. Наблюдается нарастание симптомов пневмонии (воспаления легких), одышка (может прогрессировать до затруднения дыхания в покое) сначала с сухим, а потов вязким с мокротой кашлем, вздутие грудной клетки, вплоть до развития пневмоторакса (проникновение воздуха в плевральную полость).
Своевременное и компетентное лечение приводит к выздоровлению. В случае сниженного иммунодефицита (ВИЧ-инфекции, при СПИДе) смерть наступает в среднем в 50% случаев. Смерть от пневмонии при ВИЧ наступает по причине дыхательной недостаточности из-за нарушения газообмена.
Если отсутствует лечение и ранняя диагностика могут возникнуть следующие осложнения: абсцесс легкого (некроз легочной ткани с образованием полости), неожиданный пневмоторакс (скопление воздуха в плевральной полости), эксудативный плеврит (воспаление плевральных листков, скопление жидкости в плевральной полости).
Диагностика данного заболевания затруднена из-за отсутствия специфических поражений легочной ткани. Специалисты делают вывод на основании анамнеза, выявления причин, повлекших за собой ослабление иммунной системы, и нетипичного течения пневмонии. Должна настораживать скудная клиническая картина на фоне сильной одышки. Рентгенография не дает точной картины, понадобится проведение МРТ или КТ.

Рис 1. Проведение исследований методом ПЦР.
При помощи данного метода определяют возбудителя, а не реакцию на его внедрение со стороны организма. Метод позволяет точно диагностировать заболевание ещё в инкубационном периоде, когда нет никаких клинических или лабораторных признаков болезни, а также в любые сроки на фоне заболевания. Кроме того, это позволяет одновременно в течение нескольких часов, в одном и том же материале, проводить поиск нескольких возбудителей без какого-либо ущерба для качества ответа.
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено: увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей; внедрением в практику пересадки донорских органов, трансплантации кос
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено:
- увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей;
- внедрением в практику пересадки донорских органов, трансплантации костного мозга и других форм гематологических манипуляций, выполняемых с гематопоэтической и гематопротезирующей целью;
- эпидемией СПИДа/ВИЧ-инфекции;
- врожденными нарушениями иммунитета, а также ростом числа лиц с аутоиммунными заболеваниями;
- проводимыми многолетними курсами иммуносупрессивной терапии у пациентов с болезнями соединительной ткани;
- алкоголизмом, наркоманией и расширением контингента лиц с асоциальным типом поведения [11].
Объединяющим свойством различных популяций пациентов в данном случае является их повышенная восприимчивость к различным инфекционным агентам, что объясняется снижением пороговых значений вирулентности [1, 6]. Повреждения легочной ткани как инфекционной, так и неинфекционной природы являются едва ли не самой часто описываемой патологией среди пациентов с различными нарушениями иммунитета. При этом легочная инфекция занимает лидирующее положение среди всех инвазивных инфекций, которые диагностируются у такого рода больных [6, 9, 10].
Риск возникновения инфекций нижних дыхательных путей (ИНДП) в группе больных со сниженным иммунитетом весьма различается и зависит от ряда факторов, наиболее важными среди которых являются: нейтропения, аспирация, характер и степень выраженности изменений со стороны иммунной системы (табл. 1), а также эпидемиологическая ситуация в регионе. Одним из наиболее серьезных факторов риска возникновения ИНДП у данной категории пациентов является выраженная и продолжительная нейтропения [5, 8].
Пациент с нарушениями иммунитета, с одной стороны, постоянно находится под воздействием патогенов окружающей среды, а с другой — именно наличие дефекта иммунитета определяет тип легочной инфекции, которая у него развивается. У таких пациентов наиболее распространенными причинами развития ИНДП являются: нозокомиальная инфекция, зачастую резистентная к антибиотикам; воздействие факторов окружающей среды (воздушно-капельная инфекция и/или инфекция, передающаяся через питьевую воду); инфекции, порог вирулентности которых высок среди популяции; реактивация ранее перенесенных инфекций (например, туберкулез) [10, 12].
Каковы же основные особенности респираторных инфекционных процессов у больных со сниженным иммунитетом, знание которых помогает своевременно распознать и как можно быстрее начать проводить специфическое, адекватное терапевтическое лечение.
- При выявлении незначительных по степени интенсивности затемнений легочной ткани во время обычного рентгенологического исследования органов грудной клетки (ОГК) в данной группе пациентов должна в обязательном порядке назначаться компьютерная томография ОГК.
- В случае выявления многофокусных легочных инфильтраций инфекционной (вирусной, бактериальной или грибковой) этиологии, неинфекционной природы, а также при подозрении на метастатическое поражение легочной ткани выполнение рентгенографии ОГК в сочетании с исследованием мокроты не может являться адекватной диагностической процедурой из-за низкой результативности.
- Серологическая диагностика обычно малоинформативна у этих пациентов, в организме которых не генерируется своевременная выработка антител в ответ на инфекцию; в силу этого чаще используются методики, основу которых составляет определение антигена и/или ДНК - полимеразные цепные реакции (ПЦР).
- Выполнение в наиболее сжатые сроки компьютерного томографического исследования легких, а также постановка патоморфологического диагноза (по результатам гистологического и культурального исследований полученных образцов тканей и смывов из трахеи и бронхов) в значительной степени повышают выживаемость пациентов в данной группе.
- В легочной ткани одновременно могут протекать несколько процессов, в частности инфекционный с наличием одного или нескольких патогенов (Pneumocystis сarinii/jiroveci, цитомегаловирусная инфекция (ЦМВ) и т. д.). Нередко выявляется суперинфекция на фоне течения других процессов (например, на фоне развития острого респираторного дистресс-синдрома (ОРДС) или лекарственного поражения легочной ткани).
- Использование сокращенных схем назначаемой иммуносупрессивной химиотерапии (особенно кортикостероидами) может являться столь же значительным фактором риска развития инфекции, как и назначаемая антибактериальная терапия.
Успешность проводимой эмпирической антибактериальной терапии во многом зависит от предварительно проведенного микробиологического обследования и идентификации возбудителя. В абсолютном большинстве случаев речь идет о грибковой или смешанной бактериально-грибковой флоре. Этиологическая расшифровка ИНДП у данной категории больных представлена следующим образом [1–3, 6, 11]:
- типичные бактерии - 37%;
- грибы - 12%;
- вирусы - 15%;
- Pneumocystis carinii/jiroveci - 8%;
- Nocardia asteroides - 7%;
- Mycobacterium tuberculosis - 1%;
- микст-инфекция - 20%.
Довольно часто в популяции пациентов с нейтропенией [11, 12] возникают микст-инфекции, основу которых составляют: инфекции респираторно-сентициального вируса, либо ЦМВ, или инвазия Aspergillus spp. в сочетании с грамотрицательной флорой или P. carinii/jiroveci. Пневмоцистоз в виде моноинфекции и/или в виде микст-инфекции чаще всего описывается у пациентов, получающих системную кортикостероидную терапию (это касается как длительных курсов монотерапии кортикостероидами, так и использования их в качестве составной части режима химиотерапевтической поддержки у онкологических больных).
В современной литературе описывается увеличение количества грибковых поражений и их торпидное течение у пациентов со сниженным иммунитетом, несмотря на применение новейших противогрибковых препаратов [8, 11, 12]. В настоящее время наиболее актуальными являются три инфекционных агента, вызывающих легочные изменения: Pneumocystis carinii/jirovici, представители рода Aspergillus (особенно A. fumigatus) и Cryptococcus neoformans [12, 14].
Таксономически пневмоцисты относят к грибам. В начале нового тысячелетия тип Pneumocystis carinii, вызывающий инфекции у человека, был выделен в отдельный вид Pneumocystis jiroveci — в честь чешского ученого-паразитолога Отто Йировеца, впервые описавшего этот микроорганизм как причину заболевания у человека.
P. jiroveci, являющийся внеклеточным паразитом с преимущественным тропизмом к легочной ткани, поражает пневмоциты 1-го и 2-го порядков. Сложности при проведении дифференциальной диагностики в случае подозрения на развитие у пациента пневмоцистной пневмонии (ПП) в основном объясняются тем фактом, что стандартное обследование больных малоинформативно, до 20% из них имеют стертую клинику, а рентгенологическое обследование не выявляет патологии. Первыми признаками развивающейся ПП являются медленно нарастающая гипоксемия, одышка и кашель при скудности данных физического осмотра и рентгенологических проявлений.
С клинических позиций выделяют три стадии болезни.
- Отечная стадия, продолжительностью в среднем 7-10 дней, характеризуется медленно нарастающей одышкой, которая неуклонно прогрессирует, вплоть до выраженной одышки в покое, и сопровождается сухим непродуктивным кашлем. В легких хрипы не выслушиваются, дыхание, как правило, ослабленное. Симптомы общей интоксикации незначительны (субфебрилитет, общая слабость). Рентгенологическая картина в начале заболевания неясная, чаще всего описываемая как вариант нормы; реже выявляется прикорневое снижение пневматизации легочной ткани и усиление интерстициального рисунка.
- Для ателектатической стадии (продолжительность около 4 нед) характерна выраженная одышка в покое (до 30-50 дыхательных движений в 1 мин), пациентов беспокоит малопродуктивный кашель с выделением вязкой мокроты, нередко описывается вздутие грудной клетки. Часто отмечается фебрильная лихорадка. Аускультативная картина характеризуется жестким и/или ослабленным дыханием (локально или над всей поверхностью легких), иногда выслушиваются сухие хрипы. На более поздних этапах в клинической картине заболевания на первый план выходят симптомы дыхательной и сердечно-сосудистой недостаточности. Рентгенологи на этой стадии более чем в половине случаев выявляют билатеральные облаковидные инфильтраты (симптом "бабочки"), а также - обильные очаговые тени ("ватное" легкое).
- Последняя, эмфизематозная стадия характеризуется развитием эмфизематозных лобулярных вздутий и, возможно, разрушением альвеолярных перегородок с развитием пневмоторакса. Клинически может наблюдаться некоторое улучшение состояния больных, уменьшение одышки.
Диагностические мероприятия, направленные на выявление Pneumocystis jiroveci, начинают с получения индуцированной мокроты. Материал исследуют методом прямой микроскопии окрашенных мазков. В последнее время для более точной диагностики разработаны и применяются метод ПЦР, иммунофлюоресцентные методы с моно- и поликлональными антителами. Бронхоскопия с бронхоальвеолярным лаважем в сочетании с трансбронхиальной биопсией позволяет почти в 100% случаев обнаружить возбудителя и, следовательно, является наиболее эффективным и достоверным методом диагностики ПП. В тех случаях, когда пациенты прибегали к лечению пентамидином, эффективность диагностики с использованием бронхоальвеолярного лаважа снижалась до 60%. Окончательный диагноз пневмоцистоза ставится при обнаружении цист или трофозоидов в ткани или альвеолярной жидкости [7, 9].
В настоящее время обследование пациентов с подозрением на развитие ПП проводится по следующей схеме — всем больным с пневмонией лечение назначается эмпирически, и только при тяжелом легочном процессе проводится легочная биопсия. В отсутствие адекватного специфического лечения пневмоцистоза летальность достигает 100% у пациентов с иммунодефицитами и 50% — у недоношенных детей. Прогноз остается неблагоприятным (зависит от фонового состояния), и без коррекции иммунного статуса у 15% пациентов возникают рецидивы ПП [4, 8].
У пациентов, не получающих триметоприм-сульфаметоксазол (или иные антибактериальные препараты, назначаемые в режиме химиопрофилактики при высоком риске развития пневмоцистоза (табл. 2), сохраняется высокая вероятность возникновения пневмоцистоза на фоне развития ЦМВ-инфекции, что, возможно, связано с блокировкой альвеолярных макрофагов и снижением функции CD4-лимфоцитов.
Относительно частоты выявления пневмоцистоза в группе пациентов с иммунодефицитными состояниями (в которую не вошли пациенты с ВИЧ-инфекцией), следует отметить, что при отсутствии своевременно проводимых профилактических мероприятий примерно у 5–12% пациентов развивается развернутая клиника пневмоцистоза [13]. Применение активной антиретровирусной терапии существенно снижает риск развития ПП при СПИДе. В случае снижения уровня CD4 Рисунок 1. Обзорная рентгенография органов грудной клетки от 11.11.04.
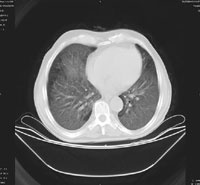
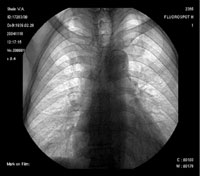
На момент госпитализации: состояние средней степени тяжести, обусловленное дыхательной недостаточностью. При осмотре кожных покровов видны сухие следы расчесов, акроцианоз. В подмышечных, паховых областях с обеих сторон пальпируются единичные, мягко-эластичной консистенции безболезненные лимфатические узлы. В легких при аускультации выслушивается жесткое дыхание, хрипов нет. Частота дыхания — 23–24 в минуту, пульс — 87 в минуту, артериальное давление — 140/80 мм рт. ст. Со стороны пищеварительной, мочеполовой, нервной систем патологии не выявлено. Больному была назначена антибактериальная терапия, включающая ципрофлоксацин, рифампицин. Помимо антибиотиков пациент получал муколитики, фестал, альмагель, бисакодил. На фоне проводимого лечения сохранялись гектические подъемы температуры, нарастала дыхательная недостаточность. С учетом затяжного течения пневмонии больной повторно был осмотрен фтизиатром, данных, подтверждающих туберкулез, снова не было выявлено. В ходе обследования методом иммуноферментного анализа и иммунного блотинга были выявлены антитела к ВИЧ, что заставило пересмотреть диагностический алгоритм и предположить развитие у больного ПП либо поражения легких в рамках ЦМВ-инфекции; окончательно не был исключен из диагностического ряда и вариант развития туберкулезного процесса в легких. Ввиду вышесказанного к проводимой терапии был добавлен бисептол в адекватных дозах. При иммунологическом исследовании выявлено абсолютное снижение CD4 до 19,3/ мкл. Все вышеперечисленное позволило диагностировать у больного ВИЧ-инфекцию в стадии 3Б (СПИД-ассоциированный комплекс), двустороннюю субтотальную пневмонию. При проведении (11.11.04) повторного рентгенологического исследования ОГК (рис. 1) отмечалась отрицательная динамика в виде нарастания объема и интенсивности инфильтрации легочной ткани. При ультразвуковом исследовании органов брюшной полости обнаружены диффузные изменения печени, поджелудочной железы, селезенки, увеличение лимфоузлов подмышечных, паховых областей. При контрольной компьютерной томографии ОГК отмечалась отрицательная динамика в виде прогрессирования диффузных изменений в обоих легких (рис. 2, 3). На фоне лечения у больного нарастала дыхательная недостаточность, сохранялись гектические подъемы температуры, развился ОРДС, в связи с чем пациент был переведен в отделение реанимации и интенсивной терапии, где осуществлялись респираторная поддержка, проводились антибактериальная, дезинтоксикационная терапия, противоязвенное и антитромботическое лечение, симптоматическая терапия. Однако, несмотря на все перечисленные мероприятия, 23.11.04 г. наступила остановка сердечной деятельности по типу асистолии.
 |
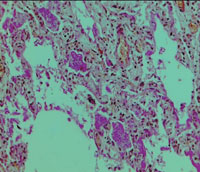
| Рисунок 4. Гиалиновые мембраны на стенках альвеол (окраска гематоксилином и эозином). Микрофотография |
 |
| Рисунок 5. Скопления Pneumocystis jiroveci в просветах альвеол (окраска PAS-методом). Микрофотография |
Согласно материалам аутопсии у больного было подтверждено наличие двухсторонней полисегментарной ПП, ОРДС: полнокровие капилляров альвеолоцитов и наличие гиалиновых мембран на стенках альвеол (рис. 4, 5).
- Collin B. A., Ramphal R. Pneumonia in the compromised host including cancer patients and transplant patients//Infect. Dis. Clin. North. Am. 1998; 12: 781.
- Junghanss C., Marr K. A. Infectious risks and outcomes after stem cell transplantation: are nonmyeloablative transplants changing the picture?//Curr. Opin. Infect. Dis. 2002; 15: 347.
- Bodey G., Rodriguez V., Chang H. et al. Fever and infection in leukemic patients: A study of 494 consecutive patients. Cancer. 1978; 41: 1610.
- Coker D. D., Morris D. M., Coleman J. J. et al. Infection among 210 patients with surgically staged Hodgkin's disease//Am. J. Med. 1983; 75: 97.
- Sickles E. A., Greene W. H., Wiernik P. H. Clinical presentation of infection in granulocytopenic patients//Arch. Intern. Med. 1975; 135: 715.
- Rubin R. H., Greene R. Clinical approach to the compromised host with fever and pulmonary infiltrates//In: Clinical Approach to Infection in the Compromised Host, 3rd edition, Rubin R. H., Young L. S. (Eds), Plenum Press, New York. 1994; 121.
- LiPuma J. J., Spilker T., Coenye T., Gonzalez C. F. An epidemic Burkholderia cepacia complex strain identified in soil//Lancet. 2002; 359: 2002.
- Escalante C. P., Rubenstein E. B., Rolston K. V. Outpatient antibiotics therapy for febrile episodes in low-risk neutropenic patients with cancer//Cancer Invest. 1997; 15: 237.
- Talcott J. A., Whalen A., Clark J. et al. Home antibiotic therapy for low-risk cancer patients with fever and neutropenia: A pilot study of 30 patients based on a validated prediction rule//J. Clin. Oncol. 1994; 12: 107.
- Rosenow E. C., Wilson W. R., Cockerill F. R. Pulmonary disease in the immunocompromised host//Mayo. Clin. Proc. 1985; 60: 473.
- Junghanss C., Marr K. A., Carter R. A. et al. Incidence and outcome of bacterial and fungal infections following nonmyeloablative compared with myeloablative allogeneic hematopoietic stem cell transplantation: a matched control study//Biol. Blood. Marrow. Transplant. 2002; 8: 512.
- Ascioglu S., Rex J. H., de Pauw B. et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus//Clin. Infect. Dis. 2002; 34: 7.
- Fishman J. A. Prevention of infection due to Pneumocystis carinii//Antimicrob. Agents. Chemother. 1998; 42: 995.
- Fishman J. A. Treatment of infection due to Pneumocystis carinii//Antimicrob Agents. Chemother. 1998; 42: 1309.
- Furrer H., Egger M., Opravil M. et al. Discontinuation of primary prophylaxis against Pneumocystis carinii pneumonia in HIV-1-infected adults treated with combination antiretroviral therapy. Swiss HIV Cohort Study//N. Engl. J. Med. 1999; 340: 1301.
А. Ф. Шепеленко, доктор медицинских наук, доцент
М. Б. Миронов, кандидат медицинских наук
А. А. Попов
Главный военный клинический госпиталь им. Н. Н. Бурденко,
ММА им. И. М. Сеченова, ГИУВ МО РФ, Москва
Отмена профилактики пневмоцистной пневмонии после интенсивной антиретровирусной терапии безопасна
Translated, with the permission of ACP—ASIM from: "Discontinuation of prophylaxis for Pneumocystis carinii pneumonia was safe after highly active antiretroviral therapy". ACP J Club 2001;135:26. Abstract of: Lopez Bernaldo de Quiros J.C., Miro J.M., Peсa J.M., et al., and the Grupo de Estudio del SIDA 04/98. A randomized trial of the discontinuation of primary and secondary prophylaxis against Pneumocystis carinii pneumonia after highly active antiretroviral therapy in patients with HIV infection. N Engl J Med 2001;344:159—67, and from the accompanying Commentary by A. McIvor.
Оценить безопасность отмены первичной и вторичной профилактики пневмоцистной пневмонии при ВИЧ-инфекции, если антиретровирусная терапия привела к улучшению функции иммунной системы, а число лимфоцитов CD4+ в крови составляет і 200 в 1 мкл.
Рандомизированное (со скрытым отнесением участников к той или иной группе)* открытое контролируемое испытание; средняя продолжительность наблюдения в группах первичной и вторичной профилактики — 20 и 12 мес соотв.
19 больниц в Испании.
Из 587 больных 474 (медиана возраста 36 лет, 73% мужчины) составили группу первичной, а 113 (медиана возраста 37 лет, 76% мужчины) — группу вторичной профилактики (ранее перенесшие пневмоцистную пневмонию). Критерии включения: наличие ВИЧ-инфекции, число лимфоцитов CD4+ в крови в прошлом і 200 в 1 мкл, уровень РНК ВИЧ-1 в плазме крови 3 мес); оценка по шкале Карновского >80. Критерии исключения: возраст і 200 в 1 мкл, безопасна.
Источники финансирования: Grupo de Estudio del SIDA de la Sociedad Espaсola da Enfermedades Infeciosas y Microbiologнa Clнnica (GESIDA/SEIMC); National AIDS Plan Secretariat of the Spanish Ministry of Health; DuPont Pharma Laboratories.
Адрес для корреспонденции: Dr. J.C. Lopez Bernaldo de Quiros, Division of Infectious Diseases, Hospital Gregorio Maraсуn, Dr. Esquedro 46, 28007 Madrid, Spain. FAX 349-158-685-92.
*Данные предоставлены автором.
В 80-х годах у ВИЧ-инфицированных широко применяли первичную или пожизненную вторичную профилактику пневмоцистной пневмонии, поскольку это заболевание было распространенным осложнением ВИЧ-инфекции. В настоящее время при ВИЧ-инфекции назначают интенсивную антиретровирусную терапию, направленную на подавление репликации вируса и увеличение числа лимфоцитов CD4+. Каковы же результаты такого лечения?
J.C. Lopez Bernaldo de Quiros et al. показали, что эффективная антиретровирусная терапия позволяет отменить первичную и вторичную профилактику пневмоцистной пневмонии. Аналогичные результаты были получены в других исследованиях, одно из которых было посвящено первичной [1], а другое — вторичной [2] профилактике этого заболевания.
Безопасность отмены первичной и вторичной профилактики пневмоцистной пневмонии в тех случаях, когда после интенсивного антиретровирусного лечения число лимфоцитов CD4+ в плазме крови составляет і 200 в 1 мкл в течение і 3 мес, убедительно доказана. Данных о безопасности отмены при кандидозе рта, продолжающемся уменьшении массы тела, терапии цитотоксическими средствами и длительном применении кортикостероидных препаратов недостаточно.
Полученные J.C. Lopez Bernaldo de Quiros et al. результаты согласуются с недавно разработанными рекомендациями [3]. При ухудшении результатов антиретровирусной терапии профилактику пневмоцистной пневмонии следует возобновить. Врачи должны следить за состоянием больных и числом лимфоцитов CD4+ у них в плазме крови и использовать приведенные выше критерии для принятия решения о возобновлении или отмене профилактики.
Andrew McIvor, MD
Halifax, Nova Scotia, Canada
1. Furrer H., Egger M., Opravil M., et al. Discontinuation of primary prophylaxis against Pneumocystis carinii pneumonia in HIV-1 infected adults treated with combination antiretroviral therapy. N Engl J Med 1999;340:1301—6.
2. Lederberger B., Mocroft A., Reiss P., et al. Discontinuation of secondary prophylaxis against Pneumocystis carinii pneumonia in patients with HIV infection who have a response to antiretroviral therapy. N Engl J Med 2001;344:168—74.
Производится перенаправление с сайта
Всероссийской акции по тестированию на ВИЧ-инфекцию

- Главная
- Лечение
- ВИЧ и заболевания легких

ВИЧ-инфекция – заболевание, которое опасно, помимо прочего, тем, что вместе с ним в организме начинают развиваться оппортунистические заболевания. Которые зачастую являются причинами очень серьезных осложнений, а порой даже смерти. Наиболее часто при ВИЧ-инфекции поражается органы дыхательной системы.
Опасность ВИЧ состоит в том, что помимо угнетения иммунной системы, он создает благоприятные условия для развития различных заболеваний, вызванных самыми разными возбудителями. Многие из них, при здоровом иммунитете не оказывают на организм негативного воздействия, но стоит иммунитету ослабнуть настолько, что его ответ на действие возбудителя оказывается недостаточным, как вирусы, бактерии или грибки начинают разрушать человеческий организм. Одним из самых распространенных заболеваний при ВИЧ-инфекции является пневмония.
Пневмония как оппортунистическое заболевание может быть нескольких видов. Одним из самых опасных видов пневмонии является пневмоцистная. Возбудителями этой пневмонии являются простейшие Pneumocystis carinii. Они являются условно-патогенными и очень часто в спящем состоянии живут в организме человека, не причиняя ему никакого вреда. Но если иммунитет падает, то происходит реактивация этих простейших, и они начинают оказывать крайне негативное воздействие на легкие человека. Наибольшая вероятность реактивации возбудителя пневмоцистной пневмонии является ситуация, когда клеток CD4 менее 200. Основными проявлениями болезни являются: лихорадка, одышка, кашель, боль в легких, выделение мокроты. Если в прошлом смертность от пневмоцистной пневмонии при ВИЧ-инфекции или СПИДе была достаточно высокой, то сегодня, благодаря антиретровирусной терапии, которая значительно снижает воздействия ВИЧ на иммунитет организма, а значит, повышает количество CD4, которые могут дать необходимый иммунный ответ, в большинстве случаев её можно вылечить.
Не менее распространенным видом пневмонии является бактериальная. Основным и наиболее часто встречаемым возбудителем оппортунистической пневмонии является Streptococcus pneumoniae или пневмококк. Возникает она в основном при низком показателе Т-хелперов (CD4 ниже 200), но дополнительными факторами риска являются употребление инъекционных наркотиков, курение, употребление алкогольных напитков. Такая пневмония крайне опасна, хотя её и возможно вылечить. Тем не менее, очень часто возникают рецидивы.
Еще одним очень опасным заболеванием, которое, зачастую, является сопутствующим при ВИЧ-инфекции и СПИДе, является туберкулез. Возбудителем этого заболевания является палочка Коха. По статистике почти третья часть населения планеты являются носителями палочки Коха. Но, при хорошо функционирующей иммунной системе, возбудитель туберкулеза находится в спящем состоянии и не наносит человеку вреда. Одна из основных опасностей туберкулеза при ВИЧ-инфекции в том, что вирус иммунодефицита, под воздействием палочки Коха, начинает значительно быстрее размножаться в организме. А ВИЧ, в свою очередь, ослабляет организм до такой степени, что и туберкулез начинает развиваться активнее. Параллельное лечение этих заболеваний осложняется тем, что противотуберкулезные препараты действуют на печень таким образом, что она начинает активно разрушать препараты, направленные на лечение ВИЧ-инфекции.
Помимо перечисленных заболеваний, при ВИЧ-инфекции в легких могут развиваться кандидоз, криптококкоз, цитомегаловирусная инфекция и ряд других. Зачастую эти заболевания могут возникать и развиваться в организме параллельно, что значительно усложняет лечение. Большинство из этих заболеваний у здорового человека не появятся, но если у вас ВИЧ, то вам необходимо следить за своим иммунным статусом, отслеживать количество лимфоцитов, чтобы предотвратить возникновение тех или иных заболеваний легких.
Читайте также:


