Лечение гепатита с лайффероном и рибавирином
Сегодня мировым стандартом в лечении вирусного гепатита С стала комбинированная терапия ИФН и рибавирином. Важно отметить, что свой антивирусный эффект рибавирин оказывает только в присутствии ИФН (монотерапия рибавирином неэффективна), что снижает формирование резистентности HCV к препарату. Хотя у 20-25 % больных на фоне монотерапии рибавирином уровень трансаминаз нормализуется, а после отмены препарата происходит возврат повышенных показателей ферментов.
По данным специалистов Кокрановской группы [по изучению заболеваний печени (Brok J., et.al., 2005)] анализ 72 протоколов клинических исследований (выборка включала 9991 пациента) с применением интерферона+рибавирина, выявил гистологический и вирусологический ответ у 40 % больных. При этом отмечено множество нежелательных реакций (гематологического, дерматологического, гастроэнтерологического типов), возникших на фоне терапии, негативно сказываясь на качестве жизни пациентов. На выраженные побочные эффекты с отменой препаратов в 56 % случаев, указывают в своих исследованиях T. Nacamura et.al. (2005), Y. Iwasaki.(2006).
С целью совершенствования терапии A.Tsubota et al. (2004) апробировал, при хроническом гепатите С у больных с 1b генотипом, терапию интерфероном, используя его в высоких дозах (интерферон назначался по 6 млн МЕ ежедневно в течение двух недель, а затем в течение 22-х недель три раза в неделю также по 6 млн МЕ), а рибавирин вводился больным в дозе 800 мг/сутки длительностью 24 недели; получен биохимический ответ у 81 % больных, ранний вирусологический в 66 % случаев, а устойчивый вирусологический ответ сохранился лишь у 19 % больных.
В ряде стран мира, с целью повышения оказания качества медицинской помощи больным с хроническим гепатитом С, приняты стандарты лечения, предусматривающие применение пегилированных интерферонов в комбинации с рибавирином.
По данным I.M.Jacobson et.al. (2005), больные 1 генотипом, не ответившие на монотерапию интерфероном и терапию с рибавирином (321 человек) дали вирусологический ответ лишь в 16 % случаев, а C Camma (2005), получил вирусологический ответ у больных с 1-м генотипом в 54-56 % случаев.
Рандомизированные исследования, проведенные Барбакадзе Г.Г. (2005), позволили установить, что применение пегилированного интерферона с рибавирином (при 1 генотипе) обеспечивает устойчивый вирусологический ответ в 45 % случаев.
Естественное течение хронического вирусного гепатита С характеризуется формированием фиброза печени, прогрессирование которого приводит к развитию цирроза печени. Использование препаратов интерферонового ряда и ненуклеозидных аналогов вероятно способно замедлить прогрессирование фиброза печени и снизить частоту формирования гепатоцеллюлярного рака. Вместе с тем, можно отметить один обнадеживающий факт, что даже при отсутствии биохимического и вирусологического ответа, у больных, получавших интерфероны, отмечается позитивный гистологический ответ, характеризующийся уменьшением выраженности воспалительного процесса в печени. Однако, значительные экономические затраты, связанные с лечением, а также высокая частота развития нежелательных побочных реакций от лечения, снижают приверженность пациентов к терапии.
Olveria A., et.al. (2003), включил в комплексную терапию амантадин 39 больным с 1 генотипом, не ответившим на терапию интерфероном и рибавирином. Вирус не выявлялся у 12,8 % больных в течение 48 недель, и у 5,1 % пациентов после 24 недель терапии. Вирусологический ответ получен в 26,3 % случаев, а устойчиво сохранился - у 10,5 % больных.
Существующая противовирусная терапия не обеспечивает ожидаемого терапевтического эффекта, вызывая нежелательные реакции (анемия, депрессия, почечная патология и другие).
В патогенезе HСV-инфекции существенное значение имеет репликативная активность вируса и его взаимодействие с иммунной системой человека, поскольку элиминация вируса обеспечивается адекватным иммунным ответом, а недостаточная интенсивность иммунного воспаления способствует персистенции вируса. Улучшить качество проводимой терапии, с включением в комплекс лечебных мероприятий иммуномодуляторов, модулирующих реакции иммунного ответа (синтез цитокинов) попытались V.K. Rustgi (2005), L. Milazzo (2006),.
Даже если не предавать значения полученной у 40 % больных резистентности к препаратам интерферона, то сроки лечения у хорошо отвечающих на терапию пациентов позволяют говорить, что современная терапия гепатита С, с точки зрения стратегии экспрессии вирусного генома, при длительном применении нуждается в корректировке.
Вирус гепатита С не дает прямого цитопатического эффекта, цитолиз гепатоцитов не связан с активной репродукцией вируса, или действием его белков на клеточные функции. Репликация РНК обеспечивает эффективную индукцию активности протеинкиназы (PKR), определяющей функциональный ответ клеток на действие интерферона, оказывающего прямое действие на репликацию РНК вируса гепатита С. Если с рибавирином можно обсуждать опосредованные влияния на вирусную репродукцию, то для амантадина существует только одна мишень среди вирусных белков, это белок р7, являющийся аналогом гриппозного белка М2. Препараты адамантанового ряда, действуя как блокаторы вирусспецифических ионных каналов, не позволяют выявить в его структуре адамант связывающие сайты, но другие производные этой группы, могут оказаться более эффективны в подавлении функции белка р7 вируса гепатита С. Большие перспективы связываются с соединениями борадаматана, которые связываются с CD81-рецепторами, специфичными для гепатита С на клетках печени.
Возвращаясь к белку NS5a, необходимо сказать, что он приводит к нарушению окислительного фосфорилирования в митохондриях и усилению генерирования свободных радикалов, за счет освобождения кальция из эндоплазматического ретикулума в цитоплазму, вызывая активацию транскрипционного фактора NF-kb, который обрывается при добавлении антиоксидантов. Но активация NF-kb может обеспечить антиапоптический эффект в развитии инфекционного процесса и приводить к трансформации гепатоцитов.
Развитие воспалительного процесса в печени и презентация вирусных антигенов на поверхности гепатоцитов приводит к активации иммунных реакций, направленных на лизис зараженных клеток. При персистенции вируса постоянная презентация вирусных антигенов активно поддерживает иммунный ответ Т-лимфоцитов, поддерживая деструктивный процесс, в котором участвуют как СD 8+, так и CD4+ - Т-лимфоциты, определяющие эрадикацию вируса или переход инфекции в стадию персистенции. Иммунный ответ, контролируемый CD4+-лимфоцитами, подразделяется на тип 1 (Th-1) и тип 2 (Th-2). Th-2 продуцируют ИЛ-4 и ИЛ-10, синтезирующих специфические антитела, осуществляющие контроль за Th-1-иммунным ответом.
Функции ИЛ-10 детально исследованы в связи с анализом природы резистентности к интерферонотерапии. Развитие иммунного ответа, контролируемого ИЛ-10, связано с Th2-клетками, что сопровождается активной секрецией этими клетками и ИЛ-4, и ИЛ-10. Последний подавляет синтез и ИЛ-1, и ИЛ-6, и ФНО, данное обстоятельство не принимается во внимание при исследовании резистентности к интерферонам 1-го типа при проведении интерферонотерапии, а именно дисбаланс между Th-1и Th-2 ответом, при инфекции, вызванной вирусом гепатита С, ответственен за прогрессивное течение заболевания и отсутствие элиминации возбудителя. Преобладание Th-1-ответа приводит к усилению воспалительно-некротического компонента, активируя фиброз, а сильный Th-2-ответ является основой для развития хронического персистентного инфекционного процесса.
Таким образом, повышенный синтез Th-1-цитокинов необходим для активной защиты от инфекции, вызванной вирусом гепатита С, а Th-2-цитокины, подавляя иммунные реакции, усиливают возможность перехода острого инфекционного процесса в хронический, при этом становится очевидным, что оценка типа иммунного ответа является основой не только для прогноза течения заболевания, но и для адекватной терапии.
Понимание негативных функций ИЛ-10 и противостояния вируса гепатита С интерферонотерапии ставит вопрос о поиске других подходов к улучшению лечения гепатита С (разработка селективных ингибиторов ИЛ-10 для повышения эффективности терапии, улучшения качества проводимой терапии с включением в комплекс лечебных мероприятий иммуномодуляторов, модулирующих реакции иммунного ответа, воздействием на иммунокомпетентные клетки с индукцией синтеза цитокинов.
L.Milazzo (2006), не ответившим на терапию интерфероном и рибавирином больным, применял талидомид, модулирующий CD8+ лимфоциты, блокирующий ФНО. Автор выявил корреляцию цитолиза и активности ФНО.
Перспективы применения индукторов интерферона более значительны, чем применение препаратов интерферона, поскольку противовирусная активность индукторов интерферона, совпадает с активностью экзогенных интерферонов, с отсутствием и сведением к минимуму нежелательных реакций, присущих длительной интерферонотерапии, что является весьма привлекательным, поэтому индукторы интерферона, как реактиваторы системы интерферона, начинают постепенно вытеснять препараты рекомбинантного интерферона.
Таблица 1
Влияние циклоферона на инфекционную активность HCV культуре клеток МТ-4
Пробы культуральной жидкости из ВГС инфицированных культур клеток МТ-4, обработанных:
Титры HCV (Lg ТЦД50 /20 мкл) на день
наблюдения за инфицированными
культурами клеток

Рибавирин-ЛИПИНТ® (Ribavirin-LIPINT)
Инструкция по применению, противопоказания и состав
Какой рибавирин лучше?
Рибавирин – противовирусный препарат, синтетический аналог нуклеозидов, механизм действия которых заключается в конкурентном ингибировании дегидрогеназы аденозинмонофосфата, что приводит к торможению синтеза вирусных РНК и ДНК. При этом рибавирин селективно ингибирует синтез вирусной РНК, не подавляя синтез РНК в нормально функционирующих клетках. Рибавирин легко проникает в пораженные клетки и быстро фосфорилируется внутриклеточной аденозинкиназой в рибавирин моно-, ди- и трифосфат. Эти метаболиты, особенно рибавирина трифосфат, обладают выраженной противовирусной активностью. Рибавирин ингибирует репликацию новых вирионов, что обеспечивает снижение вирусной нагрузки. Препараты рибавирина эффективны в отношении многих ДНК и РНК вирусов, не чувствительных к другим антивирусным препаратам. Из ДНК–содержащих вирусов наиболее чувствительными к рибавирину являются: Simple herpes virus, poks-virus, virus Mareks illness; а из РНК-содержащих вирусов - Influenza A B, paramyxovirus.
Основной способ применения - приём внутрь из расчёта 15 мг/кг/сут, что соответст-вует 800-1200 мг в день. Рибавирин легко всасывается после приема внутрь разовой дозы препарата (Тмаx=1,5 ч), после чего он быстро распределяется в организме. Абсолютная биодоступность составляет примерно 45-65 %. Существует линейная зави-симость между дозой и показателем биодоступности при приеме разовых доз рибавири-на в количестве от 200 до 1200 мг. Рибавирин не связывается с белками плазмы.
Выводится рибавирин из организма медленно - после прекращения приема период полувыведения составляет около 298 часов, что говорит о его замедленном выведении из других участков организма, кроме плазмы. 10% выделяется с мочой.
Основной недостаток - токсичность
Несмотря на высокую активность рибавирина против многих вирусов, препарат не нашел широкого применения в практике здравоохранения из-за выраженной токсичности и используется в основном для лечения хронического гепатита С в комбинации с препаратами интерферона альфа.
Приём рибавирина противопоказан детям и подросткам до 18 лет, пожилым пациентам старше 60 лет, беременным, пациентам с тяжёлыми заболеваниями сердца, щитовидной железы с гормональной дисфункцией, с онкологическими заболеваниями, туберкулёзом, почечной недостаточностью, энцефалопатией, эпилепсией, другими психическими заболеваниями. Капсулированная и таблетированная формы при применении вызывают серьёзные побочные эффекты у пациентов, такие как, например, гемолитическая анемия. Гемолиз - основной токсический эффект рибавирина. Уменьшение уровня гемоглобина на 20 г/л, 30 г/л и 40 г/л наблюдалось соответственно у 31%, 27% и 23% больных, получавших комбинированную терапию рибавирином и интерфероном альфа-2b в течение 48 недель. Исходя из этого, в процессе лечения необходимо контролировать содержание гемоглобина, билирубина и мочевой кислоты. Типичными побочными эффектами являются диспноэ, кашель, нарушения сна, экзантема. Реже проявляются гриппоподобные явления с температурой, головной болью и болью в суставах, похудание, тошнота, выпадение волос, депрессия.
Редко наблюдаются наблюдаются изменения концентрации ТТГ и, как следствие, нарушения функции щитовидной железы, а также аллергические реакции (крапивница, бронхоспазм, анафилаксия). Нарушение функции щитовидной железы, требовавшее терапевтического лечения наблюдалось в 3% случаев. Крайне редко возникают симптомы аутоиммунных заболеваний, артериальной гипотензии, лейкопения, тромбоцитопения. В большинстве случаев анемия, лейкопения, нейтропения, гранулоцитопения и тромбоцито-пения были мало выражены. Все наблюдаемые эффекты обратимы.
Рибавирин обладает эмбриотоксическим и тератогенным действием в дозах, значительно более низких, чем рекомендован для клинического применения, в связи с чем, больные (мужчины и женщины), принимающие рибавирин, а также их партнеры должны пользоваться эффективными контрацептивными средствами во время лечения и в течение 7 месяцев после его окончания; ежемесячно в течение всего этого периода женщинам необходимо проводить тесты на беременность.
Адресная доставка: токсичность ниже, эффективность выше
Рибавирин-ЛИПИНТ – новый препарат липосомального рибавирина, использующий механизм адресной доставки вещества. Рибавирин-ЛИПИНТ обладает меньшей токсичностью и более высокой терапевтической эффективностью, чем существующие препараты рибавирина.
Уникальная нанотехнология позволила заключить рибавирин в мельчайшие, искусственно созданные биоконтейнеры – липосомы. Это сферические микрочастицы, заполненные жидкостью. Их оболочка (мембрана) состоит из молекул тех же природных фосфолипидов, что входят в состав клеточных мембран. Доказано, что липосомы не обладают токсичностью и полностью биодеградируемы. Рибавирин, находящийся в липосоме, защищен от разрушения при воздействии внутренней среды организма. С другой стороны - оболочка не позволяет токсичному препарату превысить допустимую концентрацию в крови. Липосомы выполняют роль контейнера, из которого препарат высвобождается постепенно, в нужных дозах, и самое главное - в определенных органах-мишенях.
Уже в ЖКТ липосомы начинают предохранять рибавирин от разрушения. Всасывание происходит в проксимальной части тонкого кишечника. Известно, что тонко эмульгированные жиры, с величиной жировых капелек не более 0,5 мкм, частично всасываются через стенку кишечника без предварительного гидролиза. Средний размер липосом в препарате Рибавирин-ЛИПИНТ составляет 0,25 мкм. По своей физико-химической природе препарат оказывается подобен эмульгированным жирам. Частичное всасывание и взаимодействие со слизистой кишечника происходит без гидролиза и, соответственно, без деградации липосом, что способствует увеличению терапевтической эффективности рибавирина.
Поступив в кровяное русло, липосомы не связываются с белками крови, захватываются макрофагами и быстро оседают в органах мононуклеарно-фагоцитарной системы (МФС), преимущественно в печени. Так, естественная нацеленность макрофагов на липосомы реализует механизм адресной доставки рибавирина в печень. Это позволяет достичь максимальной концентрации рибавирина в печени и других органах МФС, и минимальной в крови. Быстрое выведение препарата Рибавирин-ЛИПИНТ из крови позволяет значительно снизить гемолитичес-кое действие рибавирина. Рибави-рин, заключенный в липосомы, не задерживается такими органами, как сердце, почки, мозг, а также клетками нервной системы, что значительно снижает кардиоток-сичность, нефротоксичность и нейротоксичность препарата.
Таким образом, липосомальная форма рибавирина обладает более низкой токсичностью, более высокой терапевтической эффективностью и биодоступностью, что подтверждено доклиническими и клиническими исследованиями Рибавирин-ЛИПИНТА.
Результаты доклинических испытаний
Доклинические испытания проводились в Российском кардиологическом научно-производственном комплексе Министерства здравоохранения Российской Федерации НИИ экспериментальной кардиологии [7].
Программа токсикологического исследования включала изучение токсичности и переносимости данной лекарственной формы. Кроме того, было проведено изучение аллергизирующих свойств препарата.
Подводя итоги токсикологического изучения новой лекарственной формы рибавирина для приема внутрь Рибавирин-ЛИПИНТ при различных способах однократного введения лабораторным собакам, можно отметить, что данная лекарственная форма препарата является малотоксичной.
Изучение токсичности в условиях хронического эксперимента проведено на собаках при ежедневном 1-месячном введении в желудок препарата в готовой лекарственной форме в дозе 133 мг/кг, превышающей высшую суточную дозу для человека (1000 мг/чел./сутки или 13,3 мг/кг/сутки) в 10 раз.
Как показали проведенные исследования, в испытанной дозе препарат хорошо переносится животными и не влияет на гематологические показа-тели, функциональное состояние основных органов и систем организма (по данным использованных биохимических тестов и ЭКГ). Отсутствие токсичес-ких повреждений внутренних органов, связанных с действием препарата, было подтверждено результатами патоморфологических исследований, проведенных после окончания хронического эксперимента. При изучении аллергизирующих свойств установлено, что при 5-кратном внутрижелудоч-ном введении морским свинкам в сенсибилизирующих дозах 66,5 и 13,3 мг/кг и при внутрижелудочном введении разрешающей дозы препарата (133 мг/кг) на 14 и 21 дни после сенсибилизации Рибавирин-ЛИПИНТ не вызывает аллергических реакций по I-му типу.
Рибавирин-ЛИПИНТ в испытанных схемах сенсибилизации не проявляет аллергизирующего действия в реакции гиперчувствительности замедленного типа на морских свинках и в реакции подколенного лимфоузла у мышей.
Таким образом, новая липосомированная лекарственная форма рибавирина является малотоксичной. Так же, было установлено, что у липосомальной формы выше биодоступность (C max и AUC увеличивались на 70%), и за счет этого, возможно уменьшение терапевтической дозы и, как следствие, уменьшение побочных эффектов при лечении [7, 8].
Результаты клинических исследований
Табл. 1. Распределение больных по генотипу HCV.

Табл. 2. Характеристика больных по степени активности АЛТ и степени виремии.

Результаты исследования свидетельствуют о лучшей переносимости липосомального препарата Рибавирин-ЛИПИНТ у больных ХВГС. Пирогенных реакций не наблюдалось ни в одном случае. Со стороны клинического анализа крови не отмечалось изменений, потребовавших отмены лечения. В основной группе, использовавшей липосомированный Рибавирин-ЛИПИНТ, реже регистрировались побочные реакции, возможные при приеме рибавирина (желтуха, гипербилирубинемия, снижение гемоглобина и эритроцитов).
Несмотря на то, что благодаря адресной доставке, липосомальный Рибавирин способен к большей концентрации в печени, его токсическое влияние было в 1.75 раза меньше, чем в контрольной группе.

Желтушный синдром, как побочный эффект, на фоне применения липосо-мального Рибавирина встречался реже.
У больных, получавших липосомальный рибавирин, уже через 2-4 недели значительно улучшалось самочувствие. Имевшие место астено-вегетативные явления значительно уменьшались или полностью исчезали, повышалась работоспособность. В группе, получавшей обычный рибавирин, клиническое улучшение самочувствия наступало несколько позже - к концу второго месяца лечения.

Уменьшение/нормализация размеров печени наступала быстрее у больных, получавших Рибавирин-ЛИПИНТ. Так, к концу первого месяца, у 26% больных основной группы печень пальпировалась у края реберной дуги, в то время, как в контрольной группе – только к 3 месяцу лечения. Похожая динамика наблюдалась в отношении уменьшения размеров селезенки.
Нормализация уровня АЛТ в основной группе происходило быстрее, чем в контрольной. Через 6 месяцев лечения, к окончанию курса, активность АЛТ в контрольной группе все же превышала норму, в основной – не превышала. Изменения уровня АСТ в процессе лечения имели такую же тенденцию, как у АЛТ - более быстрая и стойкая нормализация активности АСТ происходи-ла в группе, получавшей липосомированный Рибавирин-ЛИПИНТ.

Наряду с клиническим улучшением отмечалось снижение уровня ферментемии уже через 2 недели приема препаратов. К 6 месяцам лечения в основной группе положительный биохимический эффект наблюдался в 1,4 раза чаще чем в контрольной группе.
Улучшение клинико-биохимических показателей происходило параллельно с уменьшением или исчезновением степени виремии. Через 2 месяца от начала лечения РНК HCV в основной группе сохранялась в 1,7 раза реже, чем в контрольной группе, а через 6 месяцев - в 2,75 раза реже, чем в контрольной.
Стойкий вирусологический ответ через 6 месяцев после окончания лечения был получен у 67,9% больных основной группы, в то время как в контрольной – у 48,2% больных.
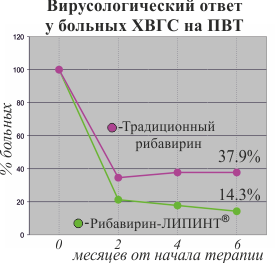
Наиболее выраженное влияние противо-вирусной терапии на содержание РНК HCV наблюдалось в основной группе.
Рекомендации по применению
Рибавирин-ЛИПИНТ, лиофилизат для приготовления суспензии для приема внутрь, показан к применению для лечения хронического вирусного гепатита С в комбинации с интерфероном альфа-2b:
- для первичной терапии ранее не лечившихся интерфероном альфа пациентов;
- при обострении после курса монотерапии интерфероном альфа у больных, не восприимчивых к монотерапии интерфероном альфа.
Препарат принимают внутрь одновременно с приемом пищи. Непосредственно перед применением к содержимому флакона добавляют 10-20 мл дистиллированной или охлажденной кипяченой воды. При встряхивании от 1 до 5 мин должна образоваться однородная суспензия.
Рекомендованы следующие схемы лечения:
Вторая схема, с применением липосомального рибавирина и липосо-мального интерферона, апробирована клиническими исследованиями, оказалась высоко эффективной в лечении ХВГС, хорошо переносимой. Показано, что данная схема, по клиническим, биохимическим и вирусологическим показателям, превосходит стандартную комплексную схему противовирусной терапии с применением традиционных препаратов.
Длительность курса комбинированной терапии по данным схемам, как правило, составляет 24-48 нед. (для ранее не лечившихся пациентов - не менее 24 нед., а у пациентов с вирусом генотипа 1 - 48 нед.). При невосприимчивости к монотерапии интерфероном альфа или с рецидивом заболевания длительность курса составляет не менее 6 мес.
Актуальность. Проблема этиотропного лечения хронического вирусного гепатита С (ХВГС), несмотря на большое количество исследований, по-прежнему остается актуальной и до конца не решена.
Эффективность лечения по данным разных исследователей не превышает 46-51% у больных ХВГС с 1-м генотипом и 70-80% у больных ХВГС с не 1-м генотипом 2. Так же ограничивают их применение высокая стоимость препаратов и большое количество побочных эффектов от проводимой терапии. Целью проведения этиотропной терапии ХВГС является подавление вирусной репликации, эрадикация вируса из организма и, соответственно, прекращение инфекционного процесса. Даже отсутствие вирусологического эффекта при специфической терапии приводит к замедлению прогрессирования заболевания, стабилизации или регрессии патологических изменений в печени, предупреждению формирования цирроза печени и первичной гепатоцеллюлярной карциномы, а также повышению качества жизни.
Оценку эффективности специфического лечения осуществляют на основании нескольких критериев: вирусологического (исчезновение рибонуклеиновой кислоты (РНК) вируса из сыворотки крови), биохимического (стойкая нормализация уровня ферментов печени) и морфологического (уменьшение индекса гистологической активности и стадии фиброза).
В целом около 5% больных [1,5] вынуждены отказаться от специфического противовирусного лечения в начале курса из-за многочисленных побочных эффектов, а 20% не доводят его до конца.
Побочные эффекты интерферона (ИФН) и рибавирина иногда вынуждают временно или постоянно снижать их дозы или отменять препараты. Некоторыми исследователями [5] показано, что для достижения устойчивого вирусологического ответа (УВО) необходимо получение не менее 2/3 дозы ИФН и рибавирина, поэтому эффективность комбинированной противовирусной терапии (КПВТ) напрямую зависит от наличия побочных эффектов и возможностью их коррекции.
Некоторые побочные эффекты не требуют медикаментозной терапии, так как носят легкий или среднетяжелый характер, другие - тяжелый и угрожающий жизни характер, при этом необходима специфическая коррекция. Как правило, после окончания терапии большинство побочных эффектов полностью исчезает без применения симптоматической терапии.
Проблема побочных эффектов на фоне проводимой КПВТ остается до конца не изученной, несмотря на проведенные многочисленные исследования.
Основными побочными явлениями, описанными в литературе, являются: гематологические изменения; гриппоподобный, диспепсический, неврологический и астеновегетативный синдромы; аутоиммунные поражения; снижение массы тела; выпадение волос; огрубение кожи; аллергические реакции различной степени выраженности; местная реакция в области введения интерферонов.
Таким образом, проблема побочного действия комбинированного противовирусного лечения ХВГС, его влияние на достижение УВО является актуальной в настоящее время.
Целью данного исследования было изучение побочных явлений КПВТ в зависимости от схемы лечения, сопутствующих заболеваний, влияние на достижение УВО. Для достижения поставленной цели были сформулированы следующие задачи: оценить переносимость КПВТ пациентами с различными схемами терапии, выявить частоту побочных эффектов КПВТ и взаимосвязь их с достижением УВО.
Материалы и методы. В исследование были включены 50 пациентов с установленным диагнозом ХВГС, которые получали КПВТ. Диагноз был подтвержден согласно общепринятым методикам.
Из исследования исключались пациенты с микст-инфекцией (вирусный гепатит В, ВИЧ-инфекция) а так же наличием сопутствующей патологии печени (первичный билиарный цирроз, болезнь Вильсона-Коновалова, синдром Бадда-Киари, гемохроматоз, аутоиммунный гепатит, дефицит альфа-1 антитрипсина) и предшествующего специфического противовирусного лечения по поводу ХВГС, больные с наличием любого из общепринятых противопоказаний для проведения КПВТ.
Продолжительность лечения составила 48 недель для пациентов, инфицированных генотипом 1в вирусного гепатита С или при наличии у больного цирроза печени; 24 недели для пациентов, инфицированных генотипом 2 и 3а. Согласно рекомендациям по ведению пациентов с ХВГС, КПВП включала комбинацию стандартного (Интрон или Альтевир 3 млн МЕ 3 раза в неделю) или пегилированного (ПегИнтрон 120 мкг или Пегасис 180 мкг в неделю) ИФН и рибавирина в дозировке 800-1200 мг в зависимости от массы тела.
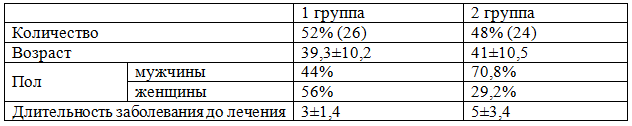
Устойчивый вирусологический ответ (УВО) определялся как отсутствие РНК вируса в сыворотке крови спустя 24 недели после окончания КПВТ. Больные находились под наблюдение в течение терапии на базе Воронежской областной клинической инфекционной больницы и поликлиник Воронежа. Все пациенты были разделены на 2 группы: получающие в составе КПВТ стандартные ИФН – 52,0% (26 человек) или пегилированные ИФН – 48,0% (24 человек). Пациенты были сопоставимы по возрасту и полу: средний возраст составил 40,3 ±10,4, количество мужчин - 57,1%, женщин 42,9%. Распределение по группам показано в табл. 1.
Таблица 1. Характеристика пациентов в исследуемых группах
При анализе полученных результатов использовались описательные методы математической статистики с применением пакета программ Microsoft Excel 2010. Достоверность различий оценивалась методами непараметрической статистики, статистически значимыми считались различия результатов при р≤0,05.
Результаты. При анализе эпидемиологических данных выяснено, что в большинстве случаев (34% случаев) ХВГС выявлен случайно, без клинических проявлений. Одинаковое количество пациентов (по 8 человек - 19,2%) обследовались по поводу диспепсических жалоб и длительного повышения печеночных ферментов. У 30 % пациентов в анамнезе отмечались неоднократные операции или переливание крови; употребление внутривенных наркотиков - у 16% человек. Длительность заболевания до начала противовирусной терапии составила в 1 группе 3±1,4 лет, во 2 группе 5±3,4лет. Степень фиброза по Metavir в среднем составил в 1 группе 1±0,85 балла, во второй группе выше - 1,9±1,5 баллов.
Соотношение генотипов вируса гепатита С, определенных до начала КПВТ, показано в табл. 2.
Таблица 2. Соотношение генотипов вирусного гепатита С
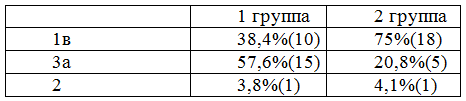
Среди всех пациентов УВО определялся в большинстве случаев - 80,0%, при применении обоих видов терапии, но при этом достоверных различий между группами по этому признаку не выявлено. Эффективность терапии в 1 группе составила 75,1%, во 2 группе - 78,2%. Отсутствие вирусологического ответа в половине случаев связано с отменой препаратов из-за развития выраженных побочных эффектов (прогрессирование неврологической симптоматики с развитием энцефалопатии в 1 группе, длительная некупируемая лихорадка во 2 группе).
Частота побочных эффектов в общей выборке была достаточно высокой - 72,3% среди всех пациентов, при этом в 1 и 2 группе нежелательные явления встречались с одинаковой частотой (69,1% и 73% соответственно).
На протяжении всей терапии у большинства пациентов встречался астеновегетативный синдром в виде выраженной слабости, усталости, нарушения сна, при этом значительно чаще эти проявления отмечали пациенты 2 группы - принимающие пегилированные ИФН (30,7%), что в 2,1 раза чаще, чем во 1 группе (66,6%). Снижение настроения, появление раздражительности, неконтролируемой агрессии при опросе отмечали 23,0% пациентов 1 группы и 25,0% пациентов 2 группы. Данные жалобы чаще встречались на 24±2 неделе терапии. Описанная в литературе депрессия, индуцированная КПВТ, среди данной выборки не встречалась. Для выявления депрессии у всех пациентов применялся опросник Цунга в начале и при завершении КПВТ.
Гриппоподобный синдром, проявляющийся лихорадкой до 38±0,85?С, миалгией, артралгией, выявлен достоверно чаще в у пациентов 1 группы (38,4%), чем у 2 группы (30,1%). Длительность лихорадки составляла в среднем 14±2 недель, первый подъем температуры всегда сопровождал начало КПВТ. Лихорадка купировалась применением препаратов НПВС в стандартных дозировках.
Жалобы со стороны желудочно-кишечного тракта в виде снижения аппетита, тошноты, периодической диареи, боли, вздутия в животе отмечались у 34,6% пациентов 1 группы, что в 2,08 раза чаще, чем во 2 группе (16,6%) .Желтуха на фоне КПВТ встречалась у 2 человек в каждой группе (по 8,3% и 7,6% соответственно).
Снижение веса в среднем на 10,5±5,1 кг, регистрируемое к концу КПВТ, встречалась в 2,3 раза чаще у пациентов 1 группы (19,2%) чем у пациентов среди пациентов 2 группы (8,3%).
Выпадение волос, жалобы на сухость кожи, зуд кожи регистрировались редко: в 1 группе у 2 человек (7,6%среди группы), во 2 группе чаще - у 3 человек(12,5%).
Обострение имеющихся сопутствующих соматических заболеваний встречались в обеих группах приблизительно с одинаковой частотой (30,1% и 27,6% соответственно). Чаще всего встречались обострения хронического панкреатита, язвенной болезни желудка, сахарного диабета.
Частота манифестации впервые выявленных соматических заболеваний на фоне проведения КПВТ имеет прямую корреляционную связь с используемыми препаратами, то есть значительно чаще выявляется при применении ИФН короткого действия, чем пролонгированных форм. При этом в 1 группе на фоне КПВТ манифестировали псориаз (7,6%), аутоиммунный тиреодит (15,3%). А во 2 группе выявлялись гипотиреоз и сахарный диабет (по 4,1% пациентов).
Гематологические осложнения встречались в обеих группах. Анемия, регистрируемая в виде снижения гемоглобина ниже 110г/л, встречалась чаще всего в середине терапии (24±3недели КПВТ). Во второй группе анемия выявлена достоверно чаще – в 2,4раза чаще (38,4%случаев), чем в 1 группе (16% случаев). Эритропоэтин для коррекции анемии применялся в 4 случаях (8%), у остальных коррекции анемии не требовалось.
Среди пациентов обеих групп при наличии анемии УВО встречается в 49,7% случаев, при отсутствии анемии достоверно реже (в 1,35 раз) - у 36,6% пациентов. Таким образом, наличие анемии, в сочетании с другими факторами можно считать предиктором эффективности КПВТ.
Напротив, частота тромбоцитопении на фоне КПВТ коррелировала с отсутствием УВО. Пациенты со снижением уровня тромбоцитов в 1,8 раз реже достигали УВО. Среди всех пациентов тромбоцитопения встречалась только у 8,0% пациентов, что реже, чем по литературным данным. В обеих группах частота данного побочного действия была одинаковой.
Выводы
1. Эффективность терапии с применением препаратов пегилированных или стандартных интерферонов оказалась сходной.
2. Гематологические нежелательные эффекты выявлены достоверно чаще при использовании пегилированных ИФН в составе противовирусной терапии.
3. Гриппоподобный на фоне КПВТ встречались достоверно чаще у пациентов, получающих стандартные ИФН.
4. Астеновегетативный синдром зарегистрирован чаще у пациентов на фоне терапии пегилированными ИФН.
5. Выявлена зависимость между достижением устойчивого вирусологического ответа и величиной снижения уровня гемоглобина.
Список использованных источников:
1. Беляева Н.М., Турьянов М.Х., Рабинович Э.З. Комбинированная терапия гепатита С рибавирином и альфа-интерфероном: Пособие для врачей. - М.: РМАПО. – 2002.
2. Громова Н.И. и Богомолов Б.П. Клиническая эффективность этиотропной терапии хронического вирусного гепатита С// Клин. мед. - 2003.-№1. - С.48.
3. Ивашкин В.Т. Комбинированное лечение хронического гепатита В// Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1998. №5. С. 57-60.
4. Ferenci P., Fried M., Shiffman M. et al. Predicting sustained virological responses in chronic hepatitis C patients treated with peginterferon alfa-2a// J. Hepatol. – 2005. – Vol. 43. – P. 425–433.
5. Fried M.W. Side effects of therapy of hepatitis C and their management. Hepatology. 2002. - P.237-244
6. Князькина О.В., Каган Ю.Д., Скачков М.В. Микробиоценоз кишечника у больных хроническим вирусным гепатитом С и его лечение// Врач-аспирант, №3.4(52), 2012. – С.579-586.
7. Пирогова И.Ю., Пышкин С.А. Неинвазивная диагностика стадии фиброза у пациентов с хроническими гепатитами В и С// Врач-аспирант, №2(45), 2011. – С. 21-27.
8. Попов С.С., Попов С.Ф. Динамика биохимических показателей гепато-билиарной системы рабочих основных цехов металлургического завода, инфицированных вирусами гемоконтактных гепатитов В и С// Врач-аспирант, №6(55), 2012. – С.55-61.
9. Рихсиева Г.М. Особенности клинико-иммунологических показателей детей, больных острыми вирусными гепатитами А и В, родившихся от матерей, злоупотребляющих алкоголем// Врач-аспирант, №4.4(47), 2011. – С. 675-681.
10. Рюмин А.М., Корочкина О.В., Соболевская О.Л. Закономерности естественного течения хронического гепатита В// Врач-аспирант, №4.1(53), 2012. – С. 214-223.
Читайте также:


