Лактазная недостаточность после ротавируса
Лактазная недостаточность (ЛН) в патогенезе гастроинтестинальных проявлений пищевой аллергии (ПА)
О. Шадрин отметил, что чаще всего ПА наблюдается у детей раннего возраста. По данным разных авторов, в зависимости от региона проживания, до 50% детей в возрасте до 1 года имеют проявления ПА, практически у 60% детей с ПА наблюдаются ее гастроинтестинальные проявления, возникающие на фоне кожных проявлений. Следует помнить, что гастроинтестинальная аллергия является составляющей ПА. Клинические проявления зависят от локализации поражения; у детей первых месяцев жизни чаще всего возникают кишечные колики.
ПА может иметь различный генез. Среди неблагоприятных реакций на пищу выделяют токсические неиммунные и нетоксические иммунные реакции. К последним относят иммуноглобулин (Ig) Е- опосредованные (крапивница, анафилаксия, желудочно-кишечные реакции немедленного типа, бронхоспазм, ПА на пыльцовые аллергены), смешанные (атопический дерматит, эозинофильный гастроэнтерит, бронхиальная астма) и не связанные с IgE (энтеропатия, проктоколит, синдром Гейнера, дерматит Дюринга, целиакия) реакции.
О. Шадрин подчеркнул, что самый частый аллерген у детей с гастроинтестинальной ПА — белки коровьего молока (БКМ). При ПА довольно часто отмечается ЛН. Показано, что у 76% больных с гастроинтестинальными проявлениями ПА формируется вторичная ЛН и дисбиоз кишечника.
Нерасщепленная лактоза — активный участник многих аллергических и аутоиммунных процессов. Основной ингибитор ПА — Galectin-9 (Gal-9) — участвует в иммунологическом каскаде, который реализует аллергию в организме. Нерасщепленная лактоза существенно влияет на содержание Gal-9; лактоза, связываясь с Gal-9, может выполнять разные регулирующие функции в иммунной системе, включая регуляцию Т-клеточных реакций. Ингибируя Gal-9, лактоза тем самым усиливает клеточно-опосредованные провоспалительные процессы в организме, индуцирует развитие аутоиммунных заболеваний, реакций гиперчувствительности замедленного типа, что, в свою очередь, приводит к стимуляции развития воспалительных и аллергических процессов у детей. В то же время не следует забывать, что лактоза — основной источник и регулятор метаболизма кишечных бактерий (при ее расщеплении микрофлорой толстого кишечника образуется молочная кислота, угнетающая рост патогенных бактерий, гнилостной и газообразующей флоры). Она стимулирует рост нормальной микрофлоры кишечника и выполняет роль пребиотика, снижет рН кишечного содержимого, участвует в создании галактозы, синтезе витаминов группы В, метаболизме многих витаминных и минеральных веществ, стимулирует собственную ферментативную активность.
О. Шадрин подчеркнул, что у детей раннего возраста поступление лактозы в организм является обязательным, без лактозы ребенка оставлять ни в коем случае нельзя. Главная задача врача — соблюсти равновесие между количеством поступающей лактозы у ребенка и возможностью его организма ее переваривать. Диагноз ЛН устанавливают исключительно на основании клинической картины и эффективности безлактозной диеты/введения фермента лактазы.
Для коррекции ЛН применяют фермент лактазу. Заместительная терапия ферментом лактазой устраняет основную причину детских колик, помогает усвоить молоко (грудное или смесь), обеспечивает младенцев источником питания, энергии для физиологического развития, способствует увеличению массы тела, особенно у недоношенных детей, успокаивает кишечный дискомфорт, снижает риск развития ПА.
ЛН у детей раннего возраста как одна из причин функциональной диареи

Профессор Ольга Белоусова, заведующая кафедрой педиатрической гастроэнтерологии и нутрициологии Харьковской медицинской академии последипломного образования, отметила, что дисахаридазная недостаточность является одним из вариантов синдрома мальабсорбции, в основе которого лежит нарушение расщепления и всасывания углеводов в тонкой кишке. Клинически дисахаридазная недостаточность проявляется хронической диареей, симптомы появляются при введении в рацион ребенка продуктов, содержащих непереносимый дисахарид.
Причинами длительных диарей у детей раннего возраста в 1% случаев является муковисцидоз, в 4% — глютензависимые заболевания (целиакия), в 25% — непереносимость БКМ, в 70% — дисахаридазная недостаточность, в частности ЛН, которая лидирует не только в группе недостаточности дисахаридаз, но и в группе длительных диарей у детей раннего возраста в целом.
Выделяют несколько типов ЛН. При вторичной ЛН происходит снижение активности лактазы, вызванное повреждением энтероцитов (инфекции, аллергии, воспалительный процесс, атрофия слизистой оболочки кишки), при первичной ЛН — снижение активности лактазы при морфологически сохранных энтероцитах из-за нарушения механизма активации фермента (выделяют врожденную (генетическую) ЛН, ЛН взрослого типа и транзиторную ЛН).
О. Белоусова подчеркнула, что диагноз ЛН устанавливают на основании клинических симптомов, существующие методы диагностики не представляют никакой диагностической ценности. В частности, генетическое исследование — определение генетических полиморфизмов, ассоциированных с нарушениями обмена лактозы методом полимеразной цепной реакции — не является тем анализом, который позволит определить наличие или отсутствие у ребенка ЛН.
У всех млекопитающих, и человек не является исключением, после прекращения вскармливания грудным молоком активность гена, кодирующего лактазу (LCT), постепенно снижается, это абсолютно нормальный и генетически запрограммированный процесс, гиполактазия взрослого типа является нормой, а не патологией. Но у определенного количества людей отмечается аномалия — они продолжают пожизненно сохранять высокую активность гена LCT и могут до конца жизни употреблять молоко в неограниченных количествах. В норме на определенном расстоянии от структурного гена лактазы в той же хромосоме (2q21) находится особая последовательность нуклеотидов, которая регулярно воздействует на экспрессию гена лактазы. Наличие именно цитозинового нуклеотида в положении 13910 обеспечивает угасание активности структурного гена и приводит к возрастному уменьшению количества лактазы в кишечнике, наличие тимидинового нуклеотида — обеспечивает пожизненную активность гена лактазы в кишечнике.

Докладчик подчеркнула, что анализ на полиморфизм 13910 С/Т не позволяет диагностировать врожденную ЛН (!), он исследует не структурный ген лактазы LCT, а то, какой нуклеотид находится в регулярной области вдали от гена LCT в положении 13910 — цитозиновый или тимидиновый. Таким образом, этот анализ дает возможность только прогнозировать, будет ли у пациента в зрелом возрасте наблюдаться переносимость лактозы, или у него будет ЛН по взрослому типу. Врожденная ЛН у детей грудного возраста не может быть верифицирована с помощью анализа на выявление полиморфизма 13910 С/Т.
При ЛН грудное вскармливание обязательно должно быть сохранено (!), мамы не должны придерживаться строгой безлактозной диеты, поскольку количество лактозы в грудном молоке не зависит от диеты матери. Прием безлактозных смесей при ЛН не показан, целесообразно назначение фермента лактозы.
Говоря о терапии диареи при ЛН, О. Белоусова обратила внимание на то, что выбор пробиотика, используемого в лечении детей с диареей, должен основываться на штаммоспецифичности. Так, Lactobacillus rhamnosus GG (LGG) — один из наиболее исследованных пробиотических штаммов, его эффективность и безопасность подтверждена в многочисленных публикациях и клинических исследованиях. Доказано, что LGG (пробиотик с положительной рекомендацией) является безопасным и эффективным методом терапии при острой ротавирусной диареи у детей в возрасте от 2 мес до 3 лет, позволяет сократить время длительности диареи на более чем 20 ч. Включение в комплекс терапии при острой кишечной инфекции LGG приводит к достоверному уменьшению продолжительности как ротавирусной, так и неротавирусной диареи.
О. Белоусова отметила, что при правильной лечебной тактике толерантность к лактозе со временем повышается. У большинства недоношенных детей с транзиторной ЛН к 12 мес можно вернуться к молочной диете. У доношенных новорожденных при благоприятном течении болезни и адекватных терапевтических действиях функции кишечника, как правило, компенсируются к возрасту 5–6 мес, и симптомы заболевания постепенно сглаживаются.
ПА у детей: особенности коррекции
Диагностика ПА подразумевает поэтапное выявление причинно-значимого аллергена и включает:
- детальный анамнез (должны быть оценены причинно-значимые аллергены, характер реакции (немедленного или замедленного типа), характер клинических симптомов и их тяжесть, воспроизводимость реакции, наличие кофакторов, семейный анамнез, сопутствующая патология, включая аллергические заболевания);
- определение сенсибилизации к пище (используются стандартизированные методы);
- диагностическую элиминационную диету (исключение предполагаемого причинно-значимого аллергена (аллергенов) на 2–4-й неделе с регистрацией всей симптоматики;
- диагностическое введение продукта (начинают с дозы значительно меньше той, которая вызвала реакцию, период наблюдения за реакцией составляет от 2 ч при реакциях немедленного типа до 2 сут — при реакциях замедленного типа в анамнезе, при не-IgE-опосредованных формах гастроинтестинальной ПА длительность наблюдения составляет до 72 ч).
При диагностике ПА часто могут возникать типичные ошибки. В частности, существует мнение, что аллергия на белки продукта может возникнуть только в случае, если ребенок уже употреблял этот продукт в пищу. На самом деле сенсибилизация к пищевым белкам может сформироваться еще до рождения, и в таком случае возможна аллергическая реакция на продукт, который ребенок получил впервые в жизни. Довольно стойким оказалось представление о том, что необходимо выявлять диагностические уровни специфических IgE к белкам, чтобы подтвердить диагноз ПА у ребенка. Отрицательный анализ на специфические IgE нельзя интерпретировать как отсутствие ПА на данные продукты у ребенка, применение диагностической элиминационной диеты и диагностическое введение продукта через 1 мес позволяет установить причинно-следственную связь и назначить адекватную диету даже при отсутствии специфических IgE.
Т. Крючко обратила внимание на то, что IgE-опосредованные состояния, как правило, отмечаются, когда в анамнезе у ребенка или его родителей были анафилактические реакции (анафилактический шок, крапивница, отек Квинке, бронхоспазм), смешанные клеточно/IgE-опосредованные состояния — при эозинофильных гастроинтестинальных расстройствах, не-IgE-клеточно-опосредованные состояния — при аллергических энтеропатиях.
Существует еще одно ошибочное мнение о том, что анализ специфических антител к белкам не следует назначать детям раннего возраста, поскольку уровень у них еще низкий, и результаты анализа неинформативны. Современные методы исследования, в частности хемилюминесцентный метод, позволяет определить диагностические титры специфических IgE у детей уже в первые месяцы жизни. Что касается определения специфических IgG, которое якобы может помочь в диагностике ПА, то все ведущие медицинские сообщества в своих клинических рекомендациях отвергают такого рода диагностику. Точка зрения о том, что ПА нужно обязательно подтвердить лабораторно, влечет за собой неоправданное дорогостоящее обследование детей, в том числе, и с использованием инвазивных методов.
Т. Крючко отметила, что частым вариантом пищевой интолерантности у детей является непереносимость лактозы (гиполактазия, ЛН). ЛН часто сочетается с ПА. Клинические симптомы ЛН действительно могут превалировать, и недооценка анамнестических данных и других симптомов у ребенка обусловливает то, что основной диагноз остается неустановленным, и ребенок получает неадекватную диету (безлактозное питание вместо безмолочного). Следует помнить, что ЛН возможна при инфекциях, ПА, целиакии, лямблиозе, энтероколите, воспалительных заболеваниях кишечника. Дети с недостаточной массой тела при рождении (недоношенные дети) в 100% случаев имеют транзиторную (первичную) ЛН. Дети с ПА и атопическим дерматитом в 76% случаев имеют ЛН и дисбиоз кишечника. Таким детям, по мнению докладчика, целесообразно назначать лактазу растительного происхождения. Следует помнить, что отсутствие лечения и адекватного ухода за кожей при кожных проявлениях ПА приводит к нарушению кожного барьера и сенсибилизации к аэроаллергенам, поэтому ни в коем случае нельзя затягивать процесс коррекции кожных проявлений.
Многие считают, что при возникновении аллергии на грудном вскармливании — это аллергия на грудное молоко, и ребенка необходимо перевести на искусственную смесь. На самом деле это не так, важно знать, что аллергии на белки грудного молока у ребенка не бывает, реакция может отмечаться только на те крайне малые количества чужеродных белков пищи, которые проникают в грудное молоко. Поэтому пищевой дневник матери также важен, как и пищевой дневник ребенка.
Ошибочно и мнение о том, что при наличии у ребенка аллергии на БКМ в питании можно использовать продукты на основе козьего молока. Козье молоко не является гипоаллергенным, применение продуктов на его основе не имеет доказанного профилактического эффекта в отношении аллергии у ребенка, а использование их у детей с уже имеющейся аллергией к БКМ противопоказано.
Докладчик отметила, что основные направления терапии при поражениях ЖКТ при ПА включают элиминационные мероприятия, противовоспалительную, антимедиаторную, симптоматическую терапию с учетом локализации поражения, энтеросорбенты, заместительную ферментотерапию, коррекцию вторичного дисбиоза кишечника (аллергенспецифическая иммунотерапия с пищевыми аллергенами в стадии научных исследований).
Формирование толерантности и прогноз детей с ПА во многом зависят от особенностей сенсибилизации и формы аллергии к БКМ, а также от адекватности тактики ведения ребенка на ранних этапах развития заболевания. При не-IgE-опосредованной форме ПА переносимость БКМ к 5 годам может достигать 100%, при IgE-опосредованной — цифры существенно ниже: по разным данным, они составляют 41% — к 2 годам, 19–57% — к 4, 74% — к 5, 85% — к 8–9, 79% — к 16 годам.
ПА и ЛН у детей: современные подходы к диагностике и диетотерапии

Елена Няньковская, профессор кафедры педиатрии и неонатологии факультета последипломного образования Львовского национального медицинского университета имени Данила Галицкого, ознакомила слушателей с современными подходами к дифференциальной диагностике и диетотерапии ПА и ЛН у детей. Она отметила, что в основе диагностики ЛН лежат симптомы. Так, при ПА могут отмечаться гастроинтестинальные, кожные или респираторные симптомы, в то время как при ЛН — только кишечные (боль, вздутие, диарея). Дифференциальная диагностика включает проведение диагностических тестов: в случае ЛН при элиминационной диете со снижением лактозы эффект наступает уже на протяжении 48 ч, при ПА — через 4–6 нед.
При ПА рекомендовано исключение БКМ минимум на 6 мес, при первичной ЛН — безлактозная, редко — низколактозная диета, при вторичной ЛН — низколактозная/безлактозная диета около 6 нед.
У детей раннего возраста с хронической диареей, коликами, вздутием, симптомы которых не связаны с острыми кишечными инфекциями, необходимо провести оценку наличия симптомов со стороны других органов и систем. При отсутствии симптомов следует назначить диагностическую элиминационную диету с исключением лактозы на 48 ч (позитивная динамика свидетельствует о высокой вероятности ЛН), при наличии симптомов — диагностическую элиминационную диету с исключением БКМ на 4–6-й неделе (позитивная динамика свидетельствует об аллергии к БКМ).
Е. Няньковская обратила внимание на то, что врожденная алактазия, связанная с непереносимостью даже минимального содержания лактозы в еде, отмечается довольно редко, транзиторная ЛН проявляется практически у всех детей в первые 2 мес жизни, проходит после созревания ферментативной системы (приблизительно до 3–4 мес). Вторичная ЛН может быть вызвана острыми кишечными инфекциями, целиакией, ПА, лямблиозом, болезнью Крона. ЛН, как правило, характеризуется значительным ухудшением состояния спустя 30 мин после приема молока (грудного, коровьего), бурчанием в животе, вздутием, болью в животе, появлением редких испражнений.
Диагностика непереносимости лактозы включает клинические проявления, рН кала и оценку наличия непереваренных примесей, элиминационный и провокационный тесты (исключение на 48 ч–2 нед из диеты лактозы), определение уровня глюкозы в крови при нагрузке лактозой, дыхательный водородный тест и др. Генетические исследования проводить нецелесообразно.
Е. Няньковская подчеркнула, что основным методом лечения детей с ПА в раннем возрасте является элиминационная диета: при грудном вскармливании — элиминация молочных продуктов из диеты мамы, кормление только из одной груди, через 3 ч — из другой, при искусственном вскармливании — перевод на смеси с полным гидролизом белка. В случае если ребенок находится на искусственном вскармливании, его беспокоят колики и высыпания, назначают смесь с полным гидролизом белка и сниженным содержанием лактозы, при отсутствии улучшения — переводят на 4 нед на смесь без лактозы с полным гидролизом белка (отсутствие симптомов улучшения является показанием для назначения аминокислотной смеси, при улучшении состояния смесь без лактозы с полным гидролизом белка назначают на 6 мес). При коликах рекомендованы молочные смеси, содержащие сниженное содержание лактозы, частично гидролизованный сывороточный белок, пребиотическую смесь галактоолигосахаридов и фруктоолигосахаридов. Следует помнить, что при лечении детей с аллергией назначают смеси только с полным гидролизом белка, гипоаллергенные смеси предназначены только для здоровых детей, при наличии признаков ПА их применять не следует.
Марина Колесник,
фото автора
Разумеется, медицинские чиновники должны проинформировать жителей города о том, что у них появилась возможность привить маленьких детей от очередной инфекции. Как всегда, однако, если дело касается вакцинации, информация, которую дают родителям, страдает неточностями.
Представители официальной медицины удивляются антивакцинными настроениями ряда граждан, но чему удивляться, если их аргументы порождают недоверие, которое, в свою очередь, вызвано рядом то ли случайных, то ли намеренных ошибок в цифрах и фактах. Разберемся с ними пошагово, по мере изучения темы.
Что такое ротавирус?

Для ротавирусной инфекции характерны рвота, резкое повышение температуры, диарея. На второй – третий день заболевания может появиться характерный стул: серо-желтый и глинообразный. В острый период отсутствует аппетит, наблюдается упадок сил.
Заболевание считается детским, взрослые болеют им гораздо реже, хотя и с ними такое случается. Передается заболевание в основном через грязные руки.
Для лечения ротавирусной инфекции антибиотики бесполезны. Важнейшей задачей является восстановление баланса жидкости и электролитов в организме больного.
Врачи, как правило, назначают прием сорбентов (активированный уголь, смекту, аттапулгит) для борьбы с последствиями интоксикации. В процессе лечения необходимо соблюдать строгую диету: при ротавирусе нередко развивается лактазная недостаточность, поэтому необходимо исключить молочные продукты до полного выздоровления.
В бедных странах Азии и Африки обезвоживание может представлять серьезную проблему и в отсутствии чистой питьевой воды и своевременной медицинской помощи привести к смерти пациента.
И все-таки утверждение о том, что ротавирус — причина почти трети детских смертей в мире, вызывает серьезные сомнения.
Авторы ссылаются на статистику Всемирной организации здравоохранения, а ее очень легко проверить, потому что документы ВОЗ находятся в открытом доступе. Вот в этом документе говорится о том, что по данным на 2013 год, примерно 3,4% детских смертей имеют своей причиной ротавирус. При этом в абсолютном выражении количество умерших от этой инфекции составило в 2016 году 215 000, а не 500 000.
Как видим, ответственные за информирование чиновники сильно преувеличили реальный масштаб опасности.
Важна и география смертности от заболевания. Почти половина всех смертей от этой инфекции среди детей до 5 лет приходится на четыре страны: Индию, Пакистан, Нигерию и Демократическую республику Конго.
По количеству смертей от ротавируса (опять среди детей до 5 лет) на 100 000 населения лидирует Ангола с показателем 241, а в 70 странах мира от этой инфекции в 2013 году не умер ни один ребенок.
Несовпадение реальной статистики ВОЗ с теми данными, которые объявлены статистикой ВОЗ нашими чиновниками, вызывает недоумение.
Гораздо меньшие масштабы проблемы, однако, не делают ротавирусную инфекцию приятным опытом для детей и родителей. Смерть от нее в нашей стране с преимущественно просвещенным населением, понимающим необходимость врачебной помощи маленькому ребенку с диареей, рвотой и высокой температурой, скорее, редкость, и, тем не менее, этого заболевания лучше постараться избежать.
Профилактика – дело важное. Но в связи с этим возникают два вопроса. Что входит в профилактику – только ли вакцинация? И второй вопрос: что необходимо учесть, принимая решение об иммунизации ребенка от ротавируса?
Начнем со второго.
Вакцина
ВОЗ рекомендует вакцинацию от ротавирусной инфекции во всем мире. При этом она настоятельно рекомендует ее для тех стран, где не менее 10% всех смертей детей до 5 лет приходится на диарею различного генеза.
В США и Японии иммунизация от ротавируса внесена в национальные календари прививок, в Европе – по-разному. Такие страны, как Великобритания, Германия, Австрия, Бельгия, Финляндия, некоторые страны Восточной Европы, ввели эту прививку в календарь, а вот во Франции, Дании, Нидерландах, Швеции, Испании и большей части стран Восточной Европы она в календаре отсутствует.
Запатентованы две вакцины от ротавируса: Ротарикс (GSK) и РотаТек (Merck).
В России используется вакцина РотаТек, поэтому именно о ней мы расскажем подробно.
Вакцина содержит пять рекомбинантных вирусов, полученных на основе человеческого и бычьего штаммов ротавируса. Она оральная, то есть вводится через рот в виде капель.
Первая доза вакцины вводится в срок от 6 до 12 недель жизни, а последняя, третья – не позже 32 недель, потому что с этого возраста повышается риск инвагинации у детей (о том, что это такое, мы расскажем чуть позже). Минимальный интервал между дозами – 4 недели.
Эффективность вакцины в предотвращении ротавирусного гастроэнтерита любой тяжести оценивается в 71,3–74,0%, в предотвращении тяжелого заболевания – 98,0–100%.
Клинические испытания вакцины проводились производителем 2 сезона, в течение которых иммунитет сохранялся. Насколько долго он длится за пределами этого срока, неизвестно.
Каков же профиль безопасности прививки от ротавируса?

О возможных негативных побочных эффектах вакцины сообщает как производитель, так и Всемирная организация здравоохранения. Среди них такие, как диарея, рвота, раздражительность, отит, назофарингит и бронхоспазм. Они встречаются нечасто, однако их нужно иметь в виду и наблюдать за ребенком после вакцинации.
Самым опасным, хотя и очень редким (примерно 1:100 000), осложнением вакцины РотаТек является инвагинация кишечника.
Это вид непроходимости, причиной которого является внедрение одной части кишечника в просвет другой, иными словами, кишечник складывается, как телескоп. Такое состояние требует немедленного медицинского вмешательства, в основном консервативного, но в некоторых случаях и хирургического.
В заявлении ВОЗ о пользе и рисках вакцинации от ротавируса говорится о повышении риска инвагинации (которая случается у детей до года и по другим причинам), в основном, в первые 7 дней после прививки. В пример приводится опыт Франции: там риск этого осложнения оставался в тех же рамках, что и в остальном мире, однако две младенческие смерти от инвагинации органы здравоохранения этой страны связывают с вакцинацией.
Эксперты ВОЗ отмечают, однако, что польза от иммунизации против ротавирусной инфекции значительно превышает риски.
Что еще нужно знать, если вы приняли решение привить ребенка от ротавируса
Вакцина РотаТек противопоказана в том случае, если ребенок продемонстрировал гиперчувствительность к ней при введении предыдущей дозы. Нельзя прививать тех детей, у которых в анамнезе имеются случаи инвагинации.
Строгим противопоказанием является также диагностированный у ребенка тяжелый комбинированный иммунодефицит (SCID).
Не имеется достаточных данных о безопасности вакцины при других заболеваниях, связанных с нарушениями иммунной системы или при иммуно-супрессивной терапии, а также для детей с историей гастроэнтерологических заболеваний, хирургического вмешательства в абдоминальную область, при острых состояниях (диарея, рвота, повышенная температура).
Кроме того, следует учитывать, что привитой ребенок является вирусоносителем и в период до 15 дней после вакцинации выделяет ротавирус, поэтому если он находится в тесном контакте с человеком, страдающим иммунодефицитом, необходимо тщательно взвесить общесемейный баланс пользы и возможного вреда от прививки.

Вот на эту тему наши медицинские чиновники почему-то не проводят конференций и не пишут статей.
Между тем, существует медицинская литература о важной роли витамина D в повышении сопротивляемости организма ротавирусу. Это понятно: как и грипп, ротавирус – заболевание холодного времени года, а значит, в его эпидемиологии также имеется сезонный фактор. Как предполагают ученые, таким фактором для гриппа может быть витамин D, уровни которого снижаются осенью и зимой, когда организм человека получает меньше солнца (подробно об этом читайте здесь). Логично предположить то же самое и для ротавируса.
Это подтверждается рядом медицинских исследований.
Вот в этой работе турецкие ученые сравнили уровни витамина D в крови 67 здоровых детей и 70, страдающих ротавирусной диареей, и обнаружили существенную разницу: у больных малышей он составил в среднем 14,6, у здоровых – 29,06 нг/мл.
А вот в этом китайском исследовании прием витамина D3 остановил репликацию ротавируса у свиней.
Большое внимание ротавирусной инфекции уделяется в Индии, где она остается очень серьезной проблемой. Ряд исследований, проведенных там, также указывают на связь заболевания с дефицитом витамина D.
Имейте в виду, что использовать в качестве пищевой добавки следует витамин D3 (D2 неэффективен), и это будет для малыша также профилактикой рахита и гриппа. Единственное противопоказание приему витамина D – гиперкальциемия, но в любом случае следует предварительно посоветоваться с педиатром.
Лактазная недостаточность относится к заболеваниям из группы ферментопатий. Для нее характерна непереносимость молочных продуктов ввиду полного отсутствия или недостаточной активности специфического фермента лактазы. Он отвечает за превращение молочного сахара (лактозы) в галактозу и глюкозу, которые затем всасываются в кишечнике. Нерасщепленная лактоза не может усвоиться организмом, кроме того, она забирает на себя молекулы воды и является хорошей питательной средой для микроорганизмов, населяющих кишечник, которые активно сбраживают ее. Эти механизмы приводят к появлению определенных симптомов при лактазной недостаточности.
Лактазная недостаточность может развиваться вследствие первичных и вторичных причин. В первом случае говорят о генетических дефектах в гене МСМ6, который локализован на длинном плече второй хромосомы. Различные мутации могут приводить к изменению структуры фермента и, как следствие, к снижению его активности, а также полному прекращению его выработки. Как и любые другие генетические аномалии, первичная лактазная недостаточность является наследственным заболеванием и передается из поколения в поколение по аутосомно-рецессивному типу.
При вторичных причинах нарушение расщепления лактозы является следствием сопутствующих заболеваний, которые нарушают функции ЖКТ:
- лямблиоз;
- энтерит;
- острые кишечные инфекции;
- ротавирусная инфекция и др.
Подобные состояния оказывают влияние на слизистую оболочку кишечника и ее клетки (энтероциты), которые вырабатывают фермент. При своевременном обращении за медицинской помощью и адекватном лечении основного заболевания вторичная лактазная недостаточность исчезает.
Клиническая картина
Так как заболевание связано с нарушением расщепления лактозы, то основные симптомы проявляются только при поступлении в организм данного соединения. В больших количествах лактоза содержится в молочных продуктах и особенно цельном молоке.
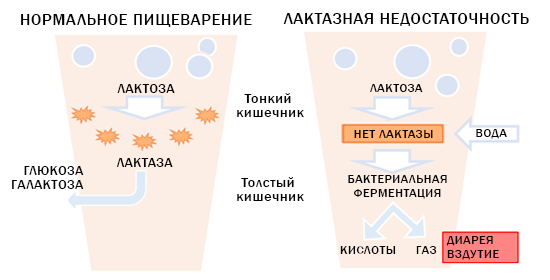
Лактазная недостаточность проявляется в виде диареи, во время которой отмечается пенистый стул с кислым запахом. Данное состояние развивается за счет процессов брожения, которые активно протекают в толстом кишечнике. Опасность диареи заключается в том, что она приводит к стремительной потере жидкости и электролитов, что тяжело переносится детьми первых лет жизни.
Среди других симптомов лактазной недостаточности выделяют:
- тошноту;
- урчание в животе;
- метеоризм;
- боли в животе.
У грудных детей отмечаются такие симптомы лактазной недостаточности, как постоянные срыгивания, вздутие живота, кишечные колики, слабая прибавка в весе, дисбактериоз. Потеря жидкости и электролитов влияет на работу нервной системы, что проявляется раздражительностью, плохим сном, плаксивостью, низкими темпами психомоторного развития. Кроме того, если у ребенка имеется лактазная недостаточность, то у него повышается риск развития таких состояний, как судороги, рахит, синдром гиперактивности, мышечная гипотония.
Диагностика лактазной недостаточности
Для того чтобы достоверно поставить диагноз, необходимо изучить активность фермента лактазы. Это можно сделать только после биопсии тонкой кишки. Данный метод диагностики хоть и является достоверным, но в то же время его сложно использовать у детей. Поэтому диагностика лактазной недостаточности подразумевает альтернативные тесты, которые не обладают высокой специфичностью, но в комплексе позволяют с большой точностью выявить заболевание:
- определение уровня водорода и метана в выдыхаемом воздухе после употребления внутрь лактозы;
- определение рН кала;
- генетические тесты;
- определение уровня углеводов в кале.
Основной метод лечения лактазной недостаточности — диетотерапия. Из рациона исключаются цельное молоко и другие молочные продукты, при употреблении которых развиваются симптомы заболевания. Новорожденным детям, которые находятся на искусственном вскармливании, назначаются безлактозные смеси. Если ребенок находится на грудном вскармливании, то возможно применение заместительной терапии одноименным ферментом.
Читайте также:


