Как вирус проникает внутрь
Как вирус проникает в клетку
Юрий Александрович Чизмаджев, чл.-корр. РАН, д. х. н., проф. кафедры биофизики МГУ,
заведующий лабораторией биоэлектрохимии Института электрохимии им.А.Н.Фрумкина РАН.
Как известно, клетка содержит огромное количество мембранных образований — от изолированных везикул до непрерывной сети эндоплазматического ретикулума. И вся эта система находится в состоянии постоянной перестройки, которая включает множественные акты слияния и деления. Так, в аппарате Гольджи белок упаковывается в контейнеры-везикулы, которые сливаются с плазматической мембраной. Это завершает процесс экзоцитоза. Другой пример — слияние синаптической мембраны и секреторных пузырьков с нейромедиаторами, в результате чего и происходит передача нервного импульса, одного из основных переносчиков информации.
Доставка крупных частиц внутрь клетки осуществляется посредством эндоцитоза. Клетка заглатывает частицы из внешней среды, которые обволакиваются участком плазматической мембраны, образуется впадина, перемычка разрушается, и контейнер оказывается внутри клетки. Его разборка — это уже другая история, а нам остается подчеркнуть, что и эндоцитоз, и экзоцитоз опосредованы множеством белков, чьи природа и механизм действия не вполне установлены.
Кроме “полезного” слияния клетка сплошь и рядом переживает случаи слияния “вредного”. Например, когда ее атакует вирус, которому достаточно сказать: “Сезам, откройся!”, и липидная оболочка вируса сливается с плазматической мембраной. При этом формируется так называемая пора слияния, и вирусная ДНК или РНК начинают хозяйничать внутри клетки. Справедливости ради надо отметить, что уникальную способность вирусов “вскрывать сейфы” уже используют во благо организму. В генной терапии подбирают безвредные вирусы-взломщики, к которым пришивают полезный ген, способный помочь больной клетке.
Разобраться в физическом механизме слияния биологических объектов чрезвычайно трудно. Как всегда, в подобных случаях на помощь приходят модельные системы. Обращаясь в недавнее прошлое, следует подчеркнуть, что в середине 80-х были достигнуты впечатляющие успехи в изучении механизма слияния липидных бислоев [1]. Однако к середине 90-х выяснилось: интермедиаты этого процесса, принятые в теоретических моделях, имеют настолько высокую энергию, что его расчетная скорость, вопреки экспериментальным данным, ничтожно мала. Кроме того, хотя было доказано, что специальные белки играют ключевую роль в ходе слияния, оставалось неясным, что же они делают. Решению этих задач были посвящены экспериментальные и теоретические работы нашей лаборатории, которые проводились во второй половине 90-х.
Путь вируса в клетку
Мир вирусов весьма разнообразен. Общее для них то, что любой наследственный материал (в форме ДНК или РНК) бережно упакован в защитный скафандр из белков. Вирусные частицы (вирионы) отличаются по форме и размерам. Так, диаметр сферических вирионов — от 20 до 300 нм. Некоторые вирусы имеют дополнительную липидную оболочку, в которую включены специализированные белки, способствующие слиянию мембран. Такие вирусы называются оболочечными. Требования к липидно-белковой оболочке двойственны. С одной стороны, она должна уберечь наследственный материал от превратностей судьбы, а с другой — легко разрушаться, когда вирус начинает активную жизнь внутри клетки-жертвы.
Оболочечные вирусы проникают в клетку двумя путями. В первом случае вирус связывается с рецепторами клеточной поверхности, затем в результате эндоцитоза, везикулы, содержащие вирион, отпочковываются. В таком состоянии вирус упакован в дополнительную оболочку, образованную клеточной мембраной. От второй оболочки он освобождается при слиянии везикулы с эндосомой, в которой кислая среда активирует белки слияния и тем самым способствует объединению мембраны вириона с эндосомальной. В результате наследственный материал попадает в цитоплазму и может добраться до ядра. На первых стадиях этого процесса, включая проникновение в эндосому, вирус играет пассивную роль. Здесь используется обычный механизм эндоцитоза, причем доверчивая клетка даже не знает, какую опасность таит в себе этот “подарок судьбы”. И только оказавшись в эндосоме, вирус активируется и берет всю игру на себя, вызывая слияние своей оболочки с эндосомальной мембраной. Именно так действует всем известный вирус гриппа.
Два пути проникновения оболочечного вируса в клетку.
Слева — эндоцитоз и слияние в эндосоме: 1 — вирус, 2 — эндосома, 3 — ядро.
Справа — слияние с плазматической мембраной.
Другие вирусы, например вирус иммунодефицита человека (HIV), не нуждаются для активации в низких рН и проникают в клетку более простым путем, в ходе которого их оболочки сразу сливаются с плазматической мембраной, и наследственный материал оказывается к клетке. Теперь ему остается только добраться до ядра.
Таким образом, в любом случае ключевое событие в битве оболочечного вируса с клеткой — слияние его липидной оболочки с плазматической или лизосомальной мембраной. Именно этой важнейшей стадии инфицирования клетки и посвящен наш рассказ. Конкретно речь пойдет о вирусе гриппа А. Благодаря особенностям своего строения он оказался наиболее удобным объектом для экспериментального изучения механизма слияния.
Этот оболочечный вирус имеет примерно сферическую форму с диаметром около 0.13 мкм. В его центральной части находятся молекулы РНК и ряд белков, необходимых вирусу на первых стадиях жизни в клетке. Сердцевина вириона окружена оболочкой из белка М1, следом за ней располагается липидная мембрана. Белковая оболочка, утопленная в липидной мембране, напоминает рыболовную сеть, которая крепится на сваях. Размер ячеек в белковой сети примерно 4 ґ 4 нм 2 , так что такая крупная “рыба”, как комплекс РНК-белок, пройти сквозь них не может. Липидная оболочка формируется из плазматической мембраны инфицированной клетки при отпочковывании синтезируемого вируса. В этой мембране заякорены три белка: нейраминидаза (Н), ионный канал М2 и гемагглютинин (ГА). При закислении среды благодаря ионному каналу внутри вириона понижается рН, что приводит к разрушению белковой оболочки М1. Одновременно активируется гемагглютинин, главная составляющая “машины слияния”. В ходе ее работы мембраны вируса и клетки смыкаются, и в цитоплазму открывается путь для чужеродного генетического материала.
Схема вириона гриппа:
ГА — гемагглютинин, М2 — ионный канал, Н — нейраминидаза, М1 — белковая оболочка.
На поверхности вирусной оболочки гемагглютинин присутствует в виде тримеров. Каждая его молекула состоит из двух субъединиц: ГА1, обеспечивающей первичный контакт с клеткой-мишенью, и ГА2, отвечающей за слияние. В исходном, нейтральном, состоянии (при рН7) все тримеры ориентированы примерно перпендикулярно к поверхности мембраны, их протяженность
13 нм. Каждая молекула гемагглютинина прочно заякорена в своей мембране и, что очень важно, имеет в своем составе короткий (25 аминокислот) пептид, который при рН7 спрятан внутри тримера и локализован недалеко от основания белка. После уменьшения pH с 7 до 5 молекулы гемагглютинина глобально перестраиваются, и пептид слияния не просто выходит на свободу, а перемещается в самый верхний конец молекулы и проникает в мембрану жертвы.
Структура гемагглютинина в исходном (рН7) и в активном (рН5) состояниях.
Цветом отмечен пептид слияния, который в кислой среде меняет свою конформацию.
В нейтральной среде молекула гемагглютинина напоминает пружину, зажатую защелкой, роль которой играет пептид слияния, спрятанный в “гидрофобный карман” тримера. Но стоит снизить рН до 5, как пептид выходит из заточения и молекула ГА может перейти в новое конформационное состояние. Выделяющаяся при этом энергия, судя по измерениям, довольно велика, но еще не достаточна для сближения мембран клетки и вируса. Чтобы решить эту задачу, молекулы гемагглютинина действуют не поодиночке, а коллективно. Как показали эксперименты, в ходе взаимодействия вируса с клеткой-мишенью образуются розетки из шести—восьми тримеров, внутри каждой из которых находятся изогнутые липидные участки с радиусом
10 нм. С помощью электронно-микроскопических и электрофизиологических исследований удалось обнаружить такие локальные вспучивания, получившие название димплов [2].
Именно здесь, на верхушках димплов, начинается перестройка липидов, приводящая к образованию поры слияния. Теоретическая модель этого процесса [3] состоит в следующем: белки слияния, изгибая мембраны, не только сближают их, но и обеспечивают энергией, облегчая образование монослойной перемычки — сталка; липиды из удаленных монослоев деформируются без больших энергетических затрат. В результате образуются новые промежуточные структуры — низкоэнергетические интермедиаты, обеспечивающие слияние.
Образование димплов между мембранами эритроцитов и клеток, экспрессирующих гемагглютинин.
Вверху — граница мембран эритроцита и клетки, экспрессирующей ГА, рН 7.4;
внизу — то же, но рН 4.9 — видно большое количество контактных областей (цветная стрелка).
На врезке показана схема контакта.
Под слиянием клеток, вирусов или клеточных органелл понимается объединение ограниченных мембранами водных объемов и самих мембран. Для наблюдения за этим процессом используют растворимые в липиде флуоресцентные метки. Если такая метка изначально содержится в клетках А, то появление ее в клетках В говорит о слиянии. Правда, бывают случаи, когда происходит так называемое полуслияние, т.е. объединяются только внешние монослои клеток, сближенные в области локального контакта. Чтобы различить случаи полу- и полного слияния, в клетки А вводят водорастворимый краситель. Его перетекание из одних клеток в другие свидетельствует о полном слиянии с образованием поры, через которую осуществляется связь. Так в эксперименте изучают массовое слияние, например в суспензии вирусов и клеток. Однако возможности этой методики ограничены, с ее помощью трудно разобраться в деталях процесса, включая образование локального контакта, появление поры и ее развитие. Подобные задачи можно решать только с использованием более точного метода, позволяющего следить за одиночными объектами, т.е. с помощью методов флуоресцентной микроскопии и современной электрофизиологии. Впервые это было сделано при изучении экзоцитоза в тучных клетках с использованием микроэлектронной техники.
Однако вирусные частицы настолько малы, что непосредственно применить к ним микроэлектронную технику нельзя. И тут на помощь пришла генная инженерия. На основе фибробластов получены клетки (названные HAb2), которые содержат на своей плазматической мембране молекулы гемагглютинина. Они оказались прекрасной моделью вирусной частицы с диаметром порядка 10 мкм, на которой можно проводить электрические измерения.
Схема эксперимента по слиянию клетки HAb2 с эритроцитом,
мембрана которого окрашена флуоресцирующим липидным зондом.
В ходе развития поры слияния краска распространяется по мембране HAb2.
Электрический сигнал измеряется с помощью электродов и усилителя тока,
а перетекание зонда — с использованием флуоресцентного видеомикроскопа.
В типичном опыте по слиянию клетки HAb2 и эритроцита при закислении окружающего раствора до рН5 образуется пора. Через нее протекает емкостной ток, который заряжает эритроцит. Его изменение во времени отражает расширение поры слияния. Одновременно из мембраны эритроцита в мембрану HAb2 перетекает краситель. Сопоставляя две кривые (проводимости и интенсивности флуоресценции) в зависимости от времени, замечаем, что вторая значительно отстает от первой. Предполагается, что эта временная задержка вызвана белковой розеткой из тримеров гемагглютинина, которая образует своеобразный заслон потоку липидного зонда. Первичная пора слияния образуется в области липидных димплов. Следовательно, изменяя липидный состав мембран, можно воздействовать на весь процесс. При сближении липидных бислоев может образоваться перемычка между близлежащими монослоями (так называемый сталк), зародыш будущей поры. Вероятность его образования существенно зависит от липидного состава. Например, введение в монослои лизофосфатидилхолина (LPC), даже в небольших концентрациях, полностью ингибирует слияние. Эксперименты в системе HAb2—эритроцит показали, что лизофосфатидилхолин здесь столь же эффективен, как и в модельных липидных системах. Иными словами, пора слияния после введения LPC не возникает вообще, хотя, судя по появлению флуоресценции, монослои объединяются.
| Кривые проводимости поры (цветная) и интенсивности флуоресценции. Вверху — контроль, внизу — та же система, но с добавкой лизофосфатидилхолина. По оси ординат — проводимость, по оси абсцисс — время. |
Схема процесса слияния.
После понижения рН образуется розетка слияния (1),
которая способствует образованию локального мембранного контакта (2)
и перемычки, которая затем превращается в пору слияния (3, 4).
Однако любая модель всегда отличается от реального объекта. Мембрана клетки HAb2 имеет другой липидный состав, нежели мембрана вириона, различна и плотность гемагглютинина, а клетка HAb2 не содержит белков М1 и М2. Разработанная в нашей лаборатории методика позволяет изучать слияние одиночного вириона с бислойной липидной мембраной [5]. В нейтральную среду (буферный раствор с рН7) впрыскиваются вирионы, часть которых адсорбируется на бислое. После этого к плоской мембране прижимается микропипетка, заполненная раствором с рН5. Поскольку кончик пипетки имеет радиус
1 мкм, весьма вероятно, что внутри него, на липидном пятачке, окажется один или несколько вирионов, в мембрану которых включен флуоресцентный зонд в концентрации самогашения. Низкое рН внутри пипетки инициирует слияние, и зонд диффундирует в бислой. Возникающее при этом разбавление приводит к флуоресценции, которую можно регистрировать.
Схема экспериментальной установки. Подробности в тексте.
Электрические измерения показали, что наряду с латеральным потоком зонда возникает флуктуирующий электрический ток, который течет через пору слияния и какие-то проводящие структуры в мембране вируса. Специальными опытами доказано, что дело обстоит именно таким образом [6]. В этих экспериментах ионные каналы М2 блокировались амантадином, а закисление внутри вириона достигалось уменьшением рН (до 5) в нижнем отсеке ячейки. Очевидно, что при такой постановке опыта сразу после слияния протоны из нижнего отсека должны устремиться внутрь вириона через открывающуюся пору, что разрушит белковую оболочку из М1 даже при заблокированных каналах М2. Действительно, в этих условиях возникает электрическая активность, точно такая же, как при открытых М2 каналах. Значит, таким способом можно следить не только за эволюцией поры слияния в липидной мембране, но и за разрушением белкового каркаса. Это чрезвычайно существенно, так как выход генетического материала вируса в цитоплазму лимитируется обеими защитными оболочками — белковой и липидной.
Итак, сочетая методы электронной микроскопии и электрофизиологии, удалось обнаружить локальные мембранные контакты (димплы). Введение лизолипида ингибирует биологическое слияние, что доказывает: первым интермедиатом процесса, как и в модельных системах, служит перемычка (сталк).
Разработанная методика изучения слияния одиночных вирионов с липидными бислоями позволяет исследовать кинетику этого процесса, а модель слияния, использующая принципиально новые интермедиаты, решает проблему “энергетического кризиса”.
Выяснение роли липида и белка в таком процессе имеет не только познавательный интерес. В перспективе это важно для разработки новых методов антивирусной терапии.
Результаты были получены в ходе исследований, поддержанных грантами РФФИ:
№93-04-20590, №96-04-50779, №99-04-48427 и №02-04-48287.
1. Черномордик Л.В., Меликян Г.Б., Чизмаджев Ю.А. // Биол. мембраны. 1987. Т.4. С.117—164.
2. Frolov V.A., Cho M.-S., Bronk P. et al. // Traffic. 2000. ?1. P.6.
3. Kuzmin P.I., Zimmerberg J., Chizmadzhev Yu.A. et al. // PNAS. 2001. V.98. P.7235—7240.
4. Chernomordik L.V., Frolov V.A., Leikina E. et al. // The Journal of Cell Biology. 1998. V.140. P.1369—1382.
5. Максаев Г.И.,Самсонов А.В., Липатов А.С. и др. // Биол. мембраны. 2000. Т.17. С.312—323.
6. Максаев Г.И., Михалев И.И., Фролов В.А. // Биол. мембраны. 2001. Т.18. С.489—495.
Если у вас течет из носа, в этом, как правило, виноват обычный простудный вирус. К счастью, у нас имеется иммунитет, способный справиться с простудой, так что она быстро проходит. Другие вирусы, такие как коронавирус, заразивший множество человек, победить сложнее. Какие бывают вирусы и как с ними бороться, разбирается норвежское интернет-издание Forskning.
Существуют лекарства против вирусов, но они не всегда эффективны. Поэтому если вирус проник в клетки организма, задача иммунной системы — очистить их.
Между бактериями и вирусами — большая разница
В России сделали фото частиц коронавируса.
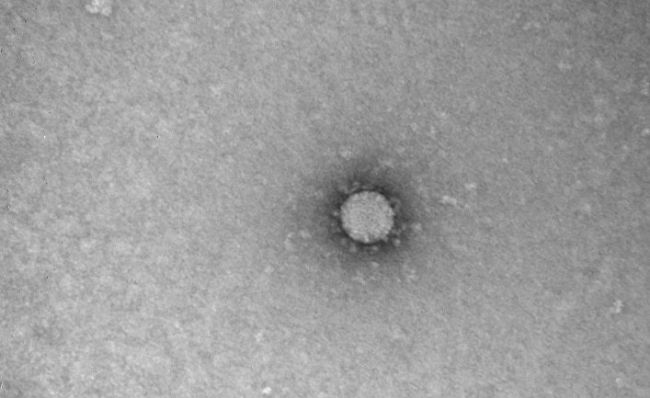
Вирус проникает в клетку. А затем начинает пользоваться ею, производя множество своих копий. Некоторые вирусы копируют себя в таких количествах, что клетка в итоге просто лопается и погибает. Из нее высвобождаются миллионы новых вирусов, готовых атаковать следующую клетку.
Коробка с инструкцией внутри
Клетка — очень сложная система. Вирус же, напротив, относительно примитивен. На самом деле он даже не выполняет все требования, сформулированные учеными, чтобы дать определение живого существа. Вирусы ничего не поглощают и не выделяют. Все эти заботы они перекладывают на других. Представьте себе вирус в виде маленькой коробочки. Внутри лежат его гены — своего рода инструкция, в которой описывается, как вирус работает.
Хорошие вирусы
Мы постоянно носим в себе множество вирусов. Они присутствуют повсюду. Но, к счастью, далеко не все вирусы опасны. Некоторые из них даже участвуют в очень важных процессах в природе. Например, в чайной ложке воды — несколько миллионов вирусов! В море они убивают бактерии, обеспечивая питанием прочие организмы. Большинство вирусов не вредят людям, ведь они атакуют лишь определенный тип клеток.
Некоторые вирусы нападают только на свиней, другие вызывают заболевания у растений. Третьи предпочитают бактерии. На земле существуют вирусы практически для всего живого.
Коронавирус
Нынешний коронавирус изначально был вирусом животных. Вероятно, его носителями были летучие мыши. Как вышло, что он перекинулся на людей?
Клетка стала фабрикой по производству вируса
Готовые вирусы затем могут покинуть клетку и отправиться в путешествие по организму. Либо клетка настолько переполняется вирусами, что лопается и погибает. И тогда множество новых вирусов вырываются на волю и атакуют новые жертвы. В организме поднимается тревога. Иммунитет выпускает своих агентов, чтобы они арестовали непрошеных гостей. В этот момент человек чувствует себя слабым и больным.
Вирусы гриппа и коронавирус атакуют и повреждают клетки легких. У заболевших коронавирусом поднимается температура и начинается кашель. Когда мы болеем гриппом, мы тоже страдаем от насморка и кашля. Так организм реагирует на инфекцию и защищается от нее.
Коронавирус распространяется по воздуху в маленьких капельках жидкости, при кашле вылетающих изо рта человека. Вдохнуть эти капельки может кто угодно. Либо кто-то может прикоснуться к месту, где они осели, а затем дотронуться до рта. Таким образом, вирус распространяется.
Лекарства и вакцины могут помочь
Сейчас ученые одновременно разрабатывают и лекарства, и вакцины против коронавируса.
Такое случается, например, когда иммунная система не в состоянии отследить вирус. К подобному типу относится вирус герпеса.
Выглядит как инопланетянин
Вирусы — это мельчайшие и простейшие микроорганизмы из всех существующих на Земле. Если представить, что клетка — это авианосец, то бактерия по сравнению с ней покажется обычной весельной лодкой. А вирус — бутылочной пробкой, качающейся на волнах поблизости. Но на самом деле есть и вирусы побольше. Их обнаружили всего несколько лет назад. Самые большие вирусы даже крупнее, чем простые бактерии. У них гораздо больше генов, чем у остальных вирусов, и большая часть их генетического материала совершенно не изучена.
Ученые задаются вопросом, откуда взялись гигантские вирусы. Может, прежде чем стать паразитами, они относились к отдельному виду живых организмов, обитавших на планете давным-давно?
К счастью, нам не стоит особенно бояться этих гигантских вирусов, как свидетельствуют проведенные исследования. Похоже, они предпочитают жить за счет амёб — одноклеточных организмов.


Коронавирус SARS-CoV-2 ранее 2019-nCoV, вирус, вызывающий коронавирусную инфекцию (COVID-19), в настоящее время распространяется по всему миру. Известно, что по меньшей мере шесть других типов коронавируса заражают людей, причем некоторые вызывают простуду, а две вызывают эпидемии: атипичная пневмония в 2002 году и MERS в 2012 году.

Покрыты шипами
Коронавирус назван в честь короноподобных шипов, выступающих из его поверхности. Вирус заключен в пузырек маслянистых липидных молекул, который распадается при контакте с мылом.

Вход в уязвимую клетку
Вирус попадает в организм через нос, рот или глаза, а затем прикрепляется к клеткам дыхательных путей, которые продуцируют белок, называемый ACE2. Считается, что вирус возник у летучих мышей, где он мог присоединиться к аналогичному белку.

Высвобождение вирусной РНК
Вирус заражает клетку, сливая ее масляную мембрану с мембраной клетки. Оказавшись внутри, коронавирус высвобождает фрагмент генетического материала под названием РНК.

Антибиотики убивают бактерии и не действуют против вирусов. Но исследователи тестируют антивирусные препараты, которые могут разрушить вирусные белки и остановить инфекцию.

Создание вирусных белков
По мере прогрессирования инфекции механизм клетки начинает производить новые спайки и другие белки, которые будут образовывать больше копий коронавируса.

Сборка новых копий
Новые копии вируса собираются и переносятся на внешние края клетки.

Распространение инфекции
Каждая зараженная клетка может выпустить миллионы копий вируса, прежде чем клетка окончательно разрушится и умрет. Вирусы могут инфицировать близлежащие клетки или попасть в капли, которые покидают легкие.

Иммунная реакция
Большинство инфекций Covid-19 вызывают лихорадку, поскольку иммунная система борется, чтобы очистить вирус. В тяжелых случаях иммунная система может чрезмерно реагировать и начать атаковать клетки легких. Легкие закупориваются жидкостью и отмирающими клетками, что затрудняет дыхание. Небольшой процент инфекций может привести к острому респираторному дистресс-синдрому и, возможно, смерти.

Покидая тело
Кашель и чихание могут привести к попаданию вирусных капель на находящихся поблизости людей и поверхности, где вирус может оставаться заразным от нескольких часов до нескольких дней. Зараженные люди могут избежать распространения вируса, надев маску, но здоровым людям не нужно носить маску, если они не заботятся о больном человеке.

Как быть с возможной вакциной
Будущая вакцина может помочь организму вырабатывать антитела, которые нацелены на вирус SARS-CoV-2 и предотвращают его заражение человеческими клетками. Вакцина против гриппа работает аналогичным образом, но антитела, полученные из вакцины против гриппа, не защищают от коронавируса.
Лучший способ избежать заражения коронавирусом и другими вирусами - мыть руки с мылом, избегать прикосновения к лицу, держаться подальше от больных людей и регулярно чистить часто используемые поверхности.
Финляндия построит забор на границе с Россией для защиты от кабанов
Как защититься от COVID-19 в ожидании создания вакцины против него
Об авторе: Валерий Дмитриевич Молостов – врач, кандидат медицинских наук. Минск
Обыватели недоумевают: почему современная медицина не может так долго найти средство (антибиотики) против коронавируса? Но медицина бессильна не только перед коронавирусом, но и перед вирусом гриппа (птичьего или свиного), болезнью Эбола и десятком других. Микробные заболевания современная медицина лечит хорошо, фармацевты синтезировали огромное количество антибиотиков. Антибиотики омывают межклеточное пространство (где расположены бактерии), но они, к большому огорчению, никогда не проникают внутрь клетки (где расположены вирусы).
Крупные микробы в 100 раз мельче клеток тканей человека. Средний размер крупного вируса – 0,0004 мм, а мелкого вируса – 0,000006 мм. Вирус СПИДа считается крупным и имеет размер 0,00008 мм, свиной цирковирус – 0,000017 мм. Вирусы в среднем в 1000 раз меньше размера микроба и в 10 000 раз меньше любой человеческой тканевой клетки. Не повреждая клеточную оболочку, болезнетворный вирус проникает внутрь клетки человека, а питательной средой служит ему цитоплазма – жидкое содержимое самой клетки. Вирус быстро размножается, и за сутки внутри клетки появляются тысячи вирусов.
Возникает вопрос: почему же больной человек выздоравливает при поражении его органов вирусами? Дело в том, что внутрь клеток, где размножаются вирусы, свободно проникают только собственные иммуноглобулины, которые и убивают вирусы. Но иммуноглобулины (в основном гамма-глобулины) могут проникнуть внутрь клетки, если они синтезированы только внутри данного организма. Чужие иммуноглобулины, которые взяты из крови другого человека, практически не проникают внутрь ваших клеток, пораженных вирусами.
При заболевании, вызванном коронавирусом, больному организму нужна неделя, чтобы синтезировать высокую концентрацию иммуноглобулинов. Глобулины синтезируются внутри костного мозга, лимфоидной ткани, селезенки и печени. Сразу после проникновения вируса в организм человек фактически на протяжении пяти дней не имеет никакой защиты против вирусной инфекции, так как иммуноглобулины еще не выработаны! За пять дней иммунитет только начинает вырабатываться!
Лечение всех тяжелых заболеваний, вызванных вирусом, происходит следующим образом.
Прежде всего врачи ставят своей задачей не дать пациенту умереть за шесть дней острого проявления заболевания. На шестой день организм пациента начнет вырабатывать собственные антитела. Тогда пациент будет обязательно спасен. Как сохранить жизнь пациента до шести дней течения острого периода?
Во-первых, медики ставят перед собой цель снизить концентрацию вирусных токсинов в крови при помощи увеличения количества воды в кровяном русле. Если у больного весом в 70 кг в венах и артериях содержится 3 л крови, то ему предстоит ввести в артерии и вены еще 2–3 л воды, чтобы уменьшить концентрацию вирусных токсинов. Для этого больного заставляют пить много воды и вводят ему внутривенно (инъекционно) до 3 л в день водных растворов: глюкозы, физиологического раствора и различных кровезаменителей. Только выдержали бы почки пациента!
Во-вторых, есть вещества, которые в кровяном русле больного пациента создают химические связи с молекулами вирусных токсинов, и от этого токсины становятся менее ядовитыми. Таких веществ существует сотни. Одно из них – аскорбиновая кислота (витамин С).
Однако, подчеркнем еще раз, все врачи понимают, что до тех пор пока организм пациента не выработает огромную концентрацию собственных иммуноглобулинов – до тех пор излечения пациента не произойдет.
Для большинства опасных вирусных инфекций созданы профилактические прививки, которые представляют из себя ослабленный живой вирус. Но пока не существует вакцины (ослабленного вируса) для коронавируса. Конечно, через год вирусологи создадут вакцину и против коронавируса. Но дело в том, что после инъекции такой вакцины необходимо ждать три недели до того момента, пока у данного человека выработается стойкий иммунитет. Если человек уже заболел, то прививка этому человеку не поможет.
Читайте также:


