Как определить цпд вируса


тЙУ. 5. йОДЙЛБГЙС ТЕРТПДХЛГЙЙ ЧЙТХУБ Ч ЛХМШФХТЕ ФЛБОЙ РП ГЙФПРБФЙЮЕУЛПНХ ДЕКУФЧЙА (грд): 1.ЙОФБЛФОБС НПОПУМПКОБС ЛХМШФХТБ ЛМЕФПЛ; 2. ЪБТБЦЕООБС ЛХМШФХТБ (грд). (нЙЛТПВЙПМПЗЙС Й ЙННХОПМПЗЙС.-рПД ТЕД. б.б. чПТПВШЕЧБ.-н, нЕДЙГЙОБ, 1999.-464 У.)
л РПМХРЕТЕЧЙЧБЕНЩН ЛХМШФХТБН ПФОПУСФУС ДЙРМПЙДОЩЕ ЛМЕФЛЙ ЮЕМПЧЕЛБ. пОЙ РТЕДУФБЧМСАФ УПВПК ЛМЕФПЮОХА УЙУФЕНХ, УПИТБОСАЭХА Ч РТПГЕУУЕ 50 РБУУБЦЕК (ДП ЗПДБ) ДЙРМПЙДОЩК ОБВПТ ИТПНПУПН. дЙРМПЙДОЩЕ ЛМЕФЛЙ ЮЕМПЧЕЛБ ОЕ РТЕФЕТРЕЧБАФ ЪМПЛБЮЕУФЧЕООПЗП РЕТЕТПЦДЕОЙС Й ЬФЙН ЧЩЗПДОП ПФМЙЮБАФУС ПФ ПРХИПМЕЧЩИ.
дМС ЧЩТБЭЙЧБОЙС ЧЙТХУПЧ НПЦОП ЙУРПМШЪПЧБФШ ЛХМШФХТЩ ФЛБОЕК МАВПЗП ФЙРБ. дПЪБ ЪБТБЦЕОЙС ЪБЧЙУЙФ ПФ ГЕМЙ Й ОБЪОБЮЕОЙС ПРЩФБ. фЛБОЕЧЩЕ ЛХМШФХТЩ ЙУРПМШЪХАФ ДМС ЧЩДЕМЕОЙС ОПЧЩИ НБМПЙЪХЮЕООЩИ ЧЙТХУПЧ, ЛПЗДБ ПВЩЮОЩН НЕФПДПН (ЪБТБЦЕОЙЕ ЦЙЧПФОЩИ, ЛХТЙОЩИ ЬНВТЙПОПЧ) ОЕЧПЪНПЦОП ХУФБОПЧЙФШ ЧЙТХУОХА РТЙТПДХ ЧПЪВХДЙФЕМС. чЩВПТ ЛМЕФПЮОЩИ ЛХМШФХТ ПРТЕДЕМСЕФУС ЙИ ЮХЧУФЧЙФЕМШОПУФША Л ПФДЕМШОЩН ЗТХРРБН ЧЙТХУПЧ.
тБЪМЙЮБАФ ПУФТХА Й ИТПОЙЮЕУЛХА ЙОЖЕЛГЙЙ. пУФТПЕ ФЕЮЕОЙЕ ЙОЖЕЛГЙЙ ИБТБЛФЕТЙЪХЕФУС ГЙФПРБФЙЮЕУЛЙН ДЕКУФЧЙЕН (ДЕУФТХЛФЙЧОЩНЙ ЙЪНЕОЕОЙСНЙ ЪБТБЦЕООЩИ ЛМЕФПЛ, ЪБЧЕТЫБАЭЙИУС ЙИ ЗЙВЕМША). иТПОЙЮЕУЛБС ЖПТНБ ТЕРТПДХЛГЙЙ ЧЙТХУБ ОЕ ЧЩЪЩЧБЕФ ВЩУФТХА ЗЙВЕМШ ЛМЕФПЛ, ПОЙ ДПМЗПЕ ЧТЕНС ПУФБАФУС ЦЙЪОЕУРПУПВОЩНЙ Й ЧОЕЫОЕ НПЗХФ ОЕ ПФМЙЮБФШУС ПФ ЪБТБЦЕООЩИ.
йОДЙЛБГЙА ЧЙТХУПЧ Ч ЛХМШФХТЕ ЛМЕФПЛ РТПЧПДСФ ОБ ПУОПЧБОЙЙ УМЕДХАЭЙИ ЖЕОПНЕОПЧ:
- гЙФПРБФЙЮЕУЛПЕ ДЕКУФЧЙЕ (грд) - ЧЙДЙНЩЕ РПД НЙЛТПУЛПРПН НПТЖПМПЗЙЮЕУЛЙЕ ЙЪНЕОЕОЙС ЛМЕФПЛ, ЧРМПФШ ДП ЙИ ПФФПТЦЕОЙС ПФ УФЕЛМБ, ЛПФПТЩЕ ЧПЪОЙЛБАФ Ч ТЕЪХМШФБФЕ ЧОХФТЙЛМЕФПЮОПК ТЕРТПДХЛГЙЙ ЧЙТХУПЧ (ТЙУ. 5). иБТБЛФЕТ грд РТЙ ТБЪМЙЮОЩИ ЧЙТХУОЩИ ЙОЖЕЛГЙСИ ОЕПДЙОБЛПЧ. рТЙ ТЕРТПДХЛГЙЙ ПДОЙИ ЧЙТХУПЧ (РБТБНЙЛУПЧЙТХУЩ, ЗЕТРЕУЧЙТХУЩ) ОБВМАДБЕФУС УМЙСОЙЕ ЛМЕФПЛ У ПВТБЪПЧБОЙЕН УЙОГЙФЙС, ДТХЗЙИ (ЬОФЕТПЧЙТХУЩ, ТЕПЧЙТХУЩ) - УНПТЭЙЧБОЙЕ Й ДЕУФТХЛГЙС ЛМЕФПЛ, ФТЕФШЙИ (БДЕОПЧЙТХУЩ) - БЗТЕЗБГЙС ЛМЕФПЛ Й Ф.Д.
- чЙТХУОЩЕ ЧЛМАЮЕОЙС - УЛПРМЕОЙЕ ЧЙТХУОЩИ ЮБУФЙГ ЙМЙ ПФДЕМШОЩИ ЛПНРПОЕОФПЧ ЧЙТХУПЧ Ч ГЙФПРМБЪНЕ ЙМЙ СДТЕ ЛМЕФПЛ, ЧЩСЧМСЕНЩЕ РПД НЙЛТПУЛПРПН РТЙ УРЕГЙБМШОПН ПЛТБЫЙЧБОЙЙ. чЛМАЮЕОЙС ТБЪМЙЮБАФУС РП ЧЕМЙЮЙОЕ, ЖПТНЕ, ЮЙУМЕООПУФЙ. иБТБЛФЕТОЩЕ СДЕТОЩЕ ЧЛМАЮЕОЙС ЖПТНЙТХАФУС Ч ЛМЕФЛБИ, ЪБТБЦЕООЩИ ЧЙТХУБНЙ ЗЕТРЕУБ, БДЕОПЧЙТХУБНЙ, ЗТЙРРБ, ВЕЫЕОУФЧБ, ПУРЩ Й ДТ.
- вМСЫЛЙ, ЙМЙ ОЕЗБФЙЧОЩЕ ЛПМПОЙЙ - ПЗТБОЙЮЕООЩЕ ХЮБУФЛЙ, УПУФПСЭЙЕ ЙЪ ДЕЗЕОЕТБФЙЧОЩИ ЛМЕФПЛ, ЛПФПТЩЕ ЧЙТХУЩ УРПУПВОЩ ПВТБЪПЧЩЧБФШ Ч НПОПУМПЕ ЛМЕФПЛ РПД БЗБТПЧЩН РПЛТЩФЙЕН. пОЙ ЧЙДОЩ ОЕЧППТХЦЕООЩН ЗМБЪПН ЛБЛ УЧЕФМЩЕ РСФОБ ОБ ЖПОЕ РТЙЦЙЪОЕООП ПЛТБЫЕООЩИ ОЕКФТБМШОЩН ЛТБУОЩН ЛМЕФПЛ. пДОБ ВМСЫЛБ УППФЧЕФУФЧХЕФ РПФПНУФЧХ ПДОПЗП ЧЙТЙПОБ. оЕЗБФЙЧОЩЕ ЛПМПОЙЙ ТБЪОЩИ ЧЙТХУПЧ ПФМЙЮБАФУС РП ТБЪНЕТХ, ЖПТНЕ. вМСЫЛППВТБЪПЧБОЙЕ ЙУРПМШЪХАФ ДМС ДЙЖЖЕТЕОГЙБГЙЙ, УЕМЕЛГЙЙ ЧЙТХУПЧ, Б ФБЛЦЕ ДМС ПРТЕДЕМЕОЙС ЙИ ЛПОГЕОФТБГЙЙ Ч ЙУУМЕДХЕНПН НБФЕТЙБМЕ. фЙФТ ЧЙТХУБ, ХУФБОПЧМЕООЩК ЬФЙН НЕФПДПН, ЧЩТБЦБАФ ЮЙУМПН ВМСЫЛППВТБЪХАЭЙИ ЕДЙОЙГ (впе) Ч 1 НМ.
- `гЧЕФОБС' РТПВБ. еУМЙ ЧЙТХУЩ ОЕ ТБЪНОПЦБАФУС Ч ЛХМШФХТЕ ЛМЕФПЛ, ФП ЦЙЧЩЕ ЛМЕФЛЙ Ч РТПГЕУУЕ УЧПЕЗП НЕФБВПМЙЪНБ ЧЩДЕМСАФ ЛЙУМЩЕ РТПДХЛФЩ, ЮФП ЧЕДЕФ Л ЙЪНЕОЕОЙА То УТЕДЩ Й ГЧЕФБ ЙОДЙЛБФПТБ ЖЕОПМПЧПЗП ЛТБУОПЗП ОБ ЦЕМФЩК. рТЙ РТПДХЛГЙЙ ЧЙТХУПЧ ОПТНБМШОЩК НЕФБВПМЙЪН ЛМЕФПЛ ОБТХЫБЕФУС, ЛМЕФЛЙ ЗЙВОХФ, Й УТЕДБ УПИТБОСЕФ УЧПК РЕТЧПОБЮБМШОЩК (ЛТБУОЩК) ГЧЕФ. фБЛЙН ПВТБЪПН, ЛТБУОЩК ГЧЕФ УТЕДЩ ХЛБЪЩЧБЕФ ОБ ОБМЙЮЙЕ ЧЙТХУБ Й РТЕЛТБЭЕОЙЕ ЦЙЪОЕДЕСФЕМШОПУФЙ ЛМЕФПЛ.
- зЕНБДУПТВГЙС - УРПУПВОПУФШ ЛХМШФХТ ЛМЕФПЛ, ЙОЖЙГЙТПЧБООЩИ ЧЙТХУБНЙ, БДУПТВЙТПЧБФШ ОБ УЧПЕК РПЧЕТИОПУФЙ ЬТЙФТПГЙФЩ ПРТЕДЕМЕООЩИ ЧЙДПЧ ЦЙЧПФОЩИ Й РФЙГ. зЕНБДУПТВГЙС РТПСЧМСЕФУС УЛПРМЕОЙЕН Ч ЧЙДЕ ЗТПЪДЕК ЬТЙФТПГЙФПЧ, БДУПТВЙТПЧБООЩИ ОБ ЙОЖЙГЙТПЧБООЩИ ЧЙТХУПН ЛМЕФЛБИ.
- йОФЕТЖЕТЕОГЙС - ОЕЛПФПТЩЕ ЧЙТХУЩ НПЦОП ПВОБТХЦЙФШ Ч ЛХМШФХТЕ ФЛБОЙ ФПМШЛП РП ОБМЙЮЙА ЙОФЕТЖЕТЕОГЙЙ. йУРЩФХЕНЩК ЧЙТХУ ЧЧПДЙФУС Ч ЛХМШФХТХ ЛМЕФПЛ РЕТЧЩН, ЮЕТЕЪ ОЕУЛПМШЛП ДОЕК ФХДБ ЦЕ ЧОПУСФ УФБОДБТФОХА ДПЪХ ЧЙТХУБ, ПВМБДБАЭЕЗП ЧЩТБЦЕООПК ГЙФПРБФЙЮЕУЛПК БЛФЙЧОПУФША ЙМЙ УРПУПВОПУФША ЧЩЪЩЧБФШ ЗЕНБДУПТВГЙА. рПУМЕ ПРТЕДЕМЕООПЗП ЙОЛХВЙТПЧБОЙС РТПЧЕТСАФ ОБМЙЮЙЕ ГЙФПРБФЙЮЕУЛЙИ ЙЪНЕОЕОЙК ЙМЙ ЗЕНБДУПТВГЙЙ, РПДФЧЕТЦДБАЭЙИ ТБЪНОПЦЕОЙЕ `ЧЩСЧМСАЭЕЗП' ЧЙТХУБ. пФУХФУФЧЙЕ Ч ЛХМШФХТЕ `ЧЩСЧМСАЭЕЗП' ЧЙТХУБ ЗПЧПТЙФ П ОБМЙЮЙЙ ЙУРЩФХЕНПЗП ЧЙТХУБ.
Вирусы являются внутриклеточными инфекционными агентами. Весь репликативный цикл вируса осуществляется с исполь зованием метаболических и генетических ресурсов клеток. Поэтому патогенез вирусных инфекций, в первую очередь, следует рассматривать на молекулярном и клеточном уровнях (В.И. Покровский, О.И. Киселев, 2002). Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Поэтому характер развития внутритканевых процес сов при вирусных инфекциях, с одной стороны, определяется, как правило, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты от вирусной инфекции. Последние не редко носят деструктивный характер и усугубляют течение забо левания и его последствия. Поэтому понимание патогенеза вирусных инфекций представляется исключительно важным для создания рациональных схем лечения, основанных на гармоничном сочетании симптоматического лечения и противовирусной химиотерапии.
Стадии репликативного цикла вируса гриппа представлены на рис. 1. Такой же репликативный цикл свойствен большинству РНК- и ДНК-содержащих вирусов, кроме тех, кото рые обладают особыми механизмами хронизации процесса, латенции и способностью к интеграции в клеточный геном (например, ВИЧ, гепатит С, вирус папилломы и.т.). Ключевыми стадиями репликативного цикла вируса являются проникновение в клетки, декапсидация, активация процессов транскрипции и трансляции, собственно репликация вирусного генома и созревание зрелых вирусных частиц с выходом нового потомства инфекционного вируса.
Проникновение вируса в клетки - одна из ключевых стадий патогенеза инфекционного процесса. Для большинства вирусов степень цитопатического действия вируса прямо зависит от множественности заражения. В естественных условиях инфицирова ние клеток вирусами не происходит обычно с высокой множе ственностью. Исключение составляют респираторные вирусы, которые передаются воздушно-капельным путем с высокой инфицирующей дозой. ВИЧ и гепатиты, наоборот, эффективно передаются с кровью в самых незначительных трудно определяе мых титрах. Такие вирусы имеют особые свойства, определяющие их контагиозность.
Для проникновения вируса в клетку, необходимо: высокое сродство к вирусоспецифическому рецептору; множественность рецепторов; эффективность слияния вируса с клетками при инфицировании; способность к образованию синцития, к образованию гигантских синпластов, состоящих из множества слившихся клеток, в которых вирусный нуклеопротеид без эндоцитоза беспрепятственно переходит от одной зараженной клетки к множеству других через цитоплазму.
Такими свойствами из респираторных вирусов обладает респираторно-синцитиальный вирус, а среди ретровирусов – вирус иммунодефицита человека.
Стадии жизненного цикла вируса гриппа и соответствующие ингибиторы репродукции в известной степени могут быть экстраполированы на многие другие вирусы, за исключением тех, жизненный цикл которых включает интеграцию в клеточный геном. В процессе репликации вирусов обычно происходит селективная блокада трансляции клеточных мРНК и активация экспресси клеточных генов, кодирующих провоспапительные лимфокины. Многократные раунды репликации вирусного генома приводят к истощению энер гетических ресурсов клеток и пула предшественников азотистых оснований. Повышенное содержание провоспалительных лимфокинов приводит к развитию воспалительной реакции и локально му генерированию свободных радикалов, оказывающих, в свою очередь, повреждающее действие на клетки и ткани через перекисное окисление липидов клеточных мембран, инактивацию жизненно важных ферментов. Поэтому одним из важнейших факторов патогенности вирусов является их репликативный потенциал: чем активнее происходит репликация, тем сильнее цитопатическое действие вирусов на клетки и пораженную ткань (орган).
Значительный вклад в цитопатическое действие вирусов вносит репродукция вирусов в митохондриях, что сопровождается нарушением функций этих органоидов, падением продукции АТФ и индукцией опосредованного митохондриями пути апоптоза.
Впервые возможность репродукции вирусов в митохондриях была доказана выдающимся отечественным вирусологом В.М. Ждановым. Узкий тропизм вирусов, в известной степени, спасителен для организма, так как инфекционный процесс ограничен одним органом.
Это обстоятельство позволяет, проводит рациональную симптоматическую терапию, направленную на защиту данной ткани или органа и ориентировать противовирусные средства в данный орган, например, легкие.
Возбудители гриппа относятся к семейству ортомиксовирусов (Orthomyxo-viridae) и являются пневмотропными вирусами. Схематическое строение вируса гриппа представлено на рис. 2.1. Геном вируса складывается из 8-ми фрагментов однонитчатой РНК, которые кодируют
10 вирусных белков. Фрагменты РНК имеют общую белковую оболочку, соединяющую их, образуя антигенно-стабильный рибонуклеопротеид (S-антиген), который определяет принадлежность вируса к серотипу А, В или С. Снаружи вирус покрыт двойным липидным слоем с внутренней стороны которого находится слой мембранного белка.
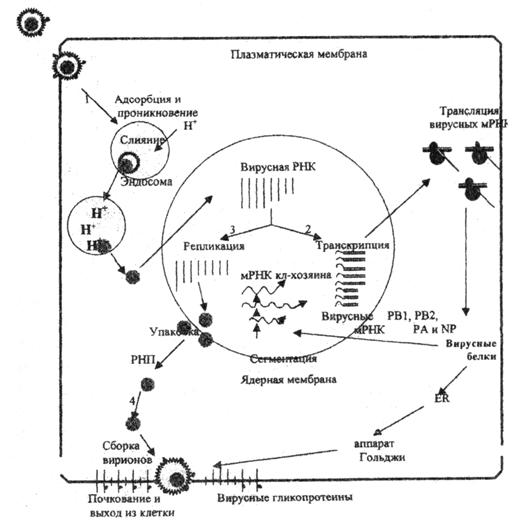
Рис. 1. Репликативный цикл вируса гриппа (В.И.Покровский, О.И.Киселев, 2002)
Представлены 4 основные фазы репликативного цикла вируса гриппа: 1 – адсорбция и проникновение вируса в клетку хозяина; 2 – транскрипция вирусной РНК и трансляция вирусных белков; 3 – репликация вирусной РНК и 4 – самосборка вирионов и последующий выход их из клетки.
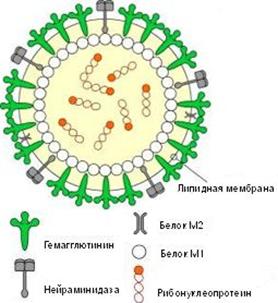
Рис. 2. Схематическое строение вируса гриппа
Гемаглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемаглютинина, а нейраминидаза обладает выраженным иммунодепресивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемаглютинины 1, 2, 3 типов и нейраминидазы 1, 2 типов содержат вирусы, которые поражают человека. Другие антигены характерные для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.).
Вирусы гриппа А. Эти возбудители более вирулентны и контагиозны, чем вирусы гриппа В и С. Это обусловлено тем, что вирус А содержит 2 типа нейраминидазы (N1, N2) и 4 –гемаглютинина (H0, H1, H2, H3); вирус В – 1 и 1 соответственно, поэтому он имеет лишь антигенные варианты внутри одного серотипа; вирус С содержит только гемаглютинин и не содержитнейраминидазу, но он имеет рецептор, который разрушает энзим. Вирусу С не свойственная изменчивость.
Одновременно циркулируют и имеют эпидемическое распространение 2 подтипа вируса гриппа А H3N2 и H1N1. На сегодняшний день во всем мире доминирует вариант А/Сидней/05/97, А/Берн/07/95 и А/Пекин/262/95. Характерной чертой современных вирусов гриппа А (H3N2) является изменение ряда их биологических свойств: тяжело размножаются в куриных эмбрионах, не агглютинируют эритроциты кур, взаимодействуют только с эритроцитами человека или морской свинки, имеют низкую иммуногенную активность.
Вирусы гриппа В выделяются только от людей. По вирулентности и эпидемиологической значимости они уступают вирусам гриппа А. По антигенным свойствам гемаглютинин инейраминидазу вируса В можно разделить на 5 подтипов. Их изменчивость носит более постепенный и медленный характер, что объясняет эпидемиологические особенности вируса гриппа В (эпидемии возникали 1 раз в 3-4 года до 1988 г.). В мире сейчас циркулируют 2 варианта вируса гриппа В: В/Пекин/184/93 (Европа, Америка, Африка, Австралия) и В/Виктория/2/87 (Юго-Восточная Азия). Характерной чертой современных вирусов гриппа А и В является их высокая чувствительность к ингибиторам гемаглютинирующей и инфекционной активности, которые содержатся в сыворотке крови нормальных животных.
Вирусы гриппа С . Вирусы гриппа С, в отличие от вирусов А и В, не вызывают эпидемий, но они могут быть причиной вспышек в организованных детских коллективах. Подъемы заболеваемости гриппом С нередко предшествуют или сопровождают эпидемии гриппа А и В. У детей раннего возраста и более старших возрастных группах он приводит к заболеваниям в легкой ибессимптомной форме.
Для вирусов гриппа С характерна значительно большая стабильность антигенных и биологических свойств. По ряду биологических характеристик эти возбудители отличаются от других представителей семейства ортомиксовирусов. Им присуща низкая репродуктивная активность в разных клеточных системах и наличие других, чем у вирусов гриппа А и В, рецепторов на поверхности эритроцитов. Рецептор-деструктирующая активность связана не с нейраминидазой, как у вирусов гриппа А и В, а с ферментом нейраминат-0-ацетилестеразою.
Сложность этиологии усиливают факты выделения от людей вирусов, которые не свойственные человеку. Гены вируса гриппа (H5N1), выделенные в 1997 году от человека в Гонконге, оказались подобными генам птичьего вируса, который преодолел межвидовой барьер. Оказалось, что человеческие и птичьи вирусы гриппа были реасортантами (рекомбинантные штаммы), которые получили внутренние гены РВ1 и РВ2 от перепелиного вируса гриппа А (H9N2) – штаммы А/перепел/Гонконг/61/97.
Вирусы гриппа малоустойчивы во внешней среде, в течение нескольких часов при комнатной температуре разрушаются. Под действием дезинфицирующих растворов (спирта, формалина, сулемы, кислот, щелочей) они быстро погибают. Нагревание до 50-60°С инактивирует вирусы в течение нескольких минут, в замороженном состоянии при температуре -70° С они сохраняются годами, не теряя инфекционных свойств, быстро погибают под воздействием ультрафиолетового излучения. Оптимум размножения вируса происходит при +37°С в слабощелочной среде. Как и другие вирусы, возбудитель гриппа отнюдь не чувствительный к антибиотикам и сульфаниламидам.
Вирус гриппа не растет на обычных питательных средах. Его можно выделить из материала, который получен от больного в первые дни болезни (смывы из носоглотки, мокроты), путем заражения культур или клеток куриных эмбрионов.
Традиционно считалось, что человеческий организм освобождается от возбудителя в ближайшие дни после выздоровления. Однако постепенно накапливались косвенные свидетельства, которые опровергают эту точку зрения. И в 1985 г. были получены прямые доказательства формирования длительной персистенции вируса гриппа. У одного человека удалось многократно выделять вирус гриппа в течение 9-ти месяцев и дольше. Возможность пожизненной персистенции вируса в организме человека продолжает изучаться.
1. Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. – СПб. – 2003.
2. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. – Санкт-Петербург. – 2003.
3. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. – Санкт-Петербург. – 2007. – 254 с.
4. Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. – М., 2006. –С. 226-247.
5. Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. – М., 2005. – С.159-175.
6. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). – М., 2005. – С. 287-292.
7. Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. – М., 2002.
8. Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. – М., – 2004. – С.5-9.
9. Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
10. Романцов М.Г., Ершов Ф.И. Часто болеющие дети: Современная фармакотерапия. – М., 2006. – 192 с.
11. Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. – СПб. – 2004. – С. 82-95.
12. Лекарственные средства в фармакотерапии патологии клетки / под редакцией Т.Г. Кожока.-М., 2007.
Цитопатическое действие вируса (ЦПД), имеет три основных типа:
- кругло- или мелкоклеточная дегенерация;
-образование многоядерных гигантских клеток (симпластов);
- развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток;
Включения выявляются в окрашенных по Романовскому-Гимза мазках из зараженных клеток. Они бывают эозинофильные и базофильные.
По локализации в клетке различают:
Характерные ядерные включения формируются в клетках, зараженных вирусами герпеса (тельца Каудри), цитомегалии и полиомы, аденовирусами, а цитоплазматические включения - вирусами оспы (тельца Гварниери и Пашена), бешенства (тельца Бабеша-Негри) и другие. По форме, размерам, структуре, отношению к красителям вирусные включения строго специфичны. Например, тельца Гуарниери имеют округлую, серповидную или амебоидную форму диаметром 1-10 мкм, тельца Бабеша-Негри -овальные или эллипсоидные, достигающие 20 мкм, включения реовирусов серповидные, наполовину охватывающие клеточное ядро, коревые включения - в виде почкующихся мелких дрожжей.
Симпласты представлены гигантскими многоядерными клетками (например, клетки Цапка, выявляемые при герпетических поражениях), образующимися в результате модификации ЦПМ лизосомальными ферментами. Реже наблюдают образование синцитиев— больших конгломератов цитоплазмы, содержащих сотни и тысячи ядер связанных между собой клеток. Образование синцитиев обусловлено модификацией ЦПМ поверхностными гликопротеинами и характерно для парамиксовирусов.
49. Взаимодействие вируса с клеткой, способы проникновения, морфогенез и выход вирусов из клетки
Типы взаимодействия вируса с клеткой. Различают три типа взаимодействия вируса с клеткой: продуктивный, абортивный и ин-тегративный.
Продуктивный тип — завершается образованием нового поколения вирионов и гибелью (лизисом) зараженных клеток (цитоли-тическая форма). Некоторые вирусы выходят из клеток, не разрушая их (нецитолитическая форма).
Абортивный тип — не завершается образованием новых вирионов, поскольку инфекционный процесс в клетке прерывается на одном из этапов.
Интегративный тип, или вирогения — характеризуется встраиванием (интеграцией) вирусной ДНК в виде провируса в хромосому клетки и их совместным сосуществованием (совместная репликация).
Адсорбция. Взаимодействие вируса с клеткой начинается с процесса адсорбции, т. е. прикрепления вирусов к поверхности клетки. Это высокоспецифический процесс. Вирус адсорбируется на определенных участках клеточной мембраны — так называемых рецепторах. Клеточные рецепторы могут иметь разную химическую природу, представляя собой белки, углеводные компоненты белков и липидов, липиды. Число специфических рецепторов на поверхности одной клетки колеблется от 10 4 до 10 5 . Следовательно, на клетке могут адсорбироваться десятки и даже сотни вирусных частиц.
Проникновение в клетку. Существует два способа проникновения вирусов животных в клетку: виропексис и слияние вирусной оболочки с клеточной мембраной. При виропексисе после адсорбции вирусов происходят инвагинация (впячивание) участка клеточной мембраны и образование внутриклеточной вакуоли, которая содержит вирусную частицу. Вакуоль с вирусом может транспортироваться в любом направлении в разные участки цитоплазмы или ядро клетки. Процесс слияния осуществляется одним из поверхностных вирусных белков капсидной или суперкапсидной оболочки. По-видимому, оба механизма проникновения вируса в клетку не исключают, а дополняют друг друга.
Биосинтез компонентов вируса. Проникшая в клетку вирусная нуклеиновая кислота несет генетическую информацию, которая успешно конкурирует с генетической информацией клетки. Она дезорганизует работу клеточных систем, подавляет собственный метаболизм клетки и заставляет ее синтезировать новые вирусные белки и нуклеиновые кислоты, идущие на построение вирусного потомства.
Реализация генетической информации вируса осуществляется в соответствии с процессами транскрипции, трансляции и репликации.
Существуют следующие общие принципы сборки вирусов, имеющих разную структуру:
1. Формирование вирусов является многоступенчатым процессом с образованием промежуточных форм;
2. Сборка просто устроенных вирусов заключается во взаимодействии молекул вирусных нуклеиновых кислот с капсидными белками и образовании нуклеокапсидов (например, вирусы полиомиелита). У сложно устроенных вирусов сначала формируются нуклеокапсиды, с которыми взаимодействуют белки суперкапсидных оболочек (например, вирусы гриппа);
3. Формирование вирусов происходит не во внутриклеточной жидкости, а на ядерных или цитоплазматических мембранах клетки;
4. Сложно организованные вирусы в процессе формирования включают в свой состав компоненты клетки-хозяина (липиды, углеводы).
Время, необходимое для осуществления полного цикла репродукции вирусов, варьирует от 5—6 ч (вирусы гриппа, натуральной оспы и др.) до нескольких суток (вирусы кори, аденовирусы и др.). Образовавшиеся вирусы способны инфицировать новые клетки и проходить в них указанный выше цикл репродукции.
Вирусы позвоночных и человека распределены на 17 семейств. Каждое семейство разбито на роды, а роды — на виды. На рисунке 1 схематически изображены структура и размеры ви- рионов различных семейств.
В процессе размножения вирусов в клетках возникают изменения, характерные для определенного вируса (или группы вирусов) и не встречающиеся при других патологических состояниях клеток. Наука о закономерностях изменений структуры и
функции клетки, развивающихся в процессе ее взаимодействия с инфекционными и онкогенными вирусами, называется вирусной цитопатологией. Комплекс морфологических изменений в культуре клеток, вызванный тем или иным вирусом, называют цитопа- тическим действием (ЦПД) или эффектом (ЦПЭ) вируса.
Цитопатические действия выявляют при микроскопии нативных препаратов или после окраски фиксированных клеток. ЦПД широко используется для индикации и идентификации вирусов. Изучение патологических изменений клеток с помощью комплекса методов цитологии, цитохимии и электронной микроскопии позволяет выявлять различия не только между видами вирусов, но часто и среди отдельных штаммов одного и того же вируса.
Взаимодействие вирусов и клеток является сложным процессом; в значительной степени он определяется нуклеиновой кислотой, ее структурой, местом репликации в клетке, степенью вирулентности и другими свойствами вирусов. Цитопатические изменения— следствие нарушения метаболизма клеток, связанных с репродукцией вирусов. Они развиваются лишь в том случае, если вирус адсорбируется и проникает внутрь чувствительной клетки. При этом основной причиной патологических изменений служит подавление нормального биосинтеза нуклеиновых кислот и белков клетки.
Основными исходами взаимодействия клетки и вируса могут 'быть деструкция клетки, деструкция вируса, взаимная деструкция клетки и вируса, пролиферация клетки, размножение вируса, синтез неполного вируса, трансформация клетки, персистенция вируса в клетке, сохранение фрагментов генетического аппарата клетки в геноме вируса и другие формы.
Наиболее важными для идентификации вируса из большого числа форм, вариантов и исходов взаимодействия вирусов с клеткой являются пять легко отлчимых под микроскопом типов цито- патогенного действия: деструкция клеток, образование симплас- тов, формирование внутриклеточных включений, трансформация клеток, хроническая вирусная инфекция.
Наиболее выраженная деструкция клеток наблюдается при размножении в них пикорнавирусов с коротким циклом репродукции Дегенеративные изменения в клетках отмечают уже через 8 ч после заражения. Характеризуются они вакуолизацией и появлением в цитоплазме ацидофильных масс, маргинацией хроматина, пикнозом ядер. Монослой большинства клеток разрушается через 24 ч. Цитолитическим действием обладают также вирусы везикулярного стоматита, вирусной диареи, ящура, везикулярной болезни свиней и др.
У многих вирусов хорошо проявляется симпластообразующая активность. Агломерацию клеток и формирование симпластов могут вызывать вирусы группы оспы, герпесвирусы, парамиксовиру- сы. В основе снмпластообразования лежит механизм слияния плазматических мембран соседних клеток. Слияние может быть извне и изнутри. Слияние извне развивается быстро и наблюдается на первых этапах взаимодействия и вируса, и клетки, при множественности заражения 100—1000 вирусных частиц на клетку. Слияние изнутри отмечают на поздних этапах процесса размножения вируса, что и обусловлено синтезом вирусспецифичес- ких антигенов. Слияние может быть между зараженными и не- зараженными клетками. Сейчас известно свыше 20 вирусов, обладающих симпластообразующей активностью. Каждому вирусу свойствен определенный диапазон симпластообразования. Среди вирусов с данной активностью есть вирусы, вызывающие деструкцию и разрушение клеток (вирусы группы оспы), цитоплазматические и внутриядерные включения (вирусы чумы крупного рогатого скота и инфекционного ринотрахеита). Симпла- стообразованне можно наблюдать в различных первичных и перевиваемых культурах клеток. У некоторых вирусов симплас- тообразованне — единственный признак поражения клеток, имеющий важное диагностическое значение при идентификации.
Многие вирусы животных образуют внутриклеточные включения — комплекс структур, выявляемых в инфицированной вирусом клетке светооптическими методами. По отношению к красителям включения бывают окси- и базофильные, по химическому составу РНК- и ДНК*содержащие, лишенные нуклеиновых кислот, по структуре — гомогенные и зернистые, по локализации — внутрицитоплазматические и внутриядерные. В процессе развития инфекции структура и состав включений меняются. Внутриклеточные включения могут состоять из вирусспецифичес- ких структур (виропластов, скоплений вирионов и клеточных образований), а органоиды клетки — находиться в состоянии деструкции, пролиферации и гипертрофии. Сейчас известно свыше 90 различных вирусов, при размножении которых формируются кле* точные включения. Однако, несмотря на большое число вирусов, способных вызывать в инфицированных клетках включения, состав, топография, локализация настолько специфичны для каждого из них, что все эти особенности имеют первостепенное значение в обнаружении и идентификации вируса (вирус чумы собак, парагрипп крупного рогатого скота).
Трансформация клеток под действием вируса сопровождается появлением очагов беспорядочного многослойного роста клеток. Трансформированные клетки отличаются от исходных изменением кариотипа, метаболизма и утратой контактной ннгиби- ции; среди них появляются гигантские клетки с резко выраженным ядерным полиморфизмом, усилением митотической активности, атипичными митозами, хромосомными аномалиями. Некоторые трансформированные клетки обладают туморогенной активностью при введении их животным.
При латентной (хронической) инфекции возможна незначительная продукция вируса без видимого поражения клеток. Механизмы латентной инфекции разнообразны. Отмечают интеграцию вирусного и клеточного геномов, размножение вируса синхронно с клеточным делением или цитоплазматическую локализацию в фагосомальных и мембранных структурах В ряде случаев латентная инфекция — промежуточная стадия между острой инфекцией и трансформацией клеток.
Все указанные выше пять видов цитопатогенного действия — это уже крайний исход взаимодействия вирусов с клетками. Задолго до наступления выраженного ЦПД наблюдают ряд других (ранних) патологических поражений клеток, которые тоже могут быть диагностическими тестами. К ним относят динамику развития патологических изменений, подавление митотической активности клеток, набухание ядер инфицированных клеток, различные взаимоотношения между репродукцией вируса и клеточным цик лом, деструктивное влияние вирусов на хромосомный аппарат клетки и т. д.
Для определения динамики ЦПД вирусов исследуют серию окрашенных препаратов, взятых через различные промежутки времени после заражения культур клеток.
Исследованы репродуктивные свойства и цитопатическое действие на клетки современных изолятов ВИЧ-1 субтипов А, В и новой циркулирующей рекомбинантной формы CRF02_AG/А на модели первичной культуры мононуклеарных клеток периферической крови. Изучение биологических свойств генетических вариантов ВИЧ-1 при экспериментальной моноинфекции показало, что изоляты CRF02_AG/А обладали более высокими репродуктивными свойствами по сравнению с ВИЧ-1 субтипов А и В. Культивирование ВИЧ-1 субтипа А сопровождалось выраженной цитодеструкцией клеток независимо от скорости репродукции, тогда как ВИЧ-1 CRF02_AG/А и при высокой вируспродукции оказывал слабое цитопатическое действие на клетки.
Ключевые слова: ВИЧ-1, субтипы ВИЧ, репродуктивные свойства ВИЧ, патогенез ВИЧ.
Целью работы являлось изучение репродуктивных и цитопатических особенностей современных российских генетических вариантов субтипов А, В и циркулирующей рекомбинантной формы (circulating recombinant forms) CRF02_AG/A ВИЧ-1 при культивировании вирусов на мононуклеарных периферических клетках крови (МПК).
С целью сравнительного анализа репродуктивных и биологических свойств вариантов ВИЧ смесь ФГА-стимулированных МПК, полученных от двух здоровых доноров, заражали аликвотами вируссодержащей суспензии ВИЧ, равными по содержанию вирусного белка р24 (30 нг/мл), как описано в материалах и методах. Культивирование инфицированных ВИЧ клеток осуществляли в течение дней. В процессе культивирования вирусов оценивали скорость и уровень накопления белка р24, производили визуальную оценку состояния клеточной культуры, рис. 1.
Рис. 1. Особенности цитопатического действия ВИЧ при инфекции МПК in vitro; А — неинфицированные МПК здорового донора, стимулированные фитогемагглютинином, Б — выраженное цитопатическое действие ВИЧ при инфекции в культуре МПК (сочетание цитодеструкции, образования гигантских клеток — синцитиев, гибели клеток), В — МПК, инфицированные изолятом ВИЧ, не обладающим выраженным цитопатическим действием (образование синцитиев, изменение формы клеток); фотография изображений при увеличении в 300 раз
Рис. 2. Динамика накопления вирусного белка р24 ВИЧ-1 при культивировании генетических вариантов ВИЧ-1 субтипов А, В и CRF02_AG/А в группах slow/low (менее 100 000 пкг/мл) и rapid/high (более 100 000 пкг/мл)
Выявленные биологические и генетические характеристики изолятов ВИЧ приведены в табл. 1 и 2. Данные по динамике накопления р24 ВИЧ-1 представлены на рис. 2 и 3.
Обсуждение результатов. Изучение биологических характеристик циркулирующих и появляющихся новых вариантов ВИЧ-1 представляется крайне актуальным в связи с тем, что генетические варианты ВИЧ могут различаться по своим биологическим свойствам — по скорости эволюции и прогрессирования заболевания, иметь отличия в механизмах развития лекарственной устойчивости и потенциале для возникновения резистентности, по проявлению ответа на применяемую антиретровирусную терапию, иметь преимущества при определенных путях трансмиссии вируса [3, 5].
Генетический вариант CRF02_AG/А ВИЧ-1 был впервые выявлен нами в Новосибирской области (НСО) в 2009 году [1], а в 2011 году было доказано, что CRF02_AG/А ВИЧ-1 появился в результате рекомбинации двух вирусных вариантов — российского ВИЧ субтипа А и среднеазиатского вируса CRF02_AG [4]. В течение последних четырех лет регистрируется неуклонный рост выявления описанной нами CRF02_AG/А среди новых ВИЧ-инфицированных НСО (в 2006 году — 2 %, в 2008 — 28 %, в 2009 более 50 %, в 2012 — 73 % среди исследованных за год 240 случаев), данный генетический вариант выявляется в 25 % случаев инфицирования в Новокузнецке (неопубликованные данные), регистрируется среди инфицированных ВИЧ-1 на других территориях России [2]. В связи с тем, что, по крайней мере, в Сибирском регионе России наблюдается активное замещение основного генетического варианта — ВИЧ-1 субтипа А, определявшего все предшествующие годы развитие эпидемии ВИЧ-инфекции в стране, новым ВИЧ-1 CRF02_AG/А, необходимо было провести сравнительные исследования биологических свойств данных вирусных вариантов. Кроме того, в исследование были включены варианты ВИЧ-1 субтипа В, циркулирующего на всем протяжении эпидемии на разных территориях РФ со стабильной распространенностью [12].
В связи со способностью ВИЧ-1 к рекомбинации (обмену участками генома между копиями РНК с образованием рекомбинантных форм вируса) для выявления отличий в репликативных свойствах отдельных вирусных штаммов проводят изучение экспериментальной моноинфекции ВИЧ invitro [11]. В данном исследовании отобранные для изучения изоляты ВИЧ-1 культивировались одновременно при одинаковых условиях (питательная среда, клетки, количество взятого для заражения ВИЧ, нормированное по содержанию вирусного белка р24). Для корректности учета данных изоляты ВИЧ-1 по схожести характеристик были поделены на две группы — с медленным и быстрым типом репродукции. В группе slow/low преимущество по скорости и количеству накопления белка р24 было выявлено у ВИЧ субтипа В. Цитопатическое действие и синцитеобразование более ярко проявлялось у изолятов ВИЧ субтипа А (табл. 1).
Биологические и генетические свойства изолятов ВИЧ-1 (группа slow/low)
| Код изолята ВИЧ | Субтип ВИЧ-1 | Синцитеобразование на МПК | Цитопатический эффект на МПК | Накопление р24 (нг/мл) на сутки |
|---|---|---|---|---|
| 6949 | A | SI ++ | ++ | 14,6 |
| 2065 | A | SI + | ++ | 56,5 |
| 6937 | A | SI + | +++ | 14,1 |
| 6939 | CRF02_AG/А | NSI | ++ | 56,0 |
| 6443 | CRF02_AG/А | SI ++ | ++ | 19,7 |
| 4011 | В | SI+ | ++ | 78,0 |
| 4457 | В | SI + | + | 59,2 |
| 6542 | B | SI ++ | ++ | 63,8 |
| 4867 | B | NSI | ++ | 37,5 |
В группе изолятов с высоким темпом накопления белка р24 наиболее высокие показатели концентрации вирусного белка были выявлены у изолятов CRF02_AG/А ВИЧ-1 (рис. 2). Цитопатическое действие на клетки и образование синцитиев в большей степени было выражено при культивировании изолятов ВИЧ-1 субтипа А (табл. 2).
Биологические и генетические свойства изолятов ВИЧ-1 (группа rapid/high)
| Код изолята ВИЧ | Субтип ВИЧ-1 | Синцитеобразование на МПК | Цитопатический эффект на МПК | Накопление р24 (нг/мл) на 11 сутки |
|---|---|---|---|---|
| 2225 | А | SI +++ | ++ | 120,5 |
| 2273 | A | SI ++ | +++ | 283,7 |
| 2240 | CRF02_AG/А | SI + | ++ | 329,5 |
| 3124 | CRF02_AG/А | SI + | + | 122,5 |
| 6909 | CRF02_AG/А | SI + | ++ | 348,0 |
| 6999 | B | NSI | + | 209,4 |
Изоляты ВИЧ субтипов А и В имели близкие репродуктивные свойства. Необходимо отметить, что аналогичное исследование репродуктивных свойств российских изолятов ВИЧ субтипа А проводилось в начале годов [10]. Данные, полученные для изолятов субтипа А ВИЧ-1 в настоящем исследовании, позволяют заключить, что современные вирусы, относящиеся к тому же генетическому варианту, превосходят по репликативным характеристикам циркулирующие ранее в РФ ВИЧ-1 субтипа А в
Культивирование изолятов ВИЧ-1 субтипа А сопровождалось более выраженной цитодеструкцией МПК независимо от скорости их репродукции, тогда как даже при высокой вируспродукции изоляты CRF02_AG/А оказывали слабое цитопатическое действие на чувствительные клетки, варианты ВИЧ-1 субтипа В по этому признаку занимали промежуточное положение.
Рис. 3. Усредненные данные по динамике накопления вирусного белка р24 при культивировании генетических вариантов ВИЧ субтипов А, В и CRF02_AG/А
Выводы. Изучение биологических свойств изолятов ВИЧ-1 показало, что в процессе развития эпидемии ВИЧ в России происходит отбор и распространение вариантов ВИЧ-1 субтипа А, имеющих более высокие репродуктивные показатели.
Российские изоляты CRF02_AG/А обладают более высокими репродуктивными свойствами при слабо выраженном цитопатическом действии на клетки по сравнению с вариантами ВИЧ-1 субтипов А и В, способностью в короткие сроки поражать большое количество клеток.
Наличие описанных в работе особенностей нового рекомбинантного ВИЧ CRF02_AG/А, а именно — быстрое размножение вируса без существенного разрушения чувствительных к вирусу клеток, позволяет предположить, что данный генетический вариант ВИЧ, возможно, способен поддерживать более высокую виремию в крови инфицированных, тем самым усиливая вероятность заражения ВИЧ при контактах со здоровыми людьми. Суммируя данные впервые проведенного сравнительного исследования биологических свойств современных циркулирующих в России ВИЧ-1, можно заключить, что биологические особенности активно распространяющегося в стране CRF02_AG/А могут позволить отнести этот вирус к более патогенным вариантам ВИЧ-1.
В связи с активным распространением CRF02_AG/А ВИЧ-1 на территории России необходимо проведение более детальных исследований структурно-функциональных особенностей нового вирусного варианта и особенностей патогенеза ВИЧ-инфекции, вызванной CRF02_AG/А ВИЧ-1.
Работа проводилась с использованием УСУ при финансовой поддержке Министерства образования и науки Российской Федерации, Государственный контракт № 14.518.11.7062; при финансовой поддержке по гранту НШ-2996.2012.4 по государственной поддержке ведущих научных школ Российской Федерации.
Государственная лицензия ФГБОУ ВО НГМУ Минздрава России
на образовательную деятельность:
серия ААА № 001052 (регистрационный № 1029) от 29 марта 2011 года,
выдана Федеральной службой по надзору в сфере образования и науки бессрочно
Свидетельство о государственной аккредитации ФГБОУ ВО НГМУ Минздрава России:
серия 90А01 № 0000997 (регистрационный № 935) от 31 марта 2014 года
выдано Федеральной службой по надзору в сфере образования и науки
на срок по 31 марта 2020 года
Адрес редакции: 630091, г. Новосибирск, Красный проспект, д. 52
тел./факс: (383) 229-10-82, адрес электронной почты: mos@ngmu.ru
Средство массовой информации зарегистрировано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) —
Свидетельство о регистрации СМИ: ПИ № ФС77-72398 от 28.02.2018.
 |
|
08.02.2016 11.01.2016 28.12.2015 Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|

