Индометацин при гепатите с

Нестероидные противовоспалительные препараты (НПВП) относятся к числу наиболее востребованных лекарственных препаратов (ЛП). Они представляют важное значение для практического здравоохранения, и относятся к наиболее часто применяемым препаратам в повседневной врачебной практике, причем многие из них отпускаются без рецепта врача, т.е. легко доступны для населения. Более тридцати миллионов человек в мире ежедневно принимают НПВП, причем 40 % этих пациентов имеют возраст старше 60 лет [1]. По прогнозам, это количество будет только возрастать по мере общего старения населения развитых стран, и, соответственно, увеличения распространенности заболеваний, при которых применяются НПВП. В первую очередь это дегенеративные заболевания опорно-двигательного аппарата и ревматические поражения мягких тканей, что имеет не только медицинское, но и большое социальное значение, т.к. приводит к длительной потере трудоспособности и инвалидности [3, 4]. По сравнению с другими классами противовоспалительных средств (глюкокортикоиды, препараты базисного лечения) НПВП – наиболее востребованы в клинической практике, их применяют в большинстве случаев воспаления как препараты I ряда. Широкое применение НПВП обусловлено их высокой активностью, быстрым развитием эффекта и относительно высокой безопасностью. Кроме того, эти средства вызывают не только симптоматический болеутоляющий эффект, уменьшают скованность и повышают подвижность суставов, но и оказывают патогенетическое действие, ограничивая повреждающее влияние простаноидных медиаторов воспаления [9, 10].
Наличие пациентов с коморбидной патологией требует осторожности при назначении НПВП у пациентов с высоким риском сердечно-сосудистой, почечной патологии, заболеваниями печени и желудочно-кишечного тракта. Для повышения эффективности лечения рекомендуется применять препараты класса НПВП в самых низких эффективных дозах и наиболее коротким по длительности курсом [2, 3].
Одной из наиболее распространенных форм заболеваний опорно-двигательного аппарата, наряду с такими заболеваниями как рак, туберкулез, сахарный диабет, патология сердечно-сосудистой системы, одно из первых мест среди причин потери трудоспособности и инвалидности занимает остеоартроз (ОА) [6, 7]. Наиболее характерными симптомами ОА являются постоянные боли в области суставов, что предполагает назначение НПВП с высоким анальгетическим индексом и хорошей переносимостью [1, 14].
Важнейшим вопросом современной фармакотерапии является не только эффективность, но и безопасность ЛС. Выделяют большую группу заболеваний, при которых нарушение равновесия между факторами агрессии желудочного содержимого и защитными факторами слизистой оболочки желудка и двенадцатиперстной кишки, являются классическим представлением о патогенезе эрозивно-язвенного поражения желудочно-кишечного тракта (ЖКТ) на всем его протяжении. К ним относятся не только язвенная болезнь желудка и двенадцатиперстной кишки, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), но и язвы, ассоциированные с приемом лекарственных средств, к которым в первую очередь необходимо отнести ЛП класса НПВП [8, 11].
Выявлена важная роль простагландинов в поддержании базального уровня секреции бикарбонатов [2, 3].
Доказано, что длительный прием некоторых групп ЛП является важным повреждающим фактором слизистой оболочки желудка и двенадцатиперстной кишки [1, 13]. Так, НПВП (ацетилсалициловая кислота, индометацин, кеторолак, диклофенак, и др.) и глюкокортикостероидные препараты способствуют угнетению защитных факторов, первые за счет подавления синтеза простагландинов, вторые за счет влияния на процессы микроциркуляции, регенерации и стимуляции секреции соляной кислоты и пепсина. Поэтому актуальной задачей рациональной фармакотерапии пациентов, страдающих полиморбидными состояниями и сочетанием заболеваний опорно-двигательного аппарата и желудочно-кишечного тракта, является возможность стратификации риска развития осложнений при совместном применении препаратов класса НПВП [5, 13].
Механизм действия НПВП достаточно хорошо изучен. Широкое применение НПВП объясняется их универсальным спектром действия. Они обладают противовоспалительным, анальгезирующим и жаропонижающим эффектами и приносят облегчение больным с соответствующими симптомами, которые отмечаются при многих заболеваниях.
В первую очередь, благодаря их анальгетической активности, они одновременно составляют и группу ненаркотических (неопиатных) анальгетиков. Важно, что начав лечение с НПВП, больные ревматическими заболеваниями очень редко (не более чем в 10 % случаев) переходят на прием простых анальгетиков [2, 6]. При этом, едва ли в клинической медицине можно отметить другой, столь частый и разнообразный по характеру проявлений и причинам феномен, как боль. Изначально она может формироваться как важная защитная биологическая реакция организма. Однако, сильная, или длительно существующая боль сама формирует очаги патологического возбуждения, усиливающие функционально-морфологические изменения в органах и костно-мышечных образованиях. Важно подчеркнуть, что острая боль – это симптом, а хроническая боль может стать, по существу, самостоятельным заболеванием.
Эксперты разных стран едины во мнении, что различия в эффективности НПВП в качестве обезболивающих и противовоспалительных препаратов относительно невелики. Обзоры нескольких десятков клинических исследований различных препаратов этой группы при остеоартрозе, ревматоидном артрите, дорсопатии не дают существенных оснований ранжировать эти препараты по степени их эффективности [7].
Сегодня арсенал НПВП достаточно широк. Препараты этой группы традиционно разделяют по их химическому строению. Однако данная классификация не характеризует свойства различных групп средств. Для понимания особенностей действия препаратов и правильного применения их в клинической практике важно знать различия в механизме действия тех или иных НПВП и, соответственно, классифицировать их по механизму действия.
По современным представлениям, ключевой и наиболее общий механизм противовоспалительного действия НПВП – угнетение ими биосинтеза простагландинов (ПГ) из арахидоновой кислоты [2, 12].
На основании этих данных в последние десятилетия достигнуты значительные успехи в изучении механизма действия НПВП. Так, в начале 1970-х гг. Дж.Р. Вэйн с коллегами показал, что болеутоляющее, жаропонижающее и противовоспалительное действия ацетилсалициловой кислоты обусловлены подавлением ею синтеза ПГ [14]. Он же показал, что НПВП снижают продукцию ПГ за счет ингибирования ЦОГ, и это действие – основной механизм действия НПВП. В сложном комплексе реакций, составляющих воспалительный процесс, участвуют многочисленные биологически активные вещества, которые определяются как медиаторы воспаления. В их число входят белки и полипептиды (кинины и калликреины), лейкоцитарные факторы (факторы хемотаксиса, интерлейкины,антикейлоны и др.), белки системы комплимента;биогенные амины (гистамин и серотонин) и продукты метаболизма арахидоновой кислоты – эйкозаноиды(простагландины, простациклин, тромбоксаны) и лейкотриены.
НПВП оказывают угнетающее влияние на образование и проявление эффектов многих из перечисленных факторов [3, 8]. Однако влияние препаратов на активность белков и биогенных аминов в основном относят к вторичным эффектам. По современным представлениям, ключевой и наиболее общий механизм противовоспалительного действия НПВП – угнетение ими биосинтеза простагландинов из арахидоновой кислоты [3, 8].
Еще в 1970-х гг. была высказана версия о существовании разных типов ЦОГ, а затем и открытие двух изоформ ЦОГ – ЦОГ–1 и ЦОГ–2 [13]. ЦОГ-1 постоянно экспрессируется и функционирует в тканях и органах и участвует преимущественно в регуляции физиологических процессов. Экспрессия ЦОГ-2 (уровень активности которой в физиологических условиях весьма низкий) индуцируется цитокинами при повреждении или воспалении тканей, с ее активностью связывают синтез флогогенных ПГ [1].
При выборе НПВП следует принимать во внимание:
– наличие (и характер) факторов риска побочных эффектов;
– наличие сопутствующих заболеваний;
– совместимость НПВП с другими лекарственными препаратами.
С одной стороны, способность НПВП ингибировать синтез ПГ, участвующих в развитии патологического процесса, определяет их противовоспалительное, болеутоляющее и жаропонижающее действия. С другой стороны, нежелательные, побочные эффекты НПВП, такие как эрозии и язвенные поражения ЖКТ, желудочные кровотечения и нарушения функций почек, развиваются также вследствие угнетения образования эйкозаноидов – простациклина (ПГ-I2), ПГ-E2 и тромбоксана А2. Так, ульцерогенная активность НПВП вызвана нарушением физиологических функций ПГ-E2 и простациклина в слизистой оболочке желудка [2, 10]. Оба гормона выполняют здесь защитную, гастропротективную функцию: стимулируют продукцию слизи, ингибируют секрецию соляной кислоты и улучшают питание тканей за счет расширения сосудов и улучшения микроциркуляции [5, 11]. Поэтому при приеме НПВП подавление синтеза ПГ приводит к развитию эрозий слизистой оболочки и ее язвенному поражению.
В настоящее время целесообразно классифицировать НПВП по их ингибирующей активности в отношении разных изоформ ЦОГ, или, иными словами, по механизму действия.
По данным многих исследований [4, 6] большинство НПВП в равной степени ингибируют ЦОГ-1 и ЦОГ-2. По избирательности действия в отношении ингибирования обеих изоформ ЦОГ выделяют селективные и неселективные НПВП. Неселективные в одинаковой степени подавляют оба изофермента, селективные – преимущественно угнетают ЦОГ-2. Некоторые авторы отмечают, что селективные ингибиторы ЦОГ-2 менее эффективны при боли, связанной с воспалительными поражениями суставов и позвоночника, чем неселективные НПВП.
Ингибирование ЦОГ–2 рассматривается, как один из важных механизмов противовоспалительной и анальгетической активности НПВП, а ЦОГ–1 – развития нежелательных лекарственных реакций [6, 15].
Очевидно, что наиболее высокой противовоспалительной активностью по-прежнему обладают неселективные ингибиторы ЦОГ, такие как диклофенак, индометацин, кетопрофен. ацеклофенак Селективные ингибиторы ЦОГ-2 обеспечивают сравнимую с традиционными НПВП аналгезию, но не превосходят их и по болеутоляющей активности [9].
Соотношение активности НПВП по степени блокирования ЦОГ-1/ЦОГ-2 позволяет судить об их потенциальной токсичности. Чем меньше эта величина, тем более селективен препарат в отношении ЦОГ-2 и, тем самым, менее токсичен. Например, для нимесулида она составляет 0,22; для мелоксикама 0,33; диклофенака – 2,2; пироксикама – 33; индометацина – 107 [8]. В исследованиях было показано, что после приема 100 мг ацеклофенака активность ЦОГ-2 в нейтрофилах человека блокируется более чем на 97 %, а активность ЦОГ-1 только на 46 %; при приеме 75 мг диклофенака это соотношение составляло 97 % и 82 % соответственно [3, 4].
Для ряда НПВП отмечают также хондропротективный, антигистаминовый и антибрадикининовый эффекты, что в ряде случаев также позволяет отнести НПВП к средствам базисной фармакотерапии. Даже при заболеваниях, считавшихся ранее дегенеративными (ОА, дорсопатия), показано развитие воспалительного процесса и продукции цитокинов (интерлейкинов -ИЛ-1, ИЛ-6), фактора некроза опухоли альфа (ФНО- альфа)), медиаторов боли и воспаления таких как простагландины (ПГ- Е2) и др.
Общепринятой считается классификация НПВП по механизму действия. Так, к селективным ингибиторам ЦОГ-1 относится ацетилсалициловая кислота в низких дозах (0,1–0,2 в сутки).
Неселективными ингибиторами ЦОГ-1 и ЦОГ-2 (нНПВП) считаются:
ацетилсалициловая кислота в высоких дозах (1,0–3,0 в сутки и более); фенилбутазон; ибупрофен; кетопрофен; напроксен; нифлумовая кислота; пироксикам; лорноксикам; диклофенак; ацеклофенак; индометацин и ряд других НПВП.
Селективные ингибиторы ЦОГ-2 (сНПВП)
Высокоселективные ингибиторы ЦОГ-2 (сНПВП)
Селективные ингибиторы ЦОГ-3
ацетаминофен; метамизол натрия.
Необходимо отметить, что исследования избирательности действия НПВП продолжаются.
Фармакокинетика НПВП – весьма важная характеристика, поскольку влияет и на фармакодинамику препаратов.
При пероральном приеме все препараты этой группы хорошо (до 80–90 % и более) абсорбируются в верхних отделах кишечника, однако скорость всасывания и время достижения максимальной концентрации в плазме могут значительно отличаться у отдельных препаратов.
Большинство НПВП – производные слабых органических кислот. Благодаря кислотным свойствам эти препараты (и/или их метаболиты) обладают высоким сродством к белкам – связываются с белками плазмы более чем на 90 %. Высокое сродство к белкам плазмы – причина конкурентного вытеснения из связи с альбуминами лекарственных средств других групп.
Метаболизм НПВП протекает в основном в печени путем глюкуронирования. Ряд препаратов (диклофенак, ацеклофенак, ибупрофен, пироксикам, целекоксиб) предварительно гидроксилируется при участии цитохрома P-450 (преимущественно изоферментов семейства CYP 2С9). Метаболиты и остаточные количества препарата в неизмененной форме выводятся почками с мочой и, в меньшей степени, печенью с желчью [1, 3].
Показатели T1/2 препарата в плазме и в очаге воспаления (например, в полости сустава) тоже различны, в частности, для диклофенака они составляют 2–3 ч и 8 ч, соответственно. Поэтому длительность противовоспалительного эффекта не всегда коррелирует с клиренсом препарата из плазмы.
Такие НПВП, как диклофенак, кетопрофен, ацеклофенак, ибупрофен – весьма активные, но относительно безопасные средства в связи с особенностями их распределения и метаболизма. Эти особенности заключаются в накоплении и длительном присутствии препаратов в воспаленной ткани и, одновременно, быстром клиренсе их из центрального компартмента, включая кровь, сосудистую стенку, сердце и почки, что уменьшает возможность развития нежелательных лекарственных реакций (НЛР) [15].
Побочные эффекты НПВП
Несмотря на несомненную клиническую эффективность, применение НПВП имеет свои ограничения. Это связано с тем, что даже кратковременный прием этих препаратов в небольших дозах может приводить к развитию НЛР, которые в целом встречаются примерно в 25 % случаев, а у 5 % больных могут представлять серьезную угрозу для жизни [10]. Особенно высок риск НЛР у лиц пожилого и старческого возраста, которые составляют более 60 % потребителей НПВП.
Значительная часть этих пациентов имеют одно, а чаще, несколько сопутствующих заболеваний (артериальную гипертонию, сахарный диабет, стенокардию и др.), что существенно повышает риск развития осложнений проводимой фармакотерапии.
Оценка безопасности включает регистрацию любых нежелательных явлений (НЯ) независимо от их связи с исследуемым препаратом, зарегистрированных после подписания пациентом согласия на участие в исследовании.
В настоящее время стало очевидным, что до 50 % всех атипичных фармакологических ответов: неэффективность лекарственного средства или нежелательные лекарственные реакции могут быть также связаны с генетическими особенностями пациентов. Эти генетические особенности представляют собой полиморфные участки генов белков, участвующих в фармакокинетике или фармакодинамике лекарственных средств, называемые полиморфными маркерами или аллельными вариантами. Для НПВП таким геном-кандидатом является CYP2C9, кодирующий основной фермент биотрансформации НПВП в печени. Поэтому в последние годы особое внимание привлечено к проблеме безопасного применения НПВП, при этом основным негативным свойством всех препаратов этой группы является высокий риск развития нежелательных реакций со стороны желудочно-кишечного тракта (табл. 1).
Побочные эффекты, отмечаемые при приеме НПВП
Орган или система органов
Побочные эффекты, отмечаемые при приеме НПВП
Ненаркотические анальгетики по своим фармакологическим свойствам существенно отличаются от анальгетиков группы морфина. Эти препараты по силе анальгетического действия значительно уступают наркотическим болеутоляющим средствам. Их эффект проявляется, главным образом, при болях воспалительного характера (артриты, миозиты, невралгии и др.).
Ненаркотические анальгетики не угнетают дыхания, не вызывают эйфории и лекарственной зависимости, не обладают снотворным эффектом, не влияют на кашлевой центр. У данной группы препаратов отчетливо проявляются противовоспалительный и жаропонижающий эффекты, которых нет у наркотических анальгетиков.
Достоинством этих препаратов является отсутствие наркотического эффекта, что дало основание широко применять их в амбулаторной практике.
Классифицируются ненаркотические анальгетики по химической структуре:
5. Оксикамы: пироксикам, теноксикам. Некоторые ненаркотические анальгетики часто называют анальгетиками-антипиретиками, так как они имеют не только болеутоляющее, но и жаропонижающее действие. К ним относятся производные пиразолона (анальгин), салициловой кислоты (кислота ацетилсалициловая) и анилина (парацетамол, фенацетин). У этих препаратов слабо выражено противовоспалительное свойство. Однако широкое применение в последнее время получили ненаркотические анальгетики, обладающие болеутоляющим, жаропонижающим, противовоспалительным и десенсибилизирующим эффектами. Эти препараты в результате выраженного противовоспалительного действия называются " нестероидные противовоспалительные средства" (НПВС). Они нашли не только применение как анальгезирующие и жаропонижающие средства, но и широко используются при лечении разных воспалительных заболеваний. К нестероидным противовоспалительным средствам относятся препараты, производные органических кислот (ибупрофен, диклофенак, индометацин, мефенамовая кислота); оксикамы (пироксикам), производные салициловой кислоты и некоторые препараты пиразолонового ряда (бутадион).
НПВС, несмотря на различия химического строения, имеют общий механизм действия всех эффектов (болеутоляющего, противовоспалительного, жаропонижающего, десенсибилизирующего), в основе которого лежит угнетающее влияние на биосинтез простагландинов.
В процессе воспаления под влиянием различных повреждающих факторов (микробы, их токсины, ферменты лизосом, гормоны) активируется фосфолипаза A 2 , которая из фосфолипидной фракции клеточных мембран освобождает арахидоновую кислоту. Последняя вовлекается в процесс метаболизма: циклооксигеназный и липоксигеназный. При участии циклооксигеназы из нее образуются циклические эндопероксиды, простагландины (ПГ), простациклины (при участии простациклинсинтетазы) и тромбоксаны (при участии тромбоксансинтетазы). Следует иметь в виду, что многие простагландины являются медиаторами воспаления и боли.
Под влиянием липоксигеназы арахидоновая кислота превращается в лейкотриены (ЛТ) - медиаторы аллергических реакций немедленного типа и медиаторы воспаления.
Синтез эндопероксидов, ПГ и ЛТ сопровождается появлением свободных радикалов кислорода, способствующих развитию воспалительного процесса, повреждению клеток, субклеточных структур и возникновению болевых реакций. В свою очередь ПГ (например, E 1 , I2) повышают активность медиаторов воспаления и боли (гистамина, серотонина, брадикинина), расширяют артериолы, увеличивают проницаемость капилляров, участвуют в развитии отека и гиперемии, в нарушении микроциркуляции, в формировании болевых ощущений. ПГF2 a и тромбоксан A 2 вызывают сужение венул, а последний способствует также образованию тромбов, усугубляющих нарушения микроциркуляции.
НПВС, блокируя циклооксигеназу, снижают образование простагландинов (E 1 , I2, F2 a ), тромбоксанов, в результате тормозится развитие воспаления, боли и снижается повышенная температура тела.
Противовоспалительный эффект препаратов в основном связан с подавлением экссудативной и пролиферативной фазы воспаления, на процесс альтерации они влияют мало. Однако при блокаде синтеза ПГ уменьшается образование свободных радикалов кислорода, повреждающих клеточные мембраны в очаге воспаления, и несколько снижается альтерация. Подавление экссудативной фазы в основном связано с блокадой циклооксигеназы, торможением синтеза простагландинов (ПГЕ2, ПГI2, ПГF2 a ), тромбоксана A 2 , это приводит к уменьшению гиперемии, отека, боли. Снижение уровня простагландинов одновременно тормозит выброс других тканевых медиаторов воспаления (гистамина, серотонина, брадикинина, норадреналина); угнетение образования тромбоксана A 2 и активности гиалуронидазы способствует нормализации микроциркуляции. Препараты снижают энергетический обмен клетки, уменьшая АТФ в тканях очага воспаления. Нестероидные противовоспалительные средства подавляют интенсивность пролиферативных процессов. Блокируя синтез ПГ, препараты уменьшают проницаемость сосудистой стенки и проникновение в ткани плазменных факторов. При этом снижается активность гуанилатциклазы и уровень цГМФ, угнетается деление фибробластов, синтез коллагена, мукополисахаридов, образование ревматических гранулем и соединительной ткани. Антипролиферативное действие частично связано и с торможением активности серотонина и брадикинина, стимулирующих деление фибробластов. Деструктивные процессы в хрящевой и костной ткани препараты, к сожалению, не тормозят. Более того, они подавляют способность хондроцитов секретировать ингибиторы "разрушающих" протеолитических ферментов (коллагеназы и эластазы), последние накапливаются, вызывая деструкцию хрящевой и костной ткани. Кроме того, снижается синтез протеинов, необходимых для регенерации хрящевой и костной тканей, подавляется гемоперфузия в очаге воспаления, что также нарушает процесс регенерации, особенно в головках костей. Из всех препаратов только пироксикам не вызывает деструкции хряща и кости, так как блокирует интерлейкин-1, стимулирующий продукцию "разрушающих" протеолитических ферментов (коллагеназы и эластазы).
НПВС обладают десенсибилизирующим действием, что весьма важно при лечении заболеваний, в патогенезе которых имеют место аллергические реакции замедленного типа (ревматизм, ревматоидный артрит и др.). Это их свойство наиболее выраженое у индометацина, ортофена, напроксена, бутадиона, проявляется не сразу (как правило в течение 2-6 месячного применения). Десенсибилизирующий эффект объясняется редукцией синтеза ПГE 2 , что снижает хемотаксис моноцитов, Т-лимфоцитов, эозинофилов, полиморфноядерных лейкоцитов в очаге воспаления и тормозит деление (бласттрансформацию) лимфоцитов.
Анальгетический эффект препаратов тесно связан с их противовоспалительным действием, они, в основном, снижают боль, обусловленную воспалением. В результате подавления воспалительного процесса падает уровень простагландинов, особенно ПГE 2 и ПГI2 (простациклин), принимающих участие в возникновении боли, способствующих отеку, повышающих чувствительность болевых рецепторов к брадикинину и гистамину - основным медиаторам боли. Однако анальгетический эффект ненаркотических анальгетиков есть следствие не только их периферического противовоспалительного действия. Так, парацетамол, не обладая противовоспалительным действием, широко применяется как болеутоляющее средство, поскольку в анальгетическом эффекте ненаркотических анальгетиков (в том числе парацетамола) имеется центральный
компонент: снижается уровень ПГ в структурах головного мозга, участвующих в проведении боли, угнетается поступление болевых импульсов по восходящим путям спинного мозга, в области таламуса, а также несколько увеличивается выделение эндорфинов.
По обезболивающей активности ненаркотические анальгетики существенно отличаются. Наиболее сильным анальгетическим действием обладают индометацин, диклофенак натрия (ортофен), ибупрофен, кетопрофен, напроксен, кислота мефенамовая. Несколько слабее действуют метамизол натрия (анальгин), парацетамол, ацетилсалициловая кислота. Препараты можно применять амбулаторно и длительно, так как они не вызывают психической и физической зависимости, не угнетают дыхания.
Жаропонижающий эффект препаратов проявляется только при повышенной температуре тела. При лихорадке пирогены стимулируют синтез ПГ в цереброспинальной жидкости. НПВС уменьшают содержание ПГ в спинномозговом пространстве и тормозят их активирующее влияние на клетки гипоталамуса, нормализуя состояние теплорегулирующих структур и способствуя увеличению теплоотдачи и усилению потоотделения. Поскольку ПГ в поддержании нормальной температуры не участвуют, НПВС на нее не влияют. Жаропонижающие средства применяются при температуре выше 38,5°С-39°С, когда есть опасность возникновения гипоксии с отеком мозга, гипертермических судорог, нарушения микроциркуляции почечного кровотока и деятельности сердца. При более низкой температуре эти препараты лучше не назначать, так как лихорадка активирует механизмы защиты организма. По интенсивности •жаропонижающего действия препараты располагаются в следующий ряд: индометацин, ибупрофен, анальгин, парацетамол, ацетилсалициловая кислота.
Ацетилсалициловая кислота редко используется как жаропонижающее средство, так как уступает другим препаратам по этому эффекту, например, анальгину, парацетамолу и, кроме того, часто дает осложнения. Для снижения температуры тела применяют анальгин. Он действует быстро, не обладает "судорожным" эффектом (в отличие от амидопирина), может назначаться и внутрь, и внутримышечно, и внутривенно (в тяжелых случаях вводят 50% раствор). Однако, как и другие производные пиразолона (амидопирин), анальгин угнетает кроветворение, вызывая лейкопению, анемию, иногда агранулоцитоз. Как правило, в качестве жаропонижающего средства используется парацетамол, особенно у детей. Выгодна комбинация парацетамола с ацетилсалициловой кислотой (для получения жаропонижающего и болеутоляющего эффектов); они взаимно усиливают действие, кроме того, парацетамол
защищает слизистую желудка от раздражающего действия ацетилсалициловой кислоты.
Торможение синтеза ПГ, имеющих важное значение для течения физиологических и патологических процессов в тканях, может привести к возникновению ряда общих осложнений. Наиболее частым и опасным побочным эффектом являются эрозивно-язвенные изменения слизистой оболочки желудка. Локальное раздражающее действие препаратов не является главной причиной гастропатии. В основном она обусловлена снижением в стенке желудка синтеза ПГ. которые регулируют ее защитные свойства, нормализуя кровоснабжение, усиливая образование слизи, снижая секрецию соляной кислоты. Поэтому НПВС могут повышать кислотность желудочного сока, нарушать кровоснабжение слизистой, приводить к диспепсическим расстройствам, желудочным кровотечениям, провоцировать эрозивно-язвенные процессы (ульцерогенное действие). Высокий риск побочных эффектов со стороны желудочно-кишечного тракта характерен для бутадиона, индометацина, пироксикама, ацетилсалициловой кислоты. Частота этих осложнений снижается, если препараты принимают после еды, запивая большим количество воды, или в сочетании с антацидами. В меньшей степени повреждают слизистую оболочку кишечнорастворимые лекарственные формы (аспирин) и так называемые пролекарства, например, сулиндак: в печени он превращается в два метаболита, один из которых (сульфит) является активным ингибитором простагландинов. Для профилактики возникновения гастропатий специфическим средством считается мизопростол (сайтотек) -аналог простагландина E1 , входящий, например, в состав артротека (комбинация мизопростола и диклофенака натрия).
Опасным осложнением НПВС является бронхоспазм. Блокада ПГ может вызвать сдвиг метаболизма арахидоновой кислоты в сторону образования лейкотриенов (возникает отек тканей, спазм гладкой мускулатуры и другие проявления аллергии немедленного типа). Наиболее часто это осложнение развивается при назначении ацетилсалициловой кислоты (аспирина). НПВС снижают диурез и вызывают отеки, так как подавляют образование почечных ПГ, участвующих в регуляции почечного кровотока, клубочковой фильтрации, секреции ренина и водно-солевого баланса. Падение уровня ПГ способствует задержке натрия и возникновению отеков (особенно характерно для бутадиона, диклофенака натрия, кетопрофена, кислоты мефенамовой). Бутадион, кроме того, повышает чувствительность рецепторов почек к антидиуретическому гормону (диурез снижается).
Наряду с перечисленными, НПВС дают ряд других (не связанных с ПГ) побочных эффектов: изменения со стороны крови, печени, ЦНС, кожи. Тяжелые гематологические нарушения (лейкопения и даже агранулоцитоз, апластическая анемия) характерны для пиразолоновых производных (бутадион, амидопирин, анальгин); нарушения кроветворения могут вызвать индометацин, кислота мефенамовая. Различные формы поражения печени вплоть до токсического гепатита (длительное назначение) развиваются при применении бутадиона, индометацина, сулиндака, диклофенака натрия (ортофен). Побочные эффекты со стороны центральной нервной системы наблюдаются при лечении ацетилсалициловой кислотой (шум в ушах. снижение остроты слуха, головокружение, гипервентиляция), индометацином (головокружение. сильные головные боли, депрессия, иногда галлюцинации. судороги); со стороны кожных покровов (кожный зуд, ограниченная или генерализованная крапивница, эритродермия) - особенно при применении бутадиона, индометацина, оксикамов.
НПВС (в частности, напроксен, кетопрофен, пироксикам) могут вызвать афтозный стоматит, способствуют кровоточивости десен и раздражению слизистой оболочки полости рта.
НПВС нельзя назначать в первый триместр беременности, так как они обладают тератогенными свойствами, например, применение ацетилсалициловой кислоты в этот период может вызвать расщелину верхнего неба у плода. Лечение НПВС во второй половине беременности также рискованно, поскольку иногда способствует сужению (и даже закрытию) артериального протока и нарушению гемодинамики плода.
Опасно назначение этих препаратов (особенно индометацина) в предродовом периоде - снижая уровень ПГ, они ослабляют сократимость матки и тормозят родовую деятельность.


Рассказывает специалист по заболеваниям печени, врач-гастроэнтеролог, доктор медицинских наук, профессор Первого Московского государственного медицинского университета им. Сеченова
Алексей Буеверов.
Говорящие цифры
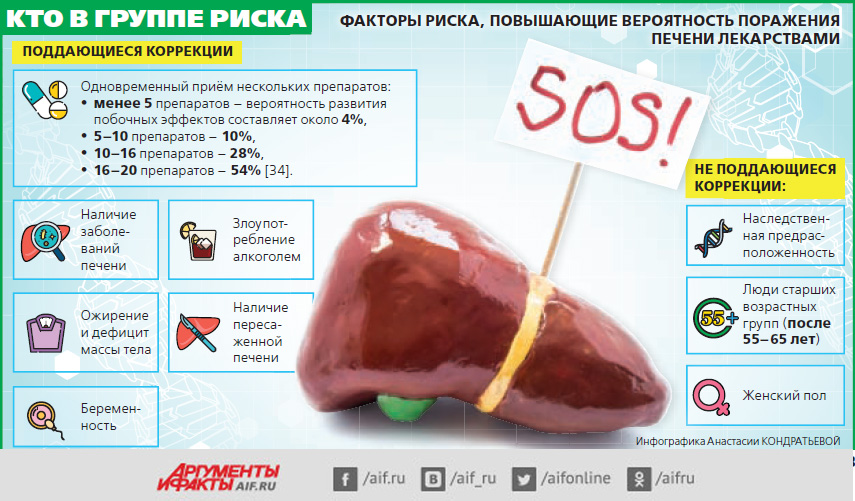
Влияние лекарств на печень – реальная и очень серьёзная проблема. Но представления пациентов о вреде далеки от реалий. Зачастую люди занимаются самолечением, принимая разрекламированные средства без консультации с врачом. А иногда даже не читают инструкцию по применению, считая, что ничего страшного с ними не произойдёт. Но это не так.
Для начала несколько фактов. В мире зафиксировано около 1000 препаратов с токсическим действием на печень. При этом из-за таких побочных эффектов за последние 32 года сняты с регистрации только 11 лекарств. Считается, что негативное действие на печень бывает у 1,4% всех пациентов, получающих лекарственную терапию. Это примерно 13,9–19,1% случаев на 100 000 назначений лекарств. Однако, по данным французских учёных, истинная частота поражений печени от лекарств в 16 раз выше.
По статистике, у 2–5% пациентов, попадающих в больницу с желтухой, в болезни виноваты именно лекарства. При острых гепатитах у людей старше 40 лет вред от препаратов гораздо больше – 40%. А в тяжелейшей печёночной недостаточности, требующей пересадки этого органа, препараты виноваты в 13–25%. Причём в США половина таких случаев связана с обычным парацетамолом, продающимся без рецепта.
Кроме парацетамола, тяжёлую печёночную недостаточность вызывали кетоконазол, флуконазол и другие противогрибковые препараты, галотан для наркоза, противотуберкулёзный изониазид, метилдофа для снижения давления, витамин никотиновая кислота, противобактериальные тетрациклин и нитрофурантоин, цитостатики меркаптопурин и метотрексат, а также ряд других лекарств, включая и противораковые.
Такое воздействие на печёночные клетки всегда зависит от принимаемой дозы препарата и может коснуться любого человека. Типичный пример – отравление суррогатами алкоголя или парацетамолом при его применении в дозах, значительно превышающих терапевтические (более 10 г в сутки).
Знание – сила
Что нужно знать пациентам? Если существенно превысить дозировку препарата, проблемы с печенью возникнут независимо от того, есть ли генетическая предрасположенность к печёночной недостаточности или нет. Поэтому очень важно следить за дозой лекарств и избегать приёма нескольких препаратов с одним активным веществом. Это очень важно относительно парацетамола, так как он находится в массе комплексных лекарств от простуды, которые люди принимают одновременно в большом количестве. Уже через 1–2 дня после такого активного приёма наступает передозировка и начинаются проблемы. Чтобы избежать негативных последствий, необходимо срочно прекратить приём опасного препарата и начать лечение ацетилцистеином – этот антидот используют при передозировке парацетамолом.
Чаще встречается другой тип осложнений, который зависит не от дозы препарата, а от индивидуальной непереносимости какого-то из лекарств. Это может быть из-за врождённых дефектов биохимических и ферментных систем организма или из-за особенностей иммунологической реакции (гиперчувствительность). В последнем случае такой побочный эффект может быть уже после первого приёма лекарства, но развивается он постепенно и проявляется обычно через 1–8 недель. Бывают случаи, когда этот скрытый период длится до года от начала лечения препаратом. В итоге человек получает одну из форм аутоиммунного гепатита. Подобные осложнения чаще всего развиваются при длительном лечении антибиотиками (амоксициллин + клавуланат и другие) и нестероидными противовоспалительными средствами (диклофенак, нимесулид и другие). После отмены препарата гепатит может приобретать хроническое течение.
При любых поражениях печени важно сразу обратиться к врачу. Это непростые ситуации, от которых нередко зависит вопрос жизни и смерти, и лечить их должен только специалист.
Основные группы широко используемых препаратов, поражающих печень
Женские половые гормоны (эстрогены и гестагены).
Используют для контрацепции, лечения многих женских заболеваний и климакса.
НПВС (нестероидные противовоспалительные средства) – нимесулид, диклофенак, ацетилсалициловая кислота, сулиндак, индометацин, напроксен и другие.
Используют в лечении болезней суставов, позвоночника и для облегчения разных болей.
Статины и фибраты – симвастатин, аторвастатин и масса других лекарств.
Используют для снижения холестерина.
Антибиотики – миноциклин, карбенициллин, оксациллин, амоксициллин-клавуланат, моксифлоксацин, макролиды, триметоприм-сульфаметоксазол и многие другие.
Используют в лечении бактериальных инфекций.
Противогрибковые средства – вориконазол, итраконазол, амфотерицин, флуконазол и др.
Для лечения разных заболеваний, вызываемых грибками.
Читайте также:


