Индикация вирусов из воды

ВИРУСОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ , комплекс методов исследования, позволяющих распознать этиологию вирусного заболевания и изучить его возбудителя.
Осн. этапами В. и. являются выделение вируса от больных и павших животных (взятие, консервирование, пересылка и подготовка материала, заражение им животных, куриных эмбрионов, культуры клеток); титрование вирусов для определения их кол-ва в исследуемых материалах; культивирование вирусов на восприимчивых домашних и лабораторных животных, особенно на развивающихся куриных эмбрионах и культурах тканей (гл. обр. первичнотрипсинизированных).
С помощью морфологич. методов выявляют элементарные тельца, внутриклеточные включения (напр., Бабеша — Негри при бешенстве, Боллингера при оспе птиц). Иммунохимич. методы (гл. обр. метод флуоресцирующих антител) позволяют определить специфич. вирусный антиген в заражённых [зараженных] клетках тканевой культуры или органов и тканей инфицир. животных. С помощью серологич. методов проводят видовую и группоспецифич. идентификацию вируса и антител в сыворотках переболевших животных. С этой целью используют реакции нейтрализации, РСК, реакцию гемагглютинации, задержки гемагглютинации, диффузионной преципитации, торможения гемадсорбции. Реакция нейтрализации позволяет улавливать антигенные различия сходных между собой вирусов даже в пределах одноимённой [одноименной] группы. РСК применяют для обнаружения вирусных антигенов в материалах от больных и павших животных, идентификации выделенного вируса, изучения антигенных связей между различными вирусами и определения антител у переболевших животных. Реакции гемагглютинации и задержки гемагглютинации широко применяют в В. и. для диагностич. целей и типирования возбудителей болезни Ньюкасла, гриппа птиц, парагриппа и нек-рых аденовирусов; непрямую реакцию гемагглютинации используют для выявления адено- и миксовирусов, хламидий. Реакцией прицепитации в агаре изучают антигенную структуру вирусов, выявляют антитела в сыворотке и антигены в исследуемом материале. Реакцию гемадсорбции применяют для предварительной индикации и титрования вирусов в культуре клеток, особенно тех, к-рые не вызывают цитопатич. действия. Гемадсорбция наступает раньше проявления цитопатогенного действия, поэтому её [ее] используют как ранний метод предварительной индикации вирусов. Гемадсорбция островковая (адсорбция эритроцитов на отдельных участках монослоя клеток) типична для гриппа свиней, эпидемич. паротита; диффузная (адсорбция эритроцитов на клетках всего монослоя)— для классич. чумы кур, болезни Ньюкасла, афр. чумы свиней и др. Методы очистки и концентрации вирусов используют при изучении физич., химич. и морфологич. свойств вирусов. Фазовые системы, образованные полимерами, используют для концентрации вирусов из больших объёмов [объемов] вируссодержащих жидкостей, выделения нуклеиновых к-т вирусов. Радиобиологич. методы применяют в В. и. для изучения распределения и локализации вирусов (антител) в организме и особенно для изучения процессов онтогенеза вирусов. С помощью электронной микроскопии обнаруживают вирионы в исследуемом материале и специфич. конгломераты вирусов и антител (иммунная электронная микроскопия). Иммуноэлектроосмофорез обусловлен одновременным встречным движением в геле агара антигена и антитела в результате разной величины электрич. заряда с образованием комплекса антиген — антитело в виде линии преципитации и последующей его денатурацией. Метод применяют при изучении антигенной структуры вируса. Изоэлектрич. фокусирование основано на способности белков переходить в инертное (в отношении электрофоретич. подвижности), а затем агрегированное состояние в изоэлектрич. точке. Метод применяют для изучения белков вирусов. При иммуноферментативном методе происходит присоединение фермента к антителам с последующим образованием комплекса фермент — антитело — антиген, к-рый выявляют в клетке с помощью цитохимич. реакции на фермент (пероксидазу, щелочную и кислую фосфотазу, глюкозооксидазу). Метод используют с диагностич. целью для выявления вирусных антигенов в культурах клеток, мазках-отпечатках, криостатных срезах, а также для изучения тонкой структуры антигенов вируса, патогенеза вирусных болезней и др. См. также Вирусоскопия .
Лит.: Тихоненко Т. И., Методические основы биохимии вирусов, М., 1973, с. 152—58; Лабораторная диагностика вирусных и риккетсиозных заболеваний, пер. с англ., ред. Э. Леннет и Н. Шмидт, М., 1974.
С введением в действие СанПин 2.1.4.559-96 "Вода питьевая", а также СанПин 2.1.5.980-2000 "Гигиенические требования к охране поверхностных вод" разработана новая нормативная база, предусматривающая контроль качества воды различного вида водопользования не только по показателям бактериального, но и вирусного загрязнения, в частности по колифагам, а также энтеровирусам.
В связи с низкой концентрацией вирусов в воде, важным первичным этапом вирусологического исследования является их концентрирование из больших объемов воды (10-100 л и более до 10 - 50 мл).
Минимальный размер патогенных вирусов составляет 0,03 микрометра, что значительно меньше размера пор микрофильтрационной мембраны. Поэтому для их выделения можно использовать низкопроизводительные мембраны (нанофильтры), либо микрофильтрационные мембраны обладающие повышенной сорбцией вирусов.
Схема установки с использованием компрессора и напорной емкости
Установка для вирусологического анализа состоит из мембранного модуля МФМ-0142 с мембраной ММПА+, напорной емкости на 10 л ( или 20л) и компрессора. Исследуемую воду заливают в напорную емкость, крышку которой тщательно закрывают и включают компрессор. С помощью компрессора в напорной емкости создается давление 1,0-1,5 Bar. В процессе фильтрации фильтрат поступает на слив, а концентрат вирусов остается на мембране модуля.
Схема установки концентрирования вирусов с перистальтическим насосом
При фильтрации значительных объемов исследуемой воды предлагается разработанная схема с перистальтическим насосом. Исследуемая вода из расходной емкости подается перистальтическим насосом на мембранный модуль МФМ-0142. Фильтрат после модуля поступает в сборник фильтрата, а концентрат остается на мембране. При фильтрации сильнозагрязненной воды установка комплектуется предфильтром в виде капсульного фильтра (миникапсула МКМ).
Стадия элюции вирусов
Используемый ранее большинством вирусологов способ элюции предусматривал изъятие мембраны из модуля и механический смыв вирусов с мембраны струей элюента из пипетки, что представляло определенную опасность инфицирования работающего персонала. Исключение риска инфицирования возможно было только при выполнении данной процедуры в условиях ламинарного бокса, что сопряжено с существенными сложностями и значительными финансовыми затратами.
В разработанном специалистами НПП "Технофильтр" способе элюция вирусов осуществляется без извлечения мембраны, т.е. в режиме закрытого модуля.
Элюция вирусов с мембраны осуществляется без разборки модуля (в закрытом режиме), путем продавливания элюента в три приема по 20 мл двумя одноразовыми шприцами. Шприцы, один из которых содержит элюент, присоединяется к стыковочным устройствам на линии воды и на линии выхода фильтрата. Все соединительные шланги оснащены быстросъемными соединениями. В каждый прием элюент продавливается через мембрану с помощью этих шприцов не менее 8÷10 раз.
Рекомендовано НИИ ЭЧ и ГОС им. А.Н. Сысина
Основные преимущества мембранного модуля МФМ-0142
Основными достоинствами фильтрующего модуля МФМ-0142 (ТУ 3614-005-32915592-2005) являются:
- возможность совмещения процессов концентрирования и элюции в одном аппарате,
- высокая эффективность концентрирования и элюции, достигаемая за счет оригинальной конструкции, обеспечивающей интенсивный массоперенос жидкости над мембраной и через неё,
- возможность осуществления щадящих условий концентрирования и десорбции вирусов (фильтрация проводится при средах близких к нейтральным без использования каких-либо реагентов),
- снижение количества элюанта до 60мл,
- обеспечение безопасности обслуживающего персонала (элюция проводится с помощью шприцев без разборки аппарата),
- простота и удобство при эксплуатации.
Особенности и преимущества мембран ММПА+
Высокая эффективность мембран ММПА+-0,2 была подтверждена при многочисленных испытаниях (фильтрация речной воды, воды из подземных источников, а так же сточных вод). В 2007 году в Нижегородском НИИ эпидемиологии и микробиологии им. И.Н. Блохиной мембраны ММПА+-0,2 были использованы в процессе концентрирования вирусов гепатита А, одного из трудно культивируемых вирусов. Были использованы искусственно приготовленные суспензии ВГА в дистиллированной воде взятых в разведении от 1·10-4 до 1·10-8 ПУЛ.
Установлено, что использование мембран ММПА+-0,2 обеспечивает повышение чувствительности метода контролирования ВГА на 2 порядка по сравнению с ранее известными методами. При этом достигается надежное удержание вируса даже при концентрациях ниже пороговой чувствительности используемого метода. Было показано, что концентрирование вирусов на мембране ММПА+-0,2 можно проводить при нейтральном рН в отличие от нитроцеллюлозных мембран, для которых достаточный уровень выделения достигается при рН ниже 4,0. Поскольку элюирование собранных вирусов не всегда удобно проводить сразу же после концентрирования важно, чтобы условия проведения процесса и сам материал фильтрата не оказывали влияния на жизнеспособность вируса (экстремальные значения рН могут инактивировать некоторые вирусы). Этим требованиям в наибольшей мере соответствует мембрана ММПА+.
Сравнительные испытания мембран ММПА+-0,2 дают основания для заключения об их превосходстве над остальными по эффективности задержания производительности и универсальности.
Вода считается средой, где зародилась жизнь. Таким образом, именно вода представляет собой наиболее благоприятную атмосферу для жизнедеятельности простейших организмов на всей планете. Однако, к сожалению, не всегда эти микроорганизмы полезны для человека.
Интересно, что загадочным образом мудрая природа на протяжении тысячелетий всячески оберегала здоровье и жизнь человечества от всех опасных вирусов и бактерий, содержащихся в ручьях, реках и морях. Вода регулярно проходила самоочищение при помощи планктона и водорослей, а возможно и других, не известных нам, методов. Но наступивший двадцатый век создал такие условия перед природой, что она не может самостоятельно справиться с современными загрязнениями, созданными людьми.
Наша планета буквально окружена смогом промышленных городов, а количество продуктов человеческой жизнедеятельности в водоемах медленно, но верно отравляет всю воду Земли. По этой причине все более актуальными становятся фильтры для воды, цена которых вполне доступна рядовому покупателю.
Промышленная очистка воды для питья, отвечающая установленным стандартам качества, совершенно не гарантирует того, что Н2О, доставляемая потребителям, является отличного качества. Ведь даже после очищения в водопроводной воде обитают и развиваются всевозможные микроорганизмы. Они распространяются по всем отводам водопровода и имеют тесную связь с биологическими органическими веществами, а также биогенными элементами.
Большинство микроорганизмов, которые размножаются в системе водоснабжения, должны по идее быть безопасными для человека, однако среди них могут встречаться и достаточно болезнетворные бактерии, несущие реальную угрозу потребителям. Прежде всего, страдает категория людей с поврежденной иммунной системой, поскольку их организм не в состоянии бороться с вирусами.
Как свидетельствуют данные доклада Всемирной организации здравоохранения, преимущество процесса городской водопроводной очистки заключается в удалении особо опасных патогенных микроорганизмов из воды (к примеру, кишечной палочки, шигеллы, сальмонеллы), а также таких болезнетвореных бактерий, как синегнойная палочка, Aeromonas SPP, Legionella SPP и Mycobacterium SPP. Все эти вирусы легко размножаются в воде. Несмотря на это, в практике микробиологического контроля применяется только один бактериологический индикатор, который указывает на загрязнение воды организмами отходного происхождения или же, другими словами, возможное наличие патогенных организмов кишечного происхождения.
Всевозможные исследования, как международные, так и отечественные, постоянно фиксируют присутствие в водных экосистемах опасных патогенных вирусов и условно-патогенных бактерий, представляющих угрозу для человека. Их размножение в воде происходит стремительными темпами, соответственно, потенциальный риск от употребления микробиологически загрязненной воды возрастает с каждым днем. Поэтому есть смысл подобрать себе качественную фильтрующую установку для воды.
Как считают специалисты, предотвратить накопления микроорганизмов можно, если максимально ограничить количество частиц, а также концентрацию всех органических веществ на водоочистительных станциях. Помимо этого, нужно регулярно удалять отложения, которые накапливаются в водопроводной сети на биологических мембранах, и всячески поддерживать оптимальные концентрации дезинфицирующих средств. Однако, к сожалению, все эти напутствия остаются пока лишь в воздухе в качестве слов, а объем вирусов и бактерий в водопроводной воде остается по-прежнему рискованно высоким. Перечислим лишь приблизительный список тех организмов, которые попадают к нам в чайники и кастрюли вместе с водой.
Из бактерий самыми распространенными являются холерный вибрион, палочка синезеленого гноя, сальмонеллы, аэромонада спп, шигеллы, иерсиния ентероколитика,энтеропатогенные кишечные палочки, кампилобактер еюни и коли.
Из вирусов постоянные обитатели воды из-под крана – это аденовирусы, ротавирус, энтеровирусы, норволк вирус, мелкие круглые вирусы, вирус гепатита А, а также энтеровирусы гепатита А, В, Е. Помимо вирусов и бактерий, в воде наличествуют еще и простейшие - дракункулюс мединензис, энтамеба гистолитика, криптоспоридум парвум, гиардиа интестиналис. Это все лишь малая часть вредных веществ в сырой воде. С учетом того, что сменные модули и картриджи к настольным диспенсерам являются уже обыденным делом, то фильтры для воды – это вообще прибор первой необходимости.
Изобретение относится к области биотехнологии, молекулярной биологии, молекулярно-генетической диагностики вирусных болезней животных, и может быть использовано в научных исследованиях для обнаружения генетического материала вирусов иммунодефицита FIV (feline immunodeficiency virus) и лейкемии FeLV (feline leukemia virus) кошек методом мультиплексной полимеразной цепной реакции (ПЦР) в крови животных.
Возбудителей заболеваний - FIV и FeLV - относят к семейству Retroviridae. Данные вирусы характеризуются высокой степенью гомологии и сходным строением геномов: имеют три основных структурных гена, кодирующих вирусные протеины в следующем порядке: 5′-gag-pol-env-3′: gag (group specificanti gen - кодируют белки сердцевины), pol (кодируют обратную транскриптазу - polymerase и интегразу) и env (кодируют белки оболочки - envelope).
Внутри группы штаммов FIV, изолируемых от домашних кошек, можно различить 5 генетических вариантов, обладающих определенной вариабельностью геномов. Разделение на типы и подтипы осуществляется на основании анализа модификаций структуры гена env (Martins A.N. et all, 2008). FeLV также характеризуется значительной вариабельностью в структуре генов. По результатам анализа вирусных геномов наименее вариабельными оказались: ген gag FIV и область, расположенная непосредственно перед геном gag-pro-pol FeLV.
Схема жизненного цикла ретровирусов включает: связывание вириона с рецептором клетки хозяина, вход в клетку, обратное транскрибирование с образованием кДНК интеграцию в геном хозяина (формирование провируса) (Супотницкий М.В. Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. - М.: Вузовская книга, 2009. - 400 с.). В соответствии с биологическими особенностями вирусов методы, направленные на выявление антител, менее информативны, чем те, что позволяют обнаружить сам вирус.
Вирусы лейкемии и иммунодефицита кошек могут долгие годы не проявлять себя в зараженном организме, делая его источником инфекции. Они передаются горизонтальным путем и вертикально, от матери к плоду. Часто данные болезни протекают сочетано, то есть одно животное является носителем обоих вирусов. Эти инфекции широко распространены как среди домашних, так и среди бродячих кошек (Красников А.В., Ларионова О.С., Марушева Ю.А. Анализ инфицированности кошек ретровирусными инфекциями в Саратовской области // Аграрный научный журнал №2, 2015. С. 14-16).
Вирусы являются лимфонейротропными, инфицирование приводит к глубокой иммуносупресии, проявляющейся развитием вторичных инфекций и опухолевых процессов. Животное всю жизнь находится на поддерживающей терапии. При этом схемы лечения вирусных лейкемии и иммунодефицита кошек различны, так как несмотря на то что вирусы поражают преимущественно лимфоциты, FIV вызывает иммунное заболевание - снижение популяции CD4-Т-лимфоцитов, а FeLV провоцирует онкологическое заболевание - клонирование вирусмодифицированных В-лимфоцитов (Сулимов А.А. Вирусные болезни кошек. - М.: КолосС, 2004. - С. 40-48, 66-70).
В России для диагностики этих инфекций есть две ПЦР-тест-системы, одна для выявления лейкоза, другая - иммунодефицита кошек (ООО ИнтерЛабСервис, Россия). Обе предназначены для проведения ПЦР в реальном времени. Прибор, на котором можно провести анализ, стоит от 2 миллионов рублей и выше. Это делает недоступной диагностику данных заболеваний для рядовых ветеринарных лечебниц и лабораторий. Там же, где есть такой прибор, один анализ стоит от 600 рублей. Учитывая то, что инфекционных агентов два и в ряде случаев исследование требуется повторить, владельцы не в состоянии оплатить качественную диагностику. Поэтому возникает необходимость разработки и внедрения в практику более доступных и экономичных методов.
Метод ПЦР является прямым высокочувствительным и высокоспецифичным методом, с помощью которого можно идентифицировать фрагменты провирусной ДНК FIV и FeLV в лимфоцитах периферической крови кошек. Специфичность метода обуславливают праймеры - олигонуклеотиды, которые фланкируют искомый участок, присоединяясь по принципу комплиментарности на денатурированную ДНК (отжиг), и, являясь затравкой для полимеразы, инициируют элонгацию новой цепи на искомом фрагменте ДНК. Основными параметрами эффективного прохождения реакции амплификации, обеспечивающими специфичность и чувствительность, являются правильный выбор области генома идентифицируемого агента, структура и температурный режим отжига праймеров.
Известен способ определения антител к FIV и FeLV в крови животных методом твердофазного иммуноферментного анализа (ELISA), основанный на обнаружении специфического комплекса антиген-антитело с помощью цветной реакции вследствие ферментирования субстрата энзимом, связанным с коньюгатом (BMC Vet Res. 2013; 9: 2. Comparison of the geographical distribution of feline immunodeficiency virus and feline leukemia virus infections in the United States of America (2000-2011). Bimal К Chhetri, Olaf Berke, David L Pearl, and Dorothee Bienzle). Недостатком метода является невысокая информативность в случае обследования вакцинированного животного (ложноположительные результаты) и на ранних этапах заражения, когда в крови не достаточно высокий уровень антител (ложноотрицательные результаты).
Известен способ выявления FIV в крови кошек методом one-step PCR, основанный на обнаружении ДНК провируса иммунодефицита кошек, а также способ выявления FeLV в крови кошек методом one-step RT-PCR, основанный на обнаружении РНК вируса лейкемии кошек (Vet Res Forum. 2014 Fall; 5(4): 255-61. Molecular and clinical study on prevalence of feline herpesvirus type 1 and calicivirus in correlation with feline leukemia and immunodeficiency viruses. Hamideh Najafi, Omid Madadgar, Shahram Jamshidi, Arash Ghalyanchi Langeroudi, and Mahdieh Darzi Lemraski). Недостатками метода являются многооперационность анализа, то есть необходимость постановки как минимум трех последовательных реакций на одном биоматериале для выявления вышеуказанных патогенов, причем каждого в отдельности.
Известен способ выявления FIV и FeLV в крови кошек методом Real-time PCR, основанный на обнаружении каждого из патогенов по отдельности с помощью двояко меченых флуоресцентных зондов (Красникова Е.С., Красников А.В., Агольцов В.А. Оценка диагностической ценности полимеразной цепной реакции и иммунохроматографического анализа при некоторых превалирующих ретровирусных инфекциях кошек // Аграрный научный журнал. 2013. №2. С. 23-25). Недостатками данного способа является невозможность выявления FIV и FeLV одновременно, что приводит к увеличению времени исследования и повышенному расходу материалов, кроме того, необходимость применения флуоресцентных зондов для учета результатов способствует удорожанию.
Но данный способ не предназначен для выявления вирусов бешенства у животных методом мультиплексной ПЦР и не может быть использован для обнаружения вирусов иммунодефицита и лейкемии из-за неспецифичности праймеров для FIV и FeLV, а также необходимо осуществлять реакцию обратной транскрипции перед постановкой ПЦР и секвенирование для учета результатов, что достаточно трудоемко и затратно.
Технической задачей является разработка эффективного, быстрого и недорогого способа обнаружения ДНК провирусов иммунодефицита и лейкемии кошек методом мультиплексной ПЦР путем конструирования двух специфических пар олигонуклеотидных праймеров и подбора условий для проведения мультиплексной ПЦР с ними.
Технический результат предлагаемого изобретения достигается за счет конструирования диагностического набора праймеров на консервативную область геномов FIV и FeLV и разработка способа их применения в мультиплексной ПЦР с учетом результата методом электрофореза в агарозном геле, что обеспечивает простоту, информативность и доступность исследований для рядовых лабораторий.
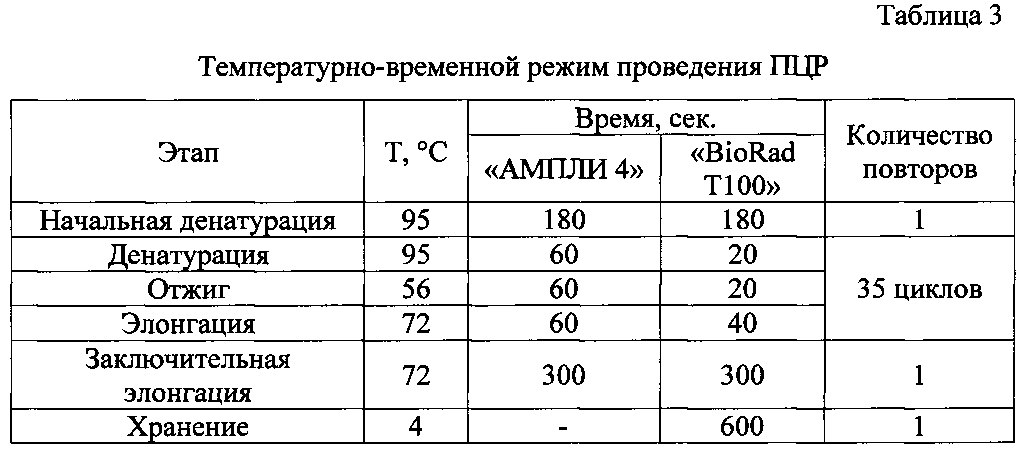
Указанный технический результат достигается созданием набора олигонуклеотидных праймеров для идентификации вирусов иммунодефицита и лейкемии кошек путем сравнения нуклеотидных последовательностей различных штаммов FIV и FeLV, депонированных в международной базе данных GeneBank. При этом на консервативных районах геномов FIV и FeLV, которые не имеют полиндромных повторов нуклеотидов, были рассчитаны и синтезированы две пары олигонуклеотидных праймеров, которые не образуют выраженных вторичных структур, не имеют протяженных G-C участков и отличаются тем, что имеют температуру отжига - 55°C для обоих пар олигонуклеотидов и следующую структуру - FIV F: 5′-AAGAGTCCCAAATATGCCATAGG-3′ и FIV R: 5′-TCCATCCAAATTGCTACTGTTC-3′; FeLV F: 5′-GAATAAACCTCTTGCTGTTTGC-3′ и FeLV R: 5′-AATCAGATCGAATGACAGAGACAC-3′, с образованием в результате работы одной пары (FIV) фрагмента длиной 397 п.н., в результате работы другой пары (FeLV) - длиной 221 п.н. Для применения праймеров используют мультиплексную ПЦР, отличающуюся от прототипа тем, что отсутствует необходимость проводить ОТ, а также составом реакционной смеси, которая готовится путем смешения буфера 10-кратного для ПЦР - 2,5 мкл, дНТФ (25 мМ) - 0,4 мкл, праймеров FIV F, FIV R FeLV F и FeLV R (15 пмоль/мкл) по 1 мкл, Taq полимеразы (5 ед./мкл) - 0,2 мкл, MgCl2 (50 мМ) - 1,5 мкл, бидистиллированной воды - 11,4 мкл и пробы ДНК - 5 мкл. При этом амплификацию проводят в следующем режиме: тотальная денатурация 95°C - 3 мин, цикл денатурация (95°C - 20 или 60 сек) - отжиг (55°C - 20 или 60 сек) - элонгация (72°C - 40 или 60 сек), причем цикл денатурация-отжиг-элонгация повторяется 35 раз, заключительная элонгация 72°C - 5 мин., хранение 4°C - 10 мин. При этом детекция полученных результатов осуществляется методом электрофореза в 1,5%-ном агарозном геле, где по наличию или отсутствию амплифицируемых фрагментов нуклеотидных последовательностей длиной 397 п.н. для FIV и 221 п.н. для FeLV судят о наличии или отсутствии вирусов в организме кошек.
На фигуре 1 представлены схемы строения геномов вирусов иммунодефицита и лейкемии кошек, где показано, что вирусы содержат аналогичные гены и имеют примерно одинаковый размер геномов. На фигуре 1 овалом выделены области, на которых осуществлялось конструирование праймеров.
На фигуре 2 представлена электрофореграмма результатов исследования крови FIV и FeLV позитивных кошек методом мультиплексной ПЦР с использованием разработанных праймеров для определении размеров амплифицируемых фрагментов. Пробы 1, 4, 5, 7 и 8 являются FIV и FeLV положительными, а пробы 2, 3 и 6 содержат только ДНК FeLV.
На фигуре 3 представлена электрофореграмма результатов исследования клинического материала от кошек разработанным способом. Пробы 1, 2, 3, 4, 5, 9 - FIV и FeLV - положительные, пробы 6, 7, 10 содержат только ДНК FeLV, проба 8 - отрицательная.
Конструирование двух пар синтетических олигонуклеотидных праймеров, применяемых для выделения ДНК провирусов иммунодефицита и лейкемии кошек, и разработка способа диагностики вирусного иммунодефицита и лейкемии кошек с их использованием осуществлялись в пять этапов:
- анализ структуры геномов FIV и FeLV;
- подбор оптимально сочетающихся между собой двух пар праймеров;
- моделирование состава реакционной смеси способа диагностики вирусных иммунодефицита и лейкемии кошек с использованием подобранных пар праймеров;
- проверка эффективности работы подобранных праймеров с клиническим материалом.
Конструирование праймеров. С помощью компьютерной программы GeneRunner, геном вирусов в формате FASTA применяли для подбора праймеров на участке гена gag FIV и на участке, расположенном непосредственно перед геном gag-pro-pol FeLV, как наиболее консервативных областях геномов данных вирусов.
Подбор оптимально сочетающихся между собой двух пар праймеров. Проверку качества и термодинамический анализ выбранных праймеров выполняли с помощью программ OLIGO DNA/RNA primer analysis software, v. 5.0. (http://molbiol-tools.ca/molecular_biology_freeware.htm#Primer%20design) и BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi). При дизайне праймеров основными требованиями были: степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков внутри праймеров и комплементарности друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига и плавления праймеров.
На основании проведенного компьютерного анализа была подобраны две пары праймеров, характеристики которых приведены в таблице 1.

Подобранные две пары олигонуклеотидных праймеров (FIV F и FIV R; FeLV F и FeLV R) имеют оптимальные размер (22-24 н.) и структуру (отсутствие само- и взаимокомплементарности), о чем свидетельствуют показатели энергии Гиббса на 3′ конце (0 cal/mol) и энергии Гиббса димерных структур (-1 cal/mol), оптимальный GC состав (42%) и температуру отжига для обоих пар праймеров 55°C. В результате работы одной пары (FIV F и FIV R) образуется фрагмент длиной 397 п.н., в результате работы другой пары (FeLV F и FeLV R) - длиной 221 п.н., GC состав продуктов 40% и 56% соответственно, температура плавления продукта 74°C и 79°C соответственно.
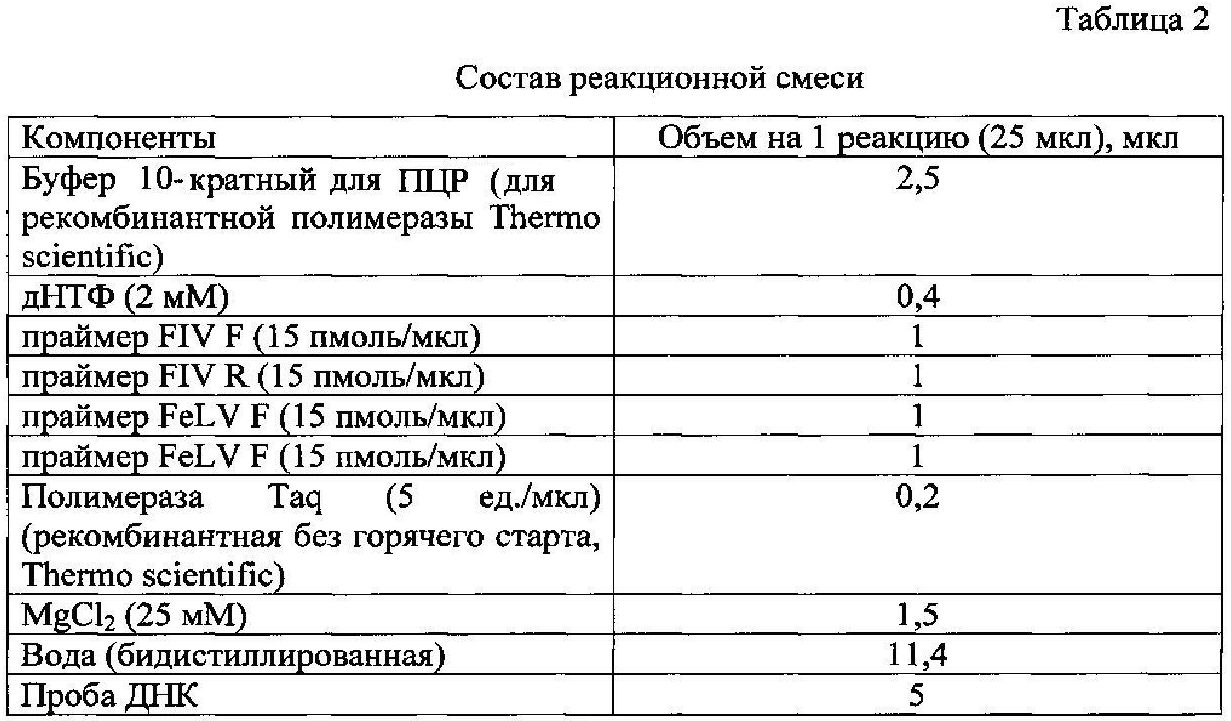
Состав реакционной смеси подбирали таким образом, чтобы концентрация ионов MgCl2 (1,5 мМ) обеспечивала оптимальную скорость и точность работы фермента Taq-полимеразы, концентрация дНТФ - 0,4 мМ, концентрация праймеров - 15 пмоль/мкл и объем пробы - 5 мкл, что способствует повышению специфичности реакции. При использовании амплификатора с крышкой без нагрева на смесь наслаивают 20 мкл минерального масла для ПЦР. При использовании амплификатора с нагревающейся крышкой минеральное масло не используется.
Проверка эффективности работы подобранных праймеров с клиническим материалом. В качестве положительного контроля использовали ДНК, выделенную из крови кошек, у которых наличие FIV и FeLV были подтверждены методом иммунной хроматографии (Animal Genetics, inc., Корея) и Real-time PCR (ООО ИнтерЛабСервис, Россия). Для исследования брали пробы крови от кошек, подозрительных в заражении вирусным иммунодефицитом и лейкемией (фиг. 3). Пробы 1, 2, 3, 4, 5, 9 - содержат ДНК провирусов FIV и FeLV, электрофоретическая подвижность ампликонов которых 397 п.н. и 221 п.н. соответственно и совпадает с размерами ампликонов положительного контроля (К+). Пробы 6, 7, 10 содержат только ДНК провируса FeLV, электрофоретическая подвижность ампликонов которого 221 п.н., проба 8 - отрицательная. В электрофоретической дорожке, соответствующей отрицательному контролю (К-), полосы отсутствуют.
Заявленное изобретение является доступным по стоимости, достоверным, высокочувствительным и высокоспецифичным способом выявления фрагментов провирусной ДНК вирусов иммунодефицита и лейкемии кошек в лимфоцитах крови животных в короткие сроки. При этом компьютерный анализ показал отсутствие реакции на гомологичные и гетерологичные организмы.
Владельцы патента RU 2444011:
Изобретение относится к области медицины, а именно к вирусологии, и может быть использовано для выявления кишечных вирусов из воды. Для этого концентрирование кишечных вирусов осуществляют путем внесения в исследуемый образец воды сорбента на основе магнитных микрочастиц, покрытых полимером диоксида кремния с аминопропильными группами, в соотношении 1:1000-3000 от объема образца воды. Инкубируют при постоянном перемешивании в течение 1-2 часов. Собирают сорбент с использованием магнита, удаляют супернатант и получают комплекс сорбента с кишечными вирусами. При этом элюцию кишечных вирусов осуществляют раствором 0,5М NaCl и 0,05М Трис (рН-10,5). Идентификацию кишечных вирусов проводят иммунохимическими, культуральными или молекулярными методами. Изобретение обеспечивает высокую степень концентрирования вирусов в элюате, уменьшение объема элюирующего раствора. 2 пр.
Изобретение относится к области медицины, эпидемиологического надзора и вирусологии, и может быть использовано для выявления кишечных вирусов в водопроводной воде, в воде открытых водоемов, пресной и морской, в воде из подземных источников, в питьевой бутилированной воде, в воде плавательных бассейнов и в сточной воде.
Известны также способы, предложенные зарубежными авторами. Это концентрирование вирусов на мембранах с лигандами [патент США US 20080014625], на отрицательно заряженных мембранах [Katayama H., Shimasaki A., Ohgaki S. Development of a virus concentration method and its application to detection of enterovirus and Norwalk virus from coastal seawater. Appl. Environ. Microbiol., 2002, 68: 1033-1039].
Наиболее близким к заявленному способу является способ выявления кишечных вирусов, включающий концентрирование вирусов с помощью флизелиновых пакетов с макропористым стеклом [Конторович В.Б., Иванова О.Е., Еремеева Т.П., Ширман Г.А., Казанцева В.А. Метод концентрирования вирусов в водных объектах окружающей среды. Вопр. вирусол., 1996, 1: 40-42]. В указанном способе время концентрирования вирусов из воды поверхностных водоемов и сточной воды составляет 3-7 суток. Для повышения сорбционных свойств макропористого стекла, представляющего собой белый порошок, его обрабатывают следующим образом: один объем стекла заливают в колбе одним объемом смеси (1:1) 3% раствора H2O2 и 6М раствора соляной кислоты и кипятят в вытяжном шкафу в течение 1 ч без пробки, соблюдая меры предосторожности. Отмывают большим количеством дистиллированной воды до нейтрального значения рН и высушивают при 100°С. В пакет из флизелина размером 5×7 см помещают 3,0 см 3 подготовленного сорбента. Пакет с сорбентом закрепляют с помощью лески за неподвижный предмет так, чтобы он оказался в токе воды. После экспозиции в течение 3-7 суток пакет вынимают, помещают в отдельный новый полиэтиленовый мешочек или стерильный флакон и доставляют в лабораторию в сумке-холодильнике в максимально короткий срок (не более 6 ч). Каждую пробу маркируют с указанием точки отбора, датой установки и времени экспозиции пакета. До обработки пробы можно хранить не более суток при 4°С. Пакет с сорбентом извлекают из транспортировочной емкости и помещают в стерильную чашку Петри. Обрезают край пакета, вымывают стекло дистиллированной водой (5 мл) с помощью пипетки в эту же чашку Петри и переносят пипеткой или через воронку в колонку объемом 5-10 мл. Вирусы элюируют ступенчато тремя растворами по 3 мл каждый, собирая фракции в отдельные пенициллиновые флаконы. Исследованию подвергают каждую фракцию в отдельности (всего 3 фракции). В качестве элюирующих растворов используют: 1) 0,05 М трис-HCl рН 9,1; 2) 0,05 М трис-HCl рН 9,1 и 0,5 М NaCl; 3) 3% мясной экстракт на 0,05 М трис-HCl рН 9,1. Для выявления вирусов в элюате выбирают культуральные, иммунохимические или молекулярные методы.
Недостатками вышеописанного способа являются его длительность, большое количество и объем фракций элюата, маленькая площадь контакта сорбента с объемом воды.
Задача настоящего изобретения, на решение которой направлен технический результат, заключается в сокращении продолжительности заявленного способа и в его упрощении. Кроме того, обеспечивается высокая степень концентрирования вирусов, уменьшается объем элюирующего раствора и, как следствие, повышается выход вируса в элюате за счет использования в качестве сорбента магнитных микрочастиц, покрытых полимером диоксида кремния с аминопропильными группами.
Для достижения указанного технического результата в способе выявления кишечных вирусов, включающем концентрирование вирусов из образцов воды на сорбенте, элюцию кишечных вирусов с сорбента с их последующим выявлением иммунохимическими, культуральными или молекулярными методами, отличающегося тем, что концентрирование кишечных вирусов осуществляют путем внесения в исследуемый образец воды сорбента на основе магнитных микрочастиц, покрытых полимером диоксида кремния с аминопропильными группами, в соотношении 1:1000-3000 от объема образца воды, инкубации при постоянном перемешивании в течение 1-2 часов, сбора сорбента с использованием магнита, удаления супернатанта и получения комплекса сорбента с кишечными вирусами, причем элюцию кишечных вирусов осуществляют раствором 0,5M NaCl и 0,05М Трис (рН=10,5).
Признаками, отличающими настоящее изобретение от аналогов, являются:
- время инкубации сорбента MagSi+ с образцом - 1-2 часа;
- сорбент MagSi+ представлен суспензией, что увеличивает вероятность адсорбции вирусов за счет равномерного распределения сорбента по всему объему воды;
- магнитные свойства MagSi+ позволяют собирать сорбент с помощью магнита во флаконах или проточных системах;
- положительный заряд MagSi+ в воде позволяет адсорбировать вирусы не только за счет гидрофобных взаимодействий, но и за счет ионных;
- элюция вирусов с сорбента проводится небольшим объемом элюирующего раствора, что увеличивает концентрацию вирусов в элюате;
- состав и значение рН элюирующего раствора.
Способ выявления кишечных вирусов в воде заключается в их концентрировании из воды на магнитных микрочастицах, покрытых полимером диоксида кремния с аминопропильными группами, снятии вирионов с сорбента с использованием специального буфера для элюции и последующим выявлением кишечных вирусов в элюате с использованием молекулярных, иммунохимических или культуральных методов.
Сорбент MagSi+ получали согласно методике, описанной в патенте США US 20030148101 А1 с некоторыми изменениями. Покрытие магнетита проводилось в два этапа, где первый этап был идентичен описанному в патенте (полимеризация тетраэтоксисилана на поверхности частиц магнетита при значении рН 4,6 и температуре 90°С), а на втором этапе раствор тетраэтоксисилана был заменен 3-аминопропилтриметоксисиланом в той же концентрации. В результате реакции на поверхности магнетита образуются слои полимера диоксида кремния с аминопропильными группами, которые при рН ниже 7,0 имеют положительный заряд. Сорбент представляет собой частицы темно-бурого цвета размером 2-10 мкм, не склонные к образованию агрегатов, что обусловливается одноименным положительным зарядом частиц. Емкость сорбента MagSi+, оцененная по модельному белку БСА (бычий сывороточный альбумин), составляет 15-20 мг белка на 1 см 3 сорбента. В модельных экспериментах по концентрированию вирусов из 1 л водопроводной воды эффективность концентрирования аденовирусов составила 76%, энтеровирусов - 81% и вируса гепатита А - 88%.
Принцип адсорбции вирусов на сорбенте MagSi+ основан на двух типах взаимодействий: (1) гидрофобные взаимодействия капсидных белков вирусов с полисилоксановыми связями полимера диоксида кремния; (2) электростатические взаимодействия аминогрупп сорбента, которые в водных условиях (при рН ниже 7,0) имеют положительный заряд, с вирионами, отрицательно заряженными при значениях рН выше 5,0. Кроме того, одноименный положительный заряд частиц MagSi+ обеспечивает распределение сорбента по всему объему воды, увеличивая тем самым вероятность контакта вирионов с частицами сорбента и ускоряя процесс сорбции. Таким образом, для обеспечения эффективного концентрирования вирусов за счет электростатических взаимодействий необходимо, чтобы значения рН воды находились в диапазоне 5,0-7,0. Данный диапазон рН соответствует средним значениям рН воды.
Способ включает в себя следующие этапы.
1. Внесение сорбента в пробу воды. Суспензия сорбента MagSi+ в объеме 1 мл (1:1 по объему сорбент MagSi+ и 50 мМ раствор NaCl) добавляется к 1 л исследуемой воды.
2. Инкубация при постоянном перемешивании в течение 1-2 часов при комнатной температуре. Перемешивание осуществляется с помощью шейкера или верхнеприводной мешалки, при этом весь сорбент должен находиться во взвешенном состоянии.
3. Сбор сорбента MagSi+ с использованием магнита во флаконах, либо на специальных установках для проточного концентрирования магнитных микрочастиц. Удаление супернатанта, получение комплекса вирус + сорбент.
4. Элюция вирусов осуществляется раствором следующего состава - 0,5М NaCl, 0,05М Трис, рН=10,5, из расчета на 1 мл взвеси сорбента MagSi+ добавляется 1 мл элюирующего раствора.
Осуществляют концентрирование кишечных вирусов из проб сточной воды. К 1 л предварительно осветленной сточной воды добавляют 1 мл суспензии сорбента MagSi+. Инкубируют при постоянном перемешивании на шейкере или с использованием верхнеприводной мешалки в течение 1 ч. После экспозиции собирают сорбент с помощью редкоземельного магнита, переносят суспензию в 15-мл стерильную полипропиленовую пробирку. Удаляют супернатант, удерживая магнитом сорбент с адсорбированными вирусами на внутренней стенке пробирки, и проводят элюцию вирусов 1 мл раствора следующего состава - 0,5М NaCl, 0,05M Трис, рН=10,5. Интенсивно встряхивают пробирку на вортексе в течение 15 минут, при этом весь сорбент должен находиться во взвешенном состоянии. Осаждают сорбент центрифугированием при 3000 об/мин в течение 10 минут или с помощью магнита. Супернатант переносят в две 1,5-2,0-мл полипропиленовые пробирки с завинчивающейся крышкой. Индикацию и идентификацию вирусов или их структурных элементов (вирусных белков или нуклеиновых кислот) проводят с использованием иммунохимических, культуральных или молекулярных методов (различные модификации ПЦР).
Осуществляют концентрирование кишечных вирусов из водопроводной (питьевой) воды. К 10 л водопроводной (питьевой) воды добавляют 3 мл суспензии сорбента MagSi+. Инкубируют при постоянном перемешивании на шейкере или с использованием верхнеприводной мешалки 2 ч. После экспозиции в воду добавляют 100 мл раствора 5М NaCl и инкубируют при перемешивании еще 30 минут. Собирают сорбент с помощью редкоземельного магнита, переносят суспензию в 15-мл стерильную полипропиленовую пробирку. Удерживая сорбент магнитом, удаляют супернатант и проводят элюцию кишечных вирусов в 3 мл раствора следующего состава - 0,5М NaCl, 0,05М Трис, рН=10,5. Интенсивно встряхивают пробирку на вортексе в течение 15 минут, при этом весь сорбент должен находиться во взвешенном состоянии. Осаждают сорбент центрифугированием при 3000 об/мин в течение 10 минут или с помощью магнита. Супернатант по 1,5 мл переносят в две 1,5-2,0-мл полипропиленовые пробирки с завинчивающимися крышками. Индикацию и идентификацию кишечных вирусов или их структурных элементов (вирусных белков или нуклеиновых кислот) проводят с использованием иммунохимических, культуральных или молекулярных методов (различные модифиации ПЦР).
Способ выявления кишечных вирусов, включающий концентрирование вирусов из образцов воды на сорбенте, элюцию кишечных вирусов с сорбента с их последующим выявлением иммунохимическими, культуральными или молекулярными методами, отличающийся тем, что концентрирование кишечных вирусов осуществляют путем внесения в исследуемый образец воды сорбента на основе магнитных микрочастиц, покрытых полимером диоксида кремния с аминопропильными группами, в соотношении 1:1000-3000 от объема образца воды, инкубации при постоянном перемешивании в течение 1-2 ч, сбора сорбента с использованием магнита, удаления супернатанта и получения комплекса сорбента с кишечными вирусами, причем элюцию кишечных вирусов осуществляют раствором 0,5М NaCl и 0,05М Трис (рН 10,5).
Читайте также:


