Инактивированные противовирусные вакцины это








ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В ВИРУСОЛОГИИ
Инактивированные вакцины - готовятся из инактивированных вирулентных штаммов бактерий и вирусов [2]. Это сложные по составу препараты. Производство их требует большого количества вируса [1].
В изготовлении инактивированных противовирусных вакцин с каждым годом проблема сырья (биологической системы, в которой репродуцируется вирус) приобретает все более острый характер. Все возрастающие трудности получения первичной культуры почечных и тестикулярных клеток для репродукции вирусов (инфекционного ринотрахеита, рота-, аденоинфекции, вирусной диареи крупного рогатого скота) побуждает исследователей получить чувствительные к этим вирусам перевиваемые линии клеток. В течение многих лет считалось недопустимым применение перевиваемых клеточных линий в производстве противовирусных вакцин в связи с наличием у таких линий онкогенных потенций. Однако к настоящему времени накоплен определенный материал, свидетельствующий о безопасности биопрепаратов, полученных с использованием линий перевиваемых клеток в биологической практике [1].
Среди первых инактивированных вирусных вакцин были вакцины против бешенства, желтой лихорадки, ящура, классической чумы свиней, чумы плотоядных, ньюкаслской болезни и оспы животных [2].
Для получения вакцин, сывороток и препаратов для животноводства и сельского хозяйства используются как живые ослабленные или видоизмененные возбудители, так и убитые клетки, либо их отдельные части (антигены), которые вводятся во время прививки в здоровый организм, чтобы с профилактической целью научить его вырабатывать антитела. Вакцина - это собственно возбудитель (антиген), а сыворотка - полученные на антиген готовые антитела, вводимые уже заболевшему животному для быстрого ответа на инфекцию [1].
Основное требование, предъявляемое к инактивированным вакцинам - полная и необратимая инактивация генома при максимальной сохранности антигенной детерминанты (цепей полипептидов, вызывающих образование специфических антител и цитотоксических лимфоцитов) и иммунная защита привитых животных. Так как иммунный ответ обусловлен главным образом белками оболочки вириона или белками, экспрессированными на плазматической мембране зараженной клетки, то эти соединения в условиях инактивации генома либо вообще не должны подвергаться изменениям, либо эти изменения должны лишь в незначительной степени влиять на иммунный ответ организма [1].
Для инактивации микроорганизмов применяют нагревание, обработку формалином, ацетоном, фенолом, ультрафиолетовыми лучами, ультразвуком, спиртом. Такие вакцины не опасны, они менее эффективны по сравнению с живыми, но при повторном введении создают достаточно стойкий иммунитет [3].
В настоящее время инактивированные вакцины нашли широкое применение в вирусологической практике. Рассмотрим три типа инактивированных вакцин для профилактики гриппа: цельновирионные, расщепленные и субъединичные [4].
Инактивированная вакцина может быть цельновирионной. Такая вакцина содержит цельные вирусы гриппа, прошедшие предварительную инактивацию и очистку. В этом случае токсичных примесей в ней меньше, чем в живой вакцине, но значительно больше, чем в расщепленной (сплит-вакцине ). Цельновирионная вакцина довольно часто вызывает симптомы интоксикации, характерные для гриппа [4].
Субъединичная вакцина - это вакцина, в которой достигается максимальная очистка антигенов от токсичных примесей. Такая вакцина содержит только поверхностные антигены вируса - гемагглютинин и нейраминидазу, и не содержит внутренних вирусных белков [4].
В настоящее время в практическом здравоохранении применяются вакцины, разработанные много лет назад, но усовершенствованные по мере развития медицинской науки. Усовершенствование вакцин обусловлено необходимостью повышения их безопасности, переносимости и эффективности. В результате появились продукты, обладающие улучшенными характеристиками, производство которых, однако, невозможно без усложнения технологических процессов. В то же время, некоторые разработанные десятилетия назад вакцины, например, вакцину против гриппа, до сих пор получают с помощью технологически устаревших методов. Изменения в подходах к производству таких вакцин стимулируются желанием внедрения более эффективных усовершенствованных технологий [5].
Библиографический список
Открытие метода вакцинации дало старт новой эре борьбы с болезнями.
В состав прививочного материала входят убитые или сильно ослабленные микроорганизмы либо их компоненты (части). Они служат своеобразным муляжом, обучающим иммунную систему давать правильный ответ инфекционным атакам. Вещества, входящие в состав вакцины (прививки), не способны вызвать полноценное заболевание, но могут дать возможность иммунитету запомнить характерные признаки микробов и при встрече с настоящим возбудителем быстро его определить и уничтожить.
Производство вакцин получило массовые масштабы в начале ХХ века, после того как фармацевты научились обезвреживать токсины бактерий. Процесс ослабления потенциальных возбудителей инфекций получил название аттенуации.
Сегодня медицина располагает более, чем 100 видами вакцин от десятков инфекций.
Препараты для иммунизации по основным характеристикам делятся на три основных класса.
- Живые вакцины. Защищают от полиомиелита, кори, краснухи, гриппа, эпидемического паротита, ветряной оспы, туберкулеза, ротавирусной инфекции. Основу препарата составляют ослабленные микроорганизмы — возбудители болезней. Их сил недостаточно для развития значительного недомогания у пациента, но хватает, чтобы выработать адекватный иммунный ответ.
- Инактивированные вакцины. Прививки против гриппа, брюшного тифа, клещевого энцефалита, бешенства, гепатита А, менингококковой инфекции и др. В составе мертвые (убитые) бактерии или их фрагменты.
- Анатоксины (токсоиды). Особым образом обработанные токсины бактерий. На их основе делают прививочный материал от коклюша, столбняка, дифтерии.
В последние годы появился еще один вид вакцин — молекулярные. Материалом для них становятся рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии (рекомбининтная вакцина против вирусного гепатита В).
Схемы изготовления некоторых видов вакцин
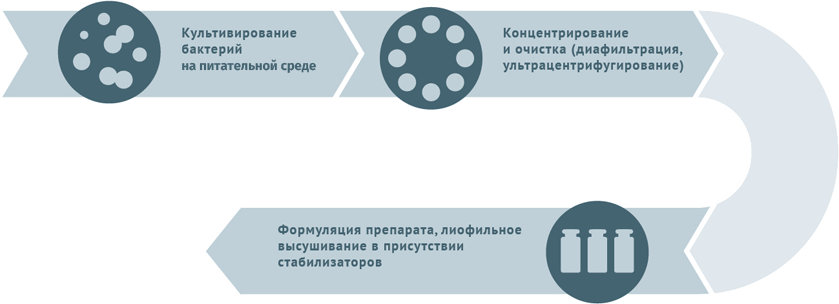
Схема подходит для вакцины БЦЖ, БЦЖ-М.
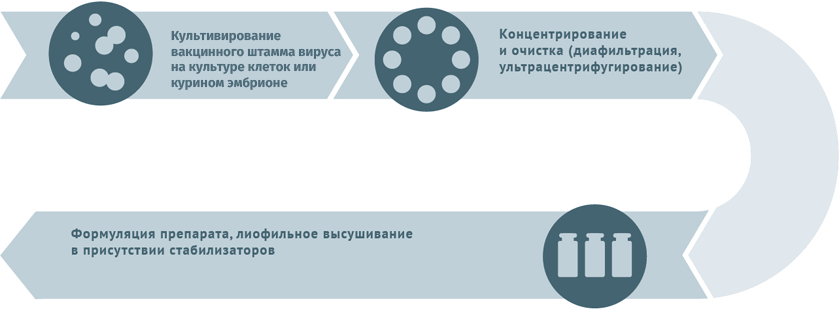
Схема подходит для производства вакцин от гриппа, ротавируса, герпеса I и II степеней, краснухи, ветряной оспы.
Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться:
- куриные эмбрионы;
- перепелиные эмбриональные фибробласты;
- первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков);
- перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293).
Первичный сырьевой материал очищают от клеточного дебриса в центрифугах и с помощью сложных фильтров.
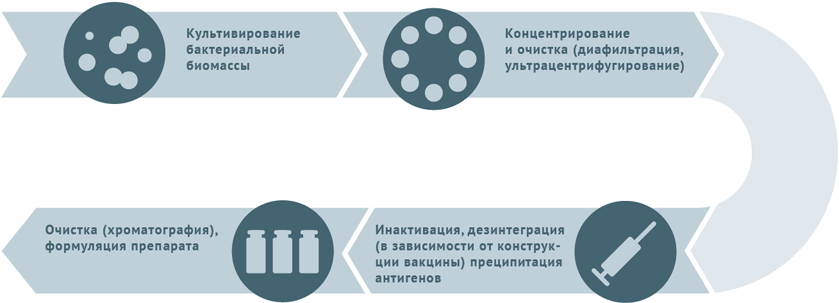
- Культивация и очистка штаммов бактерий.
- Инактивация биомассы.
- Для расщепленных вакцин клетки микробов дезинтегрируют и осаждают антигены с последующим их хроматографическим выделением.
- Для конъюгированных вакцин полученные при предыдущей обработке антигены (как правило, полисахаридные) сближают с белком-носителем (конъюгация).
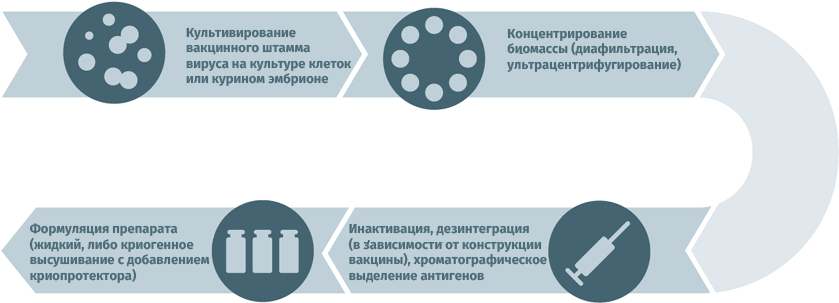
- Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться куриные эмбрионы, перепелиные эмбриональные фибробласты, первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков), перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293). Первичная очистка для удаления клеточного дебриса проводится методами ультрацентрифугирования и диафильтрации.
- Для инактивации используются ультрафиолет, формалин, бета-пропиолактон.
- В случае приготовления расщепленных или субъединичных вакцин полупродукт подвергают действию детергента с целью разрушить вирусные частицы, а затем выделяют специфические антигены тонкой хроматографией.
- Человеческий сывороточный альбумин применяется для стабилизации полученного вещества.
- Криопротекторы (в лиофилизатах): сахароза, поливинилпирролидон, желатин.
Схема подходит для производства прививочного материала против гепатита А, желтой лихорадки, бешенства, гриппа, полиомиелита, клещевого и японского энцефалитов.
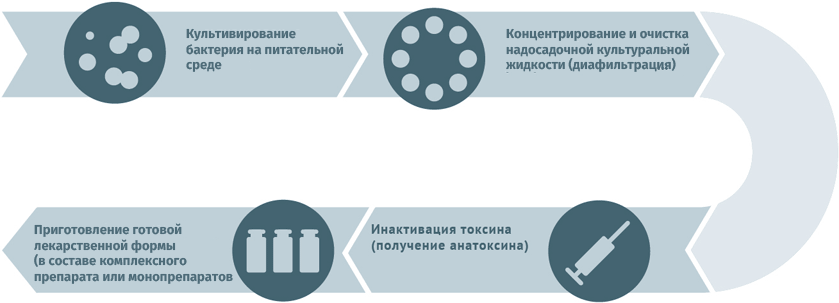
Для дезактивации вредного воздействия токсинов используют методы:
- химический (обработка спиртом, ацетоном или формальдегидом);
- физический (подогрев).
Схема подходит для производства вакцин против столбняка и дифтерии.
По данным Всемирной Организации Здравоохранения (ВОЗ), на долю инфекционных заболеваний приходится 25 % от общего количества смертей на планете ежегодно. То есть инфекции до сих пор остаются в списке главных причин, обрывающих жизнь человека.
Одним из факторов, способствующих распространению инфекционных и вирусных заболеваний, являются миграция потоков населения и туризм. Перемещение человеческих масс по планете влияет на уровень здоровья нации даже в таких высокоразвитых странах, как США, ОАЭ и государства Евросоюза.
Задать вопрос специалисту
Вопрос экспертам вакцинопрофилактики
Вакцина "Менюгейт" зарегистрирована в России? С какого возраста разрешена к применению?
Отвечает Харит Сусанна Михайловна
Да, зарегистрирована, вакцина – от менингококка С, сейчас также есть вакцина конъюгированная, но уже против 4 типов менингококков – А, С, Y, W135 – Менактра. Прививки проводят с 9 мес.жизни.
Муж транспортировал вакцину РотаТек в другой город.Покупая ее в аптеке мужу посоветовали купить охлаждающий контейнер,и перед поездкой его заморозить в морозильной камере,потом привязать вакцину и так ее транспортировать. Время в пути заняло 5 часов. Можно ли вводить такую вакцину ребенку? Мне кажется,что если привязать вакцину к замороженному контейнеру, то вакцина замерзнет!
Отвечает Харит Сусанна Михайловна
Вы абсолютно правы, если в контейнере был лед. Но если там была смесь воды и льда- вакцина не должна замерзать. Однако живые вакцины, к которым относится ротавирусная, не увеличивают реактогенность при температуре менее 0, в отличие от неживых, а, например, для живой полиомиелитной допускается замораживание до -20 град С.
Моему сыну сейчас 7 месяцев.
В 3 месяца у него случился отек Квинке на молочную смесь Малютка.
Прививку от гепатита сделали в роддоме, вторую в два месяца и третью вчера в семь месяцев. Реакция нормальная, даже без температуры.
Но вот на прививку АКДС нам устно дали медотвод.
Я за прививки!! И хочу сделать прививку АКДС. Но хочу сделать ИНФАНРИКС ГЕКСА. Живем в Крыму. В крыму ее нигде нет. Посоветуйте как поступить в такой ситуации. Может есть зарубежный аналог? Бесплатную делать категорически не хочу. Хочу качественную очищеную, что бы как монжно меньше риска.
Отвечает Полибин Роман Владимирович
В Инфанрикс Гекса содержится компонент против гепатита В. Ребенок полностью привит против гепатита. Поэтому в качестве зарубежного аналога АКДС можно сделать вакцину Пентаксим. Кроме того, следует сказать, что отек Квинке на молочную смесь не является противопоказанием к вакцине АКДС.
Подскажите, пожалуйста, на ком и как тестируют вакцины?
Отвечает Полибин Роман Владимирович
Как и все лекарственные препараты вакцины проходят доклинические исследования (в лаборатории, на животных), а затем клинические на добровольцах (на взрослых, а далее на подростках, детях с разрешения и согласия их родителей). Прежде чем разрешить применение в национальном календаре прививок исследования проводят на большом числе добровольцев, например вакцина против ротавирусной инфекции испытывалась почти на 70 000 в разных странах мира.
Отвечает Полибин Роман Владимирович
Состав вакцин изложен в инструкциях к препаратам.
Ребёнку 1 год и 8 месяцев, все прививки ставились в соответствии с календарем прививок. В том числе 3 пентаксима и ревакцинация в полтора года тоже пентаксим. В 20 месяцев надо ставить от полиомиелита. Очень всегда переживаю и отношусь тщательно к выбору нужных прививок, вот и сейчас перерыла весь интернет, но так и не могу решить. Мы ставили всегда инъекцию (в пентаксиме). А теперь говорят капли. Но капли-живая вакцина, я боюсь различных побочек и считаю, что лучше перестраховаться. Но вот читала, что капли от полиомиелита вырабатывают больше антител, в том числе и в желудке, то есть более эффективные, чем инъекция. Я запуталась. Поясните, инъекция менее эффективна (имовакс-полио, например)? Отчего ведутся такие разговоры? У каплей боюсь хоть и минимальный, но риск осложнения в виде болезни.
Отвечает Полибин Роман Владимирович
В настоящее время Национальный календарь прививок России предполагает комбинированную схему вакцинации против полиомиелита, т.е. только 2 первых введения инактивированной вакциной и остальные – оральной полиовакциной. Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита. В связи с вышесказанным вашему ребенку необходимо сделать пятую прививку ОПВ или ИПВ.
Следует также сказать, что на сегодняшний день идет реализация глобального плана Всемирной организации здравоохранения по ликвидации полиомиелита в мире, которая предполагает полный переход всех стран к 2019 году на инактивированную вакцину.
В нашей стране уже очень долгая история использования многих вакцин – ведутся ли долгосрочные исследования их безопасности и можно ли ознакомиться с результатами воздействия вакцин на поколения людей?
Отвечает Шамшева Ольга Васильевна
За прошлый век продолжительность жизни людей возросла на 30 лет, из них 25 дополнительных лет жизни люди получили за счет вакцинации. Больше людей выживают, они живут дольше и качественнее за счет того, что снизилось инвалидность из-за инфекционных заболеваний. Это общий ответ на то, как влияют вакцины на поколения людей.
На сайте Всемирной Организации Здравоохранения (ВОЗ) есть обширный фактический материал о благотворном влиянии вакцинации на здоровье отдельных людей и человечества в целом. Отмечу, что вакцинация –это не система верований, это - область деятельности, опирающаяся на систему научных фактов и данных.
На основании чего мы можем судить о безопасности вакцинации? Во-первых, ведется учет и регистрация побочных действий и нежелательных явлений и выяснение их причинно-следственной связи с применением вакцин (фармаконадзор). Во-вторых, важную роль в отслеживании нежелательных реакций играют постмаркетинговые исследования (возможного отсроченного неблагоприятного действия вакцин на организм), которые проводят компании — владельцы регистрационных свидетельств. И, наконец, проводится оценка эпидемиологической, клинической и социально-экономической эффективности вакцинации в ходе эпидемиологических исследований.
Это наиболее сложные по составу биопрепараты.
Важным условием эффективности вакцин является выбор инактиватора и оптимальных условий инактивации, позволяющих полностью лишить вирус инфекционности при максимальном сохранении антигенности. Однако механизм инактивирующих воздействий недостаточно изучен и их использование зачастую эмпирическое.
Для инактивации вирусов используют физические и химические методы. Из физических методов наиболее распространенными являются γ-лучи, УФ-лучи, воздействие температуры, реже ультразвука, фотодинамическое воздействие некоторых красителей (метиленовая синька, акридиновый оранжевый, толуидин и др.). Наиболее уязвимыми мишенями для γ-лучей являются пуриновые и пиримидиновые основания. Белковая оболочка под воздействием радиации повреждается незначительно. Этот метод дает возможность одновременно надежно инактивировать и стерилизовать готовый препарат.
Эффективность УФ-лучей определяется их проницаемостью и адсорбцией биологическими молекулами. Белки поглощают УФ-лучи в меньшей степени, чем нуклеиновые кислоты и поэтому более устойчивы к их действию. Полагают, что под влиянием УФ-лучей в нуклеиновой кислоте образуются димеры между соседними пирамидиновыми основаниями, а также ковалентные связи между нуклеиновой кислотой и белковой оболочкой.
В практике создания инактивированных вакцин наиболее широкое применение получили химические инактиваторы, такие, как формальдегид (присоединение формальдегида к аминогруппам пуринов и пиримидинов уничтожает матричную и информационную активность нуклеиновых кислот), β-пропиолактон, этиленимины, гидроксиламин (инактивирующее действие определяется его взаимодействием с пиримидиновыми основаниями нуклеиновой кислоты, зависящим от величины pH) и др. Реагенты, которые используют для инактивации вирусов, являются мутагенами, поэтому инактиватор должен либо подвергнуться самораспаду β-пропиолактон, гидроксиламин), либо переведен в неактивную форму (нейтрализован), а продукты нейтрализации — остаться безопасными.
После инактивации осуществляют контроль на авирулентность, направленный на выявление оставшихся жизнеспособных вирионов. Степень безопасности инактивированных вакцин неразрывно связана с чувствительностью тест-системы, по которой оценивается полнота инактивации вируса. Для этой цели используют чувствительные культуры клеток животных, в том числе эмбрионов птиц. При этом репродукции вируса быть не должно.
Индивидуальный подход определяется свойствами вируса, особенностями болезни, чувствительностью биологических систем. Так, авирулентность вакцин против ящура определяют на крупном рогатом скоте (это более надежно), на свиньях, лабораторных животных и культуре клеток; вакцину против бешенства — на белых мышах; вакцину против болезни Ауески — на кроликах или в культуре клеток, которую использовали для накопления вируса; вакцину против болезни Ньюкасла — на куриных эмбрионах (не менее трех слепых пассажей). Если производственный штамм вируса, который используют для получения вакцины, культивируется в культуре клеток и вызывает характерные цитопатические изменения, то общепризнанным методом является испытание инактивированных препаратов в чувствительных культурах клеток (не менее трех слепых пассажей). Однако при оценке безопасности некоторых вакцин используют сложные комплексные подходы.
Для повышения иммуногенной активности вакцины в ее состав вводят адъюванты — вещества разнообразной химической природы, неспецифически стимулирующие иммунный ответ к различным антигенам. В качестве адъювантов используют: гидроксид алюминия, аэросил, минеральные масла, ДЭАЭ-декстран, сапонин; кроме того, используют синтезированные вещества — мурамилдипептид, полианионы, поликатионы и др. Механизмы действия адьювантов разнообразны и до конца не изучены. Одни из них вызывают воспалительную реакцию, другие способствуют депонированию антигенов и замедляют их гидролиз, третьи способствуют усилению поглощения антигенов макрофагами и антиген-представляющими клетками.
К адъювантам предъявляют следующие требования: они должны быть нетоксичными в используемых дозах, не вызывать побочных реакций в организме, сами не обладать антигенной активностью, должны стимулировать развитие длительного гуморального и клеточного иммунитета.
После добавления адъюванта вакцину контролируют на отсутствие посторонних контаминантов (бактерий, грибов) путем посева на питательные среды (МПА, МПБ, МППБ, Сабуро или Чапека). Роста микроорганизмов не должно быть. Затем вакцину фасуют во флаконы и этикетируют. Окончательный контроль вакцины на основные показатели: авирулентность, стерильность, безвредность, допустимую степень реактогенности (на восприимчивых животных), антигенную и иммуногенную активность (на лабораторных и восприимчивых животных) осуществляют государственные контролеры в соответствии с техническими условиями на данный препарат.
Инактивированные вакцины отличаются большей стабильностью свойств, они безопаснее. Их применяют для животных любого возраста и в репродуктивных стадах. Такие вакцины используют преимущественно с профилактической целью в благополучных хозяйствах и угрожаемых зонах. Однако эти вакцины имеют некоторые недостатки:
- технология их изготовления гораздо сложнее, что связано с необходимостью получения большого количества вируссодержащего материала, очистки, концентрации антигена, инактивации вирусного генома и включения в состав вакцины адъювантов;
- необходимо проводить прививки многократно и в значительных дозах;
- они индуцируют менее напряженный и длительный иммунитет, чем при использовании живых вакцин;
- применять их возможно только парентерально;
- они слабее стимулируют Т-систему иммунитета и местный иммунный ответ, поэтому резистентность слизистых оболочек верхних дыхательных путей и пищеварительного тракта бывает менее выражена, чем после применения живых вакцин;
- способны иногда вызывать аллергическое состояние после повторной вакцинации.
Технология производства инактивированных вакцин сложнее, чем живых вакцин, и состоит из следующих этапов:
- выбор производственного штамма;
- культивирование вируса в биологической системе;
- определение концентрации вируса (антигена);
- инактивация, очистка и концентрация вирусного материала;
- добавление адъюванта;
- внутрицеховой контроль;
- расфасовка, этикетирование;
- заключительный контроль на стерильность, авирулентность, безвредность, реактогенность, антигенную и иммуногенную активность.
Помимо традиционных цельновирионных вакцин (живых, инактивированных) разработаны методы создания вакцин новых поколений: субъединичных, синтетических, получаемых методами генной инженерии. Совершенствование вакцин шло в направлении снижения количества балластных компонентов, снижения реактогенности и повышения иммуногенности препарата.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Мищенко А.В., Думова В.В., Мищенко В.А., Кононов А.В. ФГБУ"ВНИИЗЖ"
Черных О.Ю. Кропоткинская краевая ветеринарная лаборатория
Для профилактики экономически значимых вирусных болезней органов пищеварения, дыхания и воспроизводства крупного рогатого скота на территории Российской Федерации используются живые и инактивированные вакцины, изготовленные отечественными (ФГБУ "ВНИИЗЖ". НПО "НАРВАК", Ставропольская биофабрика. ГНУ ВИЭВ) и зарубежными (Пфайзер, Интервет) производителями. Из инактивированных вакцин применяют сорбированные и эмульсионные препараты.
В каждой форме вакцины имеются свои преимущества и недостатки. Работами многих исследователей показано, что после применения живых вирус-вакцин возникает поствакцинальный инфекционный процесс [3. 10]. В связи с этим в медицинской практике приняты следующие противопоказания к применению живых противовирусных вакцин:
1) иммунодефицитное состояние:
3) злокачественные новообразования:
4) острые вирусные респираторные инфекции;
5) острые вирусные инфекции органов пищеварения;
6) беременность [3].
Эмульсионные препараты обладают повышенной реактоген-ностью. Местные реакции на введение противоящурных эмульсионных вакцин частично могут быть следствием бактериального загрязнения и действия эндотоксинов [2].
Согласно существующих инструкций по применению инактивированных препаратов, вакцины различаются по способу введения - подкожно, внутримышечно. Известно, что уровень поствакцинальных антител зависит от многих факторов: качество вакцины, схема иммунизации, физиологическое и иммунобиологическое состояние животных, условия содержания и кормления, наличие в кормах и воде иммунодепрессивных факторов [4. 5. 6].
Разнообразие существующих препаратов, различающихся по способу применения, является существенным затруднением для ветеринарных специалистов. При вакцинации животных, особенно если она производится на пастбищах, всегда существует объективно определенная вероятность отклонения от рекомендуемого инструкцией способа иммунизации. Во многом это связано с отсутствием необходимых условий для обработки животных.
В данной статье приведены результаты сравнительного изучения влияния способа введения инактивированных противовирусных вакцин на иммунный ответ крупного рогатого скота.
Материалы и методы. Для проведения исследований в качестве моделей были использованы:
- вакцина против коронавирусной инфекции крупного рогатого скота сорбированная инактивированная (ФГБУ "ВНИИЗЖ", патент РФ N°2301079):
- вакцина против коронавирусной инфекции крупного рогатого скота эмульсионная инактивированная (ФГБУ "ВНИИЗЖ", патент РФ N°2342157);
- ассоциированная вакцина против инфекционного ри-нотрахеита и коронавирусной инфекции крупного рогатого скота (ФГБУ "ВНИИЗЖ". патент N°2378017).
Глубокостельных коров вакцинировали за 45-55 дней до отела, ревакцинацию проводили через 20-25 дней. Молодняк крупного рогатого скота вакцинировали в возрасте 20-30 дней, ревакцинирова-ли через 30 дней. Вакцину вводили внутримышечно или подкожно в области средней трети шеи. За привитыми животными проводили наблюдение в течение 10 дней после каждой инъекции.
Антитела к коронавирусу определяли в реакции торможения гемагглютинации (РТГА). а к вирусу инфекционного ринотрахеита - в реакции непрямой агглютинации (РИГА) соответствующими коммерческими диагностическими наборами. Титры вирусоспецифических антител в сыворотке крови животных выражали в виде средних по группе логарифмированных значений, обратных степени разведения. Полученные результаты обрабатывали статистически общепринятым методом.
Результаты исследований. Указанные вакцины были взяты как модели, так как в ФГБУ "ВНИИЗЖ" унифицированы технологии изготовления и контроля инактивированных сорбированных и эмульсионных препаратов.
В первой серии опытов вубойных цехах мясокомбинатов была изучена местная реакция на подкожное введение сорбированной инактивированной противоящурной вакцины 20 головам крупного рогатого скота герефордской породы и 20 животным симментальской породы. Через 3 месяца поствакцинальные гранулемы были обнаружены в подкожной клетчатке у 60% голов, а у остальных - в мышечной ткани. При проведении ветеринарно-санитарной экспертизы туш молодняка крупного рогатого скота голштинской породы, вынуждено убитого через 1 месяц после внутримышечной инокуляции инактивированной эмульсионной вакцины против инфекционного ринотрахеита и коронавирусной инфекции, была выявлена поствакцинальная гранулема в мышечной ткани у 70% животных, а у остальных - подкожно. Вероятно, это связано с отсутствием необходимой фиксации животных.
При клиническом осмотре всех вакцинированных животных не было обнаружено каких-либо клинических признаков реактоген-ности.
Были исследованы сыворотки крови вакцинированных глубокостельных коров и полученных от них новорожденных телят, которым своевременно было выпоено молозиво от иммунизированных матерей (табл. 1).
Таблица 1. Сравнительная оценка влияния способа введения глубокостельным коровам инактивированной вакцины против коронавирусной инфекции на уровень иммунного ответа
Титр антител к коронавирусу. log
эмульсионная форма вакцины
сорбированная форма вакцины
коровы до вакцинации
коровы за 10-15 дней до отела
телята.
2-4-дневные от указанных коров
Анализ результатов лабораторных исследований не выявил существенной разницы в титрах антител к коронавирусу в сыворотке крови глубокостельных коров, вакцинированных внутримышечно или подкожно, и полученных от них новорожденных телят. Не было выявлено разницы в состоянии здоровья новорожденных телят полученных от коров всех четырех групп.
Результаты исследований сыворотки крови молодняка, привитого ассоциированной вакциной против инфекционного ринотрахеита и коронавирусной инфекции, свидетельствуют об отсутствии существенной разницы в уровне вирусоспецифических антител (табл. 2). Способ введения противовирусной вакцины не повлиял ни на уровень, ни на продолжительность поствакцинального гуморального иммунитета.
Таблица 2. Влияние способа введения молодняку крупного рогатого скота ассоциированной вакцины против инфекционного ринотрахеита и коронавирусной инфекции эмульсионной инактивированной на уровень иммунного ответа
Титр антител к вирусу, log
ИРТ крупного рогатого скота
Коронавирус крупного рогатого скота
животные до вакцинации
животные через 30 дней после ревакцинации
животные через 60 дней после ревакцинации
Полученные результаты согласуются с данными других исследователей при использовании вакцины против гриппа птиц и инфекционной бурсальной болезни [1. 7. 8. 9].
Заключение. При иммунизации беспривязно содержащегося крупного рогатого скота вакцина попадает в мышечную и подкожную соединительную ткань. Способ введения противовирусных инактивированных вакцин (подкожно или внутримышечно) не оказывает существенного влияния на уровень гуморального ответа крупного рогатого скота.
- Алиева. А.К. Иммунобиологические свойства инактивированной вакцины против инфекционной бурсальной болезни / А.К. Алиева. А.С. Алиев // Ветеринария и кормление - 2011. - N°4. - С. 20-21.
- Дудников, А.И. Иммунитет и средства специфической профилактики / кн. Ящур, под ред. Бурдова А.Н. - 1990. - С. 216-275.
- Медуницин. Н.В. Вакцинология. М.: 2004.
- Мищенко. А.В. Полевая эффективность противовирусных вакцин для коров, инфицированных вирусом лейкоза / А.В. Мищенко. В.В. Думова, В.А. Мищенко, О.Ю. Черных // Ветеринарная медицина. Харьков. - 2011. - N° 95. -С. 214-215.
- Мищенко, А.В. Экологические особенности иммунодефицитов у крупного рогатого скота /А.В. Мищенко. В.А. Мищенко// Ветеринарная медицина. Харьков. - 2010. - N° 93. - С. 293-298.
- Особенности иммунодефицитов у KPC/ В.А. Мищенко. Н.А. Яременко. А.В. Мищенко [и др] // Ветеринария. - 2007. - N° 11. - С. 17-20.
- Effect of vaccine use in the evolution of Mexican lineage H5N2 avian influence virus / C.W. Lee. D.A. Senne. D.L Suarez D.L [et al] // J.Virology. - 2004. - N°32. - P. 311-323.
- Influenza vaccination strategies in birds / van den Berg Т.. B. Lambrecht, S Marche [et al] // Com. Immunology. Microbiology and infectious Diseases. -2008. - N° 31. - P. 121-165.
- Kangzhen. Yu. Avian influenza virus / Yu. Kangzhen // 15th World veterinary Poultry Congress. Abstract book. - China. - 2007. - P. 105-107.
- Singh M.. 0' Hagan D . Advances in vaccine adjuvantes / M. Singh. D. 0' Hagan // Nature Biotechnology. - 1999. - N° 17. - P. 1075-1081.
В серии производственных опытов установлено, что у молодняка крупного рогатого скота мясной (герефордской) породы и молочных (голштино-фризской и симментальской) пород не было выявлено существенной разницы в местной тканевой реакции на подкожное и внутримышечное введение противовирусных вакцин в рекомендуемых дозах. Не выявлено существенной разницы в титрах антител к коронавирусу в сыворотке крови глубокостельных коров, вакцинированных внутримышечно или подкожно, и полученных от них новорожденных телят. Эмульсионные вакцины индуцировали образование противовирусных антител в более высоких титрах по сравнению с сорбированными препаратами. Результаты исследований сыворотки крови молодняка, привитого ассоциированной вакциной против инфекционного ринотрахеита и коронавирусной инфекции крупного рогатого скота, свидетельствуют об отсутствии существенной разницы в уровне вирусоспецифических антител при внутримышечном и подкожном введении препаратов.
Ключевые слова: крупный рогатый скот, инактивированные вакцины, сорбированные вакцины, эмульсионные вакцины, антитела, коронавирус. вирус ИРТ. РИГА, глубокостельные коровы, молодняк.
Сведения об авторах
Черных Олег Юрьевич, директор Кропоткинской краевой ветеринарной лаборатории, доктор ветеринарных наук: 352380. Краснодарский край. г. Кропоткин, ул. Красноармейская, д. 303: тел: 8 (86138) 6-23-14: e-mail: gukkvl50@kubanvet.ru.
Ответственный за переписку с редакцией: Ду-мова Виктория Валентиновна, кандидат биологических наук, старший научный сотрудник лаборатории профилактики болезней свиней и рогатого скота ФГБУ "ВНИИЗЖ"; 600901, Россия, г. Владимир, мкр. Юрьевец; тел: (4922) 26-17-65 20-85; e-mail: dumova@arriah.ru.
IMPACT OF INACTIVATED VIRUS VACCINE ADMINISTRATION ON CATTLE IMMUNE RESPONSE
Mishchenko A.V., Dumova V.V., Mishchenko V.A, Kononov A.V., Chernykh O.Yu.
Sorbated and emulsion vaccines, that were different in methods of administration (subcutaneous and intramuscular), were used for prevention of cattle diseases. No reactogenicity was observed during clinical examination of vaccinated down-calving cows and youngsters. The analysis of results of laboratory investigations revealed no difference in titres of coronavirus antibodies in blood sera from intramuscularly or subcutaneously vaccinated down-calving cows and their newborn calves, that were promptly fed by colostrum.
The level of virus specific antibodies to infectious rhinotracheitis virus and coronavirus in blood sera from immunized youngsters as well as the duration of postvaccinal humoral immunity did not depend on a method of vaccine administration. Subcutaneous or intramuscular administration of antiviral inactivated vaccines exerts no significant influence on a level of postvaccinal antibodies.
Key words: large horned cattle, inactivated vaccine, sorbated vaccine, emulsion vaccine, antibodies, coronavirus. infectious rhinotracheitis virus, indirect hemagglutination test, down-calving cows, youngsters.
- Alieva A.K.. Aliev A.S. Immunobiologicheskie svoystva inaktivirovannoy vaktsiny protiv infektsionnoy bursalnoy bolezni [Immunobiological properties of the inactivated vaccine against infectious bursal disease]. - Veterinariya i kormlenie, 2011. - # 4. - pp. 20-21.
- Dudnikov A.I. Immunitet i sredstva spetsificheskoy profilaktiki [Immunity and means of specific prophylaxis]. - 1990: pp. 216-275.
- Medunitsin N.V. Vaktsinologiya [Vaccinology]. - Moscow. 2004.
- Mishchenko A.V.. Dumova V.V.. Mishchenko V.A. Chernykh O.Yu. Polevaya effektivnost protivovirusnykh vaktsin dlya korov. infitsirovannykh virusom leykoza [Field efficacy of antiviral vaccines for cows infected with the virus of leucosis].- Veterinarnaya meditsina. - Kharkov. 2011. - # 95. - pp. 214-215.
- Mishchenko V.A. Mishchenko A.V. Ekologicheskie osobennosti immunodefitsitov u krupnogo rogatogo skota [Ecological features of immunodeficiency in cattle]. - Veterinarnaya meditsina. - Kharkov. 2010. - # 93.- pp. 293-298.
- Mishchenko V.A. Yaremenko N.A.. Mishchenko A.V. Osobennosti immunodefitsitov u krupnogo rogatogo skota [Peculiarities of immunodeficiency in cattle]. - Veterinariya. 2007. - # 11. - pp. 17-20.
- -10. Vide supra.
Responsible for correspondence with the editorial board:
Читайте также:


