Имунорикс и противовирусное одновременно
Большинство детей раннего возраста периодически переносят заболевания органов дыхания, в развитии и течении которых решающее значение имеет состояние иммунной системы организма. Известно, что некоторые дети подвержены рецидиву острых респираторных заболеваний, склонны к затяжному их течению, развитию осложнений и рецидивированию. Эта категория детского населения заслуживает особого внимания, так как частые респираторные инфекции могут обусловить срыв основных компенсаторно-адаптационных механизмов, привести к значительным нарушениям функционального состояния организма (особенно органов дыхания, пищеварительной и вегетативной нервной систем), способствовать снижению иммунорезистентности организма и раннему развитию хронической патологии. Наиболее достоверными признаками иммунодефицита принято считать высокую подверженность инфекциям и снижение показателей иммунного статуса, в первую очередь количества Т- и В-лимфоцитов, дисбаланс субпопуляций Т-хелперов и Т-супрессоров и снижение фагоцитарной активности моноцитарно-макрофагальной системы, наличие которых указывает на необходимость проведения иммунокоррекции (Бережной В.В., 2004).
Мировой опыт свидетельствует, что респираторные инфекции вызываются широким спектром возбудителей. Наиболее важным фактором в развитии рецидивирующего бронхита у детей являются острая респираторная вирусная инфекция или массированная вирусно-бактериальная инфицированность и персистенция оппортунистической микрофлоры. Рецидивированию бронхита способствуют низкая фагоцитарная активность макрофагов и нейтрофилов, сниженная протеолитическая система трахеобронхиального секрета, низкая неспецифическая ферментная защита бронхов, иммунодефицитное состояние (Антипкин Ю.Г., 2003).
Заболевания органов дыхания являются одной из наиболее важных проблем в педиатрии, поскольку до настоящего времени, несмотря на достигнутые успехи, они занимают одно из первых мест в структуре детской заболеваемости. Высокий уровень распространенности острых респираторных инфекций среди детей — важная социальная проблема, решение которой является одной из основных задач здравоохранения в педиатрии.
Дети, часто болеющие острыми респираторными инфекционными заболеваниями, составляют группы риска развития острого бронхита, бронхиолита, формирования рецидивирующего бронхита, включая обструктивные формы, и хронической бронхолегочной патологии. Одной из самых распространенных нозологий, особенно среди детей в возрасте 1–3 лет, является бронхит. По данным ряда российских авторов, заболеваемость бронхитами составляет 15–50% (Середа Е.В., 2002). Особенно актуальна эта проблема для детей с частыми острыми респираторными заболеваниями, особенно проживающих в экологически неблагоприятных регионах; при этом нередко развивается обструктивный синдром. Чувствительность рецепторов бронхов повышается при вирусной инфекции, сопровождающейся повреждением эпителия слизистой оболочки дыхательных путей. Повышенная чувствительность бронхиального дерева к вирусной инфекции может быть связана с аллергической предрасположенностью и гиперреактивностью бронхов.
Повторные острые респираторные заболевания могут способствовать сенсибилизации организма и создавать предпосылки для развития генерализованных реакций повышенной чувствительности с последующим формированием рецидивирующего обструктивного бронхита, бронхиальной астмы и других бронхолегочных заболеваний.
Известно, что воспаление — пусковой механизм всех изменений, характерных для хронического бронхита, приводящих к гиперсекреции, нарушению мукоцилиарного клиренса, нарушению дренажной функции, развитию бронхиальной обструкции, снижению местных защитных механизмов, и создает благоприятные условия для бактериальной инфекции. При этом возникает порочный круг взаимосвязанных и взаимообуславливающих факторов воспаления.
Принципиально важным представляется вопрос: рецидивирующая бронхолегочная патология — болезнь легких или иммунной системы? Если принять во внимание топический принцип классификации болезней, то следует признать, что патологический процесс действительно протекает в дыхательной системе. Однако, согласно более корректному этиологическому и патогенетическому подходам, причинами развития и перехода воспалительного процесса в легких в хроническую форму являются различные иммунные нарушения, вызывающие снижение резистентности организма к микробной агрессии. Таким образом, когда клиницист сталкивается с рецидивирующим бронхитом, он имеет дело не с первичной болезнью дыхательной системы, а с заболеванием иммунитета, неспособного осуществить надлежащую защиту бронхиального дерева. Исключение составляют редкие случаи аномалий развития органов дыхания (Казмирчук В.Е., 2008).
На сегодня рецидивирующие респираторные заболевания занимают центральное место среди клинических масок иммунодефицитных болезней, поэтому проблема диагностики, лечения и реабилитации таких больных до сих пор остается чрезвычайно актуальной.
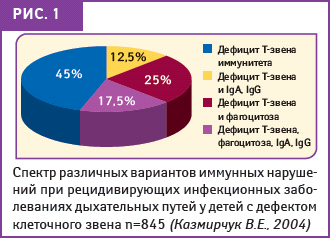
В большинстве случаев истинной причиной рецидивирующей бронхолегочной патологии у детей являются иммунные нарушения (рис. 1), приводящие к снижению сопротивляемости организма инфекционным агентам, а наиболее значимыми факторами риска — наследственная предрасположенность к бронхолегочным заболеваниям, антенатальная патология или же их сочетание.
Клинико-гематологическими критериями иммунных нарушений у детей с рецидивирующей бронхолегочной патологией являются:
- высокая частота рецидивов;
- затяжное течение;
- слабая, но чрезмерно длительная температурная реакция;
- низкая эффективность традиционного лечения;
- наличие очагов хронической инфекции в организме;
- стойкая лейкопения, нейтропения, лимфопения или немотивированный лимфоцитоз;
- низкая СОЭ в острый период заболевания, особенно при бактериальных инфекциях.
Детям с рецидивирующей бронхолегочной патологией зачастую необходимы консультация клинического иммунолога и применение иммунотропных препаратов. При этом своевременная коррекция иммунных нарушений не только позволяет добиться перелома в течении болезни, но и провести первичную профилактику хронических обструктивных болезней легких (ХОБЛ) (Казмирчук В.Е., 2008).
Основные цели при лечении рецидивирующих респираторных инфекций у детей таковы:
- устранение факторов риска;
- уменьшение количества острых эпизодов;
- снижение остроты и длительности острых эпизодов;
- сокращение приема антибиотиков, жаропонижающих/других симптоматических лекарственных средств;
- уменьшение количества пропусков школы и детского сада.
В последние годы на отечественном рынке появилось большое количество лекарственных средств, позиционируемых как иммуномодуляторы, в том числе и для применения у детей. Однако многие из них (теоретически многообещающих), так и не сумели занять достойного места в схемах лечения часто болеющих детей (Намазова Л.С., 2008).
Новый иммуномодулирующий препарат ИМУНОРИКС (пидотимод), появившийся на рынке Украины, является эффективной и надежной иммунотерапевтической защитой при рецидивирующих респираторных инфекциях у часто болеющих детей за счет предотвращения рецидивов заболеваний. Польза от более быстрого устранения острой инфекции и/или уменьшения выраженности ее симптомов заключается в уменьшении объема этиологического или симптоматического лечения, дней, проведенных в стационаре, и числа рабочих дней, пропущенных родителями. Исследования по препарату, проведенные в Европе, соответствуют уровню доказательности А.
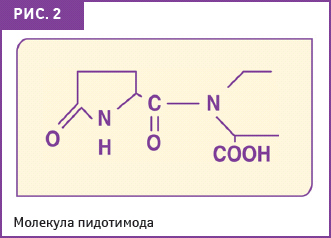
ИМУНОРИКС (пидотимод) — это синтезированный иммуномодулирующий препарат пептидной структуры (молекулярная формула C9H12N2O4S) с высокой биодоступностью для приема внутрь (рис. 2).
Процесс производства препарата ИМУНОРИКС гарантирует высокую степень очистки продукта, что обеспечивает эффективность и хорошую переносимость препарата. Таким образом, синтетическая формула пидотимода обеспечивает неизменное качество препарата и предполагаемый результат при его применении.
После перорального применения ИМУНОРИКС быстро всасывается — пик содержания вещества в плазме крови достигается через 1,5 ч после приема, биодоступность составляет 43–45% независимо от дозы, период полураспада 4 ч, выведение с мочой 95%. После повторного введения препарата не выявляют эффекта кумуляции или самоиндукции.
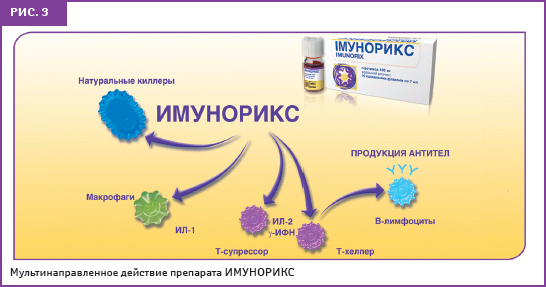
ИМУНОРИКС оказывает иммунокорригирующее действие посредством повышения активности фагоцитов как мононуклеарных, так и полиморфноядерных, повышая хемотаксическую и фагоцитарную активность и производство секреторного IgA. Миграционная способность макрофагов является важнейшим необходимым условием для эффективного фагоцитоза и элиминации возбудителя. Кроме того, препарат активирует другие неспецифические факторы иммунного ответа — естественные клетки-киллеры, которые обеспечивают одну из первых линий защиты организма от патогенных вирусов и бактерий, а также неопластических клеток. ИМУНОРИКС повышает функциональный ответ Т-лимфоцитов, которые при определенных состояниях действуют как координаторы специфического иммунитета. Препарат также стимулирует образование Т- и В-лимфоцитов, улучшая соотношение Т-хелперов и Т-супрессоров, увеличивает продукцию цитокинов (в частности — интерлейкина (ИЛ)-2), активизирует выработку гамма-интерферона — естественного противовирусного агента организма (Намазова Л.С., 2008). Эти характеристики позволяют считать препарат ИМУНОРИКС иммуномодулятором, воздействующим одновременно на несколько звеньев иммунного ответа, с возможностью его применения как в острой фазе заболевания, так и в качестве профилактики частых респираторных инфекций (рис. 3, 4).

В условиях эксперимента было доказано влияние препарата ИМУНОРИКС на параметры иммунитета. В доклинических экспериментальных исследованиях была установлена способность препарата оказывать регулирующее действие на иммунный ответ (Maillard F., 1994). Показано, что пидотимод сохраняет способность перитонеальных макрофагов синтезировать NO и фактор некроза опухоли ? при его введении с метилпреднизолоном, в то время как введение мышам только метилпреднизолона приводило к снижению способности этих клеток к синтезу NO и фактора некроза опухоли ? (Taramelli D. et al., 1994). Доказана способность ИМУНОРИКСА к стимуляции функциональной активности нейтрофилов ex vivo и in vivo: согласно результатам исследования, введение пидотимода в дозе 200 мг/кг массы тела в течение 5 дней значительно повышало активность NK-лимфоцитов (естественных киллеров) мышей (Migliorati G. et al., 1992).
Под влиянием препарата отмечено увеличение продукции ИЛ-2. Было выявлено, что превентивное назначение 2 летним мышам пидотимода за 10 дней до их инфицирования E. coli приводило к усилению спленоцитами синтеза ИЛ-2, но не фактора некроза опухоли ; вместе с тем в спленоцитах мышей, не получавших пидотимод, после введения E. coli отмечали увеличение продукции как ИЛ-2, так и фактора некроза опухоли ? (Chiarenza A. et al., 1994; Annoni G. et al., 1994). Установлено, что введение пидотимода мышам нормализует повышенную продукцию адренокортикотропного гормона, стимулированную введением ИЛ-1, что свидетельствует о регуляторном влиянии этого препарата на взаимодействие иммунной и эндокринной систем (Chiarenza A. et al., 1994). Выявлено протекторное действие ИМУНОРИКСА при бактериальной инфекции у мышей. На различных экспериментальных моделях продемонстрировано, что предварительное интраперитонеальное введение препарата в дозе 0,01–100 мкг/мл в течение 5 дней способствовало повышению выживаемости лабораторных животных после инфицирования. Кроме того, было выявлено, что пидотимод повышает эффективность -лактамных антибиотиков (Coppi G. et al., 1991). Профилактическое назначение пидотимода в дозе 25 мг/кг массы тела снижает смертность у мышей, инфицированных Str. рneumoniae (Di Marco R. et al., 1992). В эксперименте на мышах было установлено, что профилактическое введение препарата в течение 15 дней до инфицирования их вирусом простого герпеса и вирусом гриппа приводит к увеличению периода выживаемости животных (Dianzani C. et al., 1994).
В клинических исследованиях изучали клинико-иммунологическую эффективность пидотимода у больных хроническим бронхитом (ХБ) и ХОБЛ. В двойном слепом плацебо-контролируемом исследовании с участием 137 пациентов с ХБ установлено, что назначение пидотимода в течение 7 дней сочетанно с антибиотиком, а затем 8 дней в виде монотерапии в дозе 800 мг дважды в сутки достоверно способствовало сокращению длительности обострения ХБ (Pozzi E. et al., 1994). В двойном слепом плацебо-контролируемом исследовании препарат назначали в виде монотерапии для профилактики обострений ХБ. Пидотимод или плацебо назначали 181 больному с ХБ в дозе 800 мг в сутки в течение 60 дней и затем наблюдали за пациентами также в течение 60 дней. Было выявлено, что за время лечения и последующего наблюдения прогрессивно снижалась частота обострений ХБ с высокой степенью достоверности (p ® (пидотимод)//Arzneim. Forsch./Drug Res. — 1994. — 44 (II), 12a.
Ди Филиппо С., Варакалли С., Зардо Ф. Имунорикс ® (пидотимод) при лечении рецидивирующих тонзиллофарингитов//Aсtamed Drug Review — 1995.
Казмирчук В.Е. Рецидивирующая бронхолегочная патология у детей: ошибки в диагностике и лечении с позиции клинического иммунолога//Клиническая иммунология. Аллергология. Инфектология. Спецвыпуск. — 2008. — № 5/2.
Середа Е.В. Бронхиты у детей: современные принципы терапевтической тактики//Фарматека. — 2002. — № 11 (62).
Намазова Л.С. Новые возможности иммуномодулирующей терапии часто болеющих детей//Практика педиатра. — 2008. — №1. — с. 78–82.
Annoni G., Arosio B., Santambrogio D. et al. Gene Expression for Interleukin-2 and Tumor Necrosis Factor-a in the Spleen of Old Rats under Physiological Condition and during Septic Shock//Arzneimittelfoschung. — 1994. — 44 (12A): 1433–1436.
Aivazis V., Halzimichail A., Papachristou A. et al. Clinical evaluation and changes of the respiratory epithelium function after administration of Pidotimod in Greek children with recurrent respiratory tract infections//Minerva Pediatr. — 2002. — 54 (4): 315–319.
Benetti G.P., Ieleni M.T., Passera A. et al. Ex vivo evaluation of Pidotimod activity in patients with chronic obstructive pulmonary disease//Arzneimittelfoschung. — 1994. — 44 (12A): 1503–1505.
Bisetti A., Ciappi G., Bariggi F. et al. Evaluation of the Efficacy of Pidotimod in the Exacerbations in Patients Affected with Chronic Bronchitis//Arzneimittelfoschung. — 1994. — 44 (12A): 1499–1502.
Caramia G., Clemente E., Solli R. et al. Efficacy and Safety of Pidotimod in the Treatment of Recurrent Respiratory Infections in Children//Arzneimittelfoschung. — 1994. — 44 (12A): 1480–1484.
Carredu P. Role of Immunoactivation with Pidotimod in Recurrent Respiratory Infections in Childhood//Arzneimittelfoschung. — 1994. — 44 (12A): 1506–1511.
Carredu P., Mei V., Venturoli V. et al. Pidotimod in the Treatment of Recurrent Respiratory Infections in Pediatric Patients//Arzneimittelfoschung. — 1994. — 44 (12A): 1485–1489.
Chiarenza A., Icerato M.P., Barbera L. et al. Modulating effects of the synthetic thymic dipeptide pidotimod on the immune system in the aging rat//Pharmacol. Toxicol. — 1994. — 74 (4–5): 262–266.
Ciaccia A. Pidotimod Activity against Chronic Bronchitis Exacerbations//Arzneimittelfoschung. — 1994. — 44 (12A): 1516–1520.
Coppi G., Falcone A., Manzardo S. Protective Effects of Pidotimod against Experimental Bacterial Infections in Mice//Arzneimittelfoschung. — 1994. — 44 (12A): 1417–1421.
De Martino et al. The child with recurrent respiratory infections: normal or not //J. Chemother. — 1991. — Vol. 18, p. 13–18.
De la Torre Gonzalez C., Pacheco Rios A., Escalante Domingues A.Y. et al. Comparative meta-analysis of immunostimulant agents used in pediatric patients in Mexico//Rev. Allerg. Mex. — 2005. — 52 (1): 25–38.
Di Marco R., Condorelli F., Girardello R., et al. Increased rate of survival in Streptococcus pneumoniae — infected rats treated with the new immunomodulator Pidotimod//Scand. J. Infect. Dis. — 1992. — 24 (6): 82–83.
Dianzani C., Colangelo D., Tonso E. et al. In vivo Antiviral Effects of Pidotimod//Arzneimittelfoschung. — 1994. — 44 (12A): 1431–1433.
Gourgiotis D., Papadopulos N.G., Bossios A. et al. Immune modulator pidotimod decreases the in vitro expression of CD30 in peripheral blood mononuclear cells of atopic asthmatic and normal children//J. Asthma. — 2004. — 41 (3): 285–287.
Latza U., Davis S., Wilhelm D. et al. Soluble cytokine receptor CD30 in atopic disorders: a case-control study//Clin. Exp. Allergy. — 1999. — 29 (1): 97–104.
Maillard F. Introductory Overview//Arzneimittelfoschung. — 1994. — 44 (12A):1399–1401
Migliorati G., Di Adamio L., Coppi G. et al. Pidotimod stimulates natural killer activity and inhibits thymocyte cell death//Immunopharmacol. Immunotoxicol. — 1992. — 14 (4): 737–748.
Passali D., Calearo C., Conticello S. et al. Pitodimod in the Management of Recurrent Pharyngotonsillar Infections in Childhood//Arzneimittelfoschung. — 1994. — 44 (12A): 1511–1516.
Pozzi E., Dolatti A., Orlandi O. et al. Pidotimod in the Treatment of Patients Affected by Bacterial Exacerbations of Chronic Bronchitis//Arzneimittelfoschung. — 1994. — 44 (12A): 1495–1498.

О вреде, эффективности и бесполезности противовирусных препаратов спорят не один десяток лет. Точку в этом вопросе SPB.AIF.RU решил поставить в разговоре с главным клиническим фармакологом Санкт-Петербурга Александром Хаджижисом.
Надежда Плахова, SPB.AIF.RU: – Александр Кириакович, каково влияние противовирусных препаратов на организм человека?
Александр Хаджидис: – Вирусных заболеваний очень много. Когда инфекционный агент попадает в организм, важно начать правильное лечение. Для этого нужно понять – мы хотим подействовать на вирус или помочь иммунитету?
– А разве нет лекарств, которые справлялись бы сразу с обеими задачами?
– К великому сожалению, лекарств, действительно способных уничтожить или остановить размножение вирусов, очень мало. Причём многие из них обладают серьёзными побочными эффектами.
Впрочем, нежелательные реакции характерны для абсолютного большинства лекарств. Те же антибиотики на вирусы не действуют вообще, но при этом вредят здоровью. Поэтому при вирусной инфекции их принимать не стоит. Кроме случаев, когда болезнь осложнена бактериальными инфекциями.
– То есть, действительно эффективных противовирусных веществ не существует?
– Их буквально единицы. Важно успеть принять их в первые часы недомоганий. Тогда они сократят срок болезни на один день и в какой-то степени облегчат её течение. Стоят они достаточно дорого, а значит, позволить их себе может не каждый. И когда выбор стоит между тем, купить молоко и хлеб на всю семью или эту волшебную пилюлю для одного заболевшего, я бы выбрал первое. Рекомендовать такие препараты я могу разве что пациентам группы риска по развитию тяжелых форм.

– Может, тогда лучше принимать иммуностимуляторы?
– Но ведь есть мнение, что гомеопатические препараты всё-таки помогают?
– А что вы скажете о вакцинации?
– Мне, будучи главным специалистом комитета, сложно говорить о пользе вакцины. Если она от стрептококка, гепатита, к примеру, то я поддерживаю её применение. С гриппом сложно угадать, какой именно его штамм будет распространяться и может вызвать эпидемию. В этом году к нам снова пришёл совсем другой тип гриппа – не тот, который мы ждали и от которого вакцинировали.
– Сами вы прививку от гриппа делаете?
– Выходит, что в XXI веке практически нет доступных лекарств, способных помочь в борьбе с таким распространённым недугом, как, к примеру, ОРВИ?
– Не разделяю пессимистичный настрой. Мы же как-то выросли без этих препаратов? И ведь тоже болели гриппом и ОРВИ. Наоборот, нужно радоваться тому, что эти болезни проходят сами по себе, без обязательной помощи каких-то сторонних веществ. Чаще всего за 5-7 дней вирус сам уходит из организма.
Но в то же время есть такая проблема, как тяжёлые формы гриппа, которые часто заканчиваются летальными исходами. Есть пациенты, попадающие в эту группу риска. Их нужно наблюдать и назначать этиотропную терапию – тут выбора нет, и финансовый вопрос не должен подниматься.

– Как же тогда бороться с вирусными заболеваниями?
– Рекомендации настолько простые, что они вас могут смутить. Когда рекомендуют постельный режим – это не пустые слова. Вирус изначально попадает в какую-то одну клетку, а когда человек активен, то и возбудитель с той же активностью размножается. В состоянии покоя все силы и энергия организма тратятся на стимуляцию иммунитета, синтез нового белка – защитника от инфекционного агента. И неслучайно заболевший человек постоянно хочет пить, лежать. Слушайтесь своего организма. И ещё – предупреждайте критические подъёмы температуры, но не снижайте её сразу до нормы здорового человека. Когда у человека жар, вырабатывается интерферон, который помогает побороть вирус.
– Какую профилактику ОРВИ вы можете порекомендовать?
– Здоровый образ жизни, режим дня, правильное питание. Как говорится, на лекарства надейся, а сам не плошай. Не нужно думать, что мы будем подолгу губить себя, поедая копчёности, выкуривая по пачке сигарет в день, а потом волшебная пилюля нас спасёт. По факту мы снимаем с себя ответственность за своё здоровье и перекладываем её на лекарства, переоценивая их роль.
Мнение
Научный сотрудник отдела респираторных (капельных) инфекций ФГБУ ДНКЦИБ ФМБА России Елена Шарипова:
– Сегодня существуют противовирусные препараты как с прямым механизмом действия на вирусы, в частности вирусы гриппа, так и с опосредованным влиянием на иммунитет. Эффективность веществ с противовирусным действием подтверждается многими работами, в которых говорится об ослаблении основных симптомов заболевания и сокращении продолжительности болезни. Отдельные научные работы говорят о том, что такие медикаменты также снижают риск появления осложнений.
При этом важно понимать, что любое лекарственное средство должно иметь чёткие показания для применения. Если вы используете лекарство самостоятельно, без наблюдения врача, это может сформировать у вирусов устойчивость к нему.
Сегодня основным и самым эффективным способом контроля и борьбы с вирусными инфекциями, в частности гриппом, является вакцинация. Ежегодное наблюдение на мировом уровне за циркулирующими штаммами вируса гриппа позволяет предположить, с каким вирусом гриппа в следующем сезоне будет связан подъем заболевания. При совпадении вакцинных штаммов с циркулирующими рекомендованная вакцина позволяет эффективно контролировать заболеваемость.

К числу заболеваний, исход и течение которых определяется направленной иммунотерапией, относятся респираторные инфекции. Отсутствие массовой адекватной иммунопрофилактики приводит к постоянному росту этих заболеваний. В то же время даже современные антибактериальные, противовирусные и противовоспалительные средства не только не решают проблему, но и создают основу для хронизации и постоянного рецидивирования (Караулов А. В. и др., 2000).
Профилактика и лечение острых респираторных инфекций (ОРИ) по-прежнему остаются серьезной социально-экономической проблемой - в осенне-зимний период они являются причиной более 90% всех обращений за амбулаторной помощью, обуславливая огромное количество пропущенных рабочих дней родителями, школьных занятий детьми и также значительными денежными издержками на лекарственные препараты (Караулов А.В., Ликов В.Ф., 2004). Немаловажен экономический аспект проблемы ОРИ. Во всём мире основной экономический ущерб от инфекционных заболеваний наносят грипп и острые респираторные инфекции (ОРИ). Подсчитано, что из 60 прожитых лет человек болеет гриппом и ОРЗ в среднем 6 лет. В России только в период ежегодных эпидемий гриппа экономический ущерб составляет более 50 млрд рублей в год.
Кроме того, в большинстве регионов России в рационе сохраняется значительный дефицит белков, микронутриентов, витаминов, группы В и С, микроэлементов – железо, фтор, кальций, селен, йод. Дефицит макро- и микронутриентов отрицательным образом сказывается на защитных свойствах организма. Экспертами-иммунологами признаётся, что изменения иммунного реагирования у ЧБД многочисленны, но они говорят не об иммунодефиците, а лишь об особенностях иммунного ответа на инфекцию (Маркова Т.П., Чувиров Д.Г., 2002). Речь идет в основном об особенностях функционирования иммунной системы, которые в значительной степени связаны с процессами её развития и созревания. Даже новорожденный ребенок рассматривается как вполне иммунокомпетентный (первый критический период развития иммунной системы), готовый к встрече с окружающей средой, хотя в иммунной системе маленького ребёнка есть ряд особенностей, отличающих его от взрослых.
Так, его полинуклеарные лейкоциты способны к фагоцитозу, но их мобилизация в ответ на воспалительные стимулы снижена по сравнению со взрослыми в 2–3 раза. При сходном со взрослыми уровне естественных киллерных клеток их цитотоксическая активность и продукция интерферона-гамма (ИФН-гамма) снижена.
Компоненты классического пути активации комплемента у новорожденного представлены на том же уровне, что и у взрослого, но компоненты альтернативного пути присутствуют в уменьшенной вдвое концентрации. Продукция В-лимфоцитами новорожденного IgM мало отличается от таковой взрослого, но продукция IgG и IgA снижена. Соотношение CD4/CD8 у новорожденного близко к 3; изменение численности субпопуляций лимфоцитов наблюдается весьма часто, в т.ч. у ЧБД, и, в отсутствие признаков врождённого иммунодефицита, его нельзя трактовать как патологическое. Но дети первых месяцев жизни склонны давать иммунный ответ преимущественно Тh2-типа (фенотип T-хелперов 2-го типа): Т-хелперы (CD4+-лимфоциты), изолированные из пуповинной крови, в ответ на антигенную стимуляцию продуцируют в 10 раз меньше ИФН-гамма, чем те же клетки взрослых, снижена и продукция интерлейкина-
Второй критический период развития иммунной системы - 3-6 месяцев жизни характеризуется ослаблением пассивного гуморального иммунитета в связи с катаболизмом материнских антител. Сохраняется супрессорная направленность ряда иммунных реакций при выраженном лимфоцитозе в крови. На большинство антигенов (инфекции) развивается первичный иммунный ответ с преимущественным синтезом IgM-антител, не оставляющий иммунологической памяти. Проявляется недостаточность системы местного иммунитета, как повторные ОРВИ, пневмонии, затяжные кишечные инфекции, проявления пищевой аллергии, кожные заболевания, инфекции органов мочевой системы.
Третий критический период - 2-й год жизни. В этот период значительно расширяются контакты ребенка с внешним миром (свобода передвижения, внесемейного общения - социализация), в связи с этим повышается риск инфицирования детей. Иммунофенотипы CD лейкоцитов и лимфоцитов, циркулирующих в крови, практически не изменяются, однако, они становятся более чувствительны к цитокинам и интерлейкинам. Система местного иммунитета остается незрелой, дети чувствительны к вирусным и микробным инфекциям, склонны к повторным вирусным и микробно-воспалительным заболеваниям органов дыхания. К концу 1-го года жизни в крови имеется примерно 50-60% количества IgG и только 30% - IgA от средних значений у взрослых. К концу 2-го года жизни содержание IgM и IgG составляет уже около 80% значений взрослых, a IgA -около 40%. Четвертый критический период - 6-7-й годы жизни. Средняя концентрация IgG и IgM в крови соответствует уровню взрослых, однако, плазматический уровень IgA еще не у всех детей достигает окончательных значений.
Содержание IgE в плазме крови достигает наивысших нормальных величин по сравнению с его уровнем в другие возрастные периоды. Данный период характеризуется нарастанием и частоты атопических, аутоиммунных, иммунокомплексных, инфекционных и паразитарных заболеваний, проявлений поздних иммунодефицитов. Пятый критический период - подростковый возраст. Пубертатный скачок роста сочетается с уменьшением общей массы лимфоидных органов. Органы иммунной системы, прежде всего, вилочковая железа - начинают подвергаться обратному развитию - инволюции. Секреции половых гормонов (андрогенов) или повышение чувствительности тканевых рецепторов к ним ведет к подавлению клеточного звена иммунитета и преобладанию его гуморального звена.
Положительные клинические аспекты на начальных этапах коррекции иммунного статуса у часто болеющих детей имеет применение неспецифической иммунотерапией: витаминно-минеральных комплексов, адаптогенов (эхиноцея), закаливающих процедур. Однако недостаточная эффективность неспецифической иммунотерапии диктует целесообразность применения не только лечебных, но и профилактических курсов иммуномодулирующей терапии. Профилактический прием иммунокорригирующих препаратов позволяет снизить риск повторных ОРИ, а назначение этих лекарств в острой фазе заболевания позволяет сократить продолжительность болезни и компенсирует иммуносупрессию. Современные достижения в области иммунологии и иммунофармакологии позволили внедрить в практику здравоохранения инновационные лекарственные средства корригирующие функционирование иммунной системы.
В настоящее время в России зарегистрировано 468 препаратов этой группы, производимых 26 странами. Список препаратов, традиционно используемых в целях иммунотерапии, постоянно растет. Согласно классификации, предложенной J.W. Hadden и дополненной отечественными иммунологами, все иммуномодуляторы разделены на следующие группы: тимические, микробные, костномозговые, индукторы интерферонов, нуклеиновые кислоты, растительные, химически чистые иммуномодуляторы.
Принципы клинического применения иммуномодуляторов в острую фазу ОРИ должны основываться на одновременном назначении с этиотропными препаратами (антибактериальными или противовирусными средствами), что позволяет добиться клинического эффекта при заболеваниях, торпидных к проводимой стандартной терапии. При этом включение иммуномодулирующих средств в схему комплексной терапии должно происходить с первых дней заболевания. Выбор иммуномодулятора определяет врач в зависимости от особенностей клинического течения заболевания, степени его тяжести и стадии, характера иммунограммы. В виде монотерапии иммуномодуляторы назначаются при проведении иммунореабилитационных мероприятий часто и длительно болеющим детям, а также перед началом осенне-зимнего сезона для профилактики ОРИ и обострений хронических заболеваний, особенно в экологически неблагоприятных регионах. К тимическим иммуномодуляторам относят: тактивин и тималин, тимоген.
Применение этих препаратов сопровождается уменьшением дефицита и восстановлением функциональной активности Т-лимфоцитов, снижением гиперпродукции общего и специфических IgЕ. Однако в настоящее время препараты тимуса и их синтетические аналоги из-за непродолжительного действия применяются редко. Иммуномодуляторы группы нуклеиновых кислот являются выраженными индукторами интерферонов: нуклеинат натрия, деринат. Деринат - натриевая соль нативной ДНК. Данный иммуномодулятор, влияющий на клеточный и гуморальный иммунитет, стимулирует репаративные процессы, обладает противовоспалительным действием, нормализует состояние тканей при дистрофических изменениях сосудистого генеза. Препарат активизирует противовирусный, противогрибковый и противомикробный иммунитет, обладает высоким репаративным и регенераторным действием. Результаты клинических исследований позволяют рекомендовать применение препарата Деринат в педиатрической практике для лечения и профилактики ОРВИ, обструктивных бронхитов, пневмонии. Для профилактики ОРИ Деринат назначают по 2 капли раствора в каждую ноздрю 2-4 раза в сутки 1-2 недели. При появлении симптомов респираторного заболевания препарат закапывают в нос каждые 1-1.5 часа в течение суток, далее 3-4 раза в день до выздоровления.
Химически чистые иммуномодуляторы: левамизол, диуцифон, галавит, гепон, полиоксидоний. В детской практике широкое применение имеет препарат Полиоксидоний. Он оказывает иммуномодулирующее, антиоксидантное, детоксицирующее и мембранопротективное действие. Препарат нормализует провоспалительные цитокины, повышает естественную резистентность организма к бактериальным и вирусным инфекциям. Полиоксидоний применяется у детей в комплексной терапии иммунодефицитных состояний, проявляющихся в острых и хронических рецидивирующих инфекционно-воспалительных процессах любой этиологии, неподдающихся стандартным методам терапии. К бактериальным иммуномодуляторам относят очищенные бактериальные лизаты: ИРС-19, имудон, бронхо-мунал; комбинированные иммунокорректоры (содержат антигены бактерий и неспецифические имуномодуляторы (липополисахариды, протеогликан): рибомунил, поликомпонентная вакцина иммуновак-ВП-4, ликопид. Бронхо-мунал применяется для профилактики и лечения в составе комбинированной терапии инфекционно-воспалительных заболеваний: бронхитов, фарингитов, ларингитов, риносинуситов, отитов.
Схемы применения Бронхо-Мунала П (3,5 мг): для лечения - 1 капсула 1 раз в сутки 10-30 дней можно одновременно с антибиотиками, для профилактики -1 капсула в сутки 10 дней в месяц на 3 месяца. Терапевтический эффект рибомунила выражался в значительном урежении острых респираторных инфекций и снижении продолжительности острых респираторных инфекций. Препарат применяется для профилактика рецидивирующих инфекций у пациентов групп риска (часто и длительно болеющие, перед началом осенне-зимнего сезона, особенно в экологически неблагоприятных регионах, больные хроническими заболеваниями ЛОР-органов, хроническим бронхитом, бронхиальной астмой). Схема применения рибомунила: разовая доза (вне зависимости от возраста) составляет 3 таб. по 0,25 мг (с 1/3 разовой дозы), или 1 таб. по 0,75 мг (с одной дозой), или гранулы из 1 пакетика, предварительно растворенные кипяченой водой комнатной температуры.
В первый месяц лечения и/или с профилактической целью Рибомунил принимают ежедневно первые 4 дня каждой недели в течение 3 недель, в последующие 2-5 месяцев - первые 4 дня каждого месяца. Детям старше 6 месяцев препарат назначают 1 раз в сутки утром натощак. Синтетический аналог компонента клеточной стенки бактерий - ликопид является активатором фагоцитарного, гуморального и клеточного иммунитета. Препарат применяется для лечения острых и хронических гнойно-воспалительных заболеваний кожи и мягких тканей; при хронических инфекциях дыхательных путей; при атопическом дерматите, осложненном бактериальной, вирусной, грибковой инфекцией, применение ликопида в сочетании с антибиотиками способствует более быстрому уменьшению воспалительной инфильтрации кожи и позволяет сократить продолжительность терапии; при герпетической инфекции любой локализации. Назначают детям с 3-месячного возраста для профилактики и лечения ринита, синусита, отита, ларингита, трахеита, фарингита, ринофарингита, тонзиллита, бронхита, а также вазомоторного ринита. Имудон, препарат, содержащий лиофилизированные лизаты бактерий.
Показания к применению имудона: лечение и профилактика: пародонтозов, пародонтита, стоматита, глоссита, афтозного стоматита; воспалительных и инфекционных поражений ротовой полости и глотки; эритематозного и язвенного гингивита; дисбактериоза полости рта; фарингитов; хронических тонзиллитов; предоперационная подготовка к тонзиллэктомии; послеоперационный период после тонзиллэктомии. При лечении острых и обострении хронических воспалительных заболеваний полости рта и глотки, а также для профилактики препарат принимают по 6 таблеток в день. Таблетки рассасывают (не разжевывая) в ротовой полости с интервалом 2 ч. Продолжительность курса лечения при острых заболеваниях – 10 дней, для профилактики хронических – 20 дней. Рекомендуется проводить профилактическое курсовое лечение препаратом 3–4 раза в год. Кроме того, в детской практике широкое применение нашли такие иммунокорректоры, как иммунал и имунорикс.
Иммунал назначается часто болеющим детям для профилактики гриппа и простудных заболеваний; вместе с базисной терапией в качестве вспомогательного средства для сокращения длительности болезни; для укрепления иммунной системы при выздоровлении. Схемы применения иммунала: Иммунал капли: от 1 года - 6 лет 1 мл 3 раза в день; 6-12 лет – 1,5 мл 3 раза в день; старше 12 лет - 2,5 мл 3 раза в день; Иммунал таблетки: 4-6 лет – 1 таблетка 1-2 раза в день; 6-12 лет – 1 таблетка 1-3 раза в день; старше 12 лет 1 таблетка 3-4 раза в день. Для достижения клинического эффекта следует принимать не менее 1 недели, продолжительность непрерывного приема не более 8 недель. Имунорикс (пидотимод) активирует противовирусный, противобактериальный, противогрибковый иммунитет; снижает заболеваемость инфекциями респираторных путей у часто болеющих детей. Препарат разрешен к применению с 3-лет: острые эпизоды инфекции 1 флакон 2 раза в день 15 дней; профилактика рецидивирующих инфекций – 1 флакон 1 раз в день 15-90 дней. К группе иммуномодуляторов индукторов интерферонов относятся виферон, циклоферон, амиксин.
Препарат Виферон применяется у детей в комплексной терапии вирусно-бактериальной инфекции респираторного тракта, бронхиальной астмы, ОРИ у часто болеющих детей, герпетической, ЦМВ-инфекции, хламидиоза. В комплексной терапии вирусно-бактериальной инфекции респираторного тракта, ОРВИ у часто болеющих детей Виферон применяется: 2 свечи в сутки через 12 часов 10 дней; далее трижды в неделю по 2 свечи в сутки в течение 2-х недель, далее дважды в неделю по 2 свечи в сутки в течение 2-х недель, далее 1 раз в неделю по 1 свече на ночь в течение 2-х недель. В настоящее время особый интерес представляет возможность введения бактериальных иммунокорректоров со свойствами вакцин в лечебную программу терапии часто болеющих детей. Одним из препаратов данной группы является препарат IRS-19 (Иммуномодулирующий Респираторный Спрей, Solvay Farma), иммуномодулятор со свойствами вакцин, предназначенный для местного применения. Под нашим наблюдением находились 25 часто болеющих детей, получавшие IRS-19 с профилактической целью 2 раза в год (по одной ингаляции эндоназально два раза в сутки в течение 14 дней) - 1 группа и 15 детей с подверженным диагнозом ОРЗ, получавших IRS-19 дополнительно с традиционной симптоматической терапией - 2 группа. В острый период заболевания препарат назначался по одной ингаляции в обе ноздри до пяти раз в сутки с прекращением лечения при стихании симптомов инфекции. Возраст детей находящихся под наблюдением составлял от 5 до 15 лет.
Группы сравнения составляли больные с ОРЗ, не получавшие IRS-19. Установлено, что у 74% детей 1 группы частота заболеваемости за год по сравнению с контрольной группой снизилась в 2,1 раза (р Педиатрия
Читайте также:


