Иммунохроматографический метод выявления вирусов

Цена:
Авторы работы:
Научный журнал:
Год выхода:
ПРИКЛАДНАЯ БИОХИМИЯ И МИКРОБИОЛОГИЯ, 2009, том 45, № 2, с. 225-231
РАЗРАБОТКА ИММУНОХРОМАТОГРАФИЧЕСКИХ ТЕСТ-СИСТЕМ ДЛЯ ЭКСПРЕССНОЙ ДЕТЕКЦИИ ВИРУСОВ РАСТЕНИЙ
Б. Б. Дзантиев*, И. Г. Атабеков**
Поступила в редакцию 25.01.2008 г.
Разработаны иммунохроматографические экспресс-тесты для определения пяти вирусов растений, отличающихся размерами и формой вириона: сферических вирусов крапчатости гвоздики и мягкой мозаики фасоли, палочковидного вируса табачной мозаики, нитевидных вирусов X и Y картофеля. Для проведения анализа использованы мультимембранные композиты (тест-полоски), на которые нанесены поли-клональные антитела к вирусам и конъюгат антител с маркером - частицами коллоидного золота. Показано, что иммунохроматографические тест-системы позволяют проводить анализ в очищенных препаратах и в экстрактах из зараженных растений за 10 мин с чувствительностью 0.08-0.5 мкг/мл для разных вирусов. Разработанные тест-системы могут быть использованы для внелабораторной экспресс-диагностики вирусных заболеваний сельскохозяйственных культур.
Вирусные болезни приводят к серьезным потерям урожая культурных растений и ухудшают качество продукции, тогда как использование свободного от вирусов посевного и посадочного материала позволяет значительно повысить продуктивность сельскохозяйственных культур [1, 2]. В связи с отсутствием эффективных методов лечения производство безвирусного семенного и посадочного материала основано на выбраковке зараженных и отборе здоровых растений. Таким образом, диагностика вирусных инфекций является ключевой стадией получения безвирусного материала [3].
Для большинства экономически значимых фито-патогенных вирусов разработаны эффективные методы лабораторной диагностики, основанные на им-муноферментном анализе или полимеразной цепной реакции 5. В последние годы все более широкое распространение получает метод чиповой ДНК-диагностики, обеспечивающий возможность выявления всех патогенов данной культуры в одном образце [8, 9]. Все эти способы инструментального анализа обладают высокой чувствительностью и производительностью, что обуславливает их массо-
Сокращения: БР - буферный раствор (10 мМ K-фосфатный буфер, рН 7.4, с 0.14 М NaCl и 0.1% Тритона Х-100), ВКГ - вирус крапчатости гвоздики, ВММФ - вирус мягкой мозаики фасоли, ВТМ - вирус табачной мозаики, ИФА - иммунофер-ментный анализ, ИХА - иммунохроматографический анализ, КЗ - коллоидное золото, КЗ-15 - препарат коллоидного золота с номинальным диаметром частиц 15 нм, К3-30 - препарат коллоидного золота с номинальным диаметром частиц 30 нм, ФБС - фосфатный буфер солевой (50 мМ K-фосфатный буфер, рН 7.4, с 0.1 М NaCl), IgG - иммуноглобулины класса G, IgG-КЗ - конъюгат иммуноглобулинов G с коллоидным золотом, s.d. - стандартное отклонение, ХВК - Х-вирус картофеля, УВК - Y-вирус картофеля.
вое использование при сертификации и карантинном контроле посевного и посадочного материала и при мониторинге вирусных инфекций. Однако эти методы достаточно сложны, трудоемки, требуют квалифицированного персонала и дорогостоящего оборудования, что ограничивает их применение хорошо оснащенными центрами и лабораториями. Основная масса возделываемых и импортируемых овощных, ягодных, плодовых, цветочно-декоративных культур и картофеля остается вне поля зрения фитосанитарного и карантинного контроля.
Для эффективного мониторинга вирусных инфекций необходимы быстрые и чувствительные методы анализа, реализуемые как в лабораториях, так и во внелабораторных условиях. Одним из перспективных решений данной задачи является иммунохроматографический анализ (ИХА), основанный на использовании мембранных носителей (тест-полосок), на которые в определенных местах нанесены иммунореагенты (антитела и их конъюгаты с окрашенными коллоидными частицами), способные взаимодействовать с детектируемым вирусом. Возникающее при погружении тест-полоски в анализируемую пробу движение жидкости по мембранам инициирует иммунохимические взаимодействия и визуально наблюдаемое окрашивание аналитической и контрольной зон [10, 11]. Ряд зарубежных фирм производят тест-полоски для диагностики вирусов растений: Spot Check LF ("Adgen Ltd.", Великобритания), Pocket Diagnostic ("Forsite Diagnostics Ltd.", Великобритания), Immunostrips ("Agdia", США). Опыт их применения показывает, что выявление вирусной инфекции занимает несколько минут. Принципиальными достоинствами данного подхода явля-
ются высокая чувствительность, простота подготовки образца и выполнения самого анализа.
Цель исследования - разработка иммунохрома-тографических тест-систем для экспресс-детекции вирусов растений, отличающихся размерами и формой вириона: сферических вирусов мягкой мозаики фасоли (ВММФ) и крапчатости гвоздики (ВКГ), палочковидного вируса табачной мозаики (ВТМ) и нитевидных вирусов X и Y картофеля (ХВК, YBK).
Реактивы. В работе применяли овечьи ("Им-тек", Россия) и козьи ("Имтек", Россия и "Arista Bio-logicals", США) антитела против IgG кролика, пе-роксидазный конъюгат антикроличьих антител ("Медгамал", Россия), трис, Тритон Х-100, 3,3',5,5'-тетраметилбензидина дигидрохлорид, азид натрия ("Sigma", США), золотохлористоводородную кислоту ("Fluka", Германия), Твин-20, бычий сывороточный альбумин (БСА), цитрат натрия ("MP Biomedicals", Великобритания), глицерин, NaCl, K2CO3 ("ДиаэМ", Россия), Na2CO3, NaHCO3, KH2PO4, KOH ("Химмед", Россия). Все соли были аналитической или химической чистоты.
Растворы для получения коллоидного золота (КЗ) и его конъюгатов готовили на воде, деионизи-рованной с помощью установки MilliQ ("Millipore", США).
Для изготовления иммунохроматографических тест-систем использовали наборы mdi Easypack ("Advanced Microdevices", Индия), включающие рабочую мембрану CNPC-SN12 L2-P25 с размером пор 15 мкм, подложку под конъюгат PT-R5, мембрану для нанесения образца FR1(0.6), конечную адсорбирующую мембрану AP045 и ламинирующую защитную пленку на клейкой основе МТ-1.
Пробоподготовка растительного материала.
Экстракты из здоровых и зараженных вирусом растений готовили, растирая навеску листьев массой 200 ± 20 мг в 2 мл экстрагирующего буферного раствора (БР) (10 мМ K-фосфатный буфер, рН 7.4, с 0.14 М NaCl и 0.1% Тритона Х-100). Для определения вируса использовали полученный (неосветлен-ный) экстракт или экстракт, осветленный центрифугированием при 10000 g в течение 5 мин при комнатной температуре.
Вирусы и антитела к вирусам. ВММФ, ВТМ, ХВК и YВK поддерживали и размножали в теплице в растениях, соответственно, фасоли Phaseulus vulgaris L., табака Nicotiana tabacum L., дурмана Datura stramonium L. и табака N. tabacum L. Очищенные вирусные препараты получали из зараженных листьев этих растений согласно 15. ВКГ выделяли из зараженных листьев гвоздики Dianthus caryophyllus L. по [16].
Антисыворотки к вирусам получали иммунизацией кроликов очищенными вирусными препарата-
ми 13. IgG-фракцию выделяли из антисывороток ионообменной хроматографией на ДЭАЭ-сефа-целе ("Pharmacia", Швеция) в 0.01 М Na-фосфатном буфере, рН 8.0 [17].
Получение коллоидного золота [18]. При синтезе золота с номинальным диаметром частиц 15 нм (КЗ-15) к 95.0 мл деионизированной воды добавляли 1.0 мл 1%-ной HAuCl4. Смесь доводили до кипения, при перемешивании добавляли 1.5 мл 1%-ного цитрата натрия, кипятили 10 мин и охлаждали до комнатной температуры.
Методика синтеза КЗ с номинальным диаметром частиц 30 нм (K3-30) отличалась тем, что использовали 97.5 мл деионизированной воды и 1.5 мл 1%-ной HAuCl4; реакционную смесь кипятили в течение 30 мин.
Препараты КЗ хранили при +4-6°С.
Получение конъюгатов IgG с коллоидным золотом [19]. При определении количества белка, оптимального для конъюгации, к 0.1 мл растворов IgG в воде (концентрацию варьировали от 5 до 250 мкг/мл) добавляли по 1 мл КЗ, перемешивали и инкубировали 10 мин при комнатной температуре. Затем в каждую пробу добавляли 0.1 мл 10%-ного NaCl, перемешивали и через 10 мин измеряли D580. Концентрации IgG, выбранные на основании полученных данных, представлены в разделе "Результаты и их обсуждение".
Для получения конъюгата IgG-КЗ антитела диа-лизовали против 1000-кратного объема 10 мМ Na-карбонатного буфера, рН 9.0, в течение 2-3 ч при +4°С. К КЗ добавляли 0.2 М К2СО3 до достижения рН 9.0 и вносили в раствор IgG выбранной концентрации. Смесь перемешивали 30 мин при комнатной температуре, после чего добавляли БСА до конечной концентрации 0.25%. Частицы КЗ с иммобилизованными молекулами IgG отделяли центрифугированием в течение 60 мин при 20000 g для КЗ-15 и 8000 g для КЗ-30. После удаления супернатанта осадок ресуспендировали в ФБС с 0.25%-ным БСА. При необходимости длительного хранения к полученному продукту добавляли NaN3 до конечной концентрации 0.02%.
Электронная микроскопия. Препараты КЗ или его конъюгатов наносили на сеточки (300 меш., "Pelco International", США), покрытые пленкой-подложкой из поливинилформаля, растворенного в хлороформе. Снимки получали на электронном микроскопе CX-100 ("Jeol", Япония) при ускоряющем напряжении 80 кВ и увеличении 3 300000. Фотографии в цифровой форме анализировали в программе "Image Tool".
Изготовление иммунохроматографических тест-полосок. Реагенты наносили на мембраны на автоматическом диспенсере IsoFlow ("Imagene Technology", США). На 1 см полосы наносили 8 мкл конъюгата IgG-КЗ в разведении, соответствующем D520 = 2.0. Для формирования аналитической зоны
использовали IgG из антисывороток против соответствующего вируса, контрольной зоны - IgG из антисывороток против IgG кролика. В обоих случаях на 1 см полосы наносили 2 мкл раствора с концентрацией 0.75 мг/мл в ФБС с 10% глицерина.
Мультимембранный композит разрезали на полоски шириной 3.5 мм на автоматическом резаке Index Cutter-1 ("A-Point Technologies, Inc.", США), а
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
АВДИЕНКО В.Г., АТАБЕКОВ И.Г., БЫЗОВА Н.А., ГУСЕВА А.Н., ДЗАНТИЕВ Б.Б., ЖЕРДЕВ А.В., МИТРОФАНОВА И.В., САФЕНКОВА И.В., ЧИРКОВ С.Н. — 2010 г.
ЗЛОБИН В.Н., МОРОЗОВ А.А., ТИТОВ А.А., ШИЛЕНКО И.В., ЯРКОВ С.П. — 2012 г.
БЫЗОВА Н.А., ДЗАНТИЕВ Б.Б., ЖЕРДЕВ А.В., САФЕНКОВА И.В. — 2012 г.
АНДРЕЕВА И.П., АНИСИМОВ Б.В., АТАБЕКОВ И.Г., БЛИНЦОВ А.Н., ВАРИЦЕВ Ю.А., ГРИГОРЕНКО В.Г., ДРЫГИН Ю.Ф., НОВИКОВ В.К., ОСИПОВ А.П., УСКОВ А.И. — 2009 г.

Назначение
Краткая информация
Возбудителем гриппа является вирус, который поражает, главным образом, верхние дыхательные пути – нос, горло, бронхи, реже – легкие. Заболевание обычно длится одну-две недели и характеризуется высокой температурой, миалгией, головной болью, недомоганием, сухим кашлем, болью в горле и ринитом.
Для детей, пожилых людей и людей, страдающих заболеваниями легких, почек, сердца, диабетом, раком, грипп представляет серьезную опасность. Эта инфекция может вызвать осложнения основных заболеваний, пневмонию и смерть.
Заболевание человека вызывают, как правило, два типа гриппа – тип А (подтипы H3N2 и H1N1) и тип В. Причиной смертей от гриппа чаще всего является вирус А подтипа H3N2.
Принцип метода
Определение основано на принципе иммунохроматографического анализа. Анализируемый образец жидкого биологического материала абсорбируется поглощающим участком тест-полоски. При наличии в образце вируса гриппа А и/или вируса гриппа В они вступают в реакцию с нанесенными на стартовую зону специфическими моноклональными антителами против вируса гриппа А и специфическими моноклональными антителами против вируса гриппа B, меченными окрашенными частицами, и продолжают движение с током жидкости. В соответствующих аналитических зонах тест-полоски происходит взаимодействие со специфическими моноклональными антителами против вируса гриппа А и/или вируса гриппа В, иммобилизованными на поверхности мембраны, с образованием окрашенных иммунных комплексов.
В контрольной зоне тест-полоски специфический окрашенный иммунный комплекс образуется независимо от наличия в тестируемом биологическом материале вируса гриппа А и/или вируса гриппа В.
В том случае, если в анализируемом образце присутствует вирус гриппа А и вирус гриппа В, на тест-полоске образуются три параллельные окрашенные линии (красная и синяя аналитические, обозначенные буквой Т, и зеленая контрольная, обозначенная буквой С), что указывает на положительный результат анализа по вирусам обоих типов. В случае отсутствия в анализируемом образце вируса гриппа А и вируса гриппа В на тест-полоске образуется одна зеленая контрольная линия (С), что указывает на отрицательный результат анализа по вирусам обоих типов.
Состав
Кассеты с тест-полосками и одноразовые пластиковые пипетки упакованы в индивидуальные вакуумные упаковки из фольги алюминиевой, содержащие пакетики с силикагелем.
Необходимые оборудование и материалы, не входящие в состав набора
- одноразовые резиновые или пластиковые перчатки;
- часы или таймер.
Аналитические характеристики
Меры предосторожности
При проведении определения следует надевать одноразовые резиновые или пластиковые перчатки, т.к. исследуемые образцы биологического материала следует рассматривать как потенциально инфицированные.
Использованные тесты и остатки биологического материала должны быть помещены в специальный контейнер для санитарных отходов.
Анализируемые образцы
Свежесобранный биологический материал (респираторные выделения из носовой полости человека), не содержащий консерванты.
Образцы респираторных выделений до определения можно хранить при температуре 2–4°С не более 8 ч.
Перед анализом образцы респираторных выделений должны быть доведены до комнатной температуры.
Подготовка образцов
1. Ввести стерильный ватный тампон на зонде приблизительно на 3 см в одну ноздрю и, вращая его, взять мазок со стенок носового хода (рис. 1-1).
2. Внести в одноразовую пластиковую пробирку из флакона с крышкой-капельницей 15 капель буфера для растворения образца (рис. 1-2).
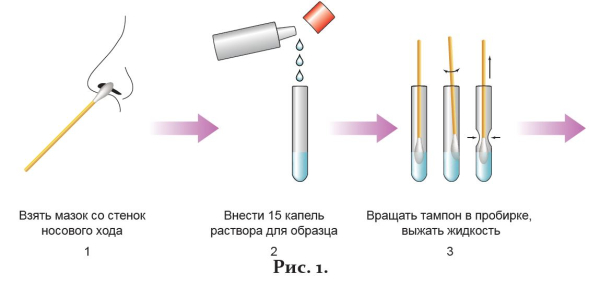
3. Поместить тампон с образцом в пробирку, смыть образец, вращая тампон по стенкам пробирки минимум 10 раз. Выдавить жидкость из тампона, сдавливая его стенками пробирки (рис. 1-3). Выбросить тампон.
Проведение анализа
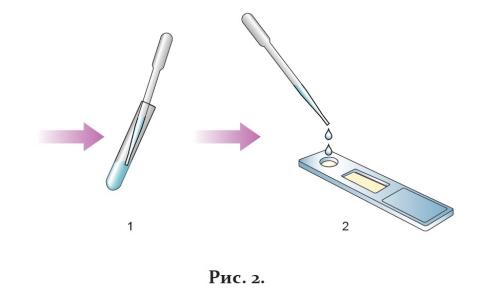
6. Через 10 мин визуально оценить результат реакции.
Интерпретация результатов
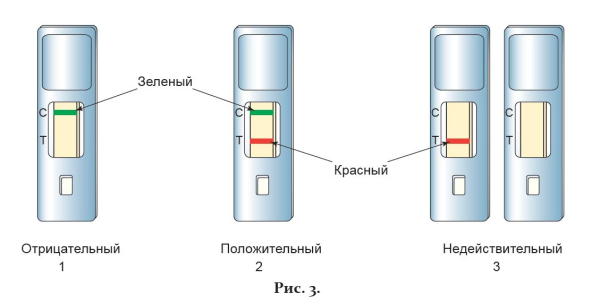
Выявление в тестовом окошке кассеты одной зеленой контрольной линии (С) свидетельствует об отрицательном результате анализа по обоим типам вируса, т.е. указывает на отсутствие в анализируемом образце респираторных выделений вирусов гриппа А и В (рис. 3-1).
Выявление в тестовом окошке кассеты трех параллельных окрашенных линий (зеленой, красной и синей) свидетельствует о положительном результате анализа по обоим типам вируса, т.е. указывает на наличие в анализируемом образце респираторных выделений вирусов гриппа А и В (рис. 3-2).

Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и красной) свидетельствует о положительном результате анализа по вирусу гриппа А, т.е. указывает на наличие в анализируемом образце респираторных выделений вируса гриппа А и отсутствие вируса гриппа В (рис. 3-3). Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и синей) свидетельствует о положительном результате анализа по вирусу гриппа В, т.е. указывает на наличие в анализируемом образце респираторных выделений вируса гриппа В и отсутствие вируса гриппа А (рис. 3-4). Интенсивность окраски красной и синей аналитических линии может меняться в зависимости от концентраций, соответственно, вируса гриппа А и вируса гриппа В в образце.
Условия хранения и эксплуатации
Москва, Кулакова ул., 20, Телефоны: , 757-99-15, 757-96-96, 8 (800) 600-54-27, e-mail: tender@bioworld.ru
Назначение
Краткая информация
Вирус гепатита А вызывает острое инфекционное заболевание печени, называемое гепатитом А. Вирус передается фекально-оральным путем через продукты питания и воду, как правило, при недостаточном уровне санитарных условий и перенаселенности.
Основные симптомы заболевания – высокая температура, общее недомогание, потеря аппетита, диарея, тошнота, боли в животе, темная моча, желтуха (окрашивание склер и кожи в желтый цвет). Тяжесть заболевания и смертность увеличиваются с возрастом. У заболевших детей младше 6 лет обычно не проявляются тяжелые симптомы и только у 10% наблюдается желтуха. У большинства подростков и у взрослых болезнь, как правило, протекает в более тяжелой форме и желтуха отмечается в 70% случаев.
Инкубационный период составляет от 2 до 6 недель, в среднем – 28 дней.
Принцип метода
Определение основано на принципе иммунохроматографического анализа. Анализируемый образец жидкого биологического материала абсорбируется поглощающим участком тест-полоски. При наличии в образце вируса гепатита А он вступает в реакцию с нанесенными на стартовую зону специфическими моноклональными антителами против вируса гепатита А, меченными окрашенными частицами, и продолжает движение с током жидкости. В аналитической зоне тест-полоски происходит взаимодействие со специфическими моноклональными антителами, иммобилизованными на поверхности мембраны, с образованием окрашенного иммунного комплекса.
В контрольной зоне тест-полоски специфический окрашенный иммунный комплекс образуется независимо от наличия в тестируемом биологическом материале вируса гепатита А.
В том случае, если в анализируемом образце присутствует вирус гепатита А, на тест-полоске образуются две параллельные окрашенные линии (красная аналитическая, обозначенная буквой Т, и зеленая контрольная, обозначенная буквой С), что указывает на положительный результат анализа. В случае отсутствия в анализируемом образце вируса гепатита А на тест-полоске образуется одна зеленая контрольная линия (С), что указывает на отрицательный результат анализа.
Состав
Кассеты с тест-полосками упакованы в индивидуальные вакуумные упаковки из фольги алюминиевой, содержащие пакетики с силикагелем.
Необходимые оборудование и материалы, не входящие в состав набора
- контейнеры для сбора образцов кала;
- одноразовые резиновые или пластиковые перчатки;
- часы или таймер.
Аналитические характеристики
Меры предосторожности
При проведении определения следует надевать одноразовые резиновые или пластиковые перчатки, т.к. исследуемые образцы биологического материала следует рассматривать как потенциально инфицированные.
Использованные тесты и остатки биологического материала должны быть помещены в специальный контейнер для санитарных отходов.
Анализируемые образцы
Свежесобранный биологический материал (кал), не содержащий консерванты.
Образцы кала должны быть собраны в чистый контейнер. Следует отбирать образцы кала для анализа в первые 1-2 недели после появления симптомов заболевания, т.к. спустя месяц после инфицирования количество вируса гепатита А значительно уменьшается.
Образцы кала до определения можно хранить при температуре 2–4°С не более 2 сут., при необходимости более длительного (до 1 года) хранения – при температуре –20°С и ниже.
Перед анализом образцы кала должны быть полностью разморожены и доведены до комнатной температуры.
Повторное замораживание и оттаивание образцов недопустимо.
Подготовка образцов
1. Снять крышку-капельницу с пробирки и с помощью стержня на крышке взять небольшое количество анализируемого образца. Для этого ввести стержень в 3 разные зоны образца, собрав примерно 150 мг кала (рис. 1-1). Если образец жидкий, отобрать 150 мкл с помощью пипетки. Ввести стержень с образцом в пробирку с буфером для растворения образца и плотно завинтить крышку-капельницу (рис. 1-2).
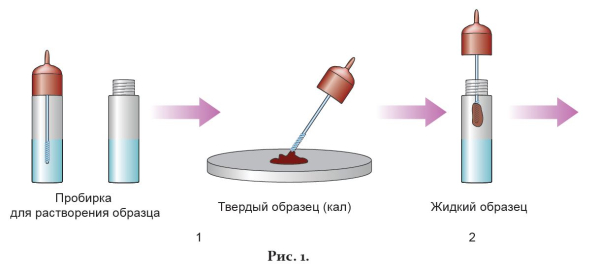
2. Несколько раз встряхнуть пробирку, чтобы облегчить растворение образца (рис. 2-1).
Проведение анализа
3. Встряхнуть пробирку с раствором образца (рис. 2-1). Отрезать или отломить кончик крышки-капельницы.
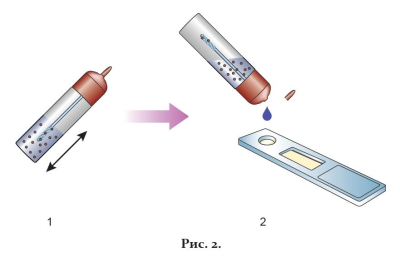
6. Через 10 мин визуально оценить результат реакции.
Интерпретация результатов
Выявление в тестовом окошке кассеты одной зеленой контрольной линии (С) свидетельствует об отрицательном результате анализа, т.е. указывает на отсутствие в анализируемом образце кала вируса гепатита А (рис. 3-1).
Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (С и Т) свидетельствует о положительном результате анализа, т.е. указывает на наличие в анализируемом образце кала вируса гепатита А (рис. 3-2). Интенсивность красной аналитической линии (Т) в тестовом окошке кассеты может меняться в зависимости от концентрации вируса гепатита А в образце.
Условия хранения и эксплуатации
Москва, Кулакова ул., 20, Телефоны: , 757-99-15, 757-96-96, 8 (800) 600-54-27, e-mail: tender@bioworld.ru

Сельское хозяйство — область хозяйственной деятельности человека с наиболее быстрой отдачей прибыли. Однако в данной сфере по-прежнему остро стоит проблема высокой степени зараженности аграрных культур фитопатогенами. Исправить сложившуюся ситуацию можно различными способами, в том числе посредством массовой молекулярной диагностики вирусных и бактериальных инфекций растений при помощи специальных методов.
В растениеводстве размер прибыли зависит многих факторов. В их число входят научный, технический и организационный уровни выращивания сельскохозяйственных культур и климатические условия. Большое значение имеет эффективность борьбы с различными вредителями — животными, насекомыми и сорняками, а также микроорганизмами — грибками, бактериями, вирусами и вироидами. Обычно вирусы не беспокоят конечного потребителя, поскольку они не опасны для здоровья. Однако эти инфекционные агенты могут негативно повлиять на урожайность культур или привести к полной гибели посевов.
Вирусные и вироидные инфекции злаковых, овощных, плодовых, ягодных и декоративных культур встречаются повсеместно. Заражение обычно происходит при проникающем ранении клеточной стенки с помощью насекомых и других вредителей либо механически — инвентарем или оборудованием. При этом проводимое массово оздоровление растений через получение апикальной меристемы не гарантирует 100-процентного освобождения от вирусов и вироидов. Именно этот фактор в совокупности с отсутствием доступной диагностики привел к широкому распространению вироида на картофеле в 80-х годах прошлого века за пределами природных очагов этого заболевания в России.
Вирусные и вироидные инфекции причиняют значительный ущерб урожаю, причем наиболее вредны смешанные варианты. Например, заражение картофеля вирусом X приводит к потере урожая на 10 процентов, а совместное инфицирование агентами X и Y — на 50–70 процентов. Чаще всего от данной проблемы страдают предприятия, культивирующие многолетние растения. Так, массовое поражение кокосовых пальм, которые начинают плодоносить лишь на 7–9 годы жизни, вироидом каданг-каданг нанесло экономике Филиппин и острову Гуам катастрофический ущерб от потери 30 млн деревьев. Сегодня растения, зараженные вирусами и вироидами, не лечат, а при постановке диагноза их выбраковывают. В случае карантинной инфекции культуры подлежат уничтожению. Поэтому для предотвращения большого ущерба от распространения заболеваний необходимы решения, позволяющие точно и быстро определить, здоровое или больное растение будет выращиваться в хозяйстве.
Очевидно, что эффективность борьбы с инфекциями многократно выше на начальных стадиях их развития, поэтому окончательный и наиболее точный диагноз о наличии вирусов и вироидов должен ставиться на молекулярном уровне. Диагностика подобных заболеваний является ключевым звеном в производстве оздоровленного семенного материала. Помимо сертификации семян и посадочных растений в массовых масштабах она применяется для контроля оздоровления культур от вирусов, фитосанитарного мониторинга посевов, селекции и карантинной проверки импортируемого семенного материала. При этом методы диагностики на молекулярном уровне не зависят от природы инфицированного организма. Для анализа требуется минимальное количество клеточного сока листовой ткани или проростков.
Повсеместный мониторинг зараженности посевного и полевого материала сельскохозяйственных культур вирусами возможен только на основе простых, надежных, доступных высокоспецифичных и высокочувствительных экспресс-методов. Они должны быть применимы для определения широкого круга вирусов, значительно различающихся по морфологии, структуре и физико-химическим свойствам, и позволять проводить быструю диагностику в полевых условиях без специальных навыков и оборудования. Поэтому одним из главных коммерческих требований, предъявляемых ко всем современным способам внелабораторной иммунодиагностики в медицине, ветеринарии и сельском хозяйстве, является полная готовность набора к тестированию. Он должен включать все необходимые реагенты. Для проведения анализа необходимо лишь добавить анализируемый растительный экстракт образца, что инициирует иммунохимические взаимодействия и формирование регистрируемого сигнала в контрольной и аналитической областях. Идеально в подобных тест-системах использование меток, позволяющих осуществлять обнаружение инфекции путем простого визуального считывания без применения каких-либо проявляющих компонентов. В целях дальнейшего повышения чувствительности технологии могут быть использованы как флуоресцентные маркеры, так и разные усилители регистрируемого сигнала.
Данным требованиям отвечает быстро развивающаяся современная аналитическая технология иммунохроматографического анализа, или ИХА, широкого спектра биологически активных соединений различной природы на тест-полосках. В силу простоты и скорости анализа она постепенно вытесняет традиционные твердофазные методы ИФА. Быстрые и легкие в использовании аналитические иммунохроматографические тест-системы, или ИХТС, позволяют проводить высокочувствительные полуколичественные измерения без специальных навыков и оборудования в полевых условиях. Являясь эффективным средством диагностирования, подобные экспресс-тесты дают возможность в течение нескольких минут визуально определить и оценить содержание диагностически важных фитопатогенов.
Основным компонентом ИХТС является мультимембранная тест-полоска, на которую в определенных зонах нанесены иммунореагенты. Эти первичные антитела, связанные с флуоресцентным красителем или меченные окрашенными наночастицами коллоидного золота, способные связываться с определяемым вирусом. При нанесении клеточного экстракта зараженного растения инфекционный агент капиллярными силами перемещается вместе с фронтом жидкости вдоль полоски. Попав в зону первичных меченых антител, он образует с ними иммунохимические комплексы, которые продолжают мигрировать дальше. Достигнув зоны фиксированных в виде поперечной линии первичных антител, комплекс патогена и меченых антител концентрируется за счет образования тройного комплекса, включающего первичные тела. В аналитической зоне связанные с патогеном частицы коллоидного золота концентрируются, и формируется окрашенная линия. При отсутствии вируса в экстракте у здорового растения меченые первичные антитела свободно проходят через тестовую черту, и цветная полоса в аналитической области не появляется. Она возникает дальше по полоске, где в виде поперечной контрольной линии фиксированы вторичные, антивидовые антитела. Эта зона служит внутренним индикатором определения рабочего состояния иммунокомпонентов. Таким образом, при анализе зараженного растения вирусом видны две красные поперечные линии в аналитической и контрольной зонах, а при проверке здоровой культуры — одна контрольная полоса. Чувствительность определения содержания вируса находится в диапазоне 1–30 нг/мл, время анализа составляет 5–15 мин. Для подавляющего большинства вирусов этого порога вполне достаточно, однако при желании чувствительность можно увеличить с помощью реакции серебряного усиления. В этом случае время анализа будет равняться 30–40 мин.
Тест-полоски предназначены для быстрого качественного определения вирусов в экстрактах из заболевших растений в полевых условиях. Наиболее эффективно они могут быть использованы для оценки зараженности, например, при сертификации элитного и репродукционного семенного картофеля, существенно дополняя его визуальный анализ. Кроме того, полоски можно применять для экспресс-исследования импортируемого семенного и товарного картофеля на карантинные и другие особо вредоносные вирусы, а также в личных, подсобных, мелких фермерских хозяйствах, в которых сегодня сосредоточено основное производство данной культуры в России. ИХТС незаменимы в чрезвычайных обстоятельствах, когда необходимо срочно определить природу фитопатогенов, в частности при эпифитотиях и биотерроризме. К подобным текст-полоскам были разработаны технические условия и регламент, а также инструкции по их созданию и производству.
В последние годы на зарубежном рынке появились иммунохроматографические тесты для определения вирусов растений различных производителей — Adgen, Central Science Laboratory, Agdia, EnviroLogiх и других. По сравнению с перечнем коммерческих тест-систем на основе ИФА данный список пока невелик и включает наборы для диагностики около 50 инфекций — ризомании сахарной свеклы, шарки сливы, тристецы цитрусовых, Y-вируса картофеля, огуречной мозаики, бронзовости томатов и других важнейших патогенов сельскохозяйственных культур. Выпускаются мультиспецифичные тест-полоски для одновременного определения в одном образце нескольких вирусов картофеля. Энергично включились в развитие и поддержку массовой молекулярной диагностики заболеваний растений государство и частный бизнес в Индии, Китае и Бразилии. Серьезным показателем надежности диагностических тест-систем на основе ИХА является включение этого метода в диагностические протоколы ЕРРО, или Европейской организации защиты растений, для определения ряда карантинных объектов.
Использование тест-полосок полностью не решает проблему массового и постоянного контроля за семенами. Так, практика интенсивного культурного растениеводства в западных странах опирается на тотальную сертификацию исходного материала и систематический контроль его качества со стороны аккредитованных инспекций без ущерба для дисциплинированных собственников. В России система подтверждения соответствия оригинального, или предбазисного, сырья предусматривает его обязательную проверку на зараженность возбудителями наиболее вредоносных вирусных и бактериальных болезней в специальных испытательных лабораториях, аккредитованных для выполнения такого рода работ. Формирование цивилизованного рынка семенного материала в России вызвало необходимость коренного улучшения системы его сертификации. В силу этого перспективы развития безвирусного семеноводства прямо зависят от обязательного регулярного применения эффективных методов лабораторной и полевой диагностики вирусных и вироидной инфекций.
Однако основная проблема в России — отсутствие тотального систематического контроля качества сертифицированных семян и исходного посадочного материала для повсеместного культивирования со стороны аккредитованных служб. Положение усугубляется тем, что далеко не полный контроль карантинная служба РФ осуществляет даже в крупных семеноводческих хозяйствах, в то время как в производстве сельхозпродукции значительную часть занимают предприятия мелких собственников. Чтобы включить эти компании в культурное ведение агробизнеса, нужно сначала снабдить их необходимым доступным инструментом отслеживания качества покупаемого и выращиваемого растительного материала, а затем уже вести систематический контроль культуры хозяйствования.
актуальной проблемой молекулярной диагностики выступаетодновременное выявление множества патогенов вирусной и вироидной природы сельскохозяйственных растений. Мультипараметрическое исследование обычно производят на молекулярных чипах. В зависимости от плотности нанесения детекторов их классифицируют на чипы низкой концентрации для анализа единиц и десятков мишеней и высокой плотности — для выявления нескольких миллионов целей, которыми являются вирусные антигены. Для аграрной отрасли вполне подойдут иммуночипы первой категории.
Поскольку сельхозпроизводители специализированы по объектам производства и сбыта, экономически целесообразно разрабатывать диагностический иммуночип для определения местных, районированных инфекций конкретной аграрной культуры. На практике для того или иного растения в конкретной зоне или даже стране опасность представляет небольшое число патогенов различной природы — около 10–20 разновидностей. В частности, для картофеля на территории РФ максимально опасны семь вирусных, одна вироидная и две бактериальные инфекции. Для их определения уже были разработаны диагностикумы, в которых используются поликлональные антитела. Более сложная ситуация складывается с выявлением грибковых патогенов. Для их идентификации лучше применять моноклональные антитела. В этом случае более эффективно обратиться к достоинствам ДНК-чиповой технологии молекулярной диагностики или технологии ПЦР, когда в одном анализе можно получить практически полную информацию о зараженности растения грибками с учетом их штаммового разнообразия. В перспективе для каждой сельскохозяйственной культуры необходимо создать иммуночипы, позволяющие одновременно определять наиболее опасные инфекции вирусного, бактериального и грибкового происхождения. После этого станет возможной разработка макрочипа для установления всех или большей части экономически важных фитопатогенов, поражающих районированные растения, для отдельных регионов России.
На современном этапе для сокращения расходов на практическую молекулярную диагностику в процессе получения суперэлитных семян следует проводить ее в два этапа. На первом экономически выгоднее осуществить частичный скрининг семенного материала мультиплексными иммуночипами или тест-полосками. На этой стадии с меньшими убытками можно оценить долю явно зараженных семян и растений. Если их количество составляет 25 процентов и более от общего объема сырья, то необходимо всю анализируемую партию изучить с помощью тест-полосок или иммуночипа. Главная задача данного этапа — определить явно инфицированные экземпляры и убрать их из последующего размножения.
На второй стадии оставшиеся семена и растения необходимо диагностировать более мощными комбинированными технологиями: ОТ, ПЦР и дотИФА, либо ОТ и ПЦР в реальном времени, либо ДНК-чип и дотИФА. Данные методики позволяют обнаруживать одиночные молекулы РНК вирусов, вироидов и бактерий в анализируемой пробе, однако подобные исследования осуществляются только в лабораторных условиях, требуют большего количества времени, специального оборудования и наличия квалифицированного персонала.
В нашей стране исторически сложилась затратная практика овоще- и плодоводства, требующая государственных субсидий. Данный факт объясняется доступностью просторов сельскохозяйственных угодий России. Например, при меньшей в 2–5 раз урожайности картофеля отечественные сельхозпроизводители снабжают население страны данным продуктом за счет возделывания его на больших площадях, чем в Западной Европе. Экстенсивное ведение сельского хозяйства, когда потребности в сельхозпродукции удовлетворяются не с помощью увеличения урожайности, а за счет возможности использовать территории большой страны, государству экономически невыгодно. Однако переход на интенсивную схему требует повышения производительности труда и сокращения потерь урожаев от различных инфекций.
Необходимость массового внедрения и использования доступных систем диагностики инфекций растений на молекулярном уровне в нашей стране сегодня вполне очевидна. Подобные технологии помогут не только повысить урожайность культур, возделываемых сельхозпроизводителями, но и сформировать отечественный рынок качественного и безвирусного семенного материала.
Читайте также:


